牛病毒性腹泻病毒NS3基因的生物信息学分析、蛋白纯化及免疫原性分析
2023-09-02杨宁宁徐明国张江伟易继海陈创夫
杨宁宁,徐明国,张江伟,易继海,陈创夫,3
(1.石河子大学 动物科技学院,新疆 石河子 832003;2.铁门关职业技术学院 畜禽智能养殖,新疆 铁门关 836000;3.西部地区高发人兽共患传染性疾病防治协同创新中心,新疆 石河子 832003)
牛病毒性腹泻是病牛以腹泻为主要特征的免疫抑制性传染病,病原为牛病毒性腹泻病毒(Bovineviraldiarrheavirus,BVDV),该病广泛分布于世界各地[1-2]。1946年,Olafson等[3]在纽约州的消化道溃疡和下痢为主要特征的病牛中首次发现了BVDV,并于1957年成功分离获得了该毒株。根据BVDV能否引起宿主细胞病变,可将其分为致细胞病变型(Cytopathic,CP)和非致细胞病变型(Noncytopathic,NCP),这2种生物型都有致病性,但只有NCP毒株可以引起牛的持续性感染(Persistent infection,PI)[4]。根据核苷酸序列的差异及交叉中和反应,可以将BVDV分为BVDV-Ⅰ 和BVDV-Ⅱ 2个基因型[5-6]。BVDV-Ⅰ 型毒株常被用于实验室研究和疫苗研发。根据BVDV-Ⅰ 型基因组5′UTR、Npro和E2核苷酸序列的差异,可将其分为23个亚型(1a~1w);根据BVDV-Ⅱ 型5′UTR差异,可将其分为4个亚型(2a~2d)[4]。2004年,在巴西收集的一批胎牛血清中分离出了全新瘟病毒(HoBi样瘟疫病毒株或者BVDV-3),该基因型可分为2个基因亚型(Brazilian源和Thai源)[4,7-9]。BVDV的基因组结构为5′UTR-Npro-C-Erns(E0)-E1-E2-p7-NS2/3-NS4A-NS4B-NS5A-NS5B-3′UTR,其中C、Erns、E1、E2 为BVDV的结构蛋白(Structural proteins),其余为非结构蛋白(Non-structural proteins,NS)。其中非结构蛋白NS3不仅对BVDV的复制具有重要作用,而且与BVDV是否致细胞病变关系密切[10-11]。且因其具有高度保守性常被作为诊断靶标,但对其是否具有免疫原性的报道较少[12]。因此,本研究以NS3蛋白为研究对象,初步探讨了其免疫原性,以期为BVDV亚单位疫苗的研发奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 动物、菌株和血清 4~6周龄的SPF级 BABL/c 小鼠购自新疆医科大学动物实验中心; BL21(DE3)和DH5α大肠杆菌感受态细胞购自北京全式金生物技术股份有限公司;pET-22b(+)表达载体、BVDV阳性血清和BVDV毒株均由石河子大学人兽共患病实验室保存。
1.1.2 主要试剂 限制性内切酶NdeⅠ和XhoⅠ购自宝生物工程有限公司;蛋白 Marker购自康为世纪生物有限公司;增强型HRP-DAB底物显色试剂盒和质粒提取试剂盒均购自天根生化科技有限公司;NC膜(0.45 μm)购自Milipore公司;ClonExpress® Ultra One Step Cloning Kit购自诺唯赞生物科技(南京)股份有限公司;BCA蛋白定量分析试剂盒购自Thermo Fisher Scientific; HRP标记的兔抗牛IgG抗体购自北京博奥森生物技术有限公司;HRP标记的Goat Anti-Mouse IgG、IgG1和IgG2a购自Abcam公司;IPTG溶液(50 mg/mL)购自北京索莱宝公司。
1.2 试验方法
1.2.1 BVDV NS3蛋白的生物信息学分析 根据NCBI GenBank核苷酸序列数据库公布的BVDVNS3基因氨基酸序列(GenBank登录号:MK102095.1),对NS3蛋白的抗原性、理化特性、跨膜结构域、信号肽、二级结构、三级结构和B细胞抗原表位分别进行在线预测分析,分析软件如表1。
1.2.2 引物设计与合成 根据GenBank公布的BVDVNS3基因序列(GenBank登录号:L27997.1),利用CE Design软件设计扩增引物,引物序列:NS3-F 5′-TGTTTAACTTTAAGAAGGAGATATACATATGGGTCCTGCTGTGTGCAAAAAGATTACC-3′(下划线为NdeⅠ酶切位点)和NS3-R 5′-CGGATCTCAGTGGTGGTGGTGGTGGTGCTCGAGCAGGCCCACCACCTGTTTCAGTGCTTT-3′(下划线为XhoⅠ酶切位点),引物序列送北京睿博兴科生物技术有限公司合成。
1.2.3 目的基因的扩增与回收 提取BVDV毒株的总RNA并制备 cDNA,利用特异性引物对cDNA进行PCR扩增,扩增产物经1.0% 琼脂糖凝胶电泳检测,切取目的基因条带使用琼脂糖凝胶DNA回收试剂盒进行纯化。

表 1 生物信息学分析软件
1.2.4 pET-22b(+)-NS3重组表达载体的构建与鉴定 将纯化的目的基因无缝克隆至pET-22b(+)表达载体,连接体系:目的基因2 μL,pET-22b(+)线性化载体 2 μL,2×ClonExpress Mix 5 μL,补充ddH2O 至10 μL,振荡混均并离心。反应条件:50 ℃ 15 min,4 ℃ 10 min。连接产物转化至DH5α感受态细胞中,并均匀地涂于含有氨苄抗性的LB固体培养板,放入37 ℃恒温过夜培养,无菌操作挑取单克隆菌并扩繁。经PCR和限制性内切酶(NdeⅠ、XhoⅠ)鉴定正确的菌液送至公司测序。测序正确的重组质粒转入BL21(DE3)感受态细胞中,均匀地涂于含有氨苄抗性的LB固体培养板,放入37 ℃恒温过夜培养,无菌操作挑取单克隆菌并扩繁。经PCR 鉴定正确的菌液与甘油(50%)按1∶1的比例混合,保存于-20 ℃。
1.2.5 NS3重组蛋白的表达与纯化 将保存的pET-22b(+)-NS3重组表达菌接种至含氨苄抗性的LB液体培养基中,37 ℃恒温振荡培养至OD600≈0.6~0.8时加入IPTG(终浓度为1.0 mmol/L),继续培养,分别于2,4,6,8 h各时间段抽取菌液进行SDS-PAGE电泳检测,以确定 NS3重组蛋白表达的最佳诱导时间和可溶性分析。菌液超声破碎后利用镍亲和层析方法进行蛋白纯化。
1.2.6 NS3重组蛋白的Western Blotting检测 纯化的NS3重组蛋白经SDS-PAGE凝胶电泳后,通过半干式碳板转运电泳仪转运至NC膜上。5%脱脂奶粉37 ℃封闭1 h; BVDV阳性血清为一抗(1∶200),4 ℃过夜孵育; HRP标记的兔抗牛lgG为二抗(1∶4 000),37 ℃孵育1 h;用增强型HRP-DAB底物显色试剂盒显色。
1.2.7 小鼠免疫 随机将12只BABL/c小鼠分为2组(NS3重组蛋白免疫组和PBS免疫阴性对照组),每组6只。免疫组每只小鼠接种100 μL NS3重组蛋白(1 mg/mL)+100 μL弗氏完全/不完全佐剂,间隔14 d使用同等剂量加强免疫1次。分别在第0,7,14,21,28,35,42,49,56天尾静脉采集小鼠血液,并分离血清,保存于-20 ℃备用。
1.2.8 ELISA 检测小鼠血清中IgG、IgG1和IgG2a 抗体水平 按提前摸好的条件稀释NS3重组蛋白,包被于96孔ELISA板,每孔100 μL,4 ℃包被过夜;第2天,移弃包被液,每孔分别加入100 μL 5% 脱脂奶粉,并于37 ℃恒温培养箱中封闭1 h;PBST洗板3次,将100 μL小鼠血清(1∶500)加入相应96孔板中,每个时间点各组随机选取3个小鼠血清,每个小鼠血清做3次重复,再次37 ℃孵育1 h;1×PBST洗板3次,分别加入100 μL HRP标记的Goat Anti-Mouse IgG、IgG1和IgG2a(1∶2 0 000),37 ℃孵育1 h;1×PBST 洗板3次,每孔加入100 μL的TMB显色液,37 ℃避光15 min;最后每孔分别加入50 μL ELISA终止液终止反应,用酶标仪读取OD450处的值。
1.2.9 小鼠血清中和抗体检测 分别取50 μL免疫后14,28,42,56 d的小鼠血清,56 ℃水浴灭活30 min,并用RIPA-1640完全培养基做2倍倍比稀释(2-1~2-8),然后用等体积的TCID50BVDV病毒液混合,37 ℃ 孵育 2 h。将MDBK细胞均匀地铺在96孔细胞培养板中,当细胞密度达80%左右时,吸弃培养液,PBS洗3次,一对一加入孵育后的病毒和血清混合液,PBS免疫组小鼠血清作为阴性对照。每天在倒置显微镜下观察细胞病变情况,并做好记录。
2 结果与分析
2.1 NS3蛋白的生物信息学分析结果
2.1.1 NS3蛋白的抗原性和理化特性分析 通过VaxiJen v2.0服务器预测NS3蛋白的免疫原性,发现总体预测保护性抗原评分为 0.587 3,表明NS3蛋白具有较好的免疫原性;NS3蛋白有683个氨基酸构成;分子质量为75.304 33 ku;理论等电点(PI)为8.15;在大肠杆菌中的半衰期>10 h,且不稳定性指数为35.23,表明该蛋白为稳定蛋白质。
2.1.2 NS3蛋白的跨膜结构域和信号肽分析 NS3蛋白的跨膜结构域和信号肽分别利用TMHMM Serverv.2.0和SignalP 4.1 server在线软件分析,结果发现NS3蛋白无跨膜结构域和信号肽序列(图1,2)。

图1 NS3蛋白跨膜结构域预测

图2 NS3蛋白信号肽预测
2.1.3 NS3蛋白的二级结构和三级结构模型预测 NS3蛋白的二级结构利用SOPMA在线软件预测分析,发现NS3蛋白的二级结构中(图3),α-螺旋由209个氨基酸,占30.60%;延伸链由149个氨基酸,占21.82%;β-转角由62个氨基酸,占9.08%;无规则卷曲由263个氨基酸,占38.51%,表明NS3蛋白的二级结构主要以无规则卷曲为主。NS3蛋白的三级模型利用phyre 2在线软件构建(图4)。

图3 NS3蛋白的二级结构预测

图4 NS3蛋白的三级结构预测模型
2.1.4 NS3蛋白的B细胞抗原表位预测 抗原表位指蛋白质表面由6~12个氨基酸或碳水基团组成并且具有刺激机体产生抗体的区域。利用IEBD软件对NS3蛋白的优势抗原表位进行预测,结果发现其有20个优势抗原表位,分别在第7—16,23—33,46—49等氨基酸片段区(表2)。表明NS3蛋白整体抗原性较好,具有作为疫苗及诊断抗原的潜力。

表2 预测多肽
2.2 目的基因的扩增
PCR 反应以 BVDV 毒株的 cDNA 为模板,以NS3-F 和NS3-R 为引物,经 1.0%琼脂糖凝胶电泳分析扩增产物,在约2 049 bp处出现一条条带(图5)。测序结果比对发现,与GenBank公布的BVDVNS3基因序列达到100%的同源性,表明成功获得目的基因片段。
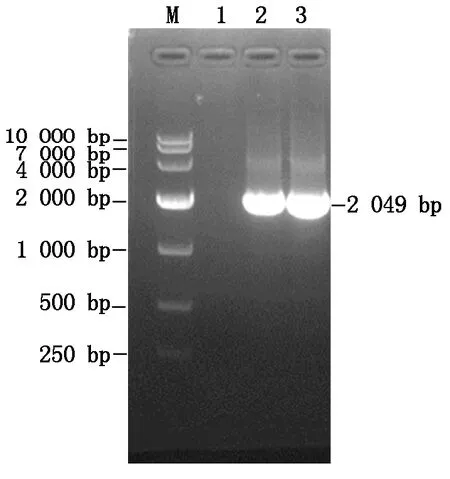
M.DM10000 Marker;1.阴性对照;2—3.NS3目的基因。
2.3 pET-22b(+)-NS3重组质粒酶切鉴定
将pET-22b(+)-NS3重组质粒转化至BL21(DE3)感受态细胞中,挑取单克隆菌并扩增,提取质粒用NdeⅠ和XhoⅠ双酶切,经1.0%琼脂糖凝胶电泳检测发现与目的基因大小相符的条带(图6),表明NS3基因与pET-22b(+)载体已相互连接,即成功获得pET-22b(+)-NS3重组质粒。

M.1 kb DNA Marker;1.pET-22b(+)质粒;2.pET-22b(+)-NS3重组质粒双酶切。
2.4 NS3重组蛋白的诱导表达和可溶性分析
将pET-22b(+)-NS3菌液接种到LB液体培养基中诱导表达,经SDS-PAGE电泳分析,结果显示,在75 ku处出现一条与NS3蛋白大小相符的蛋白条带,且随诱导时间的延长,蛋白表达量逐渐增高,表明NS3蛋白成功表达,最佳诱导时间为8 h(图7-A)。SDS-PAGE 电泳分析超声破碎后的上清和沉淀,结果显示,NS3重组蛋白在沉淀中含量较高,说明该蛋白主要以包涵体的形式进行表达(图7-B)。

A:M.蛋白质分子质量标准;1—5.pET-22b(+)-NS3 37 ℃ 诱导0,2,4,6,8 h的菌液。B:M.蛋白质分子质量标准;1.破碎后菌液沉淀;2.破碎后菌液上清液。
2.5 NS3重组蛋白的纯化与Western Blotting检测
按照His标签蛋白纯化试剂盒(包涵体蛋白)步骤对NS3重组蛋白进行纯化,经SDS-PAGE电泳分析得到了纯度较高的NS3重组蛋白(图8)。纯化的蛋白Western Blotting验证,结果显示,在约75 ku处出现明显的反应条带(图9),表明纯化的NS3重组蛋白能够与BVDV阳性血清发生特异性反应。

M.蛋白质分子质量标准;1.纯化后的NS3重组蛋白。
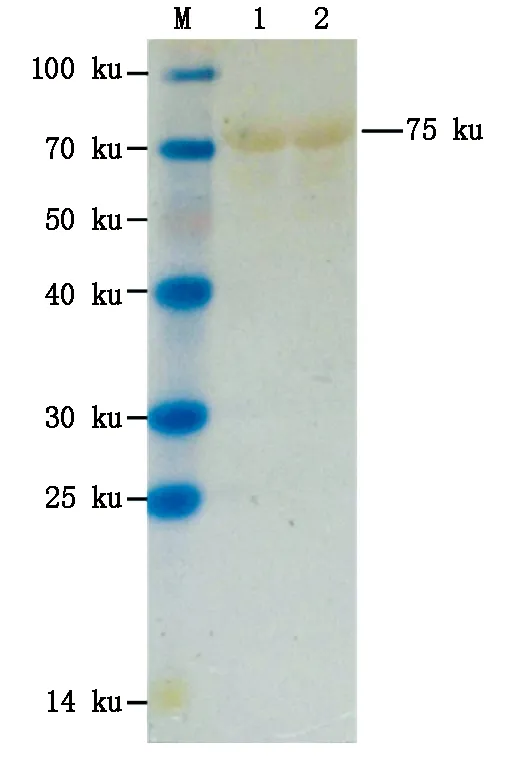
M.蛋白质分子质量标准;1—2.纯化后的NS3重组蛋白。
2.6 小鼠血清 IgG、IgG1和IgG2a 抗体检测
免疫小鼠血清中的 IgG、IgG1 和 IgG2a 抗体水平由 ELISA 检测。结果显示:与 PBS 阴性对照组相比,NS3重组蛋白免疫组能诱导小鼠产生较高水平的IgG、IgG1和 IgG2a抗体(图10),表明其具有较好的免疫原性。

A.小鼠血清中IgG抗体水平;B.小鼠血清中IgG1抗体水平;C.小鼠血清中IgG2a抗体水平。
2.7 小鼠血清中和抗体水平
小鼠血清中和抗体结果显示,一免后14 d,NS3重组蛋白免疫组与PBS阴性对照组相比极显著高于PBS阴性对照组(图11),且随着免疫时间和免疫次数的增加这种显著性更为明显。结果表明,NS3重组蛋白制备成的疫苗免疫小鼠后能够产生高水平的中和抗体,其具有较好的免疫原性。

图11 免疫小鼠血清中病毒中和抗体检测
3 结论与讨论
BVDV 主要感染牛、羊、猪、鹿等动物,临床症状为精神沉郁、厌食、腹泻、体温升高、白细胞数目减少、生产性能下降、怀孕母畜导致流产或产畸形胎儿,偶尔观察到感染动物口鼻溃烂、便血、肠黏膜脱落等[13-15]。另外,BVDV是牛源生物制品,如血清、冻精和冷冻胚胎等的常见污染源,给畜牧业造成了巨大的经济损失。
随着生物技术的快速发展,生物信息学软件广泛被用于对蛋白质结构和功能等的分析和预测,可为人工合成蛋白质、疫苗设计和疾病发生机制等方面的研究提供理论依据,能够有效地减少试验的盲目性从而节约成本[16-17]。该研究对NS3蛋白的氨基酸序列进行理化特性分析,结果发现:NS3蛋白包含683个氨基酸,分子质量为75.304 33 ku,理论PI为8.15,不稳定性指数为35.23,表明该蛋白为稳定性蛋白质。通过VaxiJen v2.0服务器预测NS3蛋白的免疫原性,发现总体预测保护性抗原为0.587 3,大于0.4的阈值,表明NS3蛋白具有较好的免疫原性。NS3蛋白既没有跨膜结构域也没有信号肽,二级结构主要以无规则卷曲为主。通过生物信息学软件对NS3蛋白进行分析,可以为该基因原核表达菌株的构建提供理论依据,尤其是对进一步的蛋白表达和获得等具有较好的指导意义。
目前,关于BVDV亚单位疫苗的研究主要集中在E0和E2这2个结构蛋白上,而这2个蛋白属于糖蛋白,利用原核蛋白表达系统表达容易导致糖基化位点丢失。由于E0和E2基因与NS3基因相比变异较快,因此,目前生产中使用的BVDV疫苗还是以弱毒和灭活疫苗为主[8,18-20]。NS3蛋白具有较高的保守性,这种保守性不仅体现在同种基因型BVDV毒株之间,而且存在于不同基因型之间,因此,国内外学者常利用NS3建立BVDV抗体/抗原检测方法[21]。然而,目前关于NS3蛋白的研究大多集中在诊断方面,关于其是否可用于疫苗的生产方面研究较少。在BVDV感染过程中,宿主免疫系统的CD4+T细胞可识别NS3蛋白,并诱导其产生特异性的抗体,且该特异性抗体持续时间较长[22-23]。因此,本研究利用原核蛋白表达系统,成功表达并获得了纯度较高的NS3重组蛋白,并将该重组蛋白与弗氏佐剂按1∶1的比例混合免疫BABL/c小鼠,定期采集免疫小鼠血液,并分离血清。ELISA检测了小鼠血清中的 IgG、IgG1和 IgG2a抗体水平,发现与PBS阴性对照组相比,NS3重组蛋白免疫组诱导产生了更高水平的IgG、IgG1和 IgG2a抗体。小鼠血清中和试验发现,自一免后14 d开始,NS3重组蛋白免疫组小鼠产生的中和抗体极显著高于PBS阴性对照组,且随着免疫时间和免疫次数的增加这种显著性尤为明显。说明由NS3重组蛋白制备成的亚单位疫苗能够诱导小鼠产生高水平的特异性抗体和中和抗体,表现出较好的免疫原性,从而推断其可作为 BVDV 亚单位疫苗的候选抗原。
本研究对BVDV非结构蛋白NS3进行了生物信息学分析,掌握了其结构与抗原特性,利用原核表达技术成功获得了具有较高纯度的NS3重组蛋白,并将其作为免疫原制备成亚单位疫苗,免疫小鼠后可诱导机体产生高水平的特异性抗体和中和抗体,从而为 BVDV 亚单位疫苗的研发奠定基础。
