合作猪StAR基因克隆、组织表达及生物信息学分析
2023-09-02闫尊强计亚楠王鹏飞石海霞滚双宝
闫尊强,计亚楠,王鹏飞,张 博,石海霞,滚双宝,2
(1.甘肃农业大学 动物科学技术学院,甘肃 兰州 730070;2.甘肃省现代养猪工程技术研究中心,甘肃 兰州 730070)
类固醇激素合成急性调节基因(Steroidogenic acute regulatory,StAR)在睾丸、卵巢、肝脏等组织中表达,编码的StAR蛋白是类固醇激素急性调节蛋白相关的脂质转移域家族的重要成员之一,在类固醇激素合成过程中起重要作用[1-3]。StAR蛋白主要由α-螺旋和β-折叠组成,属于转运蛋白,前体蛋白有285个氨基酸,逐步加工为成熟蛋白,活性部位为羧基端,称为StAR相关脂质转运结构域(StAR-related lipid transfer,START)[4-6]。StAR蛋白是类固醇激素合成过程中重要的限速酶,能结合线粒体外膜中的胆固醇,转运至内膜(羧基端协助胆固醇从含量多的线粒体外膜转运至含量低的线粒体内膜上,氨基端引导其定位到线粒体上),进入内膜中的胆固醇被细胞色素P450支链裂解酶催化生成孕烯醇酮,孕烯醇酮离开线粒体后在机体不同组织中合成孕酮、睾酮、雌激素、醛固酮等类固醇激素[7-8]。有研究表明,StAR基因突变后胆固醇很难转化成孕烯醇酮,导致先天性肾上腺增生[9-10];睾丸间质细胞StAR基因表达量降低,引起间质细胞线粒体内膜的胆固醇供应减少,睾酮生成不足,造成不育[11-12];StAR-/-小鼠卵巢中的脂质大量积累,雌激素水平降低,乳房发育不良[13],说明StAR基因在动物生殖活动中有重要功能。
合作猪(又称山猪、蕨麻猪)适应极端恶劣气候环境,主要分布于甘肃省甘南藏族自治州的合作、夏河、迭部等县(市)的高海拔牧区,是我国独有的小型高原型猪种[14-17]。StAR基因与畜禽繁殖性能密切相关,但未见合作猪StAR基因研究的报道。因此,本试验通过克隆合作猪StAR基因并进行生物信息学分析,利用实时荧光定量PCR技术检测不同组织中StAR基因表达量,为深入研究该基因在合作公猪性成熟过程中的作用提供参考。
1 材料和方法
1.1 样品采集
选择甘肃省甘南藏族自治州农户放牧饲养的3月龄合作公猪,屠宰后采集睾丸、心、肝、脾、肺、肾、十二指肠、空肠和回肠组织,液氮速冻,带回实验室-80 ℃保存。
1.2 主要试剂
TRIzol试剂购自北京全式金公司,PrimeScriptTMreagent Kit with gDNA Eraser反转录试剂盒、SYBRTMPremixExTaqTMⅡ荧光定量试剂盒、pMD19-T载体购自TaKaRa公司,琼脂糖凝胶DNA回收试剂盒、2×Taq Master Mix、DH5α感受态细胞和质粒提取试剂盒均购自天根公司,其他试剂购自Solarbio公司。
1.3 总RNA提取及反转录
用TRIzol提取睾丸、心等组织总RNA,用反转录试剂盒合成cDNA,反转录体系20 μL:①5×gDNA Eraser Buffer 2 μL,Total RNA 1 μL(0.5 μg/μL),gDNA Eraser 1 μL,RNase Free H2O 6 μL,42 ℃反应2 min;②上一步骤的10 μL反应液加PrimeScript RT Enzyme Mix Ⅰ 1 μL,RT Prime Mix 1 μL,5 ×PrimeScript Buffer 4 μL,RNase Free H2O 4 μL,37 ℃反应15 min,85 ℃反应5 s。反应结束后,-20 ℃保存备用。
1.4 引物设计及合成
根据GenBank收录的猪StAR基因序列(NM_213755.2)及内参GAPDH基因序列(NM_001206359.1),引物使用Primer 5.0软件设计,引物由苏州金唯智生物科技有限公司合成(表1)。

表1 引物信息
1.5 表达量检测
以cDNA为模板,用RT-qPCR检测StAR基因在睾丸、心等组织中的表达量。反应体系20 μL,其中SYBRPremix Ex Taq Ⅱ 10 μL,上、下游引物各0.8 μL(0.4 μmol/μL),cDNA 2 μL,RNase Free H2O 6.4 μL。反应条件为95 ℃ 3 min;95 ℃ 15 s,58 ℃ 15 s,40个循环;72 ℃ 20 s。GAPDH基因为内参,用2-ΔΔCt法[18]计算相对表达量,用平均值±标准差(Mean±s)表示,用SPSS 20.0软件中单因素方差Duncan程序进行显著性检验。
1.6 克隆及测序
睾丸StAR基因PCR产物经1%的琼脂糖凝胶电泳,纯化目的片段,与pMD19-T载体连接并转入DH5α细胞,在不含AMP+的液体培养基中振荡培养45 min,取少许液体均匀涂抹于含有AMP+、X-Gal和IPTG的LB固体培养基上,37 ℃培养过夜。采集单个的白色菌落,置入含有AMP+的100 mL LB液体培养基中摇菌10 h,吸菌液做PCR,提取大小与目的条带一致的菌液质粒,进行Sanger测序。
1.7 生物信息学分析
合作猪StAR基因生物信息学分析工具参见表2。

表2 生物信息学分析工具
2 结果与分析
2.1 StAR基因克隆及测序
PCR产物经1%的琼脂糖凝胶电泳检测,获得特异性条带,与预期片段大小一致(图1)。测序后发现CDS区长858 bp,编码285个氨基酸,其中第572位点处的A突变为G,导致第191位点的赖氨酸突变成精氨酸,为错义突变,第791位点处插入1个碱基C,导致随后20个氨基酸发生突变,为移码突变(图2,3)。
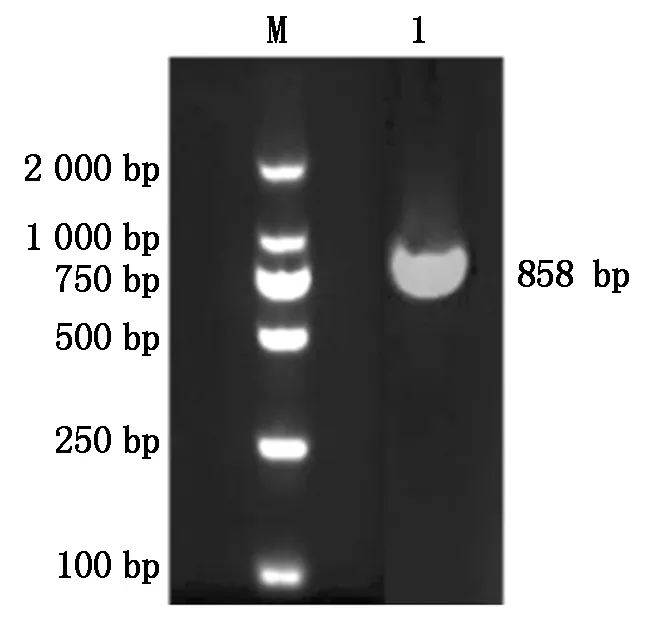
图1 合作猪StAR基因PCR扩增

图2 合作猪StAR基因测序结果分析

图3 合作猪StAR蛋白氨基酸序列比对
2.2 StAR基因同源性分析及系统进化树构建
下载人(NM_000349.3)、绵羊(NM_001009243.1)、狗(NM_001097542.1)、黑猩猩(XM_009455195.3)、家鼠(NM_011485.5)、马(NM_001081800.3)、猕猴(NM_001265769.1)、黄牛(NM_174189.3)、猪(NM_213755.2)和鸡(NM_204686.2)的核苷酸序列,使用Blast软件分析合作猪StAR基因的同源性(表3),用MEGA 7.0软件构建StAR基因的进化树(图4)。结果发现,合作猪与猪的亲缘关系最近,其次为黄牛和绵羊,与家鼠的亲缘关系最远。

图4 StAR基因系统进化树分析
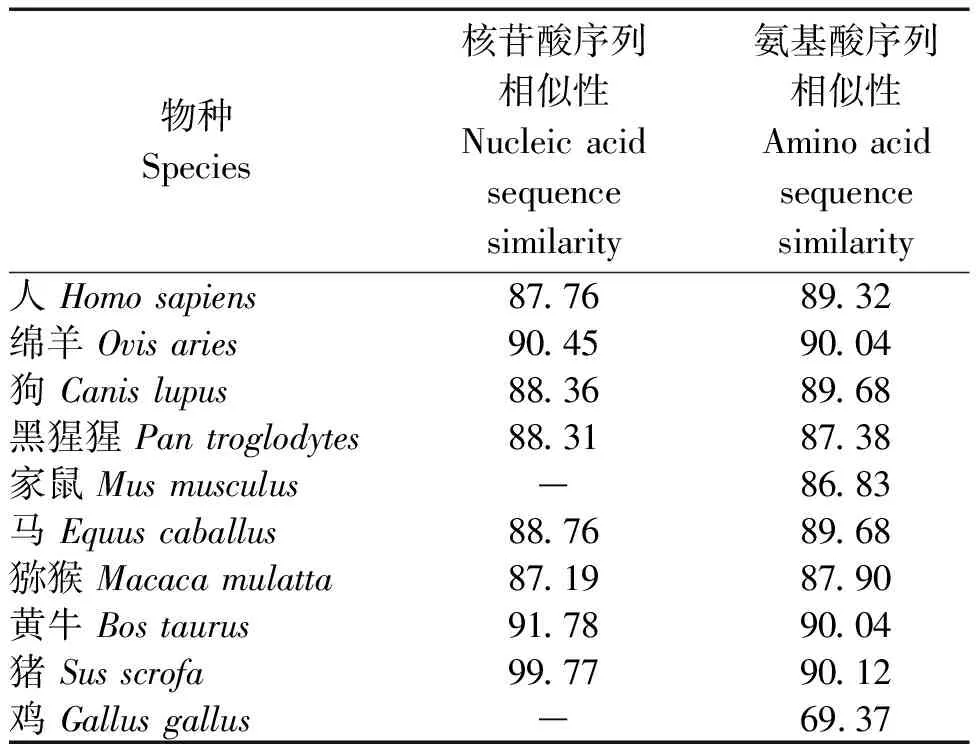
表3 合作猪StAR基因与其他物种序列比对
2.3 StAR蛋白理化性质分析
使用ProtParam软件预测合作猪StAR蛋白的理化性质。结果显示,分子式为C1391H2277N415O412S13,原子总数4 453,分子量90.95 ku,理论等电点(pI)8.87,消光系数(γ=280 nm)33 835,不稳定系数41.49,理论半衰期30 h,亲水性平均值-0.278。氨基酸残基中亮氨酸(11.6%)和精氨酸(8.5%)比例较高,带负电荷的天冬氨酸残基和谷氨酸残基31个,带正电荷的精氨酸残基和赖氨酸残基36个(图5)。
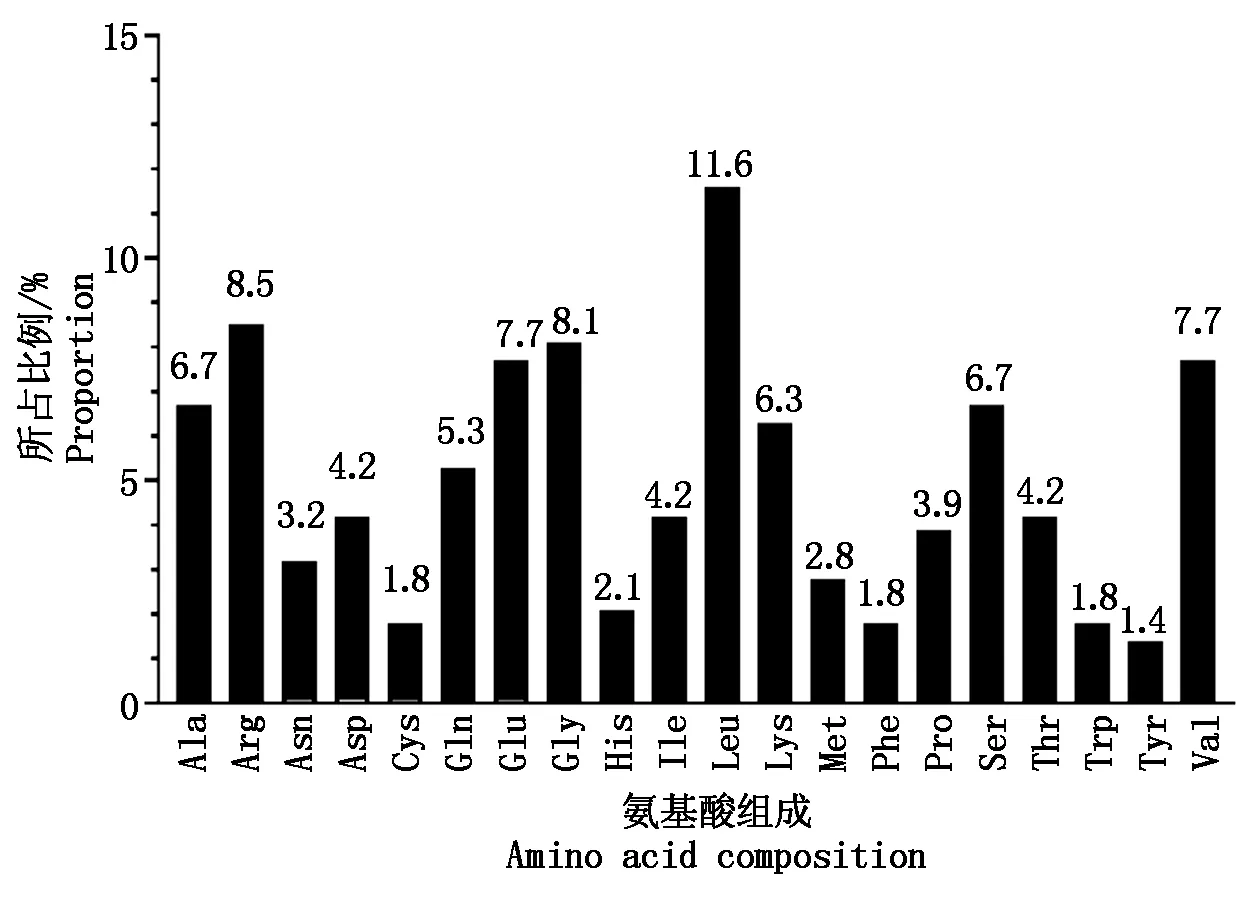
图5 合作猪StAR蛋白的氨基酸组成及频率
2.4 StAR蛋白二、三级结构预测
运用在线软件SOPMA预测合作猪StAR蛋白二级结构,发现二级结构由17.49%的延伸链、5.94%的β-转角、39.51%的α-螺旋和37.06%的无规则卷曲构成(图6-A)。采用在线软件SWISS-MODEL预测其三级结构,发现三级结构主要由α-螺旋、无规则卷曲构成(图6-B),与二级结构预测基本一致。

h.α-螺旋;t.β-转角;c.无规则卷曲;e.延伸链。
2.5 StAR蛋白亲疏水性分析
运用ExPASy在线软件Protscale分析合作猪StAR蛋白的亲/疏水性,氨基酸序列中第100位出现最小疏水值(-3.111),第200位出现最大疏水值(2.122),疏水性氨基酸残基少于亲水性氨基酸残基,推测为亲水性蛋白(图7)。

图7 合作猪StAR蛋白的疏水性分析
2.6 StAR蛋白跨膜区域及信号肽分析
采用TMHMM软件分析跨膜区域,预测期望值为0,无跨膜区域,是非跨膜蛋白(图8-A)。使用SignalP软件预测信号肽,发现剪切位点分值(Y)为0.152,信号肽酶切位点分值(C)为0.162,信号肽(S)的分值为0.312,该蛋白不存在信号肽,推测不是分泌蛋白(图8-B)。
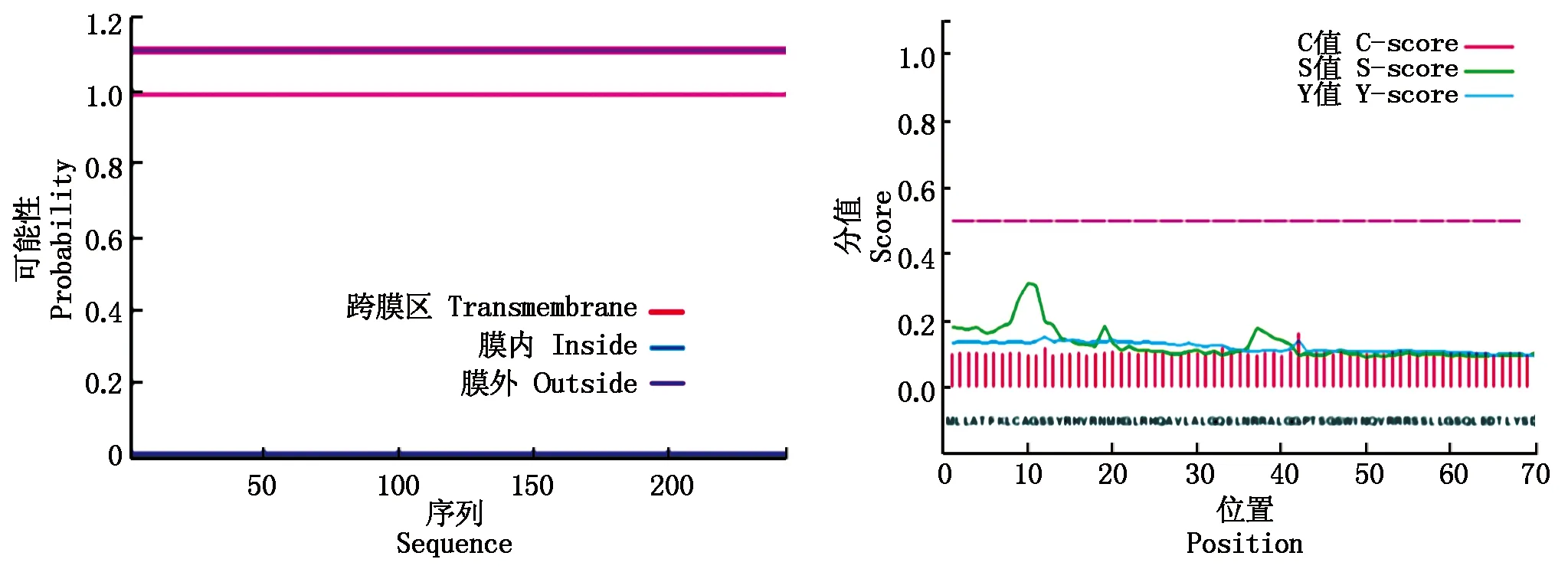
图8 合作猪StAR蛋白的跨膜区域(A)及信号肽(B)
2.7 StAR蛋白结构域预测
使用SMART软件预测合作猪StAR蛋白结构域的位置和种类,发现在76—282位氨基酸残基之间有一个START结构域,属于SRPBcc结构域蛋白超家族(图9)。

图9 合作猪StAR蛋白保守结构域预测
2.8 StAR蛋白糖基化修饰位点及亚细胞定位预测
通过NetNGlyc 1.0软件预测StAR蛋白糖基化修饰位点,发现第148位氨基酸处存在1个N-糖基修饰位点(图10-A)。采用PSORTⅡ软件对合作猪StAR蛋白进行亚细胞定位,发现分布在线粒体(52%)、细胞质(26%)、细胞核(18%)和分泌系统的囊泡(4%),推测是线粒体转运蛋白(图10-B)。
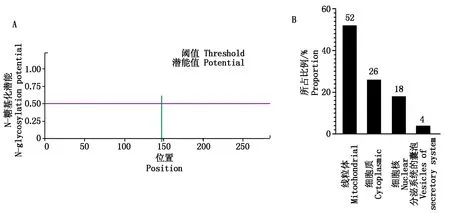
图10 合作猪StAR蛋白N-糖基化位点及亚细胞定位
2.9 StAR蛋白相互作用分析
通过STRING 11.5软件分析发现,StAR蛋白可能与FSHR、VDAC1、CERS6、NR5A1、TSPO等蛋白有相互作用(图11)。

图11 合作猪StAR蛋白网络互作分析图
2.10 StAR基因在合作猪各组织中的表达量
使用RT-qPCR检测StAR基因在合作猪不同组织中的表达水平,发现所有组织均表达,肺脏表达量最高,其次睾丸,且极显著高于脾脏、肾脏等组织(图12)。
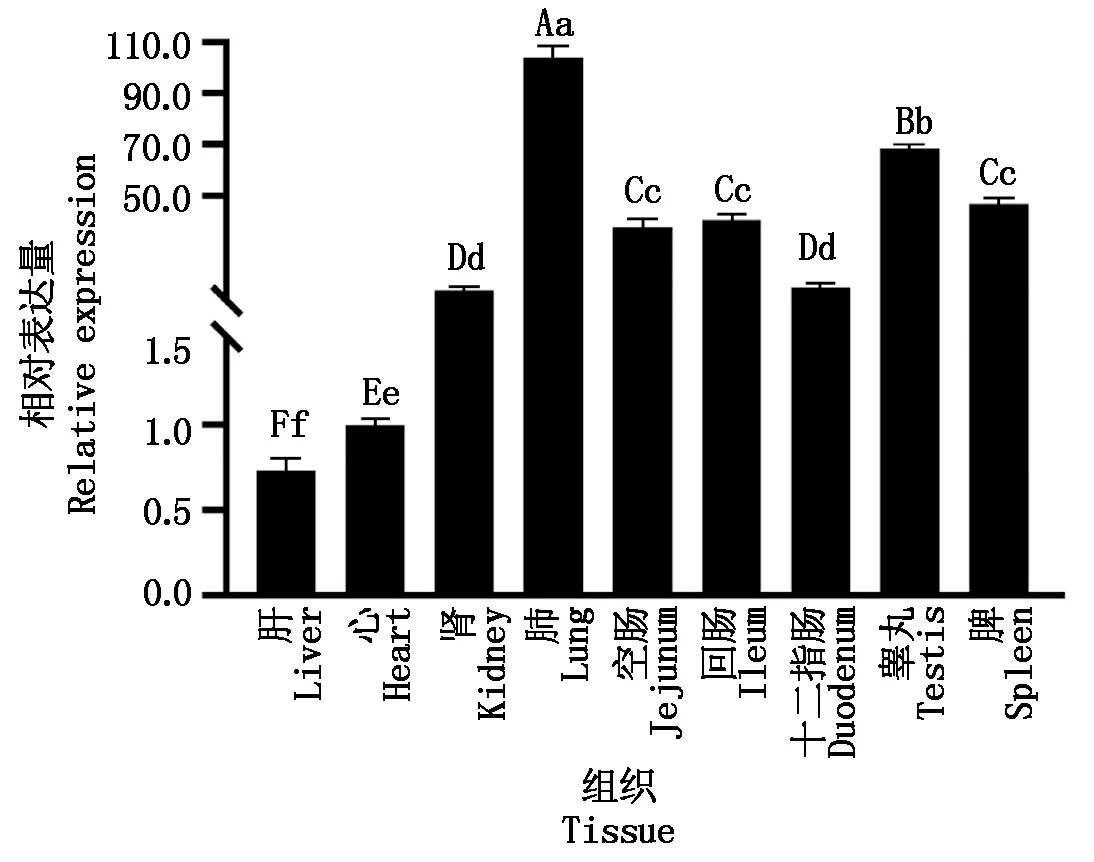
不同小写字母表示差异显著(P<0.05);不同大写字母表示差异极显著(P<0.01)。
3 结论与讨论
类固醇激素合成能力是影响畜禽繁殖力的重要因素之一。StAR基因编码的蛋白产物是类固醇激素合成过程中的重要限速酶,表达于肾上腺、卵巢﹑睾丸、胎盘等组织,对畜禽繁殖性状(如性别分化、精子发生、卵泡发育)有重要功能[19-21]。StAR-/-小鼠卵巢有早衰症状,具体表现为脂质沉积﹑基质细胞黄素化、卵泡不完全成熟等[13];胚胎期StAR基因在动物睾丸间质细胞前体的胞间隙中表达,随后在间质细胞中大量表达,在支持细胞中微量表达,最终影响生殖活动[7]。研究发现,人StAR基因序列的突变可引起肾上腺和性腺类固醇激素合成受阻,表现为脂样肾功能增生综合征[22],鸡StAR基因序列的突变影响胆固醇转运蛋白(如ABCA1、ABCG1)的表达量,引起胆固醇激素合成受阻,导致生殖机能异常[23]。以上研究表明,StAR基因对动物繁殖性状上有重要功能,其核酸序列突变可引起蛋白质功能的改变,影响动物繁殖。
目前,关于合作猪StAR基因相关研究未见报道,为获取合作猪StAR基因相关信息,本试验以合作公猪睾丸组织cDNA为模板,克隆该基因,发现CDS全长858 bp,编码285个氨基酸。刘宇等[5]发现牦牛StAR基因CDS全长858 bp,编码285个氨基酸,与本研究得到的结果一致。StAR基因的突变会引起类固醇激素含量的改变,影响睾丸功能[7,20]。本研究发现,与猪参考序列相比,合作猪StAR基因共有2处突变,第572位点处的A突变成G,导致第191位的赖氨酸突变成精氨酸,为错义突变,第791位点处插入一个碱基C,引起C端的20个氨基酸改变,为移码突变。推测合作猪StAR蛋白中21个氨基酸的改变,可提高蛋白活性,高效转运更多胆固醇进入内膜生成睾酮等类固醇激素,保证生活在高寒低氧环境中合作公猪正常的繁殖性能。为证实这种推测,今后将在细胞(如睾丸间质细胞)水平过表达正常StAR基因(对应野生型蛋白)及StAR基因突变(对应突变型蛋白),检测细胞合成类固醇激素的速率及含量。
StAR基因与猪同源性最高,遗传距离最近,亲缘关系最近,与黄牛﹑绵羊具有较高的同源性,在进化上是比较保守的。Bauer等[24]对鱼类、哺乳动物等StAR蛋白氨基酸序列做了比较﹐也发现该蛋白质在不同种类动物中具有很强的保守性,与本研究结果一致。StAR蛋白羧基端有一个START结构域,各物种间十分保守,在胆固醇运输过程中有重要功能,本研究也发现StAR蛋白在76—282位氨基酸处有一个START保守结构域。合作猪StAR蛋白是不稳定的亲水性蛋白,定位在线粒体,这与杨沛方等[25]在单、多羔黔北麻羊母羊性腺组织中StAR基因的研究结果一致。StAR蛋白互作网络图显示,其与VDAC1(电压依赖性阴离子通道1)等蛋白相互作用。VDAC属于线粒体孔道蛋白,参与多种细胞代谢物/离子的跨膜转运。Bose等[26]研究发现,肾上腺细胞中磷酸化StAR蛋白能与线粒体外膜上的VDAC1蛋白相互作用,能促进37 ku磷酸化StAR蛋白到32 ku中间体的加工。采用RT-qPCR检测该基因在合作猪不同组织中的表达丰度,结果发现,睾丸表达量较高,与StAR蛋白的功能及睾丸是类固醇激素主要来源的内分泌特性相吻合。
本研究克隆了合作猪StAR基因,CDS区长858 bp,编码285个氨基酸,是亲水性蛋白,有典型的START结构域,物种间十分保守,睾丸表达量较高。表明StAR基因在合作猪睾丸发育及性成熟过程中发挥了重要功能,此研究为进一步解析合作猪StAR基因发挥功能的分子调控机制提供了参考。
