不同果型黄瓜子房的组织学观察及其与内源激素含量的关系
2021-05-31刘晓晓潘玉朋丁圆圆王曦奥程智慧孟焕文
刘晓晓,潘玉朋,刘 策,丁圆圆,王曦奥,程智慧,孟焕文
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
黄瓜(CucumissativusL.,2n=2x=14)是葫芦科1年生蔓性草本植物,起源于印度西北部喜马拉雅山脉南麓[1],在我国已有2 000多年的栽培史[2]。黄瓜是世界十大蔬菜之一[3],不仅在我国蔬菜产业中占据重要地位,在全球范围的消费需求和栽培面积也位居前列。黄瓜果型包括果实大小和形状,由于消费习惯或加工需求的不同,不同果型的黄瓜被不同的消费市场所青睐,故果型是黄瓜遗传改良育种的重要品质和产量性状。
黄瓜果型在其子房期即表现出丰富的多样性,不同黄瓜种质间的果型差异极大,如果实小且呈卵圆形的野生种质、果实形态各异的半野生种质,以及适于不同消费类型的栽培品种。果型由细胞数目和细胞大小共同决定[4]。每个细胞都是激素活动的产物,所有的活细胞都对激素的作用有响应[5],已有研究表明,植物内源激素参与了细胞分裂和细胞膨大的调控,与果实发育有着密切的关系[6]。然而,对黄瓜果型在组织以及内源激素水平上的差异内因尚不明了。有研究指出,子房期的黄瓜果实长度和果形指数分别与成熟果实的长度和果形指数有极显著正相关性,即可用子房期的黄瓜果型来预测黄瓜最终的果型[7]。因此,本研究拟对不同果型黄瓜的子房进行组织学观察和内源激素含量测定,从而在组织学水平和激素水平上揭示黄瓜果型差异的机制,以期为后续深入阐明黄瓜果型建成的内在调控机制奠定基础。
1 材料与方法
1.1 试验材料
以12个果实大小和形状差异较大的黄瓜自交系作为试验材料(表1,图1),材料均由威斯康辛大学Weng Yiqun教授提供。
表1 供试黄瓜材料信息Table 1 Information of tested cucumbers
于2019年春季种植于西北农林科技大学园艺场的塑料拱棚中,生长期间进行常规管理。进入开花期后,于每天上午09:00-11:00,在主蔓10~15节取开花当天(开花的第1天)的雌花子房用于后续试验。
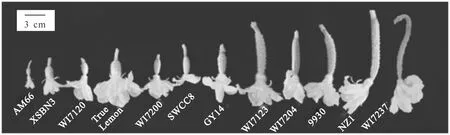
图中各材料信息与表1同。下图同The material information is the same as Table 1,the same below图1 不同果型黄瓜开花当天的子房Fig.1 Cucumber ovaries with different fruit sizes and shapes at anthesis
1.2 试验方法
1.2.1 子房形态学指标测定 采集开花当天的子房,测量子房长度、子房横径和种腔横径,计算子房形状指数(子房形状指数=子房长度/子房横径),测量标准参照李锡香[8]的方法,每个自交系测量6个子房,结果取平均值。
1.2.2 子房细胞数目和细胞面积测定 采集开花当天的子房,每个自交系采集6个子房,其中3个用作纵切面观察,另外3个用作横切面观察,用锐刀切取子房中部并立即放入FAA固定液(V(体积分数70%酒精)∶V(甲醛)∶V(乙酸)=90∶5∶5)。石蜡切片的制作参照李正理[9]的方法,通过梯度酒精脱水、二甲苯透明、浸蜡、包埋、旋转切片机切片(Leica RT2235)、脱蜡、甲苯胺蓝染色等步骤,于Olympus BX51显微镜下观察并拍照。每个样本随机选择3个视野,统计视野中所有细胞数目N和细胞总面积S,子房横切面面积S′=总横切面面积-横切面种腔面积(以圆的面积公式计算),子房纵切面面积S′=总纵切面面积-纵切面种腔面积(以长方形的面积公式计算),子房纵、横切面的细胞数目N′计算公式为:N′=NS′/S,平均细胞面积为:A=S/N,最后取平均值。在每样本的中果皮部位选取500 μm×500 μm区域,对该区域的细胞进行计数,即为细胞密度,最后取平均值。细胞数目、细胞面积统计应用Fiji软件(https://imagej.net/Fiji)完成。
1.2.3 子房内源激素含量测定 采集开花当天的子房,摘取3~5个子房作为1个生物学重复,每个自交系设3个生物学重复,采摘后立即放入液氮速冻并放置于-80 ℃冰箱保存。内源激素生长素(IAA)、玉米素(ZT)、反式玉米素核苷(tZR)、赤霉素(GA3)、脱落酸(ABA)和茉莉酸(JA)的提取参照Pan等[10]的方法,将3~5个子房混合,全部用液氮研磨后称取2 g样品,然后加入20 mL提取剂(V(异丙醇)∶V(水)∶V(浓盐酸)=2∶1∶0.002),-20 ℃预冷,样品与提取剂保持比例为1∶10(g/mL)),-20 ℃避光保存16 h;离心(4 ℃,10 000 r/min,15 min)后取全部上清,向装有上清的离心管中加入30 mL二氯甲烷(V(提取剂)∶V(二氯甲烷)=1∶1.5),摇床振荡1 h(4 ℃,130 r/min),离心(4 ℃,10 000 r/min,15 min)取出全部下相倒入蒸馏瓶中;旋转蒸发仪浓缩(38 ℃,55 r/min),样品蒸干后,用1 mL色谱级甲醇溶解瓶内物质,0.22 μm有机过滤头过滤,最后用液质联用仪LC-MS/MS(QTRAP 5500,AB Sciex)测定。由于AM66、SWCC8和XSBN3未达到检测要求,所以只测了其他9个自交系的内源激素。
1.3 数据处理
数据处理和作图均在R软件包(Version 3.6.3,https://www.r-project.org)中进行。相关性分析通过计算皮尔森相关系数(Pearson correlation coefficient)完成(https://cran.r-project.org/web/packages/psych/),多个自交系之间利用Tukey’s test进行重复间的差异显著性分析。
2 结果与分析
2.1 不同果型黄瓜子房的形态学分析
由图2可见,不同果型黄瓜开花当天的子房大小和形状不同,一些自交系间的子房形态存在显著差异,其中WI7237子房最长,子房形状指数最大;而AM66、XSBN3、WI7120、True Lemon和WI7200的子房较短,子房果形指数较小。XSBN3、True Lemon和WI7204的子房横径较粗;XSBN3的种腔横径最大,True Lemon和WI7204次之。不同果型黄瓜自交系之间子房长度的长短规律与子房形状指数基本一致,而子房横径与种腔横径的规律则相一致。
通过对子房大小性状进行相关分析,计算各性状间的皮尔森相关系数,结果表明,子房形状指数与子房长度极显著正相关(0.953 1,P<0.001),与子房横径显著负相关(-0.416 1,P<0.05),说明二者均对黄瓜的果型形成具有重要作用。种腔横径与子房横径极显著正相关(0.891 1,P<0.001),说明种腔横径对子房横径有重要影响。
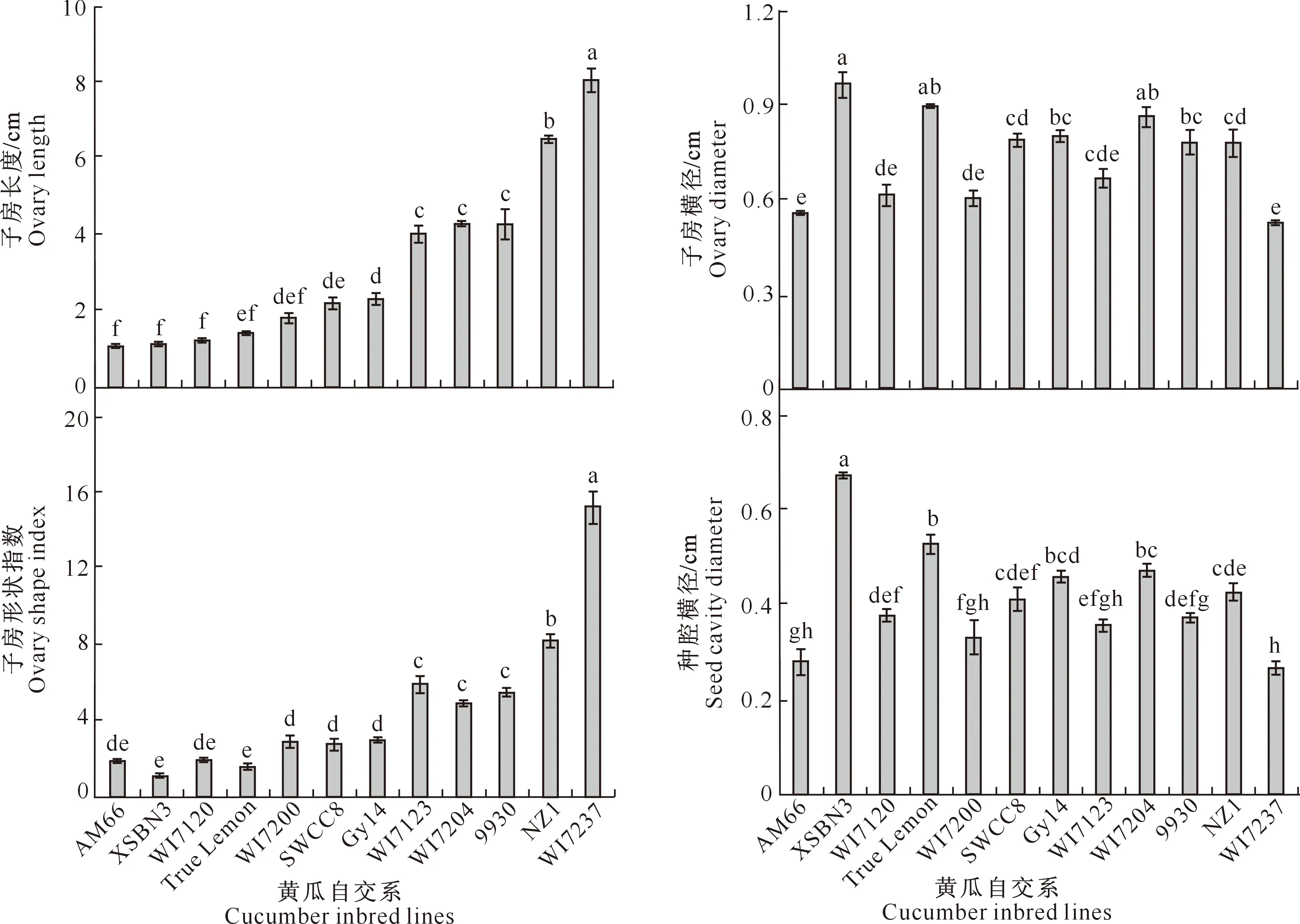
图柱上标不同小写字母表示差异达显著水平(P<0.05),下图同Different lowercase letters indicate significant difference (P<0.05),the same below图2 不同果型黄瓜开花当天的子房形态指标Fig.2 Morphological index of cucumber ovaries with different fruit sizes and shapes at anthesis
2.2 不同果型黄瓜子房的组织学分析
对不同果型黄瓜开花当天子房纵切面和横切面的观察结果见图3和图4。
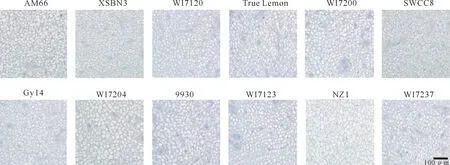
图3 不同果型黄瓜开花当天子房纵切面细胞(标尺=100 μm)Fig.3 Cell in longitudinal section of cucumber ovaries with different fruit sizes and shapes at anthesis (bar=100 μm)
对不同果型黄瓜开花当天子房纵切面(图3)和横切面(图4)的细胞数目、细胞面积、细胞密度进行分析发现,子房较长的NZ1、9930的纵切面细胞数目较多,子房较短的AM66、XSBN3、WI7120、True Lemon和WI7200的纵切面细胞数目较少(图5-A);XSBN3、True Lemon和SWCC8的横切面细胞数目较多,AM66的横切面细胞数目最少,其他自交系间均无明显差异(图5-B)。WI7204和AM66的纵、横切面细胞面积均较大,Gy14的纵切面细胞面积较小,WI7120和SWCC8的横切面细胞面积较小(图5-C,D)。XSBN3的纵切面细胞密度较大,NZ1的较小;WI7120的横切面细胞密度较大,WI7204的较小(图5-E,F)。综合上述结果可知,不同果型黄瓜自交系之间子房纵切面细胞数目的变化规律与子房长度大致相同,子房横切面细胞数目的多少则与子房横径变化规律相似。

图4 不同果型黄瓜开花当天子房横切面细胞(标尺=100 μm)Fig.4 Cell in cross section of cucumber ovaries with different fruit sizes and shapes at anthesis (bar=100 μm)
由表2可知,不同果型黄瓜开花当天子房长度与横径无显著相关性,子房纵切面细胞数目与横切面细胞数目无显著相关性,而子房纵切面细胞面积和横切面细胞面积有极显著正相关性。不同果型黄瓜开花当天子房纵切面细胞数目分别与子房长度和子房形状指数有极显著正相关性,子房横切面细胞数目分别与子房横径和子房形状指数有极显著正相关性和显著负相关性;而子房纵切面细胞面积和细胞密度与子房长度及子房形状指数均无显著相关性,子房横切面细胞面积和细胞密度与子房横径及子房形状指数均无显著相关性。以上结果显示,不同果型黄瓜子房长度和横径的差异主要是由细胞数目差异引起的,且子房长度和横径与子房形状指数显著相关,说明黄瓜果型的差异主要是由细胞数目不同所致。
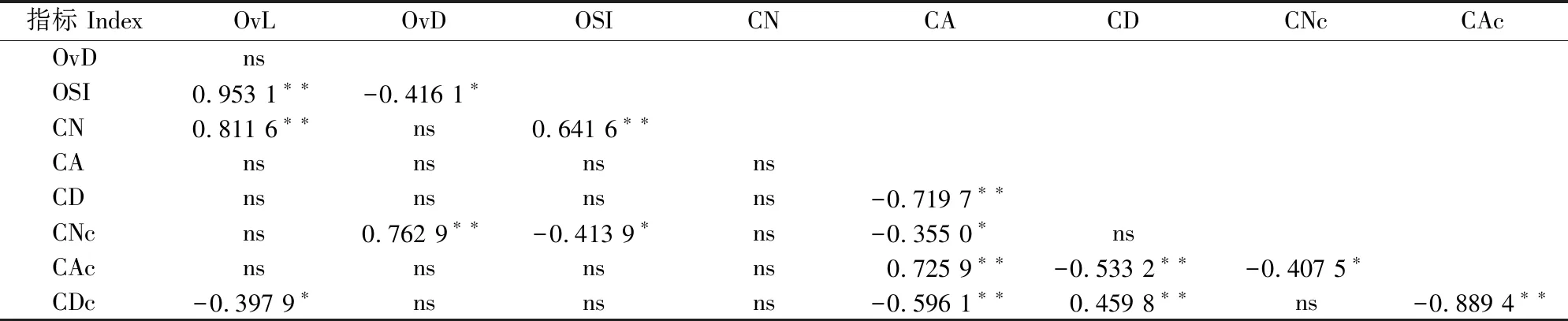
表2 不同果型黄瓜开花当天子房大小与细胞数目、面积和密度间的相关性Table 2 Correlation among ovary size and cell number,area and density in cucumbers with different fruit sizes and shapes at anthesis
2.3 不同果型黄瓜子房的内源激素含量比较
由表3可见,不同果型黄瓜开花当天子房中,WI7237的IAA含量较高,True Lemon较少,其他自交系间均无显著差异;9930和WI7204的ZT含量较高,WI7120和WI7200较少,其他自交系间均无显著差异;WI7200的tZR含量较高,WI7123和9930较少,其他自交系间均无显著差异;WI7120的GA3含量最高,总体表现为子房较长的自交系GA3含量较低,子房较短的自交系含量较高;WI7120的ABA含量最高,WI7200最低,其他自交系间无显著差异;9930的JA含量较高,True Lemon、WI7200和WI7237较低,其他自交系间无显著差异。
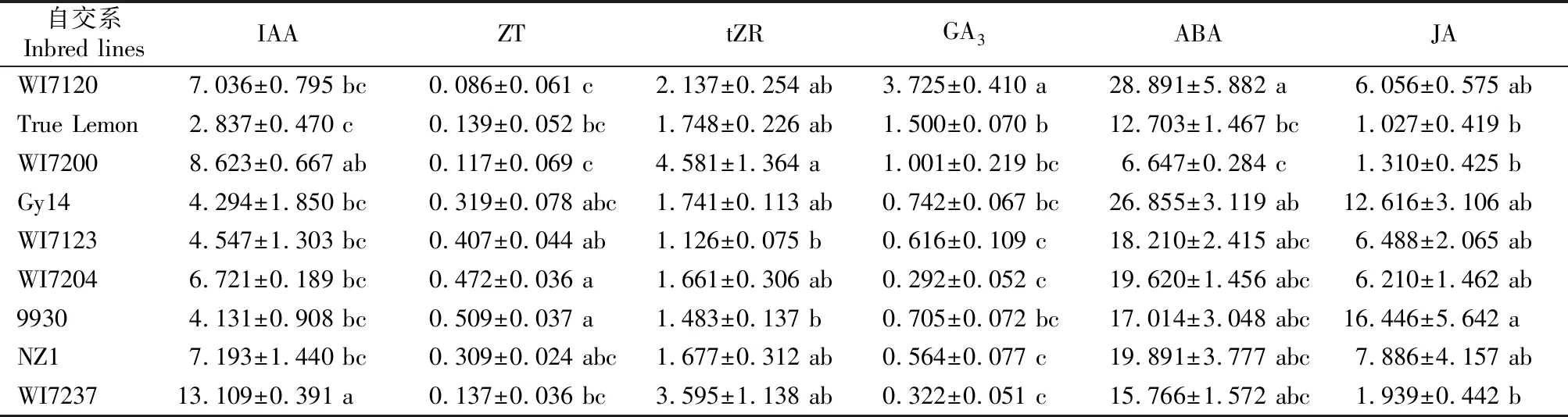
表3 不同果型黄瓜开花当天子房内源激素含量的比较Table 3 Comparison of endogenous hormone content of cucumber ovaries with different fruit sizes and shapes at anthesis ng/g
由表4可知,不同果型黄瓜自交系中,IAA含量与子房长度和子房形状指数有极显著正相关性,与子房横径有极显著负相关性,说明IAA可能通过促进子房伸长,抑制子房横向增长而影响黄瓜果型的形成。ZT含量与子房横径有显著正相关性,说明ZT对子房横径的生长有促进作用;ZT含量与子房横切面细胞面积有极显著正相关性,而与横切面细胞密度有显著负相关性,说明ZT可能通过促进子房横切面细胞面积增大而促进子房横径生长。tZR含量与子房横径和子房横切面细胞数目有显著负相关性,说明tZR可能通过抑制横切面细胞分裂影响子房横径大小。GA3含量与子房长度、子房形状指数和子房纵切面细胞数目均有极显著负相关性,说明GA3可能通过抑制纵切面细胞分裂影响子房长度和子房形状指数。ABA和JA含量总体而言对子房相关指标影响不大。

表4 不同果型黄瓜开花当天子房大小和细胞相关性状与内源激素含量的相关性Table 4 Correlation among ovary size and cell traits and endogenous hormone content in cucumbers with different fruit sizes and shapes at anthesis
3 讨 论
果实最终大小取决于花前因素和果实的早期生长[11],可以根据子房期的果型预测黄瓜成熟果实的果型[7]。本研究通过比较不同果型黄瓜子房纵、横切面的细胞数目、细胞面积和细胞密度,在组织学水平上揭示了黄瓜果型差异的原因。前人的研究表明,不同品种间果实大小主要是由细胞数目而不是细胞大小决定的,例如甜瓜[12]、甜樱桃[13]、桃[14]和梨[15]等作物。本研究结果与上述结果基本相同,但上述研究仅比较了果实纵切面或横切面细胞,本研究则同时对纵切面和横切面细胞数目进行了比较,发现纵、横切面细胞数目分别与子房长度和横径有极显著相关性,子房纵横切面细胞面积和细胞密度与子房长度或子房横径及子房形状指数均无显著相关性,说明子房长度和横径的差异是由细胞数目的差异引起的,且子房长度和横径均与子房形状指数显著相关,进一步表明黄瓜果型差异主要是由细胞数目决定的。但对于子房横径而言,种腔横径与子房横径之间有极显著正相关性,说明除子房横切面细胞数目外,种腔横径也对黄瓜子房横径有一定作用,从而影响黄瓜的果型。
IAA是参与调节植物生长发育的重要激素,影响细胞的扩增和分裂、细胞的伸长和分化以及多种生理反应,从而影响植物细胞和组织的形状和功能[16-18]。有研究表明,一定浓度的IAA对黄瓜果实有显著促进作用[19]。本研究中IAA含量与子房长度有极显著正相关性,子房期的黄瓜果实处于果实发育的早期阶段,为细胞分裂的旺盛期,不同自交系纵切面细胞数目的大小顺序与子房长度相似,然而纵切面细胞面积除WI7204与AM66较大外,其余自交系之间无显著差异,说明IAA可能通过促进细胞分裂来促进黄瓜子房的伸长。IAA含量与子房横径和横切面细胞数目均有极显著负相关性,说明IAA主要促进黄瓜子房纵向伸长,并在一定程度上通过阻碍子房横向细胞的分裂来抑制黄瓜子房横向生长。ZT可以促进细胞分裂,ZT含量与子房纵切面细胞数目有显著正相关性,表明ZT可以促进黄瓜子房纵切面细胞分裂;ZT也可以促使细胞体积扩大,它的主要作用是使细胞横向扩大,而不是纵向伸长[20]。本研究中ZT含量与子房横径有显著相关性,与子房横切面细胞面积和细胞密度分别有极显著正相关性和显著负相关性,说明ZT主要通过增加子房横向细胞面积促进黄瓜子房横向增长。tZR含量与子房横径和子房横切面细胞数目均有显著负相关性,表明tZR对子房横向细胞分裂可能有抑制作用。GA3与IAA在促进细胞分裂和细胞伸长方面具有重要功能[21],但GA3是促进生长还是抑制生长(尤其是黄瓜果实)与其浓度有着极为密切的关系,低浓度时抑制生长,而高浓度时则表现为促进生长,而且其对瓜条纵向生长的促进作用远大于横向[19]。本研究中GA3含量与子房长度、子房形状指数和子房纵切面细胞数目均有极显著负相关性,表明GA3可能通过抑制纵切面细胞分裂影响子房长度。有研究发现,在黄瓜子房期中,CsSUN和CsLNG1抑制细胞膨胀相关基因的表达并减小GA3/ABA值,可使细胞相比其他材料变小,细胞密度相对变大,导致子房相对变大[22]。综上分析认为,IAA、ZT、tZR、GA3的含量均与黄瓜子房大小和形状有关。
