急性缺血性脑卒中患者血清s-100β、NT-proBNP及cTnI水平变化与其病情进展的关系
2023-09-02吕亚敏李冰洋亓静阳
吕亚敏 李冰洋 亓静阳
安阳市第六人民医院检验科(河南 安阳 455000)
急性缺血性脑卒中又称急性脑梗死(ACI),是一种发病率高、致残率高、致死率高的疾病,多是因为脑组织突发供血障碍,发生缺血、缺氧性坏死,进而造成脑组织功能障碍,其对脑组织的损害会导致患者出现神经功能缺损症状,严重影响患者病情转归[1]。及早对脑卒中患者病情进展做出判断,合理分配医疗资源,提供针对性护理、康复措施,对患者病情恢复及远期生活质量改善意义重大。当前临床上多通过影像学手段及NIHSS量表评估患者神经功能损害程度,也有学者指出可以通过检测血清尿酸、C反应蛋白、白细胞介素等物质来评估患者卒中严重程度及预后情况[2-3],但因为相关研究较少,仍缺乏明确的血液指标可为医师在对患者卒中程度及预后情况做出诊断时提供确切参考。已有研究证实[3-5],急性缺血性脑卒中发生后,患者血清内s-100β蛋白、NT-proBNP、cTnI水平会发生较大变化,s-100β蛋白是神经系统营养因子,对神经系统正常发育意义重大,但过量表达则会加重炎症反应。脑钠肽(BNP)在脑、心、脊髓等组织含量较高,脑卒中发生后,BNP会因此发生变化,NT-proBNP为BNP的裂解产物,因其半衰期较长且敏感性较高,可以作为脑卒中的检测指标。cTnI为一种心肌酶,当心肌损伤时会在血清内大量表达,在脑卒中临床诊断具有一定参考意义。本文作者通过对比急性缺血性脑卒中患者不同发病时间后血清s-100β、NT-proBNP及cTnI水平变化及与其NIHSS、mRs评分的关系,探讨血清s-100β、NTproBNP及cTnI水平变化与其病情进展的关系,以期为临床诊断及预后提供参考,现总结如下。
1 资料与方法
1.1 一般资料选取2019年1月至2022年5月在我院就诊的急性缺血性脑卒中患者共95例作为观察组,其中男性55例,女性40例,年龄46~75岁,平均(58.6±7.2)岁。另选取同期在我院健康体检的50~75周岁健康老年人60例作为对照组,其中男性38例,女性22例,年龄48~74岁,平均(59.0±6.9)岁。
入选标准:年龄50~80岁;患者符合《中国急性缺血性脑卒中诊治指南2018》[6]中关于急性缺血性脑卒中的诊断标准;患者通过颅脑CT或磁共振成像MRI检查证实为急性缺血性脑卒中;患者为初次发病并于24h内入院治疗;临床资料齐全。排除标准:并发全身其他部位严重炎症者;并发其他严重肢体障碍者;并发其他严重精神障碍者;并发心肌疾病者;并发严重肝肾功能不全者;并发其他严重内分泌疾病者;既往有心脑疾病者。
1.2 研究方法
1.2.1标本采集 观察组患者发病24h、7d、14d的清晨空腹状态下静脉取血5ml,对照组于体检清晨空腹状态下静脉取血5ml,所有标本专人收集,于低温静置60min,使用高速离心机以3000r/min的转速离心10min分离血清,-70℃低温冻存待检。
1.2.2 血清检测 使用S100-β蛋白(S100-β)试剂盒检测血清s-100β(试剂盒购自武汉明德生物科技股份有限公司),NTproBNP仪器为cobas e411(罗氏 e411),采用贝克曼DXI800全自动化学发光仪检测cTnI。
1.2.3 研究分组 1)病情分组[7]:入院后使用NIHSS量表评测患者神经功能缺损程度并将其分为轻症组和重症组,量表分值0~42分,其中评分<7分为轻症组,评分≥7分为重症组。轻症组59例,男性37例,女性22例,年龄46~72岁,平均(58.9±7.3)岁;重症组36例,男性21例,女性15例,年龄48~75岁,平均(58.1±7.2)岁。轻症组与重症组一般临床资料比较,差异不具有统计学意义(P>0.05)。2)预后分组[8]:发病期3个月后对患者进行复诊,使用mRs量表评测患者神经功能恢复状态并将患者分为预后良好组和预后不良组,量表分值0~6分,其中评分≤2分为预后良好组,评分≥3分为预后不良组。预后良好组74例,男性42例,女性32例,年龄46~73岁,平均(58.5±6.9)岁;预后不良组21例,男性13例,女性8例,年龄49~75岁,平均(59.0±7.4)岁。预后良好组与预后不良组一般临床资料比较,差异不具有统计学意义(P>0.05)。
1.3 观察指标(1)对比轻症组与重症组患者发病24h与对照组健康人群血清s-100β、NT-proBNP、cTnI水平;(2)对比轻症组与重症组患者发病24h、7d、14d血清s-100β、NT-proBNP、cTnI水平;(3)对比预后良好组与预后不良组患者24h、7d、14d血清s-100β、NT-proBNP、cTnI水平;(4)分析轻症组与重症组患者24h血清s-100β、NT-proBNP、cTnI水平与入院后NIHSS评分相关性;(5)分析预后良好组与预后不良组患者24h血清s-100β、NT-proBNP、cTnI水平与发病期3个月后mRs评分相关性。
1.4 统计学方法所有资料数据使用EXCEL表格录入,使用统计学软件SPSS 22.0分析处理。计数资料以率(%)表示,卡方(χ2)检验,计量资料以均数±标准差(±s)表示,独立样本t检验,相关性分析使用Pearson法,以P<0.05代表差异具有统计学意义。
2 结 果
2.1 轻症组与重症组发病24h与对照组健康人群血清s-100β、NT-proBNP、cTnI水平轻症组、重症组血清s-100β、NTproBNP、cTnI水平均显著高于对照组(P<0.05),重症组血清s-100β、NT-proBNP、cTnI水平均明显高于轻症组(P<0.05)。见表1。
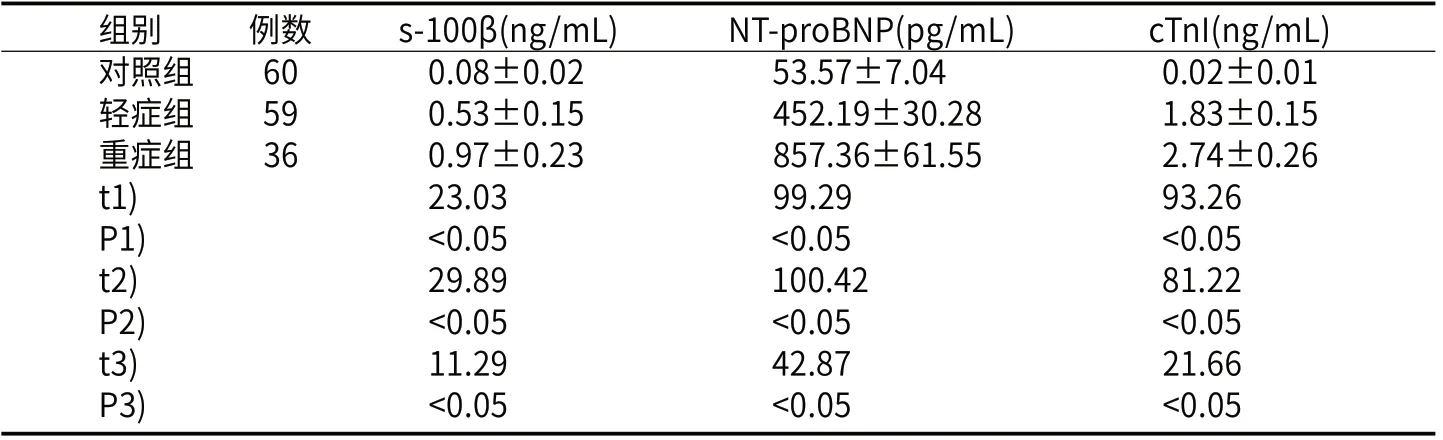
表1 三组血清s-100β、NT-proBNP、cTnI水平对比
2.2 轻症组与重症组发病24h、7d、14d血清s-100β水平轻症组与重症组血清s-100β水平在发病24h最高,发病7d、14d血清s-100β水平有所下降;轻症组在发病24h、7d、14d血清s-100β水平均低于重症组(P<0.05)。见表2。
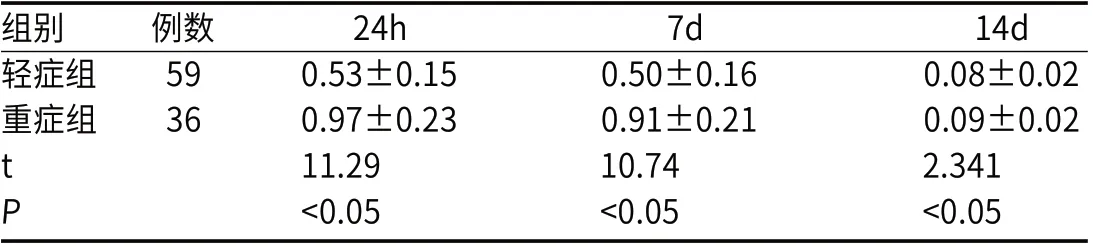
表2 轻症组、重症组24h、7d、14d血清s-100β水平对比
2.3 轻症组与重症组发病24h、7d、14d血清NT-proBNP水平轻症组与重症组血清NT-proBNP水平在发病24h最高,发病7d、14d血清NT-proBNP水平逐渐下降,轻症组在发病24h、7d、14d血清NT-proBNP水平均低于重症组(P<0.05)。见表3。
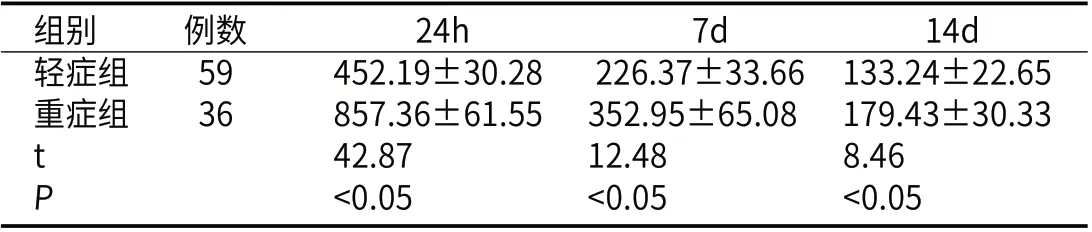
表3 轻症组、重症组24h、7d、14d血清NT-proBNP水平对比
2.4 轻症组与重症组发病24h、7d、14d血清cTnI水平轻症组与重症组血清cTnI水平在发病24h最高,发病7d、14d血清cTnI水平逐渐下降,轻症组在发病24h、7d、14d血清cTnI水平均低于重症组(P<0.05)。见表4。
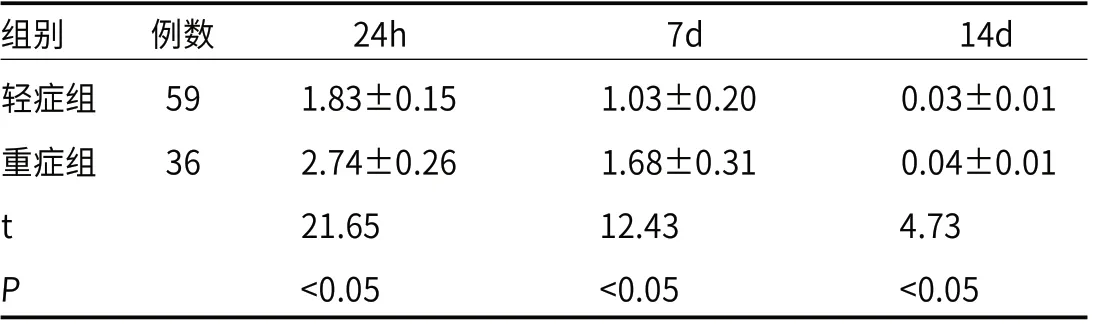
表4 轻症组、重症组24h、7d、14d血清cTnI水平对比

表5 预后良好组与预后不良组24h、7d、14d血清s-100β水平对比

表6 预后良好组与预后不良组24h、7d、14d血清NT-proBNP水平对比
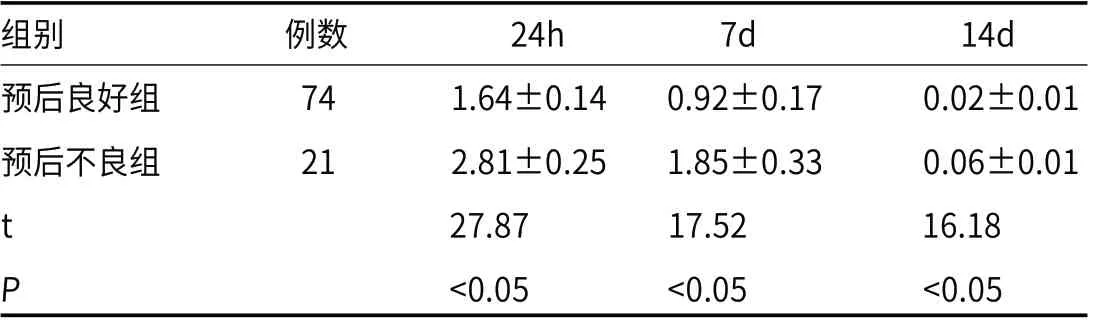
表7 预后良好组与预后不良组24h、7d、14d血清cTnI水平对比
2.5 轻症组与重症组发病24h血清s-100β、NT-proBNP、cTnI水平与NIHSS评分关系单因素相关性分析发现,急性缺血性脑卒中患者发病24h血清s-100β、NT-proBNP、cTnI水平均与入院NIHSS评分呈正相关(P<0.05)。见表8。
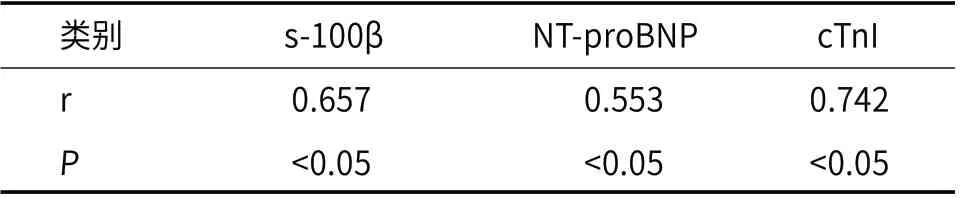
表8 发病24h血清s-100β、NT-proBNP、cTnI水平与NIHSS评分相关性
2.6 预后良好组与预后不良组24h、7d、14d血清血清s-100β水平预后良好组24h、7d、14d血清s-100β水平均低于预后不良组(P<0.05)。见表5。
2.7 预后良好组与预后不良组24h、7d、14d血清血清NTproBNP水平预后良好组24h、7d、14d血清NT-proBNP水平均低于预后不良组,差异具有统计学意义(P<0.05)。见表6。
2.8 预后良好组与预后不良组24h、7d、14d血清cTnI水平预后良好组24h、7d、14d血清cTnI水平均低于预后不良组(P<0.05)。见表7。
2.9 预后良好组与预后不良组24h血清s-100β、NT-proBNP、cTnI水平与mRs评分关系单因素相关性分析发现,急性缺血性脑卒中患者发病24h血清s-100β、NT-proBNP、cTnI水平均与发病3个月后mRs评分呈正相关(P<0.05)。见表9。
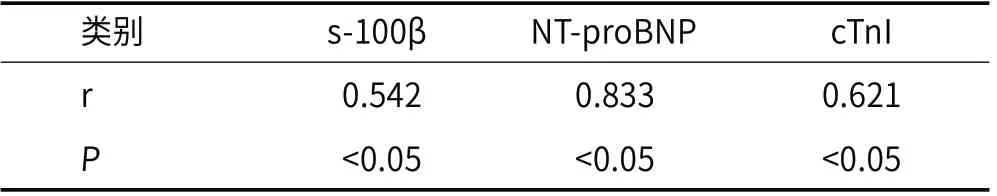
表9 发病24h血清s-100β、NT-proBNP、cTnI水平与mRs评分相关性
3 讨 论
急性缺血性脑卒中为临床常见病、高发病,属于老年人常发脑血管疾病,因卒中发生后会造成脑组织缺血坏死,进而导致神经功能损伤,故致残率、致死率较高。随着我国逐步步入老龄化社会,脑卒中发病率逐渐上升,脑卒中发生后的诊疗以及后期护理对患者身体机能恢复至关重要,如何准确评估病情严重程度及对预后作出分析为亟需探究的课题。当前临床针对脑卒中的诊断多是通过颅脑CT或磁共振成像MRI的方式,在血液学方向缺乏较为明确的诊断指标[9-10]。
s-100β蛋白于1965年首次于牛脑组织中发现,可以促进神经元生长、分化,正常情况下极少存在于血液中,仅在脑部发生病变后,因脑组织损伤,s-100β会穿透血-脑屏障,在血液中含量提升,对神经功能损伤具有较高特异性,一项研究通过对30例进展性急性脑梗死患者与60例非进展性急性脑梗死患者对照发现,s-100β水平的增高可能是导致脑梗死病情恶化的重要因素[11]。NT-proBNP为BNP的代谢产物,存在于大脑、心脏、肺部等组织,因NT-proBNP具备半衰期长、敏感性高等特点,常用于心肌损伤的检测,急性缺血性脑梗死发生后,因体内的炎症反应影响,NT-proBNP在血液中的表达也会发生较大变化,学者朱红等通过研究发现,血清NT-proBNP水平与脑损伤程度及神经功能缺损程度关系密切[12]。cTnI一般存在于心肌细胞,在心肌受损后大量表达,特异性很高,多用于心肌损伤检测,近年来有研究发现,脑组织受损后,血清cTnI水平也会变化,通过检测cTnI水平可以评估脑卒中患者神经功能[13-15]。
本文对比了急性缺血性脑卒中患者及健康人群血清s-100β、NT-proBNP、cTnI水平,同时比较了轻症患者、重症患者在发病24h、7d、14d血清s-100β、NT-proBNP、cTnI水平,发现脑卒中患者血清s-100β、NT-proBNP、cTnI水平均要明显高于健康人群(P<0.05),重症患者要明显高于轻症患者(P<0.05),提示血清s-100β、NT-proBNP、cTnI水平可作为脑卒中病症严重程度的参考,若s-100β、NT-proBNP、cTnI在血清中表达过高,则需考虑增加医护资源并重点关注。本文同时对比了预后良好患者与预后不良患者在发病24h的血清s-100β、NT-proBNP、cTnI水平,结果发现预后良好患者血清s-100β、NT-proBNP、cTnI水平要显著低于预后不良患者(P<0.05),推测可能与脑卒中发生后,s-100β蛋白过量表达,加重机体炎症反应,进而导致病情进一步恶化,影响预后。另本文通过将患者发病24h血清s-100β、NTproBNP、cTnI水平与入院NIHSS评分与发病3个月后mRs评分作相关性分析发现,血清s-100β、NT-proBNP、cTnI水平与NIHSS评分、mRs评分均呈正相关关系,说明其能够为评估患者预后神经功能缺损程度提供参考。
综上所述,急性缺血性脑卒中患者血清s-100β、NTproBNP、cTnI水平在急性期要显著高于健康人群,其与患者脑损伤程度、神经功能缺损程度正相关,可以作为急性缺血性脑卒中患者病情诊断与预后分析的参考指标。
