甲状腺癌合并桥本氏甲状腺炎患者的临床病理特征分析
2023-08-26张俊蔺瑞银李庆丰
张俊,蔺瑞银,李庆丰
(安阳市肿瘤医院 甲状腺头颈外科,河南 安阳 455000)
甲状腺癌主要分为乳头状癌(PTC)、滤泡状癌(FTC)、髓样癌(MTC)、未分化癌(ATC)。近年来,甲状腺癌合并桥本氏甲状腺炎(HT)的发生率逐年增高[1],据报道,在甲状腺癌中,合并HT 患者占21%~55%[2-3],甲状腺癌与HT 在免疫学、内分泌学及遗传学等方面表现出相似性,说明两者存在关联。HT 是一种自身免疫性病变,其组织学的特点为淋巴细胞的浸润以及破坏[4]。当甲状腺细胞被细菌,病毒或毒素等损伤后,会暴露出隐藏的抗原表位,从而引起相应的抗体分泌并导致甲状腺炎的发生。根据美国癌症协会统计[5],甲状腺癌是内分泌相关肿瘤的一种常见类型,在女性相关易患癌症中,发病率排第五位,这可能与人们生活方式的改变以及诊疗技术日益完善有关。有研究指出,HT 与PTC 之间存在着密切联系,随后各种相关研究越来越多,但仍较难阐述其真正的因果关系[6]。本研究将对安阳市肿瘤医院甲状腺头颈外科近5 年甲状腺癌合并间HT的患者病例进行分析整理,研究其相互关联,为临床诊治提供参考依据,从而提升患者的生存状态,从中获益。
1 资料与方法
1.1 研究对象
回顾性选取安阳市肿瘤医院甲状腺头颈外科2017 年1 月至2022 年1 月收治的甲状腺癌患者237 例,根据是否合并HT 分为合并组(47 例)及未合并组(190 例)。合并组为甲状腺癌合并HT,未合并组为未合并HT 的单纯甲状腺癌。
诊断标准:HT 的诊断标准:甲状腺组织伴随有弥漫性的肿大且质韧,术前超声显示,甲状腺呈弥漫性的回声减弱[7],术前甲状腺功能显示,甲状腺过氧化物酶抗体(TPO-Ab)、甲状腺球蛋白抗体(Tg-Ab)均升高,病理结果提示HT 等。甲状腺癌的诊断标准:术前穿刺病理或术后病理检查提示甲状腺癌。依据最新版美国癌症联合委员会(AJCC)对甲状腺癌进行TNM 分析[8]。纳入标准:结合病理检查结果,确定患者是否为甲状腺癌,是否合并有HT。排除标准:伴发心脏相关疾病、高血压、糖尿病等疾病;伴发有呼吸、循环、消化、泌尿等系统疾病。
1.2 方法
收集两组患者的一般资料、术前甲状腺功能检查指标以及术前甲状腺彩超检查报告,术后病理等资料,对比分析两组一般资料、病理类型、临床分期、超声表现、淋巴结转移、甲状腺功能、术后病理特点及预后情况。
1.3 统计学方法
使用SPSS 17.0 统计学软件。计量资料以均数±标准差(±s)表示,用t检验;计数资料以百分率(%)表示,用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
合并组男女比例为1.0∶6.8,未合并组男女比例为1.00∶2.22。与未合并组比较,合并组女性比例更高,发病年龄更小,差异有统计学意义(P<0.05)。见表1。

表1 两组患者一般资料比较
2.2 两组超声检测及淋巴结转移情况比较
术前甲状腺彩超检查(图1)结果显示,合并组共检出37 例钙化灶,其中31 例粗大钙化灶,粗大钙化灶占比为83.8%,高于未合并组(55.5%)(173 例钙化灶,96 例粗大钙化),差异有统计学意义(P<0.05)。合并组肿块丰富血流信号检出率为76.6%(36/47)高于未合并组[59.5%(113/190)],差异有统计学意义(P<0.05)。以术后病理为准,术前彩超检测颈部淋巴结转移准确率为88.5%(23/26),与未合并组[90.2%(92/102)]比较,差异无统计学意义(P>0.05)。
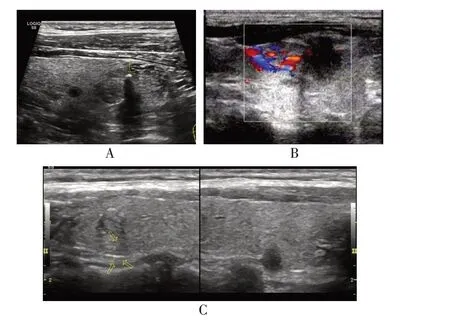
图1 术前彩超检查图示
2.3 两组患者术前甲状腺功能比较
合并组促甲状腺激素(TSH)、TG-Ab、TPo-Ab水平高于未合并组,差异有统计学意义(P<0.05),见表2。
表2 两组患者术前甲状腺功能指标比较(±s)
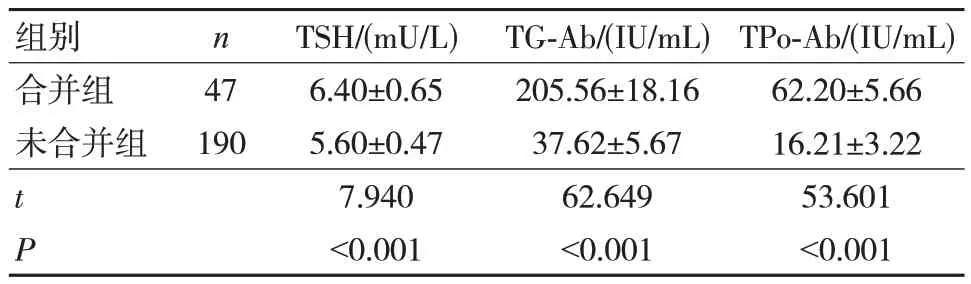
表2 两组患者术前甲状腺功能指标比较(±s)
2.4 两组手术治疗情况
合并组因多以微小癌为主,所以术前常难以明确诊断,多于术中冰冻或术后明确诊断。临床多以甲状腺近全切除术(合并组25 例,未合并组82 例),甲状腺癌根治(甲状腺近全切除+中央区淋巴结清扫)术(合并组20 例,未合并组70 例),甲状腺全切除术(合并组7 例,未合并组38 例)作为基本术式,两组间比较差异无统计学意义(P>0.05)。
2.5 术后两组病理结果
依据术后病理(见图2),合并组中颈部淋巴结转移发生率、包膜外侵犯发生率均低于未合并组,差异有统计学意义(P<0.05)。见表3。
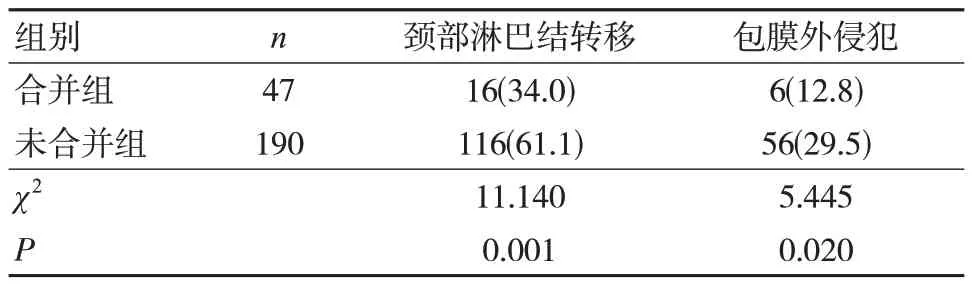
表3 两组患者术后病理比较 [n(%)]
2.6 术后预后情况
对参与研究的对象进行电话随访,患者术后定期到医院门诊复查,通过超声检测及甲状腺功能检测评估预后情况,并与患者充分沟通了解身体健康状况。合并组患者术后中位生存时间大于3 年,复发率约为0.21%。未合并组术后中位生存时间大于3 年,复发率约为0.32%,两组比较差异无统计学意义(P>0.05)。
3 讨论
在1912 年,HASHIMOTO 团队于1912 年首次在4 名女性患者中提到HT:甲状腺呈现出弥漫性的肿大,甲状腺发生淋巴样组织病变。后来几十年,研究者在HT 患者的血清中发现TPo-Ab、TG-Ab 大量存在,认为此病与自身免疫性病变存在相关性[9];有研究显示,90% 以上的HT 患者血清中TPo-Ab 含量较高,而约半数患者也出现了高滴度的TG-Ab[10]。在国内高碘地区,甲状腺功能减退大多是由HT 导致,所以,HT 也终将转化为甲减。虽然甲状腺功能的减退完全可以被左甲状腺素钠片所治疗,甲减症状完全可以改善,但HT 的发病机制仍较难以阐述清楚。有学者认为,HT 的发病可能与特异性的T 细胞被激活相关,而激活T 细胞又与感染病毒关系密切,病毒产生的蛋白与甲状腺本身的蛋白非常接近,从而引起免疫反应的过程。
近年来,甲状腺癌发病率增长较快,虽然甲状腺癌的死亡率较低,但是复发率和带瘤生存率仍相对较高,因此,其治愈效果和患病率亦有待进一步去探索改进[11]。甲状腺癌的病理类型主要分为PTC、FTC、ATC、MTC,而FTC 和PTC 同属于分化型的甲状腺癌(DTC)。近年来,甲状腺癌发病的分子水平研究取得重大突破,主要体现在对病变分子变构的认识,也包括基因水平、遗传学水平,异常激活的信号通路,如RAS-RAFMAPK-ERK 信号通路等[12]。基因突变可能与甲状腺癌发病关系密切,尤其是BRAF 基因上T1799A横向点的突变,导致BRAF-V600E 基因变异,使丝氨酸/苏氨酸激酶被持续性地激活[13]。
通过研究对比发现,甲状腺结节合并HT 可显著提升PTC 的发病风险,分析其机制可能为以下几个方面:①HT 是自身免疫性的病变,即机体对甲状腺癌的抗原产生抵抗,病理特点为甲状腺的上皮细胞逐步被单核细胞所替代,从而诱导RET/PTC 重排,RET/PTC 重排后即成为甲状腺癌的基因,所以也有学者认为HT 可看作为甲状腺乳头状癌的癌前病变[14]。此外RET/PTC 也可激活下游信号传导系统,炎症加剧,形成了促进肿瘤发生的微环境[15]。②大量研究提示炎症可能为甲状腺癌发生的起始因素。HT 通常伴随着淋巴细胞浸润,活氧簇则可通过氧化反应导致基因突变[16]。③另一方面,HT 患者TSH 的升高也可能发生癌变,因为可使滤泡上皮增生[17]。本次研究中发现合并HT的甲状腺癌患者TSH 水平要明显高于未合并者,则验证了上面结论。除了TSH,合并组TgAb 阳性率和TPOAb 阳性率也高于未合并组,一方面,甲状腺癌和HT 的基因抗原表位可以被TgAb 识别,从而诱发甲状腺癌的进展[18]。另一方面,TPOAb可诱发甲状腺细胞激活氧化物酶等物质,而这些物质参与碘有机化,此种环境也增加了基因突变的风险[19]。
另外,通过本研究发现,甲状腺癌合并HT 的患者普遍年龄偏小,病灶较小,而且周围侵犯,淋巴转移以及远处转移少见,可能具有相对良好的预后。所以,重视HT 患者的随诊观察,对于早期发现甲状腺癌以及提升治愈率及改善预后具有重要意义。对于HT 合并甲状腺结节的患者,在无法排除甲状腺癌风险的情况下,应当尽早进行细胞学穿刺检查或手术探查,以达到早期发现癌变的目的。这提示合并HT 女性的发病相比男性更趋于年轻化。所以,年轻女性中,特别是合并HT 的甲状腺结节更应给与高度重视。
综上所述,HT 与甲状腺癌之间具有一定的相互关联。甲状腺癌合并HT 患者女性居多且年龄偏小,病灶相对较小,而周围侵犯,淋巴结转移以及远处转移者少见,其预后可能相对良好,对其内在机制的深入研究可能会为甲状腺癌患者的诊治带来更为精确的方案。
