基于美国FAERS数据库的德曲妥珠单抗不良事件挖掘与分析
2023-08-26彭梦莹蔡晓军万国兴
彭梦莹,蔡晓军,万国兴
(1.锦州医科大学 研究生学院,辽宁 锦州 121001;2.十堰市人民医院 肿瘤中心,湖北 十堰 442000)
乳腺癌是女性最常见的恶性肿瘤,发病率位居全球第一。虽然乳腺癌治疗取得一定进展,但部分患者仍易复发转移。抗体药物偶联物(antibody drug conjugate,ADC)的出现进一步延长了患者无进展生存期和总生存期。这是一类通过连接子将细胞毒性药物偶联到单克隆抗体的靶向生物制剂,即以单克隆抗体作为载体将小分子细胞毒性药物以靶向方式高效地运输至目标肿瘤细胞中[1]。德曲妥珠单抗自美国食品药品管理局批准上市后,在HER2 阳性肿瘤的治疗中发挥了重要作用,尤其是在乳腺癌、胃癌的治疗中。近年来,ADC 类药物在乳腺癌治疗领域占有越来越重要的地位,但该药物在国内外的临床使用时间较短,所以全面了解其结构特点和作用机制,更有助于临床有效的管理其可能出现的不良反应。
德曲妥珠单抗由重组人源化抗HER-2 IgG1 单克隆抗体曲妥珠单抗、可裂解肽基连接头和喜树碱类似物(CPT 或称拓扑异构酶Ⅰ抑制剂)组成[2]。与最早研发的抗HER2 的ADC 药物,恩美曲妥珠单抗相比,其细胞毒性药物含量较高,药物抗体比高达8∶1,并且细胞毒性载荷的半衰期短,因此在保证对肿瘤细胞的特异杀伤作用的同时,限制了正常细胞的脱靶毒性[3]。但仍有可能在应用中出现一定的毒性,在关于此药治疗乳腺癌的安全性研究中[4],有20%的患者发生严重不良事件,包括:间质性肺病(ILD)、肺炎、呕吐、恶心、蜂窝组织炎、低钾血症和肠梗阻。因此,全面系统地研究德曲妥珠单抗可能带来的其他潜在不良事件是必要的,这对了解其潜在不良事件并做好预防和管理有着重要意义。
本文通过对美国食品药品监督管理局不良事件报告系统(FDA Adverse Event Reporting System,FAERS)收集到的德曲妥珠单抗数据进行挖掘和筛选,结合该药物安全性临床试验研究结果,分析该药物上市后的不良反应(adverse drug reaction,ADR)信号,以期为该药物的临床合理应用提供参考。
1 资料与方法
1.1 数据来源
本研究所用数据来源于PubMed、Medline、Ovid 以及美国FAERS 数据库,其中美国FAERS数据库中的数据来源于不同地区医疗保健专家、制药厂商或患者等自发呈报[5]。
1.2 数据提取和筛选
OpenVigil 2.1(http://openvigil.sourceforge.net/)是经过德国基尔大学BÖHM 等[6]学者验证的药物警戒工具,本研究通过该工具来查询FAERS 数据库,以德曲妥珠单抗的药品通用名为检索词进行检索,具体检索词为“trastuzumab deruxtecan”“fam-trastuzumab deruxtecannxki”。收集该药物从在美国上市(2019 年12 月)至2022年6 月30 日的ADR 报告,删除重复报告,排除非药物导致的不良事件,并从中筛选出以该药物为首要怀疑药物的报告。根据《国际医学用语词典》(Medical Dictionary for Regulatory Activities,MedDRA)23.1 版中的首选术语(preferred term,PT)和系统器官分类(system organ class,SOC)对ADR 进行分类、描述[7]。
德曲妥珠单抗于2016 年首次报道,本研究在XU 等[8]研究的基础上,在PubMed、Medline 和Ovid 中检索2016 年至2022 年7 月期间的所有与德曲妥珠单抗的安全性相关的临床试验,并参考Cochrane meta 分析指南进行文章回顾。具体检索词为“DS-8201a”“Trastuzumab deruxtecan”。然后从这些临床试验中提取并汇总各级ADR 以及3 级以上ADR 的发生率,随后以同样的方法对ADR进行分类、描述。
1.3 数据挖掘
目前,国内外常用的挖掘药品ADR 信号的方法主要是比例失衡分析法(measures of disproportionality)[9]。当目标药物-事件组合的出现频率明显高于整个数据库的背景频率的阈值,就代表产生了1 个信号[10]。
本研究同时采用比例失衡分析法中的报告比值比法(reporting odds ratio,ROR)和比例报告比值法(proportional reporting ratio,PRR)进行信号挖掘。两种方法均基于四格表(见表1),通过比较目标药品(德曲妥珠单抗)的不良事件发生比例与其他所有药品的目标事件发生比例,以检测其潜在不良事件信号。ROR=(a/c)/(b/d),ROR 的95% 置信区间(confidence interval,CI)=,a≥3 且ROR 的95%CI 下限>1,则为1 个ADR 信号;PRR=[a/(a+b)]/[c/(c+d)],χ2=(ad-bc)2(a+b+c+d)/[(a+b)(c+d)(a+c)(b+d)],a≥3、PRR≥2 且χ2≥4,则为1 个ADR 信号[6]。将同时满足上述ROR 和PRR 信号要求的ADR 纳入本研究,并按照ADR 发生频次和信号强度(ROR 值)进行排序,文中仅展示前15 位的ADR。事件发生率是所有接受治疗的患者中出现该ADR 患者的比率,文中只列出排名前15 位的各级ADR、3 级及以上ADR。

表1 比例失衡法四格表
1.4 统计学方法
采用Microsoft Excel 2019 软件进行统计学分析,并对标准化后的结果进行统计和计算。
2 结果
2.1 ADR 报告情况及人口学特征
提取FAERS 数据库中2019 年12 月20 日到2022 年6 月30 日的不良事件数据,删除重复报告后,共获得首要怀疑药物为德曲妥珠单抗的ADR 735 例。由于该药物最先批准用于HER2 低表达的乳腺癌患者,所以女性患者较多,是男性患者的2.68 倍,患者的年龄[M(P25,P75)]为64(53,72)岁。上报国家、患者性别与年龄等基本信息见表2。
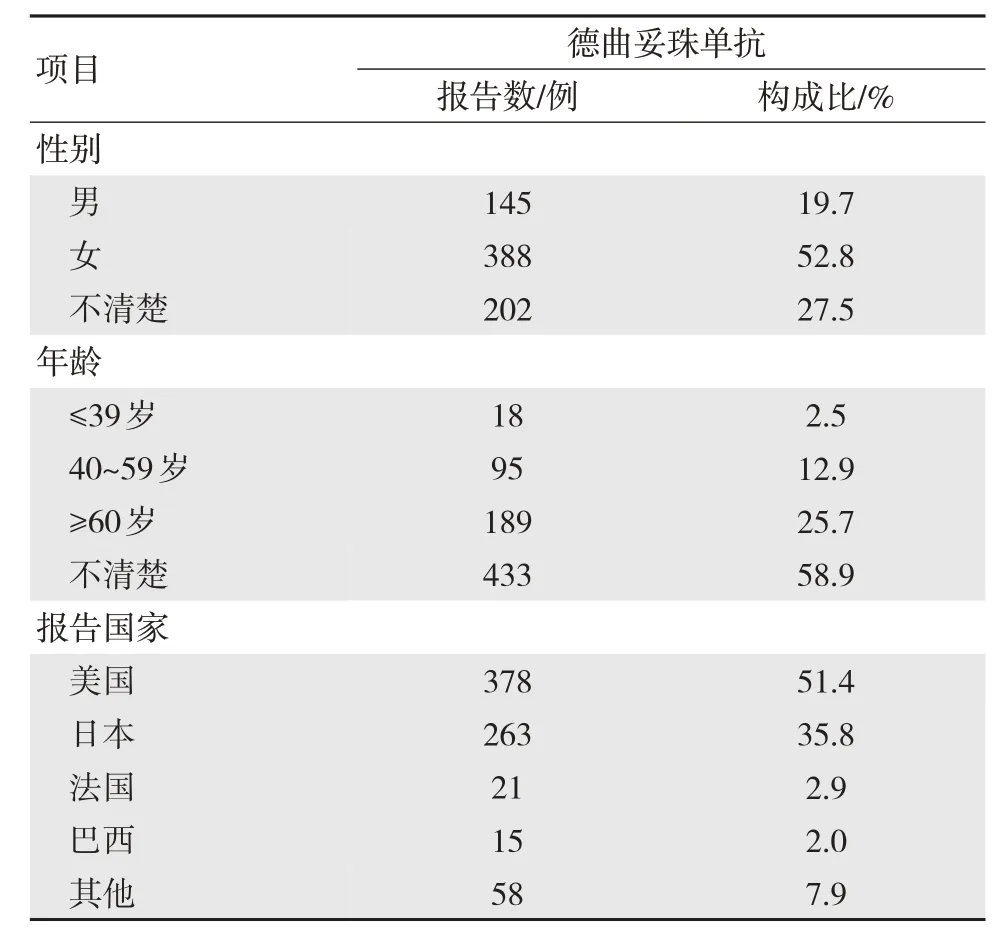
表2 ADR 报告情况及人口学特征(n=735)
2.2 ADR 发生频率
按照发生频次降序排列,德曲妥珠单抗发生频次前15 位的ADR 依次为恶心、间质性肺病、疲乏、呕吐、中性粒细胞计数减少、食欲下降、乏力、脱发、贫血、骨髓抑制、发热、腹腔积液、粒缺性发热、肺炎、中性粒细胞减少,其中腹腔积液未在美国药品说明书中出现,见表3。
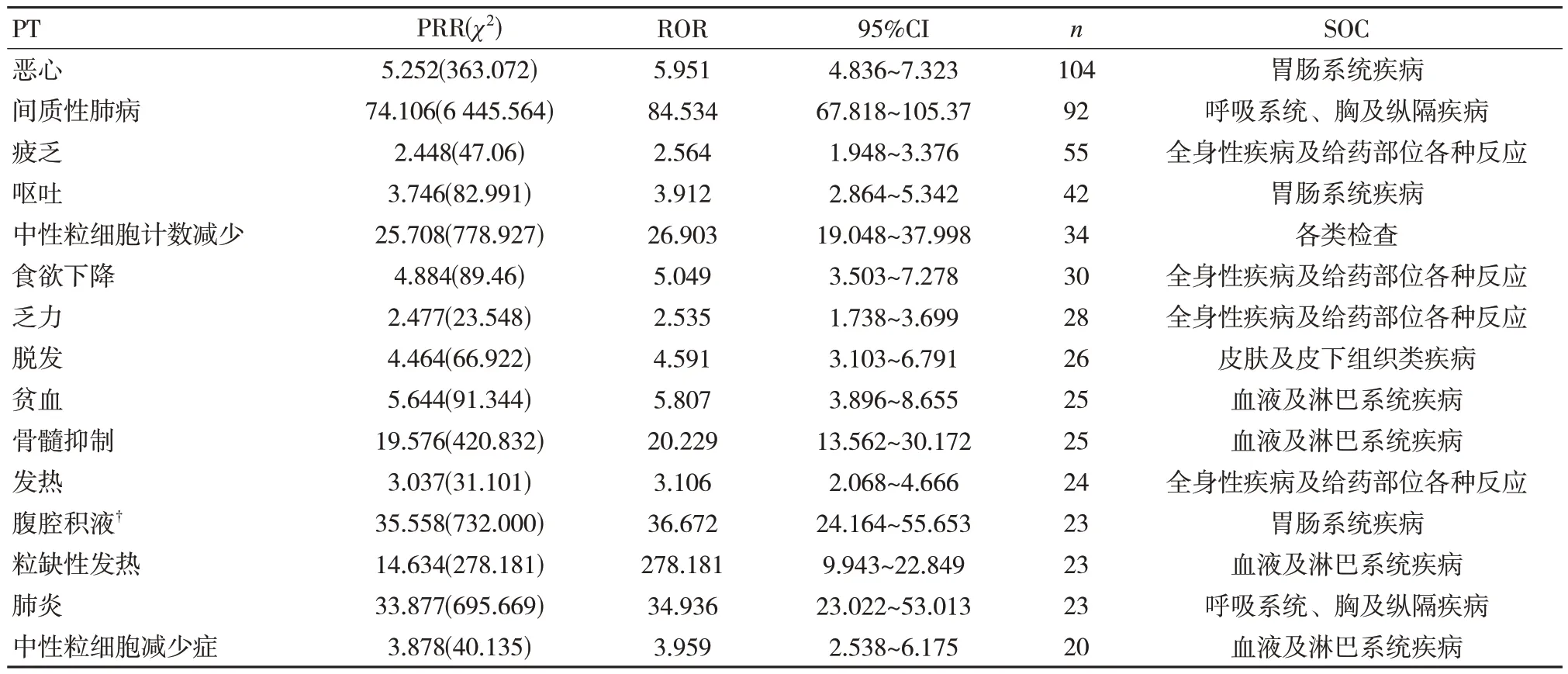
表3 德曲妥珠单抗发生频次排名前15 位的ADR
2.3 ADR 信号强度
共检测到45 个ADR 信号,ROR 信号强度排名前15 位的ADR 依次为粒缺性发热、间质性肺病、腹腔积液、细菌性肺炎、肺炎、肺毒性、中性粒细胞计数减少、骨髓抑制、心力衰竭、胆红素升高、肠梗阻、胸腔积液、肝衰竭、弥散性血管内凝血和射血分数下降,其中有5 个新的可疑高风险信号,见表4。
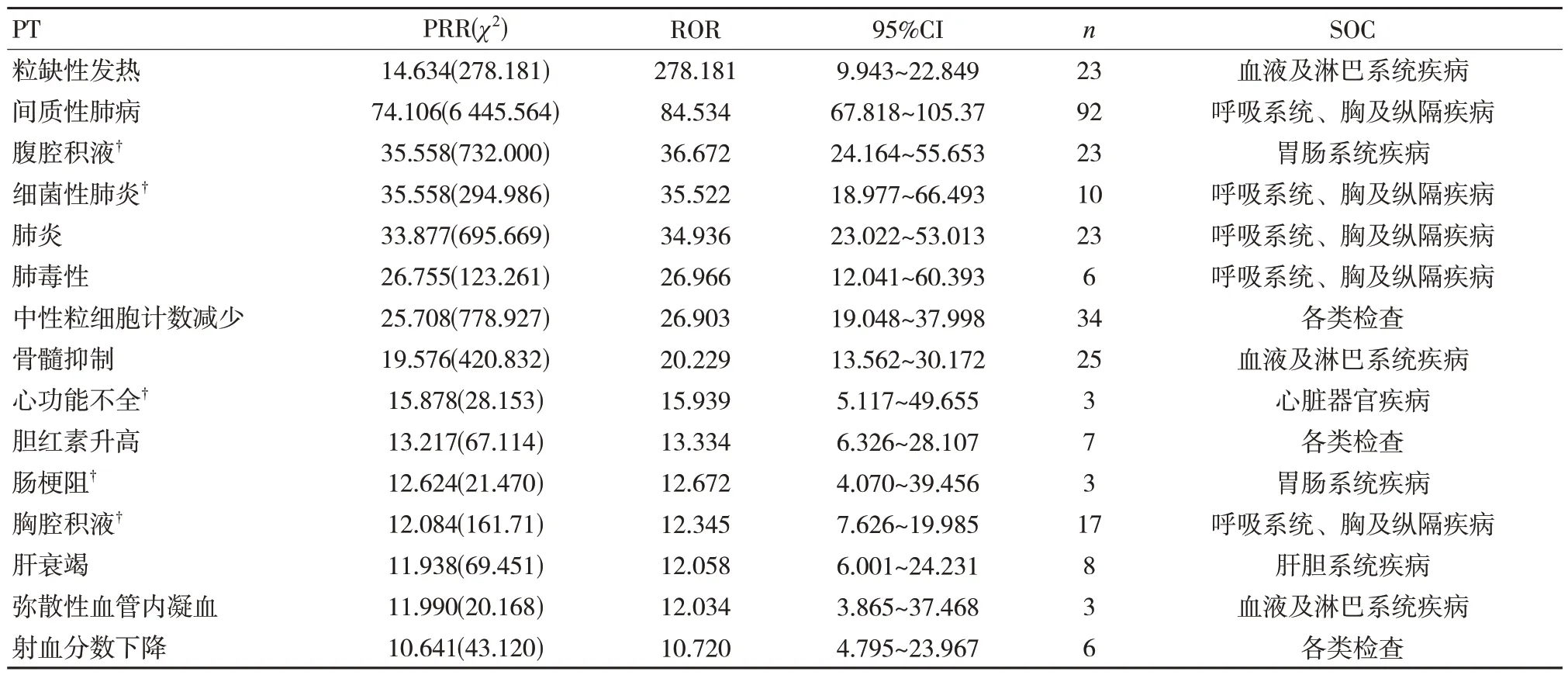
表4 德曲妥珠单抗信号强度排名前15 位的ADR
2.4 ADR 的系统器官
根据MedDRA 对有信号的PT 进行SOC 分类排序,发现有信号的SOC 共11 个,分类后各SOC的信号数及其构成比情况,见图1。在11 个SOC中,胃肠系统疾病的占比最多,共计211 个信号,占比为27.19%。此外,信号数较多的SOC 还有呼吸系统、胸及纵膈疾病、全身性疾病及给药部位各种反应、血液及淋巴系统疾病等,分别占比为21.13%、15.72%、14.56%。
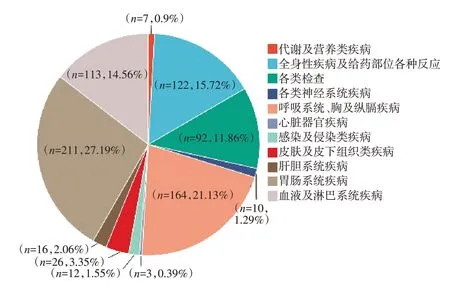
图1 各SOC 的信号数及其构成比
2.5 临床试验不良反应汇总
基于XU 等[8]的研究,在PubMed、Medline和Ovid 中共检索到148 篇文章,删除重复试验、排除不相关试验以及动物实验后,11 篇文章纳入本研究。在各级ADR 中,事件发生率≥20%的不良反应包括恶心、食欲减退、呕吐、疲乏、贫血、中性粒细胞计数降低、脱发、腹泻、血小板计数降低、便秘、白细胞计数降低、萎靡不安、口腔炎和发热,与说明书中常见ADR 基本一致。在3级及以上仅中性粒细胞计数降低发生率较高,事件发生率为20.3%,其中胆管炎、肠穿孔在美国药品说明书中未提及,见表5、表6。
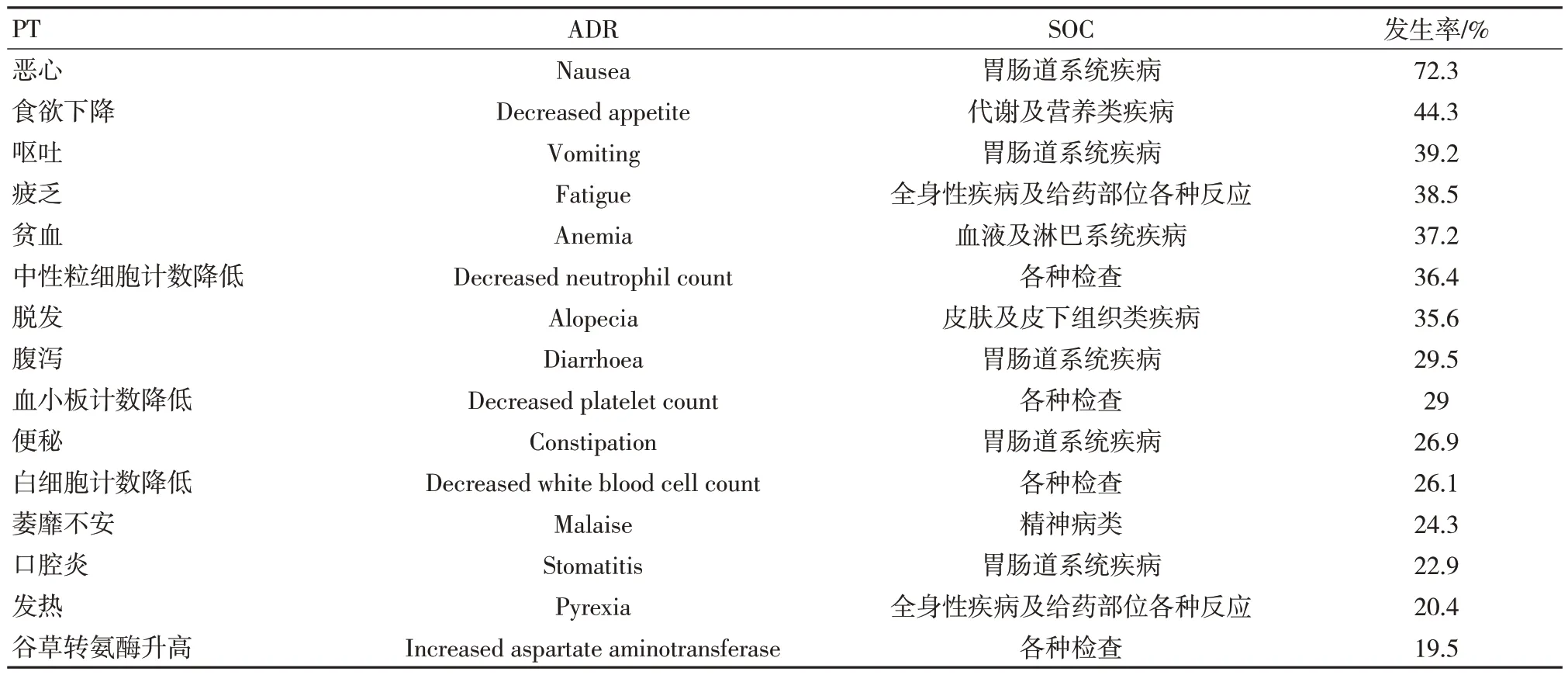
表5 各级ADR 发生率排名
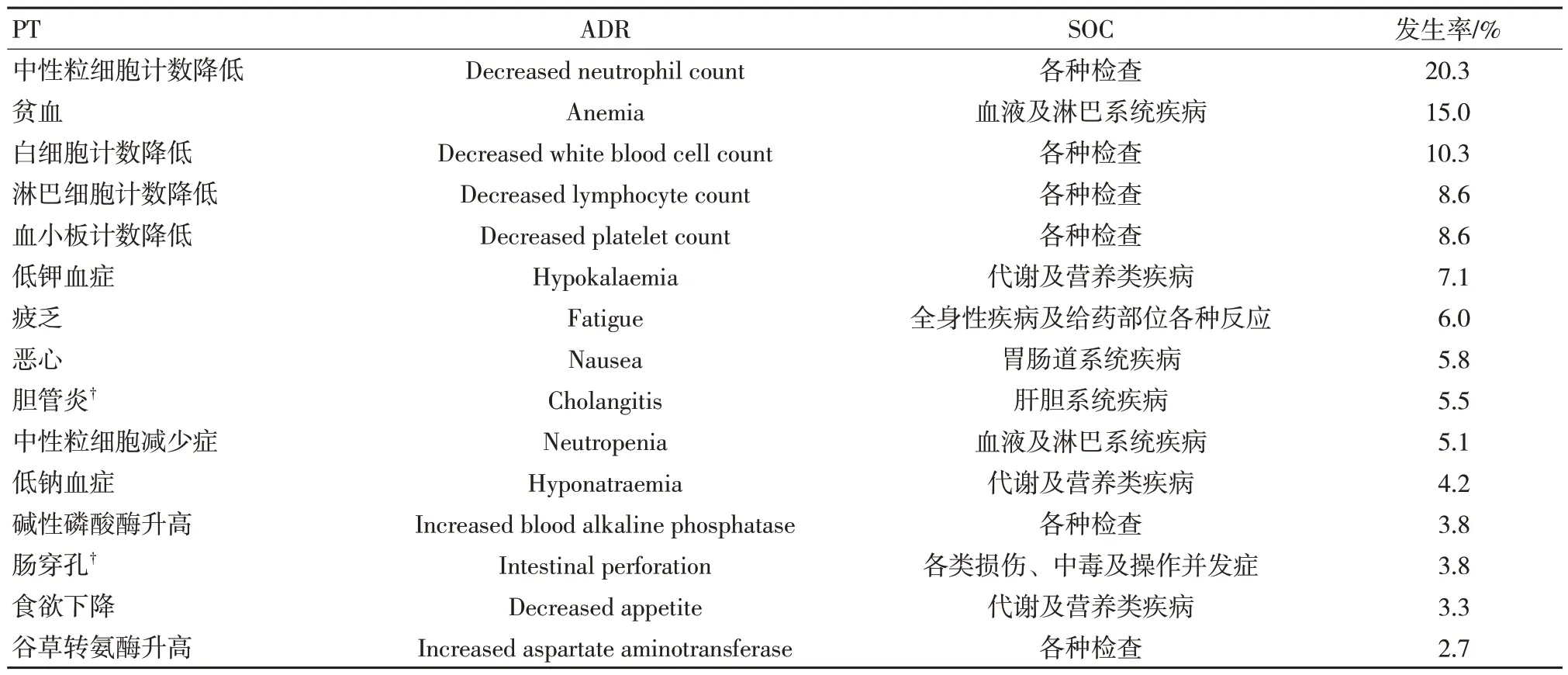
表6 3 级及以上ADR 发生率排名
3 讨论
本研究基于FAERS 数据库中德曲妥珠单抗的ADR,采用比例失衡法中的ROR 法和PRR 法进行信号挖掘分析,获得的常见ADR 信号及ADR 累及系统与药品说明书收录基本一致,也与一些文献分析、临床研究的结果相似[11-13],主要集中于胃肠道、呼吸、全身疾病等方面,包括恶心、ILD、疲乏、呕吐等,证明了本研究方法的可行性及结果的可靠性。
由于德曲妥珠单抗上市时间较短,在我国尚未建立ADR 数据库,缺乏此类研究数据,因此借助FAERS 数据可为我国患者合理使用该药提供客观资料,有助于降低用药风险。
3.1 已知的ADR 信号
本研究分析该药物报告频次排名前15 位的ADR 发现,德曲妥珠单抗的ADR 基本被药品说明书收载,说明该药物上市后应用过程中的常见ADR 发生情况与药品说明书较为一致。但是在信号强度方面,该药物近一半的ADR 在药品说明书中未被提及,提示新的可疑高风险信号较多,临床应予以关注。
基于XU 等[8]的研究,笔者在PubMed、Medline 和Ovid 中检索得到的临床安全性试验结果与FAERS 数据库中筛选得到的ADR 信号对比发现,发生频率最高ADR,均为以恶心、呕吐、食欲下降为主的胃肠道反应和中性粒细胞计数减少的血液毒性。
在德曲妥珠单抗的ADR 报告中,发生频次和信号强度中排名均为前3 位的ADR 为ILD。有研究分析[14],10.9%的患者发生了药物相关的ILD,3 级或以上ILD 1.8%。乳腺癌或肺癌患者发生ILD的时间在129~193 d 之间。而ILD 发生在胃癌或结直肠癌的ILD 发生相对较早,范围为77~84.5 d。在美国药品说明书中,ILD 是其黑框警告的ADR,且已有关于该ADR 致命病例的报道[15],故对发生2 级及以上该ADR 的患者须永久停药。因此临床用药前及用药过程中,需监测并及时观察体征和症状,包括咳嗽、呼吸困难、发热和其他新的或恶化的呼吸系统症状。如果患者出现肺部症状,并怀疑为ILD,应进行进一步的检查查找病因。若考虑为治疗相关ILD,应尽早行对症处理,并根据ILD 的分级,决定是否停药。因为早期数据表明,及时识别和积极处理ILD 可能会降低高级别ILD的风险[12]。
3.2 新的ADR 风险信号
本研究对德曲妥珠单抗和信号强度排名前15位的ADR 报告进行分析,发现了5 个新的可疑高风险信号。虽然胃肠道反应该药物是最常见的ADR,但是腹腔积液(a 为23,ROR 为36.672,95%CI 下限为24.164)、肠梗阻(a 为3,ROR 为12.672,95%CI 下限为4.070)在药品说明书均未见报道,而肠梗阻在药物安全性临床研究中也未提及。腹腔积液和肠梗阻虽然是新ADR,具有强烈的信号,但现有文献中没有相关报道,这可能与疾病本身有关。没有证据表明它们是由药物本身引起的,因此建议进一步观察。胸腔积液也是新ADR,不管在发生频率方面,还是在信号强度方面均不低,因此需在临床应用中加强管理。而心功能不全、细菌性肺炎虽然发生率不高,但是ADR 信号强,与德曲妥珠单抗的相关性比较强,且未在药品说明书及临床研究中提及,因此在用药过程中需密切监测患者心脏及肺脏情况变化。
3.3 本研究的局限性
本研究对德曲妥珠单抗进行了ADR 信号挖掘,但仍存在一些局限性:①德曲妥珠单抗在全球范围内上市时间较短,有关ADR 监测数据还相对缺乏。②与所有药物警戒研究类似,本研究无法证明药物暴露与ADR 之间的因果关系;并且由于FAERS 为自发呈报系统,ADR 数据常出现低报、漏报、患者临床信息缺失及偏倚等情况。③已知的药物ADR 报告频率往往更高,从而稀释了新信号,报告的不完整限制了药物与新信号之间关联强度的判断。④本研究采用PRR 法和ROR法产生的信号仅能表明药物与ADR 信号存在统计学关联,具体还要结合文献和临床使用情况加以证明。
综上所述,本研究基于FAERS 数据库以及临床药物安全性试验,使用OpenVigil 2.1 数据平台,剔除了上报不完整的信息,使数据分析更加完整、可靠,对德曲妥珠单抗的ADR 信号进行挖掘并进行对比。德曲妥珠单抗的ADR 发生频次与美国药品说明书中常见不良反应的报道较为一致。根据ADR 信号强度显示,有5 个潜在的危险信号且均为美国药品说明书未提及的ADR。建议临床在使用相关药物时,应关注患者腹腔积液、细菌性肺炎、心功能不全、肠梗阻、胸腔积液等ADR 的症状、体征和相关检查指标,如发生相关ADR,应及时采取干预措施,以保障患者用药安全。
