2016—2020年河北省75家医院门诊、急诊及住院患者血标本分离细菌及耐药状况分析
2023-08-25强翠欣刘晓璇温海楠杨靖李志荣牛亚楠王伟刚秦璞牛肖然欧阳紫柔董宁温宝江郝姿赵建宏
强翠欣?刘晓璇?温海楠?杨靖?李志荣?牛亚楠?王伟刚?秦璞?牛肖然?欧阳紫柔?董宁?温宝江?郝姿?赵建宏


摘要:目的 分析河北省细菌耐药监测网75家医院2016—2020年门诊、急诊及住院患者的血标本分离细菌分布和耐药性。方法 收集2016年1月—2020年12月我省细菌耐药监测网单位血标本分离细菌数据,应用WHONET和SPSS软件分析河北省5年间血标本分离细菌分布及耐药性,并按菌株来源及患者不同年龄分组进行分类比较。结果 河北省2016—2020年血标本共分离54959株细菌,其中门诊血标本分离菌占0.70%(387/54959)、急诊占5.12%(2815/54959),住院占94.17%(51757/54959)。门诊、急诊及住院患者血标本分离率前3位的细菌分别为大肠埃希菌、凝固酶阴性葡萄球菌、肺炎克雷伯菌。新生儿及儿童(≤14岁)血标本分离细菌主要为凝固酶阴性葡萄球菌;成人及老年人(>14岁)常见大肠埃希菌和肺炎克雷伯菌。河北省血标本分离细菌多重耐药率较高,门诊、急诊及住院患者耐药菌检出率存在差异,泛耐药鲍曼不动杆菌在急诊血標本中更常见。所有葡萄球菌均对万古霉素、替加环素敏感,但已出现对利奈唑胺耐药的金黄色葡萄球菌(0.1%)和凝固酶阴性葡萄球菌(0.3%)。结论 河北省门诊、急诊和住院患者血标本分离细菌均以大肠埃希菌、凝固酶阴性葡萄球菌和肺炎克雷伯菌为主;不同分离细菌的耐药率在门诊、急诊与住院患者中存在不同差异。此外,不同年龄段患者的血标本分离细菌不同。
关键词:血标本;门诊;急诊;住院;细菌;耐药性;血流感染
中图分类号:R978.1文献标志码:A
Analysis of isolated bacteria and drug resistance from blood specimens of outpatients, emergency patients, and inpatients in 75 hospitals of Hebei Province from 2016 to 2020
Qiang Cui-xin1, Liu Xiao-xuan1, Wen Hai-nan2, Yang Jing1, Li Zhi-rong1, Niu Ya-nan1, Wang Wei-gang1, Qin Pu1,
Niu Xiao-ran1, Ou Yang Zi-rou1, Dong Ning1, Wen Bao-jiang1, Hao Zi3, and Zhao Jian-hong1
(1 The Second Hospital of Hebei Medical University, Hebei Provincial Center for Clinical Laboratories, Shijiazhuang 050000;
2 Department of Laboratory Medicine, Affiliated Hospital of Chengde Medical University, Chengde 067000;
3 Hebei Medical University, Shijiazhuang 050000)
Abstract Objective To explore the distribution and antimicrobial resistance trends of pathogens from blood specimens with outpatients, emergency departments, and inpatients in 75 hospitals of Hebei Antibacterial Resistance Investigation Net (Hebarin) from 2016 to 2020. Methods The data on pathogenic bacteria of blood specimens in Hebarin from January 2016 to December 2020 were collected and classified according to the source of the strain and the age of the patients. The distribution and drug resistance of pathogenic bacteria in blood specimens were analyzed by WHONET 5.6 software and SPSS 24.0 software. Results From 2016 to 2020 in Hebei Province, a total of 54,959 bacterial strains were isolated from blood samples, of which 0.70% (387/54,959) were isolated from outpatient blood samples, 5.12% (2,815/54,959) in emergency department, and 94.17% (51,757/54,959) in hospitalization. The top three bacteria in the blood samples of outpatient, emergency, and inpatient patients were Escherichia coli, coagulase-negative staphylococci, and Klebsiella pneumoniae. Coagulase-negative staphylococci were mainly isolated from blood samples of newborns and children (≤14 years old). Escherichia coli and Klebsiella pneumoniae were common in adults and the elderly (>14 years old). The multi-drug resistance rate of bacteria isolated from blood samples in Hebei Province was high, and the detection rate of drug-resistant bacteria was different among outpatients, emergency patients and inpatients. Pan-drug-resistant Acinetobacter baumannii was more common in emergency blood samples. All staphylococci were sensitive to vancomycin and tigecycline, but linezolid-resistant Staphylococcus aureus (0.1%) and coagulase-negative staphylococci (0.3%) had emerged. Conclusion Escherichia coli, coagulase-negative staphylococci and Klebsiella pneumoniae were the main strains isolated from blood cultures of outpatients and inpatients in Hebei Province. The drug resistance rates of different isolates were different in outpatients, emergency departments, and inpatients. In addition, the bacteria isolated from blood samples of patients in different age groups is different.
Key words Blood specimens; Outpatient; Emergency department; Hospitalization; Bacteria; Drug resistance; Bloodstream infection
血流感染(bloodstream infection,BSI)是指病原微生物和/或毒素侵入血流所引起的血液感染,导致系统性炎症反应综合征,病原微生物在循环血液中呈一过性、间歇性或持续性存在[1]。近年来,随着侵入性诊疗技术的广泛开展和抗菌药物的广泛应用,BSI的发病率和耐药菌检出率不断增加,因BSI死亡的人數占全球死亡总数的1/5,人类健康受到严重威胁[2-4]。临床医生在BSI初期合理选择抗菌药物是决定患者预后的关键因素[5],BSI病原菌分布以及抗生素耐药性存在明显的地域差异[1-2,6],长期监测病原谱和细菌抗菌药物耐药性的变化对于临床治疗和感染控制至关重要。门诊、急诊与住院患者的疾病种类、用药状况及暴露环境等均存在差别,但门诊、急诊血标本分离细菌流行病学研究相对匮乏[6]。因此本研究对2016—2020年河北省细菌耐药监测网门诊、急诊及住院患者血标本分离细菌的分布及耐药性进行回顾性分析,旨在为临床治疗和感染控制提供参考。
1 资料与方法
1.1 资料来源
本研究血标本分离细菌数据来自2016—2020年河北省细菌耐药监测网75家医院上报数据的结果,使用WHONET软件将容错后的数据纳入统计分析,不包括厌氧菌及其他非典型病原菌。同时,剔除同一患者所分离的重复菌株。按门诊、急诊和住院患者分别进行统计分析,同时参照全国细菌耐药监测网(China Antimicrobial Resistance Surveillance System,CARSS)数据,将患者分为新生儿(≤28 d)、儿童(28d~14 y)、青年(15~47 y)、中年(48~64 y)、老年(≥65 y)5个年龄组分别进行分析[7]。
1.2 细菌鉴定、药敏试验及质量控制
采用VITEK等系统鉴定细菌至种。采用纸片扩散法或仪器(包括VITEK、BD等系统)法进行药物敏感性试验。药敏纸片使用Oxoid等公司产品,培养基采用MH琼脂。检测抗菌药物包括氨苄西林、阿莫西林/克拉维酸、氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢唑林、头孢呋辛、头孢他啶、头孢曲松、头孢吡肟、头孢哌酮/舒巴坦、头孢西丁、氨曲南、亚胺培南、美罗培南、阿米卡星、庆大霉素、环丙沙星、左氧氟沙星、替加环素、氯霉素、复方磺胺甲恶唑、妥布霉素、米诺环素、青霉素G、苯唑西林、利奈唑胺、四环素、克林霉素、红霉素、莫西沙星、利福平、高浓度庆大霉素、高浓度链霉素、万古霉素和替考拉宁。结果判读标准参照2020年CLSI M100执行[8]。对于肠杆菌目细菌,采用头孢哌酮的折点判读头孢哌酮/舒巴坦的药敏结果(MIC≥64 ?g/mL或抑菌圈直径≤15 mm视为耐药)。
按CLSI M100及本实验室质控规则,在实验条件稳定下每周施行一次常规质量控制程序。常用标准质控菌株如大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 25923、 金黄色葡萄球菌ATCC 29213、肺炎克雷伯菌ATCC700603、阴沟肠杆菌ATCC700323、铜绿假单胞菌ATCC27853、肺炎链球菌ATCC49619等。血标本分离污染菌按照实验室排除标准执行,排除标准参照WS/T503-2017《中国卫生行业标准-临床微生物实验室血培养操作规范》[9]。血培养瓶中培养出皮肤(如表皮葡萄球菌、痤疮丙酸杆菌、梭菌、类白喉棒状杆菌)或周围环境(如不动杆菌属、芽胞杆菌属)中常见菌,这些菌大部分为污染菌。但出现以下情况考虑可能为致病菌:①不同部位血培养标本培养出同一种菌;②多次分离出同一种菌且药敏结果相同。具体的还需要与临床医生沟通,结合患者临床表现、宿主特征、影像学表现等进行鉴别。
1.3 数据分析
应用WHONET 5.6和SPSS 24.0软件进行数据统计分析。采用R×C χ2检验进行耐药率的组间比较,不同年份细菌检出率变化趋势采用趋势χ2检验进行比较,P≤0.05为差异有统计学意义。
2 结果
2.1门诊、急诊和住院患者血标本分离细菌构成
2016—2020年河北省门诊、急诊和住院患者血标本细菌检出数量分别为387株、2815株、51757株。门诊、急诊与住院血标本分离细菌分布基本一致,分离率排名前3位的菌均为大肠埃希菌(15899株,28.93%)、凝固酶阴性葡萄球菌(coagulase-negative staphylococci, CoNS)(13787株,25.09%)、肺炎克雷伯菌(6685株,12.16%),详见表1,其中CoNS的主要组成为表皮葡萄球菌(5847株)和人葡萄球菌(4138株),各自的分离率为10.64%和7.53%。
2.2不同年龄段门诊、急诊和住院患者血标本分离细菌情况
将门诊、急诊和住院患者按不同年龄段进行分组比较,不同年龄段患者血标本分离细菌分布存在差异。河北省血标本分离细菌主要来自中老年患者(≥48 y)(70.5%)。新生儿及儿童(<14 y)血标本最常见的分离细菌为CoNS。在青年人群(15~47 y)中,门诊与住院血标本最常见的分离细菌为大肠埃希菌,而急诊则是CoNS。其余各年龄段门诊、急诊与住院血标本优势分离细菌保持一致,详见表2。
2.3细菌耐药情况
2.3.1 主要革兰阴性菌药敏情况
2016—2020年河北省血标本分离率排名前4位的革兰阴性菌是大肠埃希菌(28.93%)、肺炎克雷伯菌(12.16%)、铜绿假单胞菌(3.09%)以及鲍曼不动杆菌(2.48%)。
住院患者血标本分离大肠埃希菌对头孢类药物耐药率高于门诊和/急诊(P<0.05)。门诊分离大肠埃希菌未发现哌拉西林/他唑巴坦耐药菌,耐药率低于急诊及住院(P<0.05)。其余各类常见抗菌药物耐药菌在门诊、急诊和住院患者检出率一致,未检出替加环素耐药菌,详见表3。
河北省血标本分离肺炎克雷伯菌对氟喹诺酮类、碳青霉烯类、氨基糖苷类药物以及除氨苄西林/舒巴坦外的其他β-内酰胺酶抑制剂的耐药性均低于30%,详见表4。住院患者血标本分离的肺炎克雷伯菌对β-内酰胺类复合制剂和头孢菌素的耐药率高于急诊患者(P<0.05)。门诊分离铜绿假单胞杆菌对美罗培南的耐药率高于急诊和住院(P<0.05),但该差异是由于门诊分离菌株较少(2株),在统计分析时造成的偏差,无临床指导意义;其他常用抗菌药物的耐药率无差异,且急诊与住院患者分离菌耐药率均低于30%,详见表5。值得注意的是,河北省鲍曼不动杆菌的耐药率较高,门诊血标本仅发现1株鲍曼不动杆菌,该菌株为泛耐药鲍曼不动杆菌。急诊分离菌对头孢菌素、β-内酰胺类复合制剂、碳青霉烯类抗菌药物的耐药率超过75%,高于住院分离细菌(P<0.05),详见表6。经进一步统计分析发现,急诊分离的鲍曼不动杆菌耐药菌主要来自急诊ICU患者(P<0.05),详见表7。
2.3.2 主要革兰阳性菌药敏情况
2016—2020年河北省血标本分离常见的革兰阳性菌为金黄色葡萄球菌(6.83%)、CoNS(25.09%)和屎肠球菌(2.87%)。我省住院血标本分离金黄色葡萄球菌仅青霉素G的耐药率高于急诊分离株(P<0.05),其余各类常用治疗药物的耐药率在门诊、急诊、住院中保持一致,三者均未检测到万古霉素、替加环素耐药株,但住院血标本分离金黄色葡萄球菌中有0.1%对利奈唑胺耐药,详见表8。
急诊检出CoNS的氟喹诺酮耐药率高于门诊及住院分离株(P<0.05),门诊分离CoNS对青霉素G、复方磺胺甲恶唑和红霉素的耐药率则低于住院分离株(P<0.05),其余常见抗菌药物耐药率差异无统计学意义。利奈唑胺耐药CoNS在门诊、急诊与住院患者血标本中的检出率分别为0、0.2%和0.3%,未检出替加环素和万古霉素耐药株,详见表9。
急诊和住院患者血标本分离的屎肠球菌对青霉素、环丙沙星、左氧氟沙星和利福平及氨苄西林耐药率均超过70%,门诊相关耐药率较低(P<0.05)。住院分离菌对利奈唑胺、万古霉素和替考拉宁的耐药率分别为0.5%、1.7%和1.1%,急诊分离菌对万古霉素耐药率为2.3%,未检出利奈唑胺及替考拉宁耐药菌;门诊未发现相关耐药菌,详见表10。
2.4 5年间门诊、急诊和住院患者血标本多重耐药菌检出及变迁情况
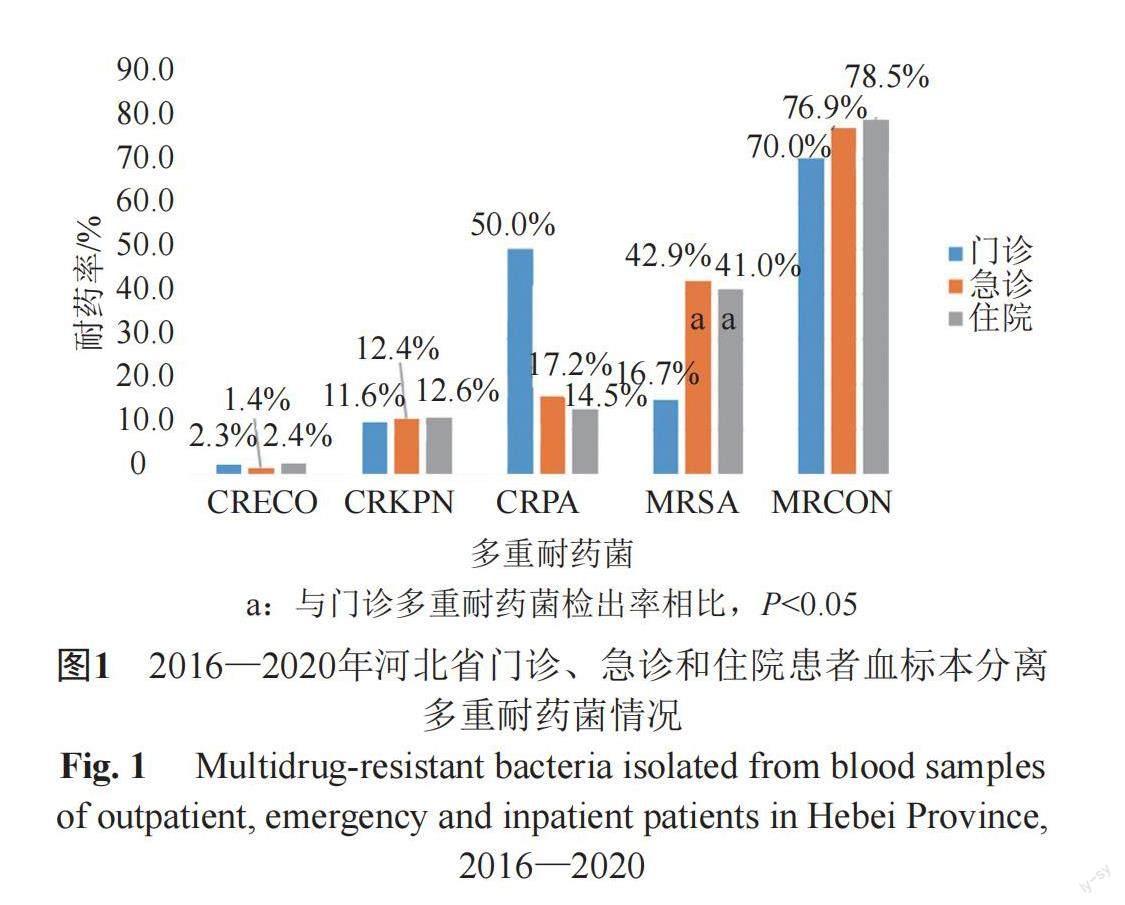
2016—2020年河北省门诊血标本耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)检出率低于急诊及住院血标本(P<0.05),其中,耐碳青霉烯类铜绿假单胞菌(carbapene-resistant Pseudomonas aeruginosa, CRPA)检出率高达50%,但门诊仅发现1株CRPA,因此与急诊、住院检出率无统计学差异,其余多重耐药菌的平均检出率一致(图1)。
5年间河北省急诊患者血标本多重耐药菌检出率趋势平稳。门诊耐甲氧西林凝固酶阴性葡萄球菌(methicillin-resistant coagulase-negative staphylococci, MRCON)检出率均呈上升趋势(P<0.05)。住院患者血标本除耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKPN)检出率保持稳定外,耐碳青霉烯类大肠埃希菌(carbapenem-resistant Escherichia coli, CRECO)、CRPA、MRSA和MRCON均呈下降趋势(P<0.05)(图2)。此外,由于门诊血标本分离铜绿假单胞菌数量较少(共2株),2017—2019年未发现铜绿假单胞菌,因此CRPA检出率变化无意义,相关数据并未在图中展示。
3 讨论
2016—2020年河北省细菌耐药监测数据显示,我省血标本分离主要细菌为大肠埃希菌(28.93%)、CoNS(25.09%)和肺炎克雷伯菌(12.16%),其中CoNS主要分离菌为表皮葡萄球菌(10.64%),与重庆[10]、四川[11]报道结果一致;而在CARSS报告中表皮葡萄球菌比肺炎克雷伯菌更常见,位居第二[12]。我省门诊、急诊与住院3者血标本排名前3的细菌一致,均为大肠埃希菌、CoNS、肺炎克雷伯菌;江苏等[6,13-14]地区急诊科常见病原菌则为大肠埃希菌、肺炎克雷伯菌,金黄色葡萄球菌。血标本检出菌的分布存在地域差异,但均以大肠埃希菌最为常见[10-11,13]。
不同年龄段患者的血标本分离菌不同。本研究成人(14~64 y)及老年人(≥65 y)群体的血标本常见细菌是大肠埃希菌;新生儿及儿童(<14 y)则以CoNS为主。值得注意的是,在青年人群(15~47 y)中,门诊与住院血标本最常分离大肠埃希菌,而急诊则是CoNS。造成這种差异的原因可能是此年龄段急诊患者基础疾病较少、多因外伤入院,而CoNS正是急诊创伤患者最常见的血流感染病原菌[15]。此外,CoNS是人体皮肤、黏膜的正常菌群,也是血标本最常见的污染菌[16],提示实验室应加强与临床的沟通,留取标本时应采取严格规范的消毒措施,建议采集双瓶多套、不同部位采血送检,以提高标本合格率,降低假阳性率,避免患者接受不必要的抗生素治疗。
河北省血标本分离细菌耐药率较高,不同细菌对抗菌药物的耐药性在门诊、急诊和住院患者中存在差异。值得注意的是,鲍曼不动杆菌是医院获得性感染的常见病原菌,其引起血标本进展迅速、死亡率高[17]。然而,我省急诊患者分离鲍曼不动杆菌具有多重耐药性,对头孢菌素、β-内酰胺类复合制剂、碳青霉烯类抗菌药物的耐药率超过75%,且耐药率高于住院分离菌株。为探究原因,我们进一步分析,发现门诊血标本仅分离到1株鲍曼不动杆菌,其余大部分泛耐药鲍曼不动杆菌分离自某大型三甲医院急诊ICU患者。急诊ICU患者病情危重,依赖经验用药,在治疗过程中可能应用了大量的抗生素或激素。研究表明,手术、机械通气、糖皮质激素以及抗菌药物(碳青霉烯类、氟喹诺酮类、头孢菌素)的使用均为耐药鲍曼不动杆菌相关血流感染的独立危险因素[18-19],同时急诊科是各类感染性疾病聚集的地方,患者具有更高的暴露风险。因此推测上述因素均为导致急诊患者血标本分离鲍曼不动杆菌耐药率高于住院患者的原因。当急诊BSI患者高度怀疑鲍曼不动杆菌感染时,应尽量避免单独使用头孢菌素、碳青霉烯类、氟喹诺酮类抗菌药物,可使用米诺环素、替加环素、多黏菌素B等替代药物或采取联和治疗措施[20]。
門诊血标本分离菌中,肺炎克雷伯菌对亚胺培南的耐药率以及大肠埃希菌对头孢西丁和亚胺培南的耐药率虽在数值上高于急诊和住院,但差异均无统计学意义,后期应密切关注此类耐药菌。此外,门诊分离铜绿假单胞菌及鲍曼不动杆菌耐药率在数值上普遍高于急诊及住院的原因可能是该细菌在门急诊血标本中分离数量较少,总计仅检出3株铜绿假单胞菌和1株鲍曼不动杆菌,其中门诊铜绿假单胞菌对美罗培南的耐药率高于急诊及住院(P<0.05),但由于菌株较少(2株),在统计分析时会造成偏差。总体来说门诊血标本检出菌较少,各类细菌的分离株数较急诊及住院相差悬殊,在分析比较耐药率时具有一定的局限性。
碳青霉烯类药物对多重耐药革兰阴性杆菌如产超广谱β-内酰胺酶(extended-spectrum β-lactamase, ESBL)肠杆菌目细菌具有很强抗菌活性,是BSI的一线治疗药物[21]。我省血标本大肠埃希菌产ESBL株超过50%,但碳青霉烯类抗菌药物在体外对大肠埃希菌分离株仍具有良好的抗菌活性,CRECO检出率始终维持在较低水平(门诊、急诊和住院5年平均检出率分别为2.27%、1.41%和2.37%)。门诊、急诊及住院患者血标本CRKPN 5年检出率稳定在12%左右,并未出现其它报道中持续升高的趋势[11,20,22-23]。
5年间,河北省血流感染MRSA、MRCON检出率呈下降趋势,与我国其他地区变化趋势一致[20,23]。所有葡萄球菌均对万古霉素、替加环素敏感,但已出现对利奈唑胺耐药的金黄色葡萄球菌(0.1%)和CoNS(0.3%)。利奈唑胺为恶唑烷酮类抗生素,用于治疗MRSA、MRCON及耐万古霉素肠球菌等多重耐药革兰阳性球菌引起的严重感染。目前已知的利奈唑胺耐药机制主要为23S rRNA V区突变以及cfr(该基因编码RNA甲基转移酶,可使23S rRNA的A2503位发生甲基化,造成利奈唑胺耐药)[24-25]。我实验室前期通过对利奈唑胺耐药的CoNS进行测序分析,发现除常见的23S rRNA G2576U耐药突变外,携带cfr的耐药菌株同时具有核糖体蛋白L3突变,此类突变在利奈唑胺抗性中发挥何种程度的作用仍需进一步研究。cfr由可移动原件携带,易水平传播,需对其密切监测,防止耐药性在院内流行传播。急诊与住院患者分离粪肠球菌对万古霉素的耐药率分别为2.3%和1.7%,虽然目前万古霉素耐药肠球菌尚未出现大规模暴发流行,但是由于van耐药基因簇可能发生水平转移,导致出现高水平耐药细菌,仍应高度重视该耐药表型的检出率变化情况。总体而言,万古霉素、利奈唑胺、替加环素和替考拉宁仍是治疗多重耐药革兰阳性球菌的最佳选择。
综上所述,2016—2020年河北省门诊、急诊和住院患者血标本分离细菌均以大肠埃希菌,凝固酶阴性葡萄球菌、肺炎克雷伯菌为主;不同分离细菌的耐药率在门诊、急诊与住院患者中存在差异。急诊患者血标本分离鲍曼不动杆菌耐药状况不容乐观,应深入探讨可能的原因,同时各监测单位需加强医院感染防控措施。此外,不同年龄段患者的血标本分离细菌不同,临床医生经验用药时需充分考虑年龄因素。
致谢:感谢CARSS网河北分中心成员单位,感谢CARSS网河北分中心专家委员会,感谢CARSS网河北分中心工作组。
参 考 文 献
McNamara J F, Righi E, Wright H, et al. Long-term morbidity and mortality following bloodstream infection: A systematic literature review[J]. J Infect, 2018, 77(1): 1-8.
Diekema D J, Hsueh P R, Mendes R E, et al. The microbiology of bloodstream infection: 20-year trends from the SENTRY antimicrobial surveillance program[J]. Antimicrob Agents Chemother, 2019, 63(7): e00355-19.
Stewardson A J, Marimuthu K, Sengupta S, et al. Effect of carbapenem resistance on outcomes of bloodstream infection caused by Enterobacteriaceae in low-income and middle-income countries (PANORAMA): A multinational prospective cohort study[J]. Lancet Infect Dis, 2019, 19(6): 601-610.
Rudd K E, Johnson S C, Agesa K M, et al. Global, regional, and national sepsis incidence and mortality, 1990—2017: Analysis for the global burden of disease study[J]. Lancet, 2020, 395(10219): 200-211.
Micek S T, Lloyd A E, Ritchie D J, et al. Pseudomonas aeruginosa bloodstream infection: Importance of appropriate initial antimicrobial treatment[J]. Antimicrob Agents Chemother, 2005, 49(4): 1306-1311.
胡宗风, 谢志康, 刘文革, 等. 急诊科血流感染临床特点和病原学分析[J]. 中华急诊医学杂志, 2020, 29(11): 1450-1455.
Lin Z, Yang R, Li K, et al. Establishment of age group classification for risk stratification in glioma patients[J]. BMC Neurol, 2020, 20(1): 310.
Humphries R, Bobenchik A M, Hindler J A, et al. Overview of changes to the clinical and laboratory standards institute performance standards for antimicrobial susceptibility testing, M100, 31st edition[J]. J Clin Microbiol, 2021, 59(12): e0021321.
中国医疗保健国际交流促进会临床微生物与感染分会, 中华医学会检验医学分会临床微生物学组, 中华医学会微生物学和免疫学分会临床微生物学组. 血液培养技术用于血流感染诊断临床实践专家共识[J]. 中华检验医学杂志, 2022, 45(2): 105-121.
Yang S, Xu H, Sun J, et al. Shifting trends and age distribution of ESKAPEEc resistance in bloodstream infection, Southwest China, 2012-2017[J]. Antimicrob Resist Infect Control, 2019, 8: 61.
龙姗姗, 黄湘宁, 张杰, 等. 四川省细菌耐药监测网2016—2020年血流感染病原菌分布及耐药分析[J]. 医药导报, 2021, 40(8): 1053-1059.
全国细菌耐药监测网2014—2019年血标本病原菌耐药性变迁[J]. 中国感染控制杂志, 2021, 20(2): 124-133.
刘韶瑜, 李姝, 姚贝, 等. 急诊社区发病的血流感染病原学与临床特征[J]. 中国急救医学, 2020, 40(12): 1147-1152.
Chiang H Y, Chen T C, Lin C C, et al. Trend and Predictors of Short-term Mortality of Adult Bacteremia at Emergency Departments: A 14-Year Cohort Study of 14 625 Patients[J]. Open Forum Infect Dis, 2021, 8(11): ofab485.
田颖, 张新蕾, 王改先, 等. 急诊创伤患者血标本分离病原菌分布及其耐药性分析[J]. 中国消毒学杂志, 2017, 34(8): 774-777.
Doern G V, Carroll K C, Diekema D J, et al. Practical guidance for clinical microbiology laboratories: A comprehensive update on the problem of blood culture contamination and a discussion of methods for addressing the problem[J]. Clin Microbiol Rev, 2019, 33(1): e00009-19.
Chopra T, Marchaim D, Awali R A, et al. Epidemiology of bloodstream infections caused by Acinetobacter baumannii and impact of drug resistance to both carbapenems and ampicillin-sulbactam on clinical outcomes[J]. Antimicrob Agents Chemother, 2013, 57(12): 6270-6275.
Tacconelli E, Cataldo M A, De Pascale G, et al. Prediction models to identify hospitalized patients at risk of being colonized or infected with multidrug-resistant Acinetobacter baumannii calcoaceticus complex[J]. J Antimicrob Chemother, 2008, 62(5): 1130-1137.
Karruli A, Boccia F, Gagliardi M, et al. Multidrug-resistant infections and outcome of critically ill patients with coronavirus disease 2019: A single center experience[J]. Microb Drug Resist, 2021, 27(9): 1167-1175.
Liu C, Xu M, Li X, et al. Trends in antimicrobial resistance in bloodstream infections at a large tertiary-care hospital in China: A 10-year retrospective study (2010—2019)[J]. J Glob Antimicrob Resist, 2022, 29: 413-419.
Elshamy A A, Aboshanab K M. A review on bacterial resistance to carbapenems: Epidemiology, detection and treatment options[J]. Future Sci OA, 2020, 6(3): FSO438.
孟雪斐, 張鸿娟, 马志刚, 等. 2018—2020年多中心血流感染分离菌分布及耐药性分析[J]. 中国抗生素杂志, 2021, 46(11): 985-993.
Chen Y, Ji J, Ying C, et al. Blood bacterial resistant investigation collaborative system (BRICS) report: A national surveillance in China from 2014 to 2019[J]. Antimicrob Resist Infect Control, 2022, 11(1): 17.
Chen H, Wu W, Ni M, et al. Linezolid-resistant clinical isolates of enterococci and Staphylococcus cohnii from a multicentre study in China: Molecular epidemiology and resistance mechanisms[J]. Int J Antimicrob Agents, 2013, 42(4): 317-321.
Schwarz S, Zhang W, Du X D, et al. Mobile oxazolidinone resistance genes in Gram-positive and Gram-negative bacteria[J]. Clin Microbiol Rev, 2021, 34(3): e0018820.
