可利霉素药理活性研究进展
2023-08-25夏明钰赵小峰谷普庆王以光赫卫清
夏明钰?赵小峰?谷普庆?王以光?赫卫清

摘要:可利霉素属于16元环大环内酯类抗生素,由多种酰化螺旋霉素组成,以3种异戊酰化螺旋霉素为主组分,在遗传改造后的螺旋链霉菌中发酵产生。它已经被国家药品监督管理局批准为国家一类新药,主要用于治疗上呼吸道感染。可利霉素除了具有抗细菌感染作用以外,还发现它具有多种药理活性如抗肿瘤、抗肝纤维化、抗炎、免疫调节等作用。最近研究还证实可利霉素还具有抗病毒活性,特别是对新冠病毒(SARS-CoV-2)也有良好的抑制活性,并在临床试验中证实对新冠肺炎患者具有一定疗效。阐明这些非抗菌的生物活性机制对扩宽可利霉素的适应症具有重要意义。
关键词:可利霉素;大环内酯类抗生素;药理活性
中图分类号:R978.1文献标志码:A
Advances in carrimycin pharmacological activities
Xia Ming-yu1, Zhao Xiao-feng2, Gu Pu-qing2, Wang Yi-guang3, and He Wei-qing3
(1 Shenyang Pharmaceutical University, Shenyang 110016; 2 Shen Yang Tonglian Group Co., Ltd., Shenyang 110042;
3 Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences, Beijing 100050)
Abstract Carrimycin, a 16-membered macrolide antibiotic, is a group of 4"-acylated spiramycins with three 4"-O-isovalerylspiramycins as its major components, produced by recombinant Streptomyces spiramyceticus. It was a class Ⅰ new drug approved by National Medical Products Administration of China for the treatment of upper respiratory infections. Further studies demonstrated that carrimycin, besides its potent anti-bacterial activity, had a variety of other pharmacological activities, such as anti-tumor, anti-liver fibrosis, anti-aging, immunomodulatory and other effects. Recent data confirmed that carrimycin displayed strong inhibition against coronavirus and SARS-CoV-2 in vitro, and also effective in anti-COVID19 clinical trials. Elucidation of these non-antimicrobial bioactivity mechanisms is of great significance for broadening the indication of carrimycin.
Key words Carrimycin; Macrolide antibiotic (MA); Pharmacological activity
大環内酯类抗生素(macrolide antibiotic, MA)通常指14至16元环MA,例如红霉素、阿奇霉素和乙酰螺旋霉素等,因其疗效好、安全性高,是临床应用非常广泛的一类抗菌药物。可利霉素属于16元环MA中的新成员,由多种4''酰基化的螺旋霉素组成的多组分抗生素。可利霉素等绝大多数MA通过结合在细菌核糖体50S大亚基的新生肽链通道附近,抑制新生肽链的延伸,干扰细菌蛋白质的合成[1-3]。大部分MA属于抑菌剂,通过不断改进,第三代MA中的酮内酯类抗生素具有一定杀菌作用,而本研究团队在研究中发现可利霉素在低浓度时也具有杀菌作用。可利霉素和阿奇霉素等MA主要用于治疗需氧革兰阳性球菌和阴性球菌、某些厌氧菌以及军团菌、支原体、衣原体等感染。它们不仅广泛用于治疗社区获得性肺炎,而且因其具有很好的细胞渗透能力,也常用于细胞内病原体所致感染疾病的治疗。其中阿奇霉素已经获准的新适应症有非淋病奈瑟球菌性尿道炎和沙眼;还有正在进行临床试验的项目,用以评价MA对动脉粥样硬化、可以危及生命的胃肠道感染、囊性纤维化和疟疾等的疗效[4-6]。红霉素及其衍生物克拉霉素、罗红霉素等大环内酯类抗生素在某些良性和恶性肿瘤方面亦有潜在的治疗价值[7];阿奇霉素等还有一定抗病毒活性[8]。在研究中发现可利霉素也具有多种非抗菌的药理活性,包括抗肿瘤、抗肝纤维化、抗炎等。MA在抗菌作用之外的这些药理作用以及临床新用途也日益为人们所重视。
1 可利霉素的适应症和优势
1.1 可利霉素的简介
可利霉素(carrimycin,商品名:必特,曾用名:生技霉素、必特螺旋霉素,图1)是由中国医学科学院医药生物技术研究所与沈阳同联集团有限公司共同开发成为有临床应用价值的1类创新药。可利霉素的发明人王以光教授带领团队历经30余年的科研攻关,并与同联集团有限公司通力合作,终于在2019年获得新药证书,同年10月正式上市销售。
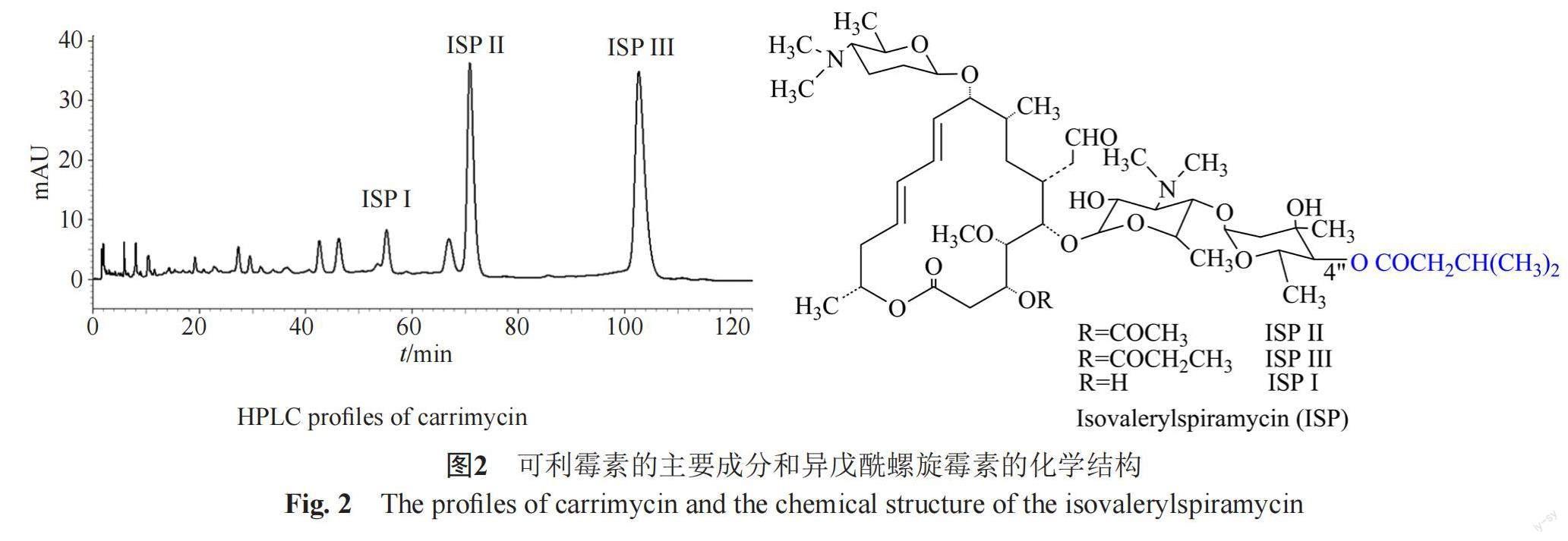
可利霉素的成功主要在于定向选用安全有效的螺旋霉素作为母核,根据药物特性和作用靶点进行针对性改造,通过基因重组技术研制出的创新药物。螺旋霉素衍生物的结构与抗菌活性研究表明,在其麦洛氨糖(mycarose)的3"和4"位上增加酰基侧链可以增加抗菌活性[9-10]。三维结构研究也证实16元环的碳霉素(carbomycin)的4"位上比螺旋霉素多了异戊酰基侧链,这个侧链可以延伸到细菌核糖体大亚基肽酰转移酶中心的A位点,从而增加与核糖体靶点的相互作用[11]。可利霉素则是利用基因重组等生物技术将碳霉素生物合成中的异戊酰基转移酶基因整合到螺旋霉素产生菌(Streptomyces spiramyceticus)中,使其产生以4"-异戊酰化螺旋霉素(isovalerylspiramycin, ISP)Ⅰ、Ⅱ、Ⅲ为主成分的可利霉素(图2) [12]。在可利霉素中还包含一些其他酰化螺旋霉素组分,包括4"-乙酰螺旋霉素Ⅲ和Ⅱ,以及4"-丁酰及4"-异丁酰螺旋霉素Ⅲ、Ⅱ两对同分异构体,4"-O-(3-甲基-2-丁烯酰基)螺旋霉素Ⅱ及4"-丙酰螺旋霉素Ⅲ、Ⅱ等。可利霉素的药品质量标准中要求ISPⅢ的含量要大于30%,总ISP要大于60%。与螺旋霉素相比,可利霉素的脂溶性和细胞穿透性更强,而且异戊酰基侧链的加入还改变了药物的代谢途径,因为异戊酰基侧链的保护使得mycarose不被首先降解,使得可利霉素的降解产物仍然保留一定的抗菌活性[13-14]。
1.2 可利霉素的适应症
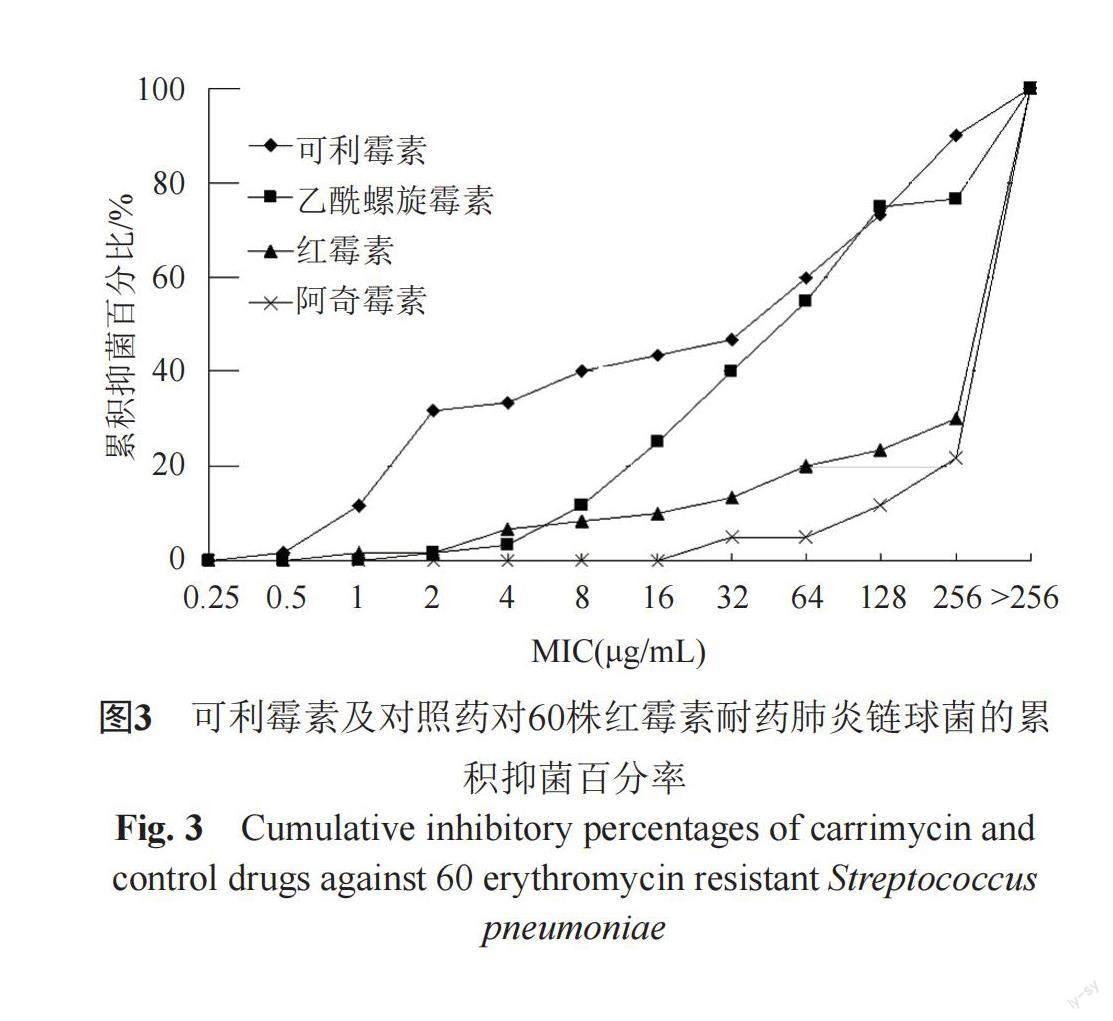
可利霉素适用于敏感细菌引起的轻、中度社区获得性感染的治疗,主要的适应症包括急性气管-支气管炎如流感嗜血杆菌、肺炎链球菌引起的急性气管-支气管炎;急性鼻窦炎:由肺炎链球菌、流感嗜血杆菌、化脓性链球菌、卡他莫拉菌以及葡萄球菌引起的急性鼻窦炎。可利霉素作为一类新药,具有较低的耐药性,与红霉素和阿奇霉素等MA不完全交叉耐药,诱导耐药率低。本课题组研究表明可利霉素除对耐药的革兰阳性菌,如耐甲氧西林金黄色葡萄球菌和耐药的化脓性链球菌等有效外,对现在难以对付的阴性耐药菌如超广谱β-内酰胺酶生成的大肠埃希菌感染和艰难梭菌引起的感染也有很好的疗效。可利霉素也可以替代治疗耐阿奇霉素的非淋球菌性尿道炎和支原体、衣原体感染。本课题组研究发现可利霉素对临床分离耐药致病菌的抗菌活性,对于耐药肺炎链球菌,可利霉素MIC众数为2 μg/mL,优于乙酰螺旋霉素、红霉素和阿奇霉素(图3)。对于红霉素耐药金黄色葡萄球菌,可利霉素MIC50值为8 μg/mL,明显优于红霉素和阿奇霉素。
此外,实验证实可利霉素对临床分离的结核分枝杆菌(Mycobacterium tuberculosis)具有良好的抗菌活性,其在抗结核杆菌感染中的应用已获得国内专利授权[15]。据报道[16]阿奇霉素对M. tuberculosis H37Rv的MIC为95 μg/mL,而可利霉素为25 μg/mL。可利霉素对临床分离的240株结核分枝杆菌中显示有抑制活性的菌株为172株,总有效率为71.66%,其中活性优于异烟肼的有37株,占有效菌数的21.5%;活性优于利福霉素的有39株,占有效菌数的22.7%;活性比两者均优的有23株,占有效菌数的13.4%。因此,可利霉素有望应用于治疗对异烟肼和利福霉素耐药的结核分枝杆菌引起的感染性疾病。
1.3 可利霉素的安全性和口服量
可利霉素对人的安全剂量为800 mg/次,在医药生物技术研究所药理室开展了临床前一般药理、毒理、长毒、致突变、致畸和围产期等实验研究表明,可利霉素对神经系统、心血管系统和呼吸系统均无明显影响;在急毒实验中,小鼠LD50大于4000 mg/kg,犬的LD50大于4500 mg/kg。长毒实验中,小鼠的LD50为200 mg/kg,犬的LD50为75 mg/kg。在犬中高剂量(150和300 mg/kg)的可利霉素使ALT(丙氨酸氨基转移酶)、AST(天门冬氨酸氨基转换酶)有些升高,但停药恢复期可转为正常;可利霉素引起体外基因突变和细胞染色体畸变的可能性很小;服用可利霉素不影响细胞的正常有丝分裂,对骨髓无抑制作用。
可利霉素口服绝对生物利用度高(91.6%),有良好的抗生素后效应。药物在胃肠道吸收较快,达峰时间约在1.0~3.5 h,进入体内后迅速进入组织,组织浓度高于血药浓度,组织分布广,药物浓度维持时间较长,其药物消除半衰期T1/2β在23~27 h之间,48 h其浓度仍达到MIC以上[17]。可利霉素与其他药物的重要区别为其原型药和在体内的主要代谢产物均具有抗菌活性,使其在组织中能较长时间发挥治疗作用,因此在体内的抗菌活性效果远大于体外。所以可利霉素给药方案为首日剂量400 mg(2片),以后每天只需服用200 mg(1片)。具有服用方便、剂量小、服药次数少,毒性低,是适应症患者追求安全、有效药物的首选。另外,可利霉素为基因工程菌发酵的直接产物,不同于目前临床使用的大环内酯类衍生物,多半为化学半合成产品。可利霉素生产工艺简便,绿色环保。
进一步研究结果[18]表明,可利霉素除具有抗细菌感染作用以外,还具有其他多种药理活性:如对多种肿瘤细胞的增殖有抑制作用、具有抗肝纤维化的功能、免疫调节作用以及延缓衰老等作用。最近还证实它对冠状病毒也有很好的抑制活性。
2 可利霉素的抗肿瘤作用
体内外研究证实可利霉素对口腔鳞状细胞癌细胞具有很好的抑制活性,此活性与调节PI3K/AKT/mTOR和MAPK途径相关[19]。另外MTT法检测可利霉素对人乳腺癌细胞(MCF-7、MDA-MB-231)、人肝癌细胞(HepG2)、人肺癌细胞(A549、H460)、人白血病细胞(HL-60)、前列腺癌细胞(PC-3)、人淋巴瘤细胞(U937)、黑色素瘤细胞(A375)、人肾腺癌细胞(786-O、A498)和人胰腺癌细胞(PANC-1)多种肿瘤细胞有抑制作用,其IC50为(6.9±1.2)至(18.0±2.5) μg/mL。体内研究显示可利霉素可明显抑制胶质母细胞瘤、肝癌、乳腺癌、肾透明细胞癌、肺腺癌、胰腺癌、黑色素瘤、白血病等多种肿瘤细胞增殖;可利霉素还具有明显的抗肿瘤转移作用,可以顯著抑制黑色素瘤和肝癌转移[20-22]。
3 可利霉素抗肝纤维化作用
肝纤维化的实质是胶原蛋白等细胞外间质成分的代谢异常,尤其是 I 型胶原的过量合成与积聚[23]。另外,肝星状细胞的持续激活是肝纤维化发生发展过程中的关键环节[24]。在分子水平、细胞水平和动物模型上都证实可利霉素明显抑制肝纤维化的产生[25-26]。
在稳定表达Ⅰ型胶原蛋白α1启动子COL1A1P的单克隆细胞LX2-COL中,可利霉素明显抑制荧光素酶报告基因的活性,说明可利霉素对Ⅰ型胶原蛋白α1启动子活性有明显的抑制作用。细胞水平研究证明,可利霉素对人肝癌HepG2细胞和肝星状细胞系LX-2的增殖有抑制作用,IC50在10~100 μmol/L之间。以qPCR和Western Blot方法证实可利霉素在转录和蛋白表达水平,均对转化生长因子(TGFβ1)诱导LX-2细胞中纤维化主要标志物COL1A1、TGFB1、ACTA2等具有抑制作用。在体内利用胆总管结扎大鼠肝脏纤维化模型中,灌胃给药可利霉素200 mg/(kg·d),14 d,大鼠肝组织结构病理改变缓解,胆管增生情况得到抑制,组织坏死程度显著降低;同时,纤维化和胶原沉积情况得到明显抑制,表明可利霉素能够有效缓解胆管结扎造成的大鼠肝脏病理改变和纤维化程度。
4 可利霉素抗衰老研究
秀丽隐杆线虫(Caenorhabditis elegans)具有结构简单、生命周期短、易培养、全身透明易观察,后代数目多易统计分析,基因组容量小且图谱清晰,与人类基因组相似度达60%~80%,其中有12条类似的信号传导系统,实验操作简单方便等优点,因此被选为国际上研究化合物抗衰老作用的主要生物模式[27-28]。
通过给药组线虫生长曲线的测定,考察可利霉素对与线虫寿命相关生理指标如产卵量和行为活动能力变化的影响,并测定给药组线虫在37℃高温胁迫和紫外线照射的存活时间等,研究结果表明5 μg/mL的可利霉素可以延长秀丽隐杆线虫平均寿命周期(3 d)、明显提高线虫的运动能力;增强线虫耐热能力及延长其在37℃高温下的平均存活时间;对线虫的防紫外线照射损伤也有一定保护作用[29]。脂褐素(lipofuscin)又称老年素。沉积于神经、心肌、肝脏等组织,其积累随年龄增长而增多,是衰老的重要指征之一。脂褐素具有自发荧光,在荧光显微镜下观察线虫,根据其荧光强度可以判断其衰老程度[30],结果表明可利霉素也可以减少线虫脂褐素的积累。
5 可利霉素的免疫调节作用
可利霉素对临床分离的200株鲍曼不动杆菌的MIC值在64~128 μg/mL之间,其抗菌活性不佳。但在动物模型中对耐碳青霉烯的临床分离鲍曼不动杆菌的半数有效量(ED50)为153.2 mg/kg;耐碳青霉烯肺炎克雷伯菌ED50为112.2 mg/kg[31]。同时观察到在免疫系统敲除的裸鼠体内也有效,但抗菌效果明显弱于正常小鼠,提示其可能通过对免疫系统的调节作用清除体内感染源。可利霉素在临床治疗剂量(200~2000 mg/(人·d)范围内,给药6 d可以改善小鼠因感染导致的组织炎症反应和组织细胞损伤;HE病理染色显示对机体组织炎症和损伤改善更有效;说明可利霉素有可能改善机体免疫系统功能,修复组织损伤,促进康复。
20世纪80年代就有报道乙酰螺旋霉素具有增强巨噬细胞的吞噬能力[32-33]。同时,在早期口服乙酰螺旋霉素可以增加淋巴因子,延长使用之后会稍为降低其产生,这些结果均提示结构相似的可利霉素可能也具有抗非感染性炎症及免疫调节作用。本课题组对可利霉素免疫调节作用的初步研究表明,在腹腔炎症模型中,给药量为50 mg/kg的可利霉素在小鼠体内显著促进总T细胞(CD3+),其中CD4+和CD8+细胞都增加,说明可利霉素可能改善免疫功能。PD-L1分子在诱导肿瘤特异性T细胞凋亡和肿瘤免疫逃逸过程中具有重要作用[34-35]。免疫组化检测结果显示,可利霉素(0.05和5 μg/mL)可以显著减低A549细胞膜上PD-L1的表达,提示可利霉素可以抑制肿瘤抗原特异性T细胞活化,使其发挥正常免疫功能,唤醒机体对肿瘤细胞的免疫监控作用。
通过LPS/IFN-γ诱导小鼠巨噬细胞RAW246.7,刺激分化M1型巨噬细胞,用IL-4刺激分化M2型巨噬细胞[36],考察可利霉素对细胞的极化过程及其影响,检测相应指标TNF-α、iNOS(一氧化氮合酶)、Arg-1(精氨酸酶)的RNA表达水平,结果表明20 μmol/L可利霉素可以显著提高LPS/IFN-γ诱导RAW246.7细胞的TNF-α、iNOS的RNA水平,明显抑制IL-4诱导RAW246.7细胞的Arg-1RNA水平,提示可利霉素有潜在的提高机体M1巨噬细胞功能,并可诱导M2型巨噬细胞向M1细胞的转化。此外,可利霉素可明显降低LPS诱导小鼠小胶质细胞BV2的IL-6和NO的生成,进而减轻神经细胞损伤,说明可利霉素对神经炎症也可能具有一定的保护作用。
6 可利霉素对新冠状病毒的作用及临床研究
近期抗病毒实验研究显示,可利霉素对普通冠状病毒(HCoV-229E和HCoV-OC43)的活性优于抗病毒药利巴韦林(RBV):可利霉素对HCoV-229E病毒的EC50为(2.35±0.31) μg/mL;RBV的EC50为(3.77±1.36) μg/mL。可利霉素对HCoV-OC43的EC50为(2.51±0.52) μg/mL;RBV的EC50为(7.06±0.91) μg/mL。可利霉素抗SARS-CoV-2的IC50为0.99 μg/mL[37-38]。
2020年可利霉素在国内多家医院包括上海公共卫生临床中心、黄石市中心医院、武汉大学人民医院、哈尔滨医科大学第一附属医院等开展治疗新冠肺炎患者的临床试验,入组患者近300例,口服可利霉素的新冠病毒核酸阳性患者转阴率明显优于对照组,并显著改善临床症状与肺部炎症,可以提高新冠肺炎患者的预后,缩短住院时间。可利霉素临床应用方便,每天1次口服给药,且未发现与可利霉素相关的不良反应。2020年11月可利霉素已获得美国FDA批準的进入抗重症新冠肺炎Ⅲ期临床试验,有9个国家共59个中心参与,现已入组重症新冠患者60例[39]。
7 小结
可利霉素等MA的特点是亲脂性较强,可累积在细胞内,组织内浓度远高于血浆浓度[40] 。与螺旋霉素相比,可利霉素口服吸收更快,具有更高的组织亲和性,且组织分布广,组织浓度维持时间较长,48 h其浓度仍达到MIC以上;其原型药及其主要代谢产物均具有抗菌活性,这些特点使其能在体内更充分地发挥治疗作用。随着对MA的深入研究,这类药物普遍具有免疫调节活性及抗炎作用[41-43]。这说明这类药物的靶点除了细菌的核糖体之外,在人体细胞中也存在着结合靶点,使其具有免疫调节和抗炎等生理活性。目前研究来看,可利霉素在体内可以下调多个免疫和炎症的相关通路,包括mTOR通路和IL-4、IL-6、IL-8、TNF-α等炎性因子;可利霉素还具有抗肿瘤和抗纤维化等生理活性;另外可利霉素对SARS-CoV-2具有很好的抑制活性,其疗效明显优于抗病毒药物利巴韦林和阿奇霉素[37]。可利霉素这么多药理活性是因其在人体细胞中具有多个靶点?还是主要结合在某个靶点后,经过一系列信号传递而激活多个靶位点?或者二者兼而有之,还需要进行深入研究才能确定。对可利霉素的多种药理活性进行深入研究,将会拓宽其临床的使用范围,为保护人类生命健康做出更大贡献。
參 考 文 献
Dinos G P. The macrolide antibiotic renaissance[J]. Br J Pharmacol, 2017, 174(18): 2967-2983.
Jeli? D, Antolovi? R. From erythromycin to azithromycin and new potential ribosome-binding antimicrobials[J]. Antibiotics (Basel), 2016, 5(3): 29.
郝天怡, 赫卫清. 大环内酯类抗生素代谢工程的研究进展[J]. 生物工程学报, 2021, 37(5): 1737-1747.
马培奇. 大环内酯类抗生素临床应用进展[J]. 国外医药(抗生素分册), 2002, 23(3): 129-131.
黄允省. 大环内酯类抗生素的研究新进展[J]. 临床合理用药, 2017, 11(1C): 164-165.
吴银霞, 陶安倩, 陈啸洪. 大环内酯类抗生素免疫调节作用及在呼吸道疾病中的临床应用[J]. 中国新药与临床杂志, 2021, 40 (10): 673-677.
程书权. 大环内酯类抗生素的抗肿瘤作用现代研究[J]. 国外医药(抗生素分册), 2005, 36 (2): 64-69.
Firth A, Prathapan P. Azithromycin: The first broad-spectrum therapeutic[J]. Eur J Med Chem, 2020, 207: 112739.
Sano H, Sunazuka T, Tanaka H, et al. Chemical modification of spiramycins. Ⅳ. Synthesis and in vitro and in vivo activities of 3", 4"-diacylates and 3, 3", 4"-triacylates of spriamycin I[J]. J Antibiot (Tokyo), 1984, 37(7): 760-772.
?mura S, Sano H, Sunazuka T. Structure activity relationships of spiramycins[J]. J Antimicrob Chemother, 1985, 16(Suppl.A): 1-11.
Hansen J L, Ippolito J A, Ban N, et al. The structures of four macrolide antibiotics bound to the large ribosomal subunit[J]. Mol Cell, 2002, 10(1): 117-128.
Shang G D, Dai J L, Wang Y G. Construction and physiological studies on a stable bioengineered strain of shengimycin[J]. J Antibiot (Tokyo), 2001; 54(1): 66-73.
Shi X G, Fawcett J P, Chen X Y, et al. Structural identification of bitespiramycin metabolites in rat: A single oral dose study[J]. Xenobiotica, 2005, 35(4): 343-358.
Shi X G, Sun Y M, Zhang Y F, et al. Tissue distribution of bitespiramycin and spiramycin in rats[J]. Acta Pharmacol Sin, 2004, 25(11): 1396-1401.
王以光, 姜洋, 赵小峰, 等. 可利霉素在抗结核分枝杆菌感染中的应用: CN, ZL201511030787.7[P]. 2018-2-13.
Falzari K, Zhu Z, Pan D, et al. In vitro and in vivo activities of macrolide derivatives against Mycobacterium tuberculosis[J]. Antimicrob Agents Chemother, 2005, 49(4): 1447-1454.
史相国. 必特螺旋霉素体内代谢与药物动力学研究[D]. 沈阳药科大学, 2003.
姜洋, 杨生武, 赵小峰. 一种可利霉素片及其制备方法: CN, 103142520A[P]. 2013-6-12.
Liang S Y, Zhao T C, Zhou Z H, et al. Anti-tumor effect of carrimycin on oral squamous cell carcinoma cells in vitro and in vivo[J]. Transl Oncol, 2021, 14(6): 101074.
Jiang X L, Jiang X D. Use of carrimycin and pharma-ceutically acceptable salt thereof for manufacture of medicament for treatment and/or prevention of tumors: WO 2018/184587A1[P]. 2018-10-11.
Xia M Y, Jiang Y, Yang S W, et al. Use of isovalerys-piramycin Ⅰ, Ⅱ, and/or, Ⅲ in preparation of drug for treating and/or preventing tumor, and drug: WO 2019/007368A1[P]. 2019-1-10.
Xia M Y, Zhao X F, Jiang X L, et al. mTOR inhibitor, pharmaceutical composition and use thereof: WO, 2019/141254A1[P]. 2019-7-25.
Sakaguchi T, Kono Y, Itaba N, et al. Identification of a novel deactivating small-molecule compound for fibrogenic hepatic stellate cells[J]. Yonago Acta Med, 2020, 63(1): 79-87.
Tsuchida T, Friedman S L. Mechanisms of hepatic stellate cell activation[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(7): 397-411.
Niu W X, Ge M X, Bao Y Y, et al. Carrimycin alleviates fibrogenesis in bile duct ligated rats and human fibroblasts by suppressing inflammation[J]. 2020, biomedRxiv, 202004. 00024.
何红伟, 姜恩鸿, 赫卫清, 等. 一种用于预防、缓解和/或治
疗纤维化的药物、组合产品及其应用: CN, 202010
298772.3[P]. 2020-11-17.
吕婷. 利用模式生物秀丽隐杆线虫对植物提取物抗衰老的研究[D]. 南京师范大学, 2014.
Dehghan E, Goodarzi M, Saremi B, et al. Hydralazine targets cAMP-dependent protein kinase leading to sirtuin1/5 activation and lifespan extension in C. elegans[J]. Nat Commun, 2019, 10(1): 4905.
Xia M Y, Zhao X F, Jiang X L, et al. Use of carrimycin of active ingredient thereof: WO, 2019141256A1[P]. 2019-7-25.
孙晓江, 蔡琰, 苏敏, 等. 神经肽对神经细胞脂褐素影响的实验研究[J]. 老年学杂志,1992, 12(4): 230-232.
何苗, 程琳, 李丹宇, 等. 可利霉素对临床分离菌的体内外研究[J]. 四川生理科学杂志, 2021, 43(6): 914-921.
Li S Y, Nelson D S. Acetylspiramycin and the immune system-I. Effects of acetylspiramycin on phagocytosis by mouse macrophages in vitro and in vivo[J]. Int J Immunopharmacol, 1985, 7(6):881-888.
Li S Y, Nelson D S. Acetylspiramycin and the immune system-Ⅱ. Effects on lymphocyte proliferation, lymphokine production, delayed-type hypersensitivity and antibody production[J]. Int J Immunopharmacol, 1986, 8(6): 657-664.
嚴琼. HPV阳性不同级别宫颈病变患者T淋巴细胞亚群变化及检测意义[J]. 临床医学, 2019, 12 (9): 42-44.
Zhang J, Dang F, Ren J, et al. Biochemical aspects of PD-L1 regulation in cancer immunotherapy[J]. Trends Biochem Sci, 2018, 43(12): 1014-1032.
陈涛, 梁潇, 贺明, 等. RAW264.7细胞M1/M2亚型的诱导和鉴定[J]. 中国分子心脏病学杂志, 2011, 2: 117-120.
Yan H, Sun J, Wang K, et al. Repurposing CFDA-approved drug carrimycin as an antiviral agent against human coronaviruses, including the currently pandemic SARS-CoV-2[J]. Acta Pharm Sin B, 2021, 11(9): 2850-2858.
姜恩鸿, 蒋建东, 车永胜, 等. 酰基化螺旋霉素在制备治疗冠状病毒感染疾病药物上的应用: 中国, CN202010220426.3[P]. 2020-09-18.
The clinical study of carrimycin on treatment patients with COVID-19[EB/OL]. https://www.clinicaltrials.gov/ct2/show/NCT04286503.
Matzneller P, Krasniqi S, Kinzig M, et al. Blood, tissue, and intracellular concentrations of azithromycin during and after end of therapy[J]. Antimicrob Agents Chemother, 2013, 57(4): 1736-1742.
吴银霞, 陶安倩, 陈啸洪. 大环内酯类抗生素免疫调节作用及在呼吸道疾病中的临床应用[J]. 中国新药与临床杂志, 2021,40(10): 673-677.
Kanoh S, Rubin B K. Mechanisms of action and clinical application of macrolides as immunomodulatory medications[J]. Clin Microbiol Rev, 2010, 23 (3): 590-615.
Zimmermann P, Ziesenitz V C, Curtis N, et al. The immunomodulatory effects of macrolides-a systematic review of the underlying mechanisms[J]. Front Immunol, 2018, 9: 302.
