植物药活性成分环阿屯醇药理、生理活性及其研究展望
2017-03-20张忠廉罗祖良石宏武张丽霞马小军
张忠廉+罗祖良+石宏武+张丽霞+马小军
[摘要]环阿屯醇为植物甾醇类化合物,也是诸多甾醇类化合物生物合成的关键前体物质之一,具有抗炎、抗肿瘤、抗氧化、抗菌、抗阿尔兹海默症等多种活性,且在植物的生长发育过程中扮演重要角色。该文综述了国内外文献关于环阿屯醇药理活性的研究进展,并对环阿屯醇及“环阿屯醇途径”中甾醇类化合物对植物生长发育的影响进行概述,以为其进一步研究与开发应用奠定基础。
[关键词]环阿屯醇; 药理活性; 生理活性; 综述
[Abstract]Cycloartenol, a phytosterol compound, also one of the key precusor substances for biosynthesis of numerous sterol compounds, has a variety of pharmacological activities such as anti-inflammatory, anti-tumor, antioxidant, antibiosis and anti-alzheimer′s disease. Furthermore, cycloartenol also plays an important role in the process of plant growth and development. This article reviewed the research progress on cycloartenol pharmacological activity in domestic and foreign articles, and summarized the effect of cycloartenol and "cycloartenol pathway" on the plant growth and development, laying foundation for the its further study, development and utilization.
[Key words]cycloartenol; pharmacological activity; physiological activity; review
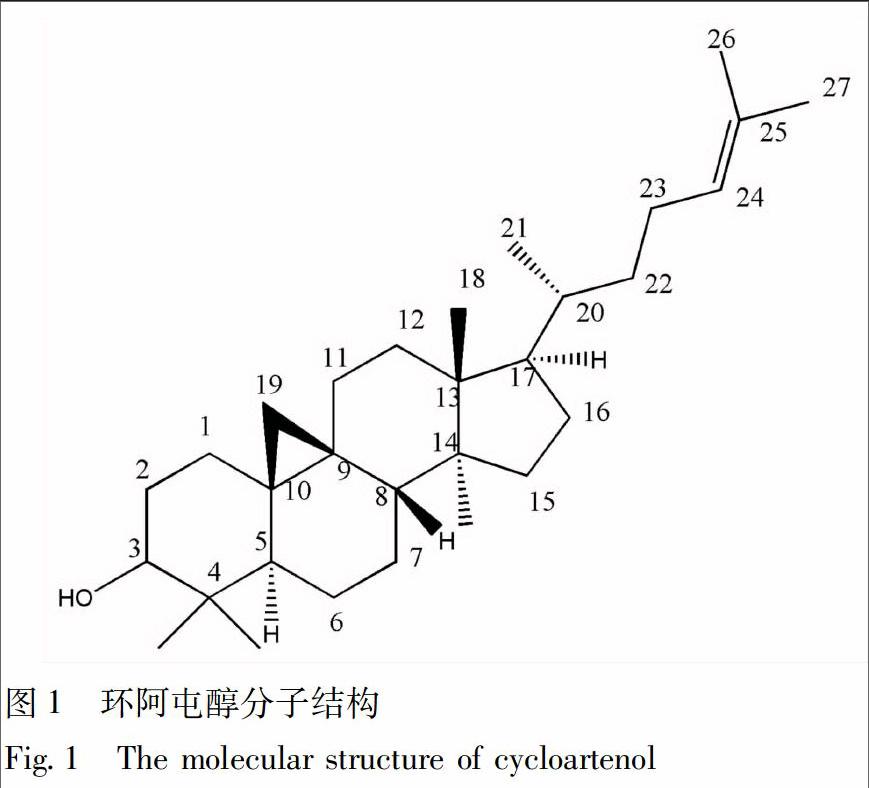
环阿屯醇(cycloartenol)为植物甾醇类化合物,也是菜油甾醇(campesterol)、豆甾醇(stigmasterol)、谷甾醇(sitosterol)等甾醇类化合物生物合成的关键前体物质之一,其结构见图1。甾醇(sterols)类化合物,广泛分布于生物体内各组织、器官中,是所有真核生物细胞质膜的重要组成部分,是真核生物细胞生长和保持细胞活力必需成分;同时,甾醇类化合物还参与植物光合作用、生殖、免疫、抗菌、抗虫等生理功能[1-5]。此外,在药用活性方面,植物甾醇类化合物还具有降低胆固醇[6]、防治前列腺疾病[7-8]、抗癌[9-12]、抗炎[13-14]、免疫调节[15]、抗病毒[16]及类激素[17-18]等作用,是具有多种药理活性的重要天然活性产物。2000年9月,美国食品与药物管理局通过了对植物甾醇的健康声明,将含植物甾醇的人造奶油和色拉酱被列入功能食品[19],在许多西方国家已被广泛用于人群慢性病预防。
作为甾醇类化合物的关键前体物质,环阿屯醇的含量高低直接决定了生物合成途径中下游甾醇化合物的生物合成效率,其合成酶CAS(cycloartenol synthase,环阿屯醇合成酶),将前体物质2,3-氧化鲨烯(2,3-oxidosqualene)环化为环阿屯醇,是环阿屯醇及下游植物甾醇类化合物生物合成的关键调控酶基因。据文献报道[20],在所有2,3-氧化鲨烯环化酶蛋白的聚类分析中,CAS酶蛋白聚为独立的一支,依据以往研究推测,环阿屯醇及其合成酶应具有某些特定的生物活性,后经研究证明,环阿屯醇对植物的生长发育具有显著影响[20]。此外,环阿屯醇还具有多种重要的显著药理活性。
本文综述了国内外文献关于环阿屯醇药理活性的研究进展,并对环阿屯醇及“环阿屯醇途径”中甾醇类化合物对植物生长发育的影响进行概述,以为其进一步研究与开发应用奠定基础。
1 环阿屯醇药理活性研究
近年来的研究表明,环阿屯醇具有抗炎、抗肿瘤、抗氧化、抗菌、提高脂肪利用率、松弛平滑肌、治愈伤口等多种活性,预示着环阿屯醇在治疗癌症、肥胖症、哮喘、皮外伤等方面具有很好的开发与应用前景。
1.1 抗炎 抗炎作用是植物甾醇类化合物较早被发现的功能之一,而环阿屯醇为其中抗炎活性最强的化合物之一。1996年,Akihisa等[21]对15种菊科植物的花进行研究,分离鉴定了包括环阿屯醇在内的11种三萜烯醇类化合物,通过采用TPA(12-O-tetradecanoylphorbol-13-acetate,12-O-十四烷酰佛波醇-13-醋酸酯)诱导小鼠耳部炎症的抗炎活性测试,结果表明11种三萜烯醇均有明显的抗炎活性,其中环阿屯醇的抗炎活性有效浓度较低,半抑制量ID50为每耳0.3 mg,与对照消炎药indomethacin(茚甲新)药效相当。2000年,该课题组又对米糠中提取的三萜烯醇和甾醇进行研究,结果再次表明来自米糠的环阿屯醇对TPA诱导小鼠耳部炎抗炎活性作用明顯[22]。2008年,杨秀伟等[23]从半夏鲜块茎中分离得到环阿屯醇,并对其活性进行研究,结果表明环阿屯醇在10 μmol·L-1浓度下对LPS(lipopolysaccharide,脂多糖)刺激的小鼠腹腔巨噬细胞产生的肿瘤坏死因子TNF-α的抑制率为54.7%,表明降低TNF-α分泌是环阿屯醇发挥抗炎作用的重要机制,推测半夏的抗炎活性可能与其有关。
1.2 抗肿瘤、抗氧化 近年来,多篇文献报道环阿屯醇具有抗肿瘤的功效,且具有多种作用机制。2004年,Chaturvedula等[24]从加拿大一枝黄花Solidago canadensis中提取得到环阿屯醇、羽扇豆醇等11个化合物,并测定了各化合物对DNA聚合酶β裂解酶活性的抑制作用,发现所有化合物对该酶活性均有抑制作用,从而推测环阿屯醇等对肿瘤具有抑制作用。其中,环阿屯醇对聚合酶β裂解酶的半抑制浓度IC50为22.6 μmol·L-1。2009年,Islam等[25]研究表明环阿屯醇自身并无自由基清除及脂膜抗氧化活性,但其具有抑制活性氧生成的作用,且可抑制LPS诱导RAW 264.7巨噬细胞的NF-κB活性,在10 μmol·L-1浓度下可显著抑制巨噬细胞中NF-κB p65的核移位。而其衍生物CAF(cycloartenyl ferulate,环木菠萝烯醇阿魏酸酯)具有显著的自由基清除及抗氧化活性,揭示了植物甾醇酸酯类化合物通过清除活性氧及抑制活性氧生成,从而达到其抗肿瘤的作用机制。2013年,Sultana等[26]对环阿屯醇在皮肤癌变及氧化应激方面的化学防护应用潜力进行了评估,发现其对表皮鸟氨酸脱羧酶活性、脂质过氧化、黄嘌呤氧化酶活性、DNA合成等方面均具有显著抑制作用,且对皮肤癌变后的谷胱甘肽消耗水平、抗氧化活性、Ⅱ相代谢酶活性均具有很好的恢复作用,因此认为环阿屯醇是一种很好的皮肤癌变化学防护剂。
1.3 抗阿尔兹海默症 2010年,JUNG等[27]从莲Nelumbo nucifera雄蕊中提取出环阿屯醇等化合物,并对其抗阿尔兹海默症活性进行检测,结果显示环阿屯醇对乙酰胆碱酯酶(acetylcholinesterase,AChE)具有很好的、非竞争性的抑制活性(IC50 11.89 μmol·L-1),对丁酰胆碱酯酶(butyrylcholinesterase,BChE)也具有很好的抑制活性(IC50 13.93 μmol·L-1)。因此,环阿屯醇具有抗阿尔兹海默症的药理活性,在抗老年性痴呆药品应用方面具有很好的开发潜力。
1.4 其他药理作用 此外,环阿屯醇还具有松弛平滑肌、提高脂肪利用率、伤口复合等药理活性。2005年,Gomes等[28]对从锦葵科植物Herissanthia tiubae提取出的2种三萜类化合物(分别为cycloeuclalenol与cycloartenol)的平滑肌松弛功能进行评估,结果显示,混合物对豚鼠气管具有解痉作用。2014年,Fukuoka等[29]研究发现从米糠中提取的环阿屯醇可以增加餐后脂肪利用率,可预防食物引起的肥胖。2015年,Ezzat等[30]对印度传统创伤药田繁缕Bergia ammannioides各化学部位的化学成分进行了提取分离,并对其创伤修复活性进行评估,结果显示,以环阿屯醇为主要化学成分之一的正己烷部位显示出最强的抗菌活性(抑制Staphylococcus aureus的最小抑菌质量浓度MIC 104 g·L-1)与抗肿瘤活性(活性强度为对照Voltaren的64.5%),而乙酸乙酯部位显示出最强的抗氧化活性,从而证实田繁缕通过抗氧化、抗菌、收敛作用从而达到重塑上皮组织并治愈伤口的目的。
2 环阿屯醇生理活性研究
环阿屯醇为植物甾醇类化合物生物合成的关键前体物质之一。早期,人们普遍认为,在甾醇化合物生物合成途径中,2,3-氧化鲨烯为共有基础物质,之后便分为不同代谢流,在高等植物、藻类及某些原生生物体内,甾醇类化合物经由2,3-氧化鲨烯环化为环阿屯醇后经一系列酶促反应生成[31-34],该途径被称为“环阿屯醇途径”;而在动物与真菌体内,2,3-氧化鲨烯则经环化步骤形成羊毛甾醇(lanosterol),之后形成结构各异的甾醇类化合物,该途径被称为“羊毛甾醇途径”。直至2009年,Ohyama等[35]在模式植物拟南芥Arabidopsis thaliana中证实植物甾醇类化合物生物合成双途径的存在,即植物甾醇类化合物既可由“环阿屯醇途径”合成,又可由“羊毛甾醇途径”合成,改变了以往人们对植物甾醇类化合物单一生物合成途径的认识。然而,进一步研究表明,在植物体内,经“羊毛甾醇途径”合成的甾醇类化合物所占比例极低,且“羊毛甾醇途径”对植物生长发育的影响力微乎其微,同时,研究表明“环阿屯醇途径”在甾醇类化合物生物合成过程中占有绝对主导性地位,且对植物的生长发育具有显著影响[20,35]。
2007年,Elena等[36]为全面了解植物甾醇在植物体内的生理机能,以拟南芥为例,采用遗传嵌合体分析法(genetic mosaic analysis)将CAS1等位基因进行突变,后观察植株次生代谢产物及表型性状变化。结果显示,前体物质2,3-氧化鲨烯在突变植株体内的积累量显著提高,下游甾醇化合物含量极低;突变植株因茎枝中质体的光合氧化作用使得类胡萝卜素与叶绿素含量降低,植株花序出现显著白化现象,且突变植株还会出现分生组织活性降低、最终细胞坏死性死亡,究其原因,可能与甾醇化合物为细胞膜不可或缺的组成成分有关。但因彼时人们并未发现植物体内“环阿屯醇途径”竞争代谢途径(“羊毛甾醇途径”)的存在,故作者并未对其进行观测。
2014年,Gas-Pascual等[20]在烟草中运用VIGS(virus induced gene silencing,病毒诱导基因沉默)技术沉默CAS1基因,以观察其对植株生长发育及次生代谢产物的影响。结果显示,对CAS1基因进行沉默后,环阿屯醇及“环阿屯醇途径”下游次生代谢产物的含量显著降低,其前体物质2,3-氧化鲨烯的积累量显著提高;作为对照,采用相同方法沉默“羊毛甾醇途径”中基底物质羊毛甾醇的合成酶编码序列LAS1(lanosterol synthases encoding sequences 1)。结果显示,该途径相关代谢产物含量無显著性变化,且其前体物质2,3-氧化鲨烯的积累量较基因沉默之前亦无显著性差异。此外,作者还对CAS1基因沉默后烟草植株的生长发育进行了观测,发现突变植株的生长发育严重受损,出现植株矮化、叶漂白化(叶脉尤其明显)、叶片萎缩(甚至坏死)等不良现象,营养生长及繁殖生长均受到严重影响,以上结果与之前拟南芥中证明的CAS1重要角色的研究结果一致。同时,该文献还指出烟草LAS1基因对植物正常生长发育无显著影响,再次证明环阿屯醇及其代谢途径无可替代、“羊毛甾醇途径”可有可无的角色地位。
3 研究展望
以上综述表明环阿屯醇具有抗炎、抗肿瘤、抗阿尔兹海默症等多种药理活性,且活性较强,但其具体的作用机制尚未可知。生理方面,初步研究表明,“环阿屯醇途径”对植物正常的生长发育意义重大,该途径相关次生代谢产物的缺失可引起植株出现矮化、叶漂白化(叶脉尤其明显)、叶片萎缩(甚至坏死)等不良现象,营养生长及繁殖生长均受到严重影响,但研究者尚未对其具体的影响机制进行深入研究。因此,今后需进一步加强环阿屯醇及“环阿屯醇途徑”相关次生代谢产物在以上所提及的药理活性、生理作用方面的机制研究,为其进一步的药品研发、优良品种选育等领域的应用奠定基础。
据统计,目前国际上以天然产物及其衍生化合物组成的药物约占所有药物的40%[37-38],其中以来源于植物的天然产物占绝大多数,植物甾醇类化合物为其重要组成部分。但因生态环境的不断恶化、人们对药用植物的滥采乱伐,外加药用植物自身所含甾醇类化合物含量的低下,采用传统的从药用植物中直接提取的方式已无法满足人们对其不断拓展的市场需求。随着合成生物学技术在青蒿素[39]、紫杉醇[40]、丹参酮[41]等重要活性成分生物合成研究中的应用,人们普遍认为合成生物学可有效解决药用植物资源匮乏、天然活性产物日益稀缺的窘境,将合成生物学应用于天然产物的可持续利用研究已成大势所趋。在合成生物学领域,酿酒酵母Saccharomyces cerevisiae为应用最成熟的真核底盘细胞,然而,在酿酒酵母细胞内,只存在完整的“羊毛甾醇途径”,而对于“环阿屯醇途径”,酿酒酵母细胞中因部分关键合成酶(如CAS)的缺失导致其体内并未存在完整的“环阿屯醇途径”,鉴于“环阿屯醇途径”对植物正常生长发育至关重要的生理作用、其次生代谢产物多种重要的显著药理活性,以酿酒酵母为底盘细胞,开展“环阿屯醇途径”生物合成相关领域的研究意义重大。
对于环阿屯醇,其不仅是甾醇分支途径首要的关键前体物质,在甾醇化合物生物合成过程中还扮演其他重要角色。当前,在医药工业领域,人们通常以植物体内含量较高的甾醇类化合物为基础物质(以谷甾醇为主),通过微生物发酵,制成重要的甾体药物半合成的中间体[42]。甾醇类化合物,依其C-4位上有无甲基及甲基个数可分为4-无甲基甾醇(如谷甾醇、豆甾醇)、4-单甲基甾醇(如钝叶大戟甾醇、卢竹甾醇)和4,4-双甲基甾醇(如环木菠萝烯醇、α-香树精),然而,在甾醇生物合成途径基础物质中,环阿屯醇为唯一的4,4-双甲基甾醇化合物,换言之,环阿屯醇是所有4,4-双甲基甾醇类化合物生物合成不可或缺的基底物质。在环阿屯醇生物转化及结构修饰方面,主要有以下4个研究方向:①将其C-3位的羟基与脂肪酸结合,形成植物甾醇酯。有文献报道[43-44],酯化后的甾醇酯可大大改善植物甾醇的酯溶性,且熔点降低,在降胆固醇方面,其效果优于甾醇;②将C-17位侧链切断,后与其他活性基团结合,可生成多种甾醇类活性物质。有研究者将谷甾醇通过生物降解法切断C-17位侧链,生成甾体药物半合成的重要中间体雄甾-4-烯-3,17-二酮(4AD)或雄甾-1,4-二烯-3,17-二酮(ADD),之后通过几步化学反应即可制得多种甾体药物;③打开9β,19-环丙烷环可生成如羊毛甾醇lanosterol、帕克醇parkeol、10α葫芦素10α-cucurbitacin等基底物质,之后经过微生物转化或结构修饰可生成多种甾醇活性物质[45];④C-14去甲基化。控制C-14去甲基化反应可生成多种衍生物,从而引发多种环阿屯醇转化衍生物的生物合成途径[45]。
[参考文献]
[1]Benveniste P, Rahier A. Target sites of sterols biosynthesis inhibitors in plants[M]//Koll er WD(ed).Target sites of fungicide action. London: CRC Press, 1992:206.
[2]李端,周立刚,谈满良,等.几种植物提取物对梨果仙人掌斑点病菌的抑制活性[J].西北农林科技大学学报, 2005, 33(Suppl):148.
[3]王冬梅,朱玮,李娟丽.卷叶黄精根茎的化学成分及抗菌活性研究[J].四川大学学报,2007, 44(4): 918.
[4]Atta-Ur-Rahman, Choudhary M I, Majeed A, et al. A succinylanthranilic acid ester and other bioactive constituents of Jolyma laminarioides[J]. Phytochemistry, 1997, 46(7): 1215.
[5]Rick C, Heupel Y, Sauvaire, et al. Sterol composition and biosynthesis in sorghum: importance to developmental regulation[J]. Lipids, 1986, 21(1): 69.
[6]Moghadasian M H, Frohlich J J. Effects of dietary phytosterols on cholesterol metabolism and atherosclerosis: clinical and experimental evidence [J]. Am J Med, 1999, 107(6): 588.
[7]Berges R R, Windeler J, Trampisch H J, et al. Randomised, placebo-controlled, double-blind clinical trial of beta-sitosterol in patients with benign prostatic hyperplasia. Beta-sitosterol study group[J]. Lancet, 1995, 345(8964): 1529.
