挤压膨化处理对酶解小米粉蛋白结构和功能特性的影响
2023-08-25乔嘉玮李涌泉陈树俊张丽珍
岐 婉,乔嘉玮,李涌泉,陈树俊,杨 埔,张丽珍
(山西大学生命科学学院,山西太原 030006)
全球对植物蛋白的兴趣与日俱增,主要存在补充蛋白营养不良和部分动物蛋白不足的问题,因此,植物蛋白市场正在快速扩张,尤其是植物蛋白饮料的快速发展,还包括植物蛋白肉、植物蛋、植物蛋白肽等,广泛应用于食品工业各领域,预计到2050 年蛋白质食品的需求将超过当前需求的三分之一[1]。但目前植物蛋白结构多样性和复杂性,加工技术与蛋白质结构和性质之间的关系仍未确立,还需要进一步研究[2]。
小米蛋白因其独特的营养价值和营养保健特性而引起了广泛的研究兴趣[3],除了高营养价值外,小米蛋白还是一种低过敏性蛋白,其成分主要包括清蛋白、球蛋白、醇溶蛋白、谷蛋白和其他不溶性蛋白[4],可用于婴儿配方食品,小米蛋白不含麸质,这是其用于无麸质产品的一个关键优点。小米蛋白含量最多的是醇溶蛋白[5],是具有治疗胃肠疾病的天然蛋白[6],具有低敏性且能治疗消化不良的效果[7-8]。有关小米挤压膨化的研究亦不断被报道,如蒋长兴等[9]优化了挤压膨化小米粉制备的工艺参数。巩敏等[10]分析了小米籽粒性状及理化性质对小米膨化后品质特性的影响。沈静等[11]将小米挤压粉与小米生粉按照1:1预先混合后,成功制作出口感、品质均较好的纯小米面条。马永轩等[12]研究了高温α-淀粉酶挤压膨化耦合处理对全谷物糙米粉品质的影响。目前有关加酶酶解后挤压膨化小米粉对蛋白的研究较少,研究方法不同、样品不同,导致研究结果存在差异性。
本研究通过酶解处理后进行挤压膨化加工方式对小米粉进行熟化处理,提取四种蛋白组分,比较其性质和结构的变化,为开发小米功能食品的研究提供理论依据,进一步提升小米加工业的发展。
1 材料与方法
1.1 材料与仪器
小米 山西省晋中市丰谷源种植专业合作社;大豆油 市售;高温α-淀粉酶(酶活力4000 U/g) 北京索莱宝科技有限公司;PBS 缓冲液、SDS-PAGE 凝胶制备试剂盒、考马斯亮蓝G250、Marker、5×非还原型蛋白上样缓冲液 赛文科技有限公司;石油醚、氢氧化钠、氯化钠、无水乙醇、碳酸钠、硫酸铜、酒石酸钾钠、牛血清蛋白、福林酚试剂等 均为分析纯,国药集团。
DS32-ⅡA 实验双螺杆膨化机 济南赛信膨化机械有限公司;MultiDrive IKA 研磨机 艾卡(广州)仪器有限公司;Ifinite 200 Pro 多功能微孔板检测仪帝肯(上海)贸易有限公司;UV 1000 紫外分光光度计、FL970 荧光分光光度计、Artemis 6000C 氨基酸自动分析仪 上海天美科学仪器有限公司;YXQLB-75SII 立式蒸汽灭菌机 上海博讯医疗生物仪器股份有限公司;Vortex dancer IIIS 漩涡机 莱普科学仪器(北京)有限公司;DYY-6C 电泳仪 北京六一生物科技有限公司;Nicolet IS50 红外光谱仪Thermos Electron Corporation。
1.2 实验方法
1.2.1 加酶挤压膨化处理工艺 小米粉碎过60 目筛,添加高温α-淀粉酶(750 U/g 以小米粉质量计)搅拌混匀,使小米粉水分含量达到16%,在立式压力蒸汽灭菌锅中100 ℃(高温α-淀粉酶最适作用温度在90 ℃以上)酶解30 min,酶解后的小米粉加入双螺杆膨化机,膨化机工作参数为:前段温度70 ℃,中段温度170 ℃,后段温度190 ℃,螺杆转速30 Hz,收集挤出样品,将样品干燥粉碎密封保存备用。实验分为4 组:小米粉不加酶不挤压(小米生粉)、小米粉加酶不挤压(加酶小米粉)、小米粉挤压不加酶(挤压小米粉)和小米粉加酶挤压(加酶挤压粉)。
1.2.2 小米蛋白的提取 将处理后的小米粉过60 目筛,石油醚浸泡(10:1)过夜,抽滤三次进行脱脂,晾干粉碎过60 目筛,采用Osborne 法[13]并稍作修改,提取清蛋白、球蛋白、醇溶蛋白和谷蛋白。清蛋白使用水提法,取脱脂小米粉与蒸馏水(1:10)混匀,浸提温度45 ℃,浸提时间1.5 h,水浴搅拌后于8000 r/min离心20 min,两次提取上清液浓缩冷冻干燥,为清蛋白。球蛋白使用盐提法,浓度为3%的氯化钠溶液80 mL,浸提时间1.5 h,水浴搅拌后离心取上清液,透析24 h,两次提取上清液浓缩冷冻干燥,为球蛋白。醇溶蛋白使用乙醇溶液提取,加入浓度为80%的乙醇溶液80 mL,浸提时间1.5 h,浸提温度45 ℃,水浴搅拌后离心, 两次提取上清液浓缩冷冻干燥,为醇溶蛋白。谷蛋白使用碱提法,加入浓度为0.2%的氢氧化钠溶液60 mL,浸提温度50 ℃,浸提时间2 h,水浴搅拌后离心,两次提取上清液浓缩冷冻干燥,为谷蛋白。提取液中蛋白质浓度的测定,采用福林酚法,计算蛋白的含量。
1.2.3 蛋白持水性及持油性的测定 参照Luo 等[14]的方法稍作修改,称取小米蛋白0.1 g,加入10 mL蒸馏水(大豆油),静置20 min 后于4000×g 下离心20 min,称取离心后沉淀的总质量,计算公式如下所示:
式中:W0表示小米蛋白样品的质量,g;W1表示离心前离心管和小米蛋白样品的总质量,g;W2表示离心后离心管和沉淀的总质量,g。
1.2.4 蛋白起泡性及稳定性测定 参照李迎秋等[15]的方法,配制0.01 g/L 小米蛋白悬浮液,放置15 mL 的螺口管中,用漩涡机搅打2 次,每次30 s,中间间隔数秒,迅速记录螺口管中的总体积和泡沫体积。静置20 min,记录泡沫体积。计算公式如下所示:
1.2.5 蛋白乳化活性及乳化稳定性测定 优化Jiang等[16]方法,称取小米蛋白0.1 g,溶于10 mL 0.1 mol/L pH7 的磷酸盐缓冲溶液中。将1.5 mL 大豆油加入4.5 mL 样品溶液中,均质5 min,在均质结束并静置10 min 后立即从底部吸取50 μL 的样品,用5 mL 0.1%的SDS 溶液进行稀释,测定500 nm 处吸光度值,分别记为A0和A10。
乳化活性指数(Emulsification Activity Index,EAI)按如下公式计算:
式中:EAI 为乳化活性指数,m2/g;N 为稀释倍数;φ为体系中油相所占分数;C 为蛋白浓度,g/mL;L 为比色池光径,1 cm。
乳化稳定性(Emulsification Stability Index,ESI)按如下公式计算:
式中:ESI 为乳化稳定性指数,min;A0为0 min时的吸光度值;ΔT 为测定乳化性的两次时间间隔,本试验取10 min;A10为10 min 时的吸光度值。
1.2.6 小米蛋白组分SDS-PAGE 电泳测定 参考Laemmli[17]的方法稍作修改,将样品溶于溶解液中,100 ℃煮沸3~5 min,冷却待用。吸取样品到SDSPAGE 凝胶制备试剂盒的上样孔,依次加入8 μL 上样缓冲液,32 μL 蛋白溶液,电泳仪设置160 V 电压运行,当试样带距边缘1 cm 时停止电泳。取下胶体,切角标记,染色液浸泡,放置摇床脱色,直到蛋白质区带清晰。
1.2.7 红外光谱测定 使用Thermo Scientific Nicolet iS50 红外光谱仪研究加酶挤压前后小米蛋白组分的二级结构。使用溴化钾压片法,记录冷冻干燥的样品在300~4000 cm-1范围内的光谱变化。
1.2.8 紫外光谱测定 使用紫外分光光度计测定加酶挤压前后小米蛋白组分悬浮液的紫外光谱,将蛋白质样品用磷酸盐缓冲液(pH7.0)稀释至0.2 mg/mL后进行紫外光谱扫描,波长范围为250~310 nm,扫描速率为100 nm/min,分辨率为0.2 nm。
1.2.9 荧光光谱测定 参考Huang 等[18]方法稍作修改,使用荧光分光光度计测量加酶挤压前后小米蛋白组分悬浮液的荧光光谱。样品用磷酸盐缓冲液(pH7.0)稀释到2 mg/mL 进行测定,设定激发波长为290 nm,发射波长范围为300~460 nm,狭缝宽度为5 nm,电压为700 mV 进行荧光光谱扫描。
1.2.10 氨基酸含量测定 根据GB/T 5009.124-2003,采用氨基酸自动分析仪测定16 种氨基酸的含量。
1.3 数据处理
使用SPSS 26 软件进行Duncan 显著性分析,P<0.05 表示差异显著,使用Origin 2019 制图,不同字母表示不同处理间差异显著。
2 结果与分析
2.1 挤压膨化处理对酶解小米粉蛋白组分含量的影响
不同处理小米粉中各蛋白组分含量见表1。清蛋白含量在5.39%~16.83%,球蛋白含量在1.48%~5.57%,醇溶蛋白含量在20.42%~51.74%,谷蛋白含量在11.53%~22.69%,郭莲东[19]测定小米挤压前后蛋白含量结果为:清蛋白在1.86%~4.12%之间,球蛋白在3.15%~11.42%之间,醇溶蛋白1.48%~43.02%之间,谷蛋白5.57%~20.77%之间。实验结果不同,主要是因为Osborne 法是根据不同溶剂溶解不同蛋白组分而进行分离,可能实验原料、提取温度、时间不同,也可能是挤压条件不同,蛋白组分之间的结合程度也有所不同[20]。经过挤压处理后,高温条件会使小米粉迅速脱去水分,蛋白质分子进行伸展、重组,分子间的二硫键与氢键部分断裂,导致蛋白质变性[21],这是蛋白含量下降的主要原因,也可能是由于在挤压过程中受到温度和压力作用,蛋白质和淀粉之间发生化学反应,使得蛋白组分和淀粉结合在一起,需要提取的蛋白较难获得。

表1 高温α-淀粉酶结合挤压膨化处理对小米蛋白含量的影响(%)Table 1 Effect of high temperature α-amylase combined extrusion on foxtail millet protein content (%)
2.2 挤压膨化处理对酶解小米粉蛋白持水性及持油性的影响
加酶挤压处理前后小米各组分蛋白的持水性如图1 所示。谷蛋白的持水能力最强,小米生粉、加酶小米粉、挤压小米粉和加酶挤压粉的谷蛋白的持水性分别为4.53、4.16、7.76、7.48 g/g,其次是醇溶蛋白、球蛋白以及清蛋白。与管骁等[22]的研究结果相似。蛋白质的持水性和溶解度成反比[23],清蛋白、球蛋白的持水力较低可能是由于较高的溶解度和清蛋白、球蛋白与水分子之间的弱分子间相互作用所导致的[24]。挤压处理使各个蛋白组分的持水性最好,这是由于小米粉经过挤压膨化处理,在机体内经高温、高压、高剪切等作用后,蛋白质变性降解,淀粉糊化,挤压产品具有疏松、多孔的结构,因此持水性最好[25]。加酶挤压处理前后小米各组分蛋白的持油性如图2 所示。谷蛋白的持油性均大于其他组分,小米生粉、加酶小米粉、挤压小米粉和加酶挤压粉的谷蛋白的持油性分别为15.97、15.58、19.21、19.92 g/g,是因为谷蛋白的容积密度较小,持油能力最好[26],其次是球蛋白、清蛋白和醇溶蛋白。有研究表明,蛋白质持油能力最主要的贡献是物理截留作用[27]。而持油性与蛋白质分子表面亲油基团有关,对于改善产品口感、保持风味很重要[28]。
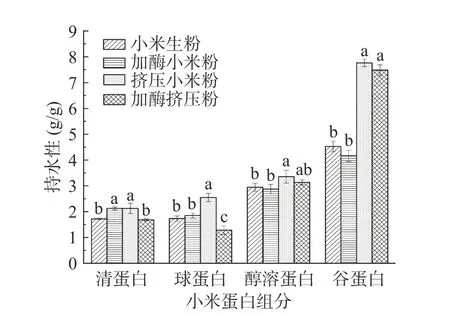
图1 挤压膨化处理对酶解小米粉蛋白持水性的影响Fig.1 Effect of extrusion treatment on water retention of enzymatic hydrolysis of foxtail millet flour protein
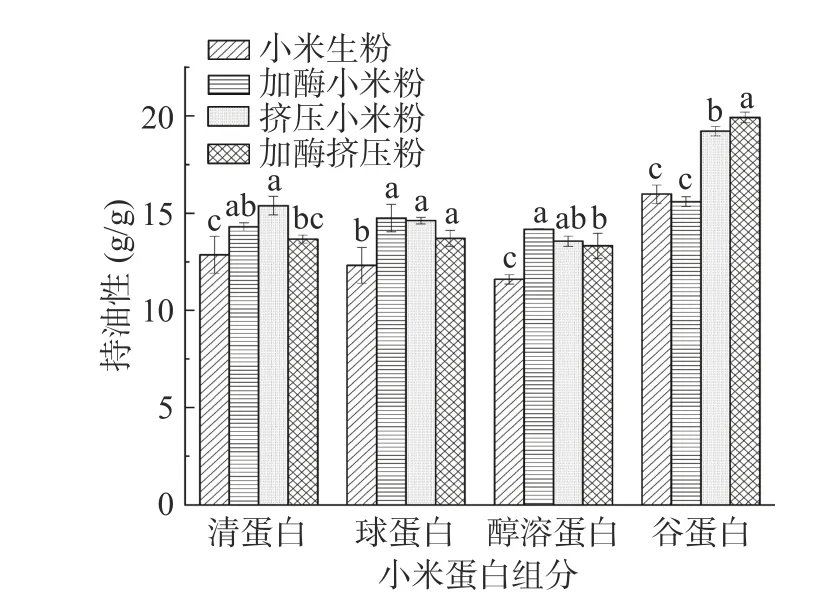
图2 挤压膨化处理对酶解小米粉蛋白持油性的影响Fig.2 Effect of extrusion treatment on oil retention of enzymatic hydrolysis of foxtail millet flour protein
2.3 挤压膨化处理对酶解小米粉蛋白起泡性及泡沫稳定性的影响
加酶挤压处理前后小米各组分蛋白的起泡性及泡沫稳定性如图3、图4 所示。起泡能力是指泡沫分散气泡的能力,泡沫稳定性是指形成连续的薄膜而捕获气泡的能力,蛋白质的起泡性可以赋予食品疏松的结构,使其具有良好的口感,其与蛋白中可溶性蛋白含量及其在溶液中的稳定性相关[29]。小米蛋白各组分的起泡能力经加酶、挤压、加酶挤压处理后下降,清蛋白和球蛋白在挤压和加酶挤压处理后起泡性为0,谷蛋白的起泡性最好,谷蛋白的起泡性分别为124%、120%、57.33%、18.67%,加酶小米粉谷蛋白、加酶挤压粉谷蛋白较小米生粉谷蛋白起泡性下降了53.77%、84.94%。挤压、加酶挤压处理起泡性下降的原因可能是高温、高压、高剪切力的作用,过高的温度会导致蛋白质大量变性和不溶组分的高度聚集,界面膜的初始稳定性降低,蛋白的起泡性出现损失[30],溶解度与起泡性有关[31],同时谷蛋白的持水性也是最好的。
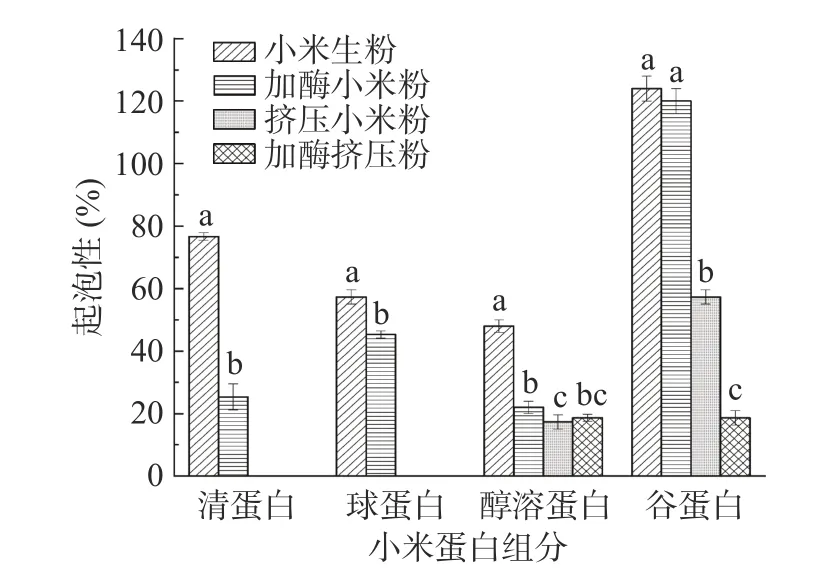
图3 挤压膨化处理对酶解小米粉蛋白起泡性的影响Fig.3 Effect of extrusion treatment on foamability of enzymatic hydrolysis of foxtail millet flour protein
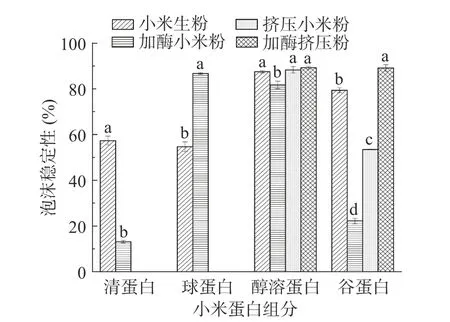
图4 挤压膨化处理对酶解小米粉蛋白泡沫稳定性的影响Fig.4 Effect of extrusion treatment on foam stability of enzymatic hydrolysis of foxtail millet flour protein
小米粉醇溶蛋白的泡沫稳定性分别为87.49%、81.72%、88.33%、89.25%,均高于其他蛋白组分;加酶处理后,清蛋白、谷蛋白的泡沫稳定性显著下降;加酶挤压处理后,醇溶蛋白和谷蛋白的泡沫稳定性增强。小米醇溶蛋白泡沫稳定性较强,是因为醇溶蛋白具有较强的疏水性,泡沫稳定性与疏水性相关[32]。加酶处理后清蛋白、谷蛋白的泡沫稳定性下降,是因为α-淀粉酶酶解后蛋白质的黏度变小,气泡不稳定,使得泡沫稳定性变差。小米醇溶蛋白、谷蛋白起泡能力主要是因为在挤压过程中,高温、高压使得谷蛋白结构发生变化,形成更多的无规卷曲结构,展开的蛋白质分子间彼此作用构成更加稳定的网络结构,从而使谷蛋白起泡稳定性增加[33]。
2.4 挤压膨化处理对酶解小米粉蛋白乳化性及乳化稳定性的影响
小米中各蛋白组分的乳化活性指数(EAI)和乳化稳定性指数(ESI)如图5、图6 所示。乳化活性是蛋白质作为界面活性剂能力的一个指标,蛋白质乳化剂在水相中分散的油滴周围形成粘弹性膜[34]。从图5可以看出醇溶蛋白的乳化活性分别为1.63、1.49、1.42、1.69 m2/g,乳化活性显著高于其他蛋白组分(P<0.05),乳化活性与表面疏水性和溶解度有关[28],醇溶蛋白疏水性极强,因此,醇溶蛋白具有良好的乳化活性。经过加酶挤压处理,小米醇溶蛋白的乳化活性显著提高,可能是因为挤压膨化处理,蛋白质受到高压和高温的影响,使部分蛋白变性,更多的亲油性疏水基团暴露,蛋白质表面疏水性增强,从而提高蛋白的乳化能力[35]。挤压膨化处理的小米谷蛋白乳化活性降低,主要原因是蛋白质分子的伸展受到阻碍导致分子链向内收缩,界面蛋白层的结构发生改变,从而降低了蛋白质在界面的吸附性和相互作用,表现为乳化活性降低[36]。

图5 挤压膨化处理对酶解小米粉蛋白乳化性的影响Fig.5 Effect of extrusion on emulsification of enzymatic hydrolysis of foxtail millet flour protein
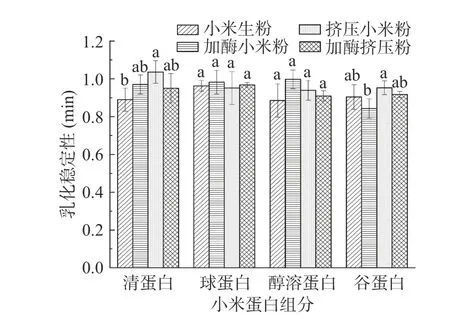
图6 挤压膨化处理对酶解小米粉蛋白乳化稳定性的影响Fig.6 Effect of extrusion on emulsification stability of enzymatic hydrolysis of foxtail millet flour protein
乳化稳定性是指乳液对外界压力保持稳定的能力[28]。蛋白质在食品体系中常做乳化剂[37]。由于不同的表面疏水性和溶解度,不同处理对不同蛋白组分的乳化稳定性和ESI 的影响不一致。研究表明,有效改善乳化稳定性可以通过适当的热处理[38],疏水基团暴露出来,蛋白质表面活性及柔性增强,蛋白质聚合物也会增多。
2.5 挤压膨化处理对酶解小米粉蛋白组分亚基的影响
不同处理所得小米蛋白电泳图如图7 所示。图7(a)为小米生粉、加酶小米粉蛋白电泳图,(b)为挤压小米粉、加酶挤压粉蛋白电泳图。在加酶挤压膨化处理下蛋白组分的电泳图谱与小米生粉有明显差异。小米生粉清蛋白约有14 条谱带,球蛋白约有2 条谱带,分别为15、42 kDa,醇溶蛋白有明显的3 条谱带,分别代表α-醇溶蛋白、β-醇溶蛋白和γ-醇溶蛋白[39],分子量分别为11.86、24.94、26.3 kDa。谷蛋白电泳条带不清晰,可能由于其溶解性较差、纯度较低的原因[40]。加酶处理后,清蛋白的谱带减少,球蛋白的谱带增加,清蛋白和球蛋白蛋白谱带相近,这是因为采用传统的Osboren 分级分离方法难免会造成清蛋白和球蛋白的相互污染,可能造成条带相混[19]。小米醇溶蛋白经过处理后分子量差异不大,经过处理后条带颜色有深有浅,加酶小米粉醇溶蛋白最深,挤压小米粉醇溶蛋白最浅,挤压处理使小米蛋白质各亚基之间发生交联,也可能使小米蛋白质发生了降解,电泳实验不易将各亚基分开,所以产生了较严重的拖尾现象,条带较不清晰。有研究表明,挤压膨化处理使二、三、四级紧密结构展开,暴露更多的酶解位点,使酶分子更容易进入蛋白质内部,促进了碱性蛋白酶的水解,小分子蛋白片段增多[34]。注:M:Marker;(a)小米生粉、加酶小米粉蛋白:1 小米生粉清蛋白;2 小米生粉球蛋白;3 小米生粉醇溶蛋白;4 小米生粉谷蛋白;5 加酶小米粉清蛋白;6 加酶小米粉球蛋白;7 加酶小米粉醇溶蛋白;8 加酶小米粉谷蛋白;(b)挤压小米粉、加酶挤压粉蛋白:1 挤压粉清蛋白;2 挤压粉球蛋白;3 挤压粉醇溶蛋白;4 挤压粉谷蛋白;5 加酶挤压清蛋白;6 加酶挤压球蛋白;7 加酶挤压醇溶蛋白;8 加酶挤压谷蛋白。
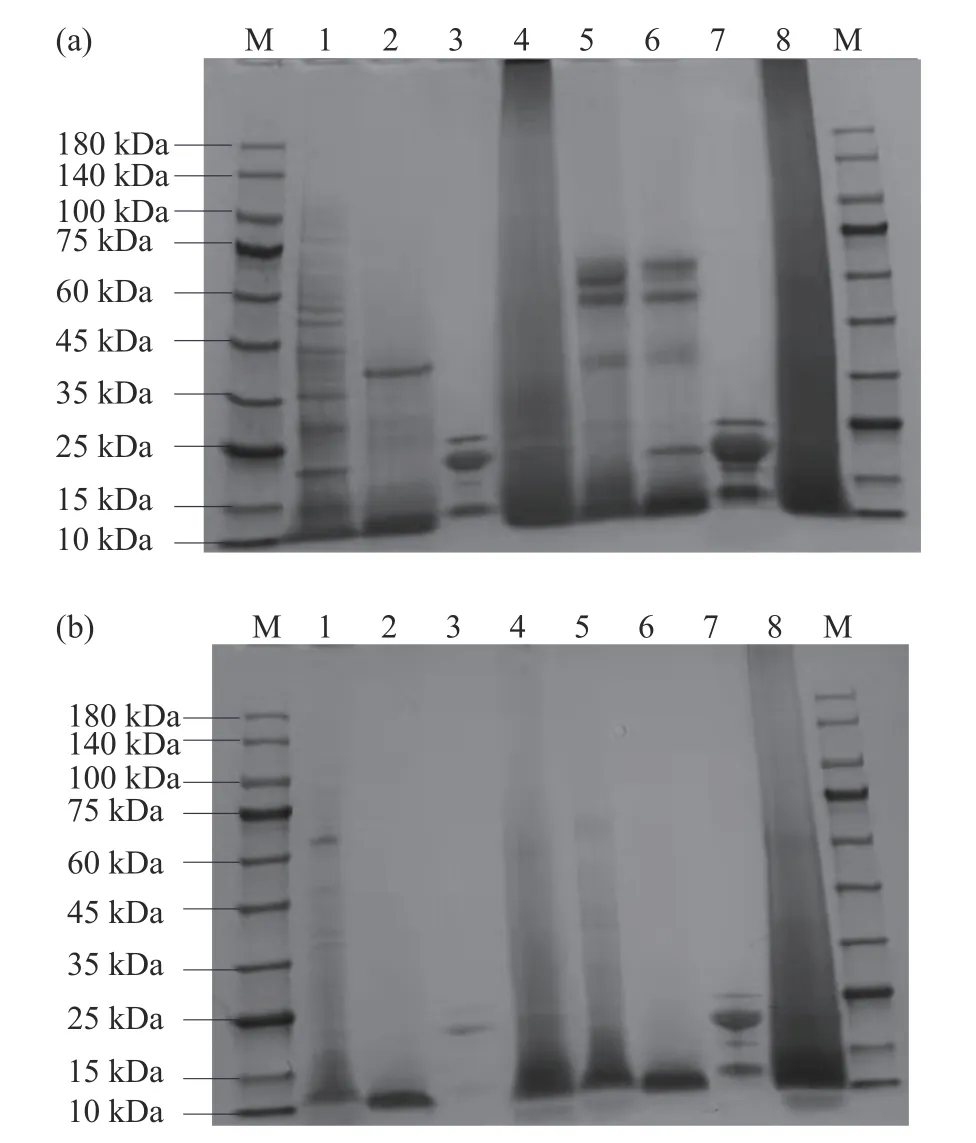
图7 挤压膨化处理对酶解小米粉蛋白组分亚基的影响Fig.7 Effect of extrusion treatment on enzymatic hydrolysis of protein subunits of foxtail millet flour
2.6 挤压膨化处理对酶解小米粉蛋白二级结构的影响
图8是小米粉4 种蛋白组分的特征红外吸收光谱。从图8 中可以看出,根据光谱图中显示的特征吸收谱带的位置,鉴别分子中所含有的特征官能团和化学键的类型[41],在3400~3300 cm-1之间代表-OH伸缩振动峰,在1700~1200 cm-1之间的吸收峰代表蛋白质和多糖的振动峰[42]。在1600~1700 cm-1处代表酰胺I 带,主要是由C=O、C-N 伸缩以及N-H 弯曲引起的[43]。从图中可以看出清蛋白吸收峰在1652 cm-1附近、球蛋白在1630 cm-1附近、醇溶蛋白在1643 cm-1附近、谷蛋白在1653 cm-1附近;在1500~1600 cm-1处代表酰胺II 带,主要是由于CN 伸展、N-H 弯曲振动引起的,图中对应酰胺II 区域分别处于1539、1534、1544、1540 cm-1处;在1400~1500 cm-1处代表酰胺III 带,主要是是由C-N 引起的,图中对应区域为1417、1442、1419、1428 cm-1处;在900~1200 cm-1处代表多糖的振动峰,其中1145 cm-1附近吸收峰主要是由C-O、C-C 的伸缩振动引起的;1012 cm-1附近吸收峰主要由C-O、COH 的振动引起的,因此小米蛋白组分中存在糖蛋白。加酶挤压前后的蛋白原料的特征吸收峰并无差别,说明挤压过程中没有新的肽键生成。
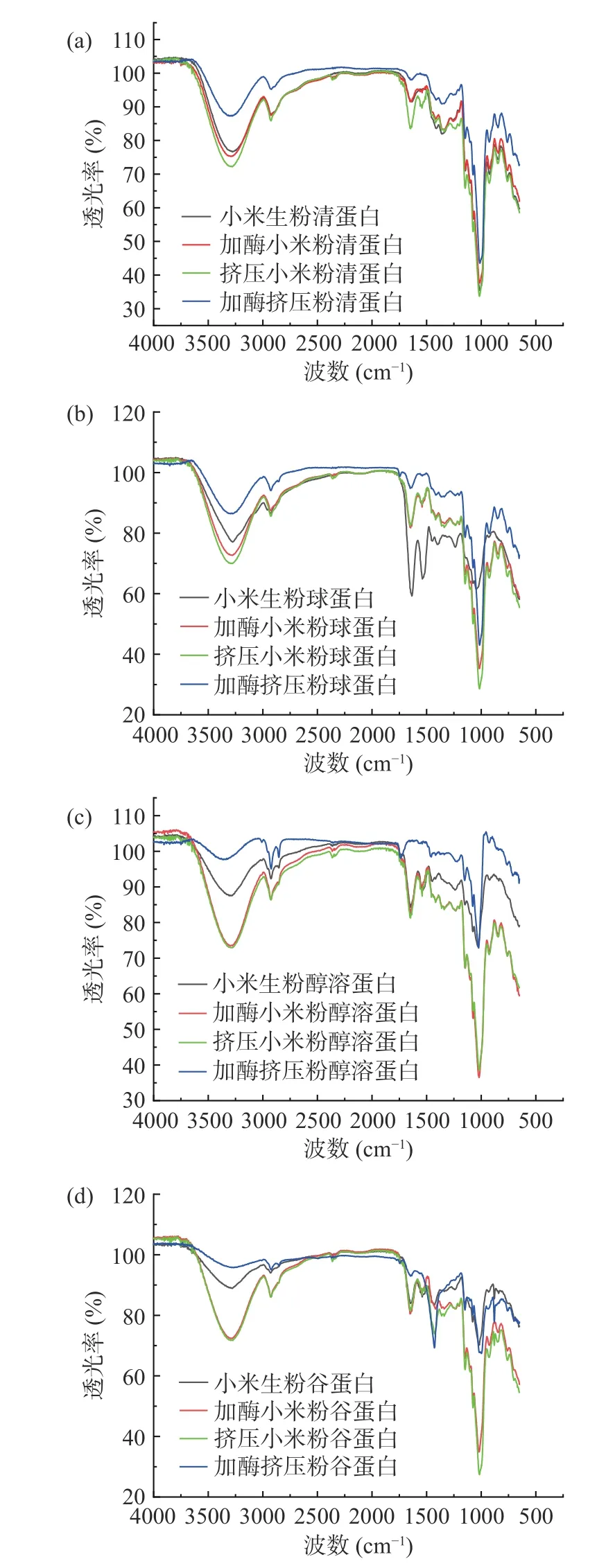
图8 酶解小米粉挤压膨化处理蛋白的红外光谱图Fig.8 Infrared spectrogram of the extruded protein of enzymatic hydrolysis of foxtail millet flour
2.7 挤压膨化处理对酶解小米粉蛋白三级结构的影响
蛋白质中紫外光是由酪氨酸(Tyr)、苯丙氨酸(Phe)和色氨酸(Trp)等氨基酸决定的,它们的最大吸收波长分别为:Tyr 275 nm,Trp 280 nm,Phe 257 nm,紫外光谱能反映蛋白结构的变化情况[44]。图9 所示为小米4 种蛋白组分的紫外吸收光谱,(a)为小米生粉、加酶小米粉蛋白紫外吸收光谱图,(b)为挤压小米粉、加酶挤压粉蛋白紫外光谱图。由图9 可知,在260~280 nm 处,不同蛋白组分均出现最大吸收峰,这是由于Tyr、Trp、Phe 紫外吸收作用,球蛋白吸收峰在259 nm 处,吸光度值为0.925;谷蛋白吸收峰在281 nm 处,吸光度值为0.564;清蛋白和醇溶蛋白的吸收峰较小,分别在259、276 nm 处。由图9 可知,挤压后四种蛋白组分的吸收强度下降,吸收峰均向左偏移2~3 nm,发生微弱的蓝移现象,说明蛋白质分子在挤压后发生复性,使芳香族氨基酸的侧链残基逐渐内埋于蛋白质内部,所处环境极性逐渐降低。
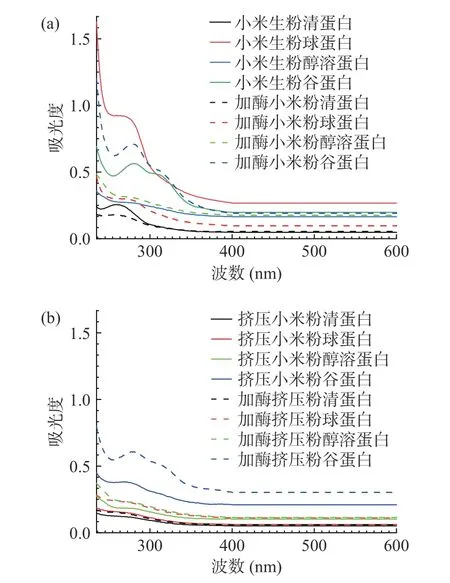
图9 酶解小米粉挤压膨化处理蛋白的紫外吸收光谱图Fig.9 UV absorption spectra of the extruded protein of enzymatic hydrolysis of foxtail millet flour
蛋白质中荧光性主要由色氨酸残基决定的[45-46]。本研究所用的激发波长为290 nm,光谱主要来源于Trp 的荧光发射,表征了Trp 所在的微环境,在第三级重新修饰蛋白质构象[47]。图10 所示为小米4 种蛋白组分的荧光吸收光谱,4 种蛋白质具有典型的Trp 发射光谱,荧光峰分布在357.5~361 nm 之间。荧光峰强度越高表现为蛋白表面疏水性越强。小米生粉球蛋白荧光强度较高可能是因为荧光发色团的色氨酸含量较高。加酶挤压处理后,四种蛋白组分观察到蓝移现象,这与蛋白紫外光谱分析结果相对应。说明蛋白质三级结构没有发生改变。四种蛋白组分的荧光强度下降,是由于挤压膨化在高温高压和高剪切力作用下,使蛋白质结构发生变化,导致蛋白质的表面疏水性下降,使芳香族氨基酸的侧链残基逐渐内埋于蛋白质内部,疏水基团被包埋[48]。
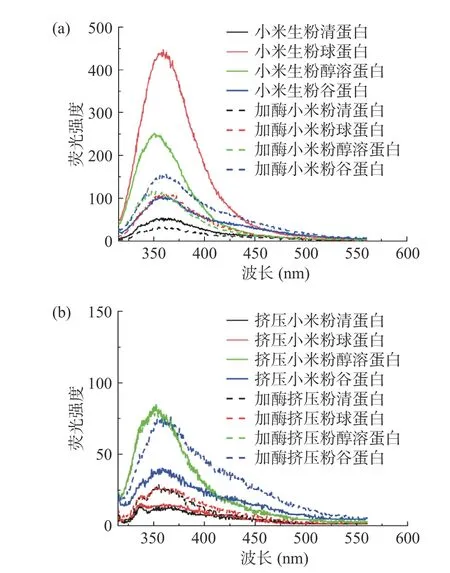
图10 酶解小米粉挤压膨化处理蛋白的荧光光谱图Fig.10 Fluorescence spectra of the extruded protein of enzymatic hydrolysis of foxtail millet flour
2.8 挤压膨化处理对酶解小米粉蛋白的氨基酸含量的影响
小米蛋白的氨基酸含量见表2,从表中可以看出小米不同蛋白组分的谷氨酸含量最高,含量较低的有赖氨酸、组氨酸、甘氨酸、精氨酸。谷氨酸营养价值十分丰富,普遍存在自然界中,可以提高蛋白质代谢水平,改善儿童智商,还能修护皮肤和增加毛发。谷氨酸具有增香调味的作用,用于鸡精、香料之中[49]。食物鲜美的味道主要取决于存在谷氨酸和天冬氨酸含量,在小米不同蛋白组分中谷氨酸和天冬氨酸含量占比很高,促使小米具有良好的风味。在4 种蛋白组分中,醇溶蛋白的氨基酸含量较高,谷蛋白次之。经挤压膨化后,除缬氨酸、亮氨酸、酪氨酸、苯丙氨酸含量基本维持外,其余氨基酸含量存在一定程度损失。由于挤压膨化过程中受高温、高压、高剪切力的作用,蛋白质分子间氢键和二硫键等次级键部分断裂,导致蛋白质变性;同时氨基酸与原料中一些还原糖等化合物发生反应,造成氨基酸损失[50]。但是与其他加工方式相比,由于它加工时间短,氨基酸含量损失会相对较低。

表2 挤压膨化处理对酶解小米粉蛋白氨基酸含量的影响(g/100 g)Table 2 Effect of extrusion treatment on amino acid content of enzymatic hydrolysis of foxtail millet flour protein (g/100 g)
3 结论
经过不同处理后,四种蛋白组分含量不同;挤压处理使小米蛋白组分的持水性提高,起泡能力下降,加酶处理后,清蛋白、谷蛋白的泡沫稳定性显著下降,加酶挤压处理后,醇溶蛋白和谷蛋白的泡沫稳定性增强,经过加酶挤压处理,醇溶蛋白的乳化性显著提高,加酶挤压处理后小米粉中各组分蛋白的乳化稳定性均比小米生粉各组分蛋白乳化稳定性好,小米谷蛋白的持水性、持油性、起泡性均大于其他组分,小米醇溶蛋白的泡沫稳定性和乳化性高于其他组分;挤压、加酶挤压膨化处理与小米生粉、加酶生粉蛋白组分的电泳图谱有明显差异,小米蛋白红外光谱相似,说明加酶挤压过程中没有新的肽键生成,加酶挤压后,小米蛋白组分的吸收强度下降,均发生微弱蓝移现象,荧光光谱分析结果与之相对应;在小米氨基酸含量中,谷氨酸最高,在4 种蛋白组分中,醇溶蛋白的氨基酸含量最高,挤压使氨基酸含量存在一定程度损失。加酶挤压处理可以有效改善小米蛋白的功能特性,对小米蛋白二级结构、三级结构有一定程度的影响。
