射频消融治疗包膜下与非包膜下早期肝细胞癌患者的远期预后
2023-08-25温钊臧铁柱宋晓改张炫江艳丽
温钊,臧铁柱,宋晓改,张炫,江艳丽
(河南科技大学第二附属医院 超声科,河南 洛阳 471000)
肝癌为全球第六大最常见的癌症类型和第三大癌症相关死亡原因,严重威胁着人类的生命和健康[1]。肝细胞癌(hepatocellular carcinoma,HCC)是肝癌中最常见的病理类型(85%~90%),具有高度的侵袭性和异质性[1]。除手术切除以外,射频消融(radiofrequency ablation,RFA)现已成为小肝癌局部治疗的优选手段写入诸多国际指南[2-4]。既往研究报道了经皮热消融治疗邻近胆囊[5]、胃肠道[6-7]、膈肌[8-9]的效果。但肝包膜下肿瘤由于肺气体干扰、位置不理想以及直接穿刺易出血并腹腔种植转移等问题,其热消融的治疗效果一直存在争议[10-11]。
最近的数据表明,包膜下HCC热消融的治疗效果与非包膜下HCC的相当,然而这些研究均是基于国外人群的回顾性研究,存在短期随访及基线信息不均衡等问题,使得研究结果存在缺陷[12-13]。因此,本研究采用了倾向评分匹配(propensity score matching,PSM)均衡包膜下和非包膜下组人群之间的基线信息,减少对长期疗效所产生的偏倚,基于国内人群回顾性比较经皮RFA作为包膜下或非包膜下早期HCC一线治疗的长期效果。
1 对象与方法
1.1 研究对象
2018年1月至2021年12月回顾性筛选出河南科技大学第二附属医院收治的143例(174枚病灶)接受RFA的HCC患者。HCC的诊断依据穿刺活检/典型的影像学结果。纳入标准:(1)结节数量≤3枚且直径≤3 cm;(2)Child-Pugh A或B级;(3)首次发病;(4)凝血状态符合手术标准。排除标准:(1)影像学有血管和/或胆管侵犯;(2)术前接受化疗和/或肝动脉化疗栓塞术;(3)肝移植;(4)肝外转移;(5)既往或现在合并其他器官恶性肿瘤;(6)邻近大血管和/或肝门部;(7)同时存在包膜下及非包膜下肿瘤;(8)相关资料不全。肝包膜下肿瘤的定义为距离肝包膜的最短距离<5 mm的肿瘤。根据肿瘤部位分为包膜下组(47例)和非包膜下组(96例),使用PSM(1∶1比例)匹配包膜下组(47例)和非包膜下组(47例)。
1.2 RFA及设备
RFA设备(LDRF-120S,绵阳立德)配合一次性17G RFA针在实时超声引导下进行消融治疗。局部皮下浸润麻醉后,消融术中静脉注射咪达唑仑(0.06 mg·kg-1)达到镇静作用。所有的治疗均有2名经验丰富的超声介入医生按照术前规划进行。术前对患者的肝脏肿瘤进行超声评估,定位穿刺目标,选择穿刺路径。必要时使用超声造影和/或水隔离技术,提高肿瘤的显示及定位。在治疗过程中,RFA设备设定100 W,通过常规灰阶超声实时监测消融的高回声区域,除邻近包膜下区域外,所有病灶均计划消融边界至少≥5 mm。对于危险部位不能充分消融的,可以辅助酒精硬化或放射性粒子辅助消融治疗。当气化样强回声完全覆盖包块及周围肝脏时,可以结束本次消融,并在退针过程中,常规消融针道。术后即刻进行超声造影检查,如果发现有肿瘤残留,则需要进行二次消融。静脉注射氟马西尼(0.5 mg)以诱导镇静恢复。在手术当天和第2天进行抗生素治疗。消融辅助技术包括水隔离[14]、乙醇硬化治疗[15]。
1.3 随访
在RFA治疗后3 d及1个月时分别进行增强MRI或超声造影以评估技术成功率及技术有效率(肿瘤是否完全灭活)及并发症[16]。患者在首次出院后1个月、前2 a每3个月和之后每4~6个月行胸部X线摄影、增强核磁共振和实验室检查。根据临床症状、影像结果和治疗后的实验室检查记录来评估并发症情况,手术后1个月内所有并发症均被记录。采用介入放射学学会分类对并发症进行分类。
1.4 结局评估
研究的主要结果是局部肿瘤进展(local tumor progression,LTP)和无病生存率(disease-free survival,DFS);次要结果是总生存率(overall survival,OS)和严重并发症。OS计算从初次RFA治疗至肿瘤进展或死亡发生或2022年12月31日前最后1次门诊就诊之间的间隔时间。DFS定义为从RFA治疗到肿瘤进展或死亡。肝内复发分为远离原发肿瘤或邻近治疗部位的LTP。LTP定义为消融区域内或邻近肝实质内出现新的肿瘤。严重并发症定义为导致额外治疗干预或与RFA术相关的住院时间延长的临床事件。严重并发症分为即刻或延迟并发症[16]。
1.5 PSM
使用PSM均衡包膜下组和非包膜下组的基线信息,以减少选择偏差对生存分析的影响。倾向评分涉及变量包括年龄、性别、年龄-合并症得分(age-adjusted charlson comorbidity index,aCCI)、肝硬化、肿瘤大小、肿瘤数目、肿瘤位置、甲胎蛋白(alpha fetal protein,AFP)、谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、谷草转氨酶(glutamic-oxaloacetic transaminase,GOT)、谷氨酰转移酶(gamma-glutamyl transferase,GGT)、血清白蛋白(serum albumin,ALB)、总胆红素(total bilirubin,T-Bil)、直接胆红素(direct bilirubin,D-Bil、血小板计数(blood platelet,PLT)、红细胞计数(red blood count,RBC)、凝血酶原时间(prothrombin time,PT)。将这些变量应用于logistic回归模型计算倾向性得分,并计算C-统计量来评估拟合优度。使用卡尺宽度<0.1估计倾向得分的合并标准差进行1∶1匹配。
1.6 统计学分析
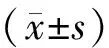
2 结果
2.1 入组患者的基线特征
本研究共纳入143例患者,包膜下组(47例)和非包膜下组(96例),见图1。所有患者Child-Pugh分级为A级。未匹配队列的特征如表1所示,两组PT差异有统计学意义(P<0.05)。使用PSM共确定了47对HCC患者。匹配后两组患者基线特征均衡(P>0.05),见表1。

图1 流程图

表1 入组患者的基线特征比较
2.2 患者RFA治疗效果
包膜下组与非包膜下组的技术成功率、术后住院时间、并发症/严重并发症、技术有效率及LTP比较差异无统计学意义(P>0.05),见表2。

表2 两组患者RFA治疗效果比较
2.3 RFA术后患者远期预后
患者中位随访时间为35个月(包膜下组34个月,非包膜下组36个月)。包膜下组和非包膜下组1、2、3 a的DFS比较差异无统计学意义(P=0.670)(图2A,表3)。包膜下组和非包膜下组1、2、3 a的OS比较差异无统计学意义(P=0.715)(图2B,表3)。

注:A为两组DFS比较结果,B为两组OS比较结果。

表3 匹配后两组患者RFA术后OS及DFS比较
2.4 OS和DFS的危险因素分析
单因素Cox分析结果见表4,将其中P<0.05的变量纳入多因素Cox分析中,结果显示年龄(HR=1.063,95% CI:1.001~1.128,P=0.045)、肝硬化(HR=4.085,95% CI:1.335~12.504,P=0.014)是OS的独立危险因素,aCCI(HR=1.288,95% CI:1.046~1.586,P=0.017)是DFS的独立危险因素。

表4 影响患者OS、DFS的单因素Cox分析
3 讨论
经皮超声引导下热消融作为一种微创和有效的治疗方法越来越多地被用于治疗肝脏肿瘤。肝肿瘤的消融疗效取决于肿瘤及肝实质能否充分消融,消融安全边界不足与LTP密切相关[17-18]。位于肝包膜下的肿瘤大部分难以顺利穿刺活检,且邻近周围有重要器官,缺乏足够的消融安全边界,容易导致肿瘤的消融范围不足。所以,热消融技术在肝包膜下肿瘤治疗中的应用仍存在一定的争议。然而,随着消融设备、引导方法、水隔离的发展,以及手术医生经验和技术的提高,最近的研究报道了热消融技术在包膜下肝肿瘤治疗中取得了良好的效果。本研究表明,在包膜下组与非包膜下组间,RFA治疗早期HCC的效果无明显差异。
既往有研究认为肿瘤邻近肝包膜是影响热消融预后的危险因素。然而,这些研究并未均衡包膜下组与非包膜下组患者之间的基本临床特征,并且包膜下位置并不是肝肿瘤外科切除术后复发的危险因素[19],也无循证医学证据表明肝肿瘤邻近肝包膜侧的边缘缺失会增加局部复发率。Cha等[20]提出,肿瘤大小、肝功能差和RFA的技术难度可能影响包膜下组局部肿瘤控制的结果,但是包膜下位置本身并不影响肝癌RFA后的局部肿瘤控制。大部分对比性研究中并未均衡包膜下组与非包膜下组患者的基本临床特征,本研究对两组进行PSM后对比分析疗效。本研究结果显示,包膜下组与非包膜下组的LTP发生率无明显差异。单因素与多因素分析显示,包膜下位置对OS及DFS的影响作用较小,但当肿瘤最大径线>3 cm时,结果还有待进一步研究证实。
RFA治疗包膜下肝肿瘤的另一个主要问题是并发症的风险。既往研究表明,相比非包膜下肝肿瘤,包膜下肝肿瘤严重并发症发生率更高,包括出血、肝周邻近结构的热损伤和肿瘤种植转移[10,21]。本研究结果显示,两组严重并发症率无显著差异。可能是因为,使用人工腹水或胸腔积液进行肝脏与邻近器官的水分离降低了包膜下组邻近器官严重热损伤的风险[14,22]。并且在消融结束后,为了减少出血及种植转移风险,常规对针道进行消融[23]。
本研究也存在一些局限性。本研究采用的是回顾性分析法,即使进行了PSM,但选择性偏倚是不可避免的。本研究纳入的结节直径≤3 cm,研究结果是否适合更大的肿瘤还需要后期进一步研究。
4 结论
作为一线治疗方案,经皮RFA术治疗包膜下和非包膜下肝癌的LTP、DFS、OS和严重并发症发生率无显著差异。
