转基因棉花再生植株育性影响因素研究
2023-08-23罗晓丽肖娟丽王志安刘圆张安红吴家和
罗晓丽,肖娟丽,王志安,刘圆,张安红,吴家和
(1.山西农业大学棉花研究所/ 棉花种质资源利用与分子生物学设计育种山西省重点实验室,山西 运城 044000;2.中国科学院微生物研究所/ 植物基因组学国家重点实验室,北京 100101)
棉花是重要的经济作物,在经济发展中占有重要地位。因此利用生物技术改良棉花品种具有重要的意义。利用转基因技术对棉花进行遗传改良是一种高效的分子育种手段,转基因不仅能够拓宽可利用的基因资源,也为棉花功能基因的验证和应用提供有效的技术支撑[1]。将调控农艺性状的关键基因转化到棉花中,提高其产量、品质和抗逆性,将其它外源基因转入到棉花中增加植株的抗虫性、抗除草剂特性,可以在提高棉花生产效率的同时减轻环境污染[2]。例如,转Bt抗虫棉20 多年的广泛种植,对棉花生产效率的提高作出了巨大贡献,并且减少了杀虫剂的使用,利于保护环境[3]。
目前棉花遗传转化最主要的方法为农杆菌介导的转基因技术,常规流程是用农杆菌菌液浸染棉花下胚轴切段并共培养后,将转化的下胚轴外植体进行愈伤组织诱导和筛选培养,再将诱导出的抗性愈伤组织进行增殖培养和分化培养以获得转基因再生植株,随后在温室或网室嫁接再生植株,生长直至收获种子。农杆菌介导的棉花转基因体系是以体细胞再生为基础,需要进行较长时间的组织培养。在棉花体细胞胚发生和植株再生过程中常伴随着大量的畸形胚和苗,转基因棉花材料具有不稳定性,尤其是T0代转化植株存在大量的不育株,有些占比高达80%以上[4-5]。张家明等[6]研究得出体细胞培养获得的再生植株中存在较大变异,其中育性变异表现最突出。前人关于不育再生植株的细胞学分析及探究棉花体细胞组织培养对不育变异影响的研究较多,研究发现造成再生植株不育的主要原因是染色体数目和结构变异[7-10]。陈志贤等[7]对棉花体细胞培养再生不育株的性状及细胞学研究中发现,与再生可育株相比,不育植株的分枝、叶、花和植株等均较小,花柱、柱头、花丝、花药小且萎缩呈干瘪状,花药不开裂;不育株花粉母细胞减数分裂异常,普遍出现染色体丢失、配对异常、单价体和染色体桥,形成二分体、三分体或多分体;不育株雄配子体和雌配子体发育异常,胚囊结构不完整,反足细胞解体延迟,造成不育。Bajaj 等[8]、郭香墨等[9]对陆地棉体细胞培养的染色体进行研究,发现愈伤组织细胞的染色体数目变异较大。王坤波等[10]对转基因棉花早代材料细胞学变异的研究揭示了染色体数目的减少、花粉母细胞染色体结构变异是转基因棉花高度败育的直接原因。组织培养时间延长也会导致棉花体细胞的变异,Stelly等[11]、张宝红等[12]在棉花组织培养中的表型变异研究证明,随着培养时间的延长,染色体变异的频率升高、畸形胚增多、变异的性状和变异的范围扩大,表明培养时间是造成变异的重要原因之一。薛美凤等[13]研究发现体细胞胚胎发生能力虽然可保持较长时间,但随着继代时间的延长,再生能力逐渐下降,畸形胚发生率和再生植株不育率逐渐升高。在对不同品种棉花体细胞再生植株育性研究中,亓建飞等[5]发现不同品种的胚状体均存在染色体变异,以染色体数目为27~52 条的非整倍变异最多,且不同品种的染色体变异率差别大,其中胚胎发生能力弱的品种的染色体变异率高。在棉花基因功能及转基因新种质创制的研究中,如何降低棉花遗传转化过程中的不育株率是亟待解决的问题之一。为探究不同转化载体大小、目标基因片段大小、出愈-分化的组织培养时间、分化- 再生植株(简称为分化- 再生)的组织培养时间对育性的影响,对6 个不同转化载体和插入片段大小的转基因再生植株育性进行研究,分析造成转基因T0植株不育的原因,为棉花遗传转化体系改良提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1棉花材料。试验以体细胞胚胎发生能力较强的棉花品种冀合713 为转基因受体材料。
1.1.2各阶段所需培养基。农杆菌培养所用培养基为通用的LB 培养基,农杆菌介导的棉花遗传转化过程及棉花组织培养所用培养基如表1 所示。
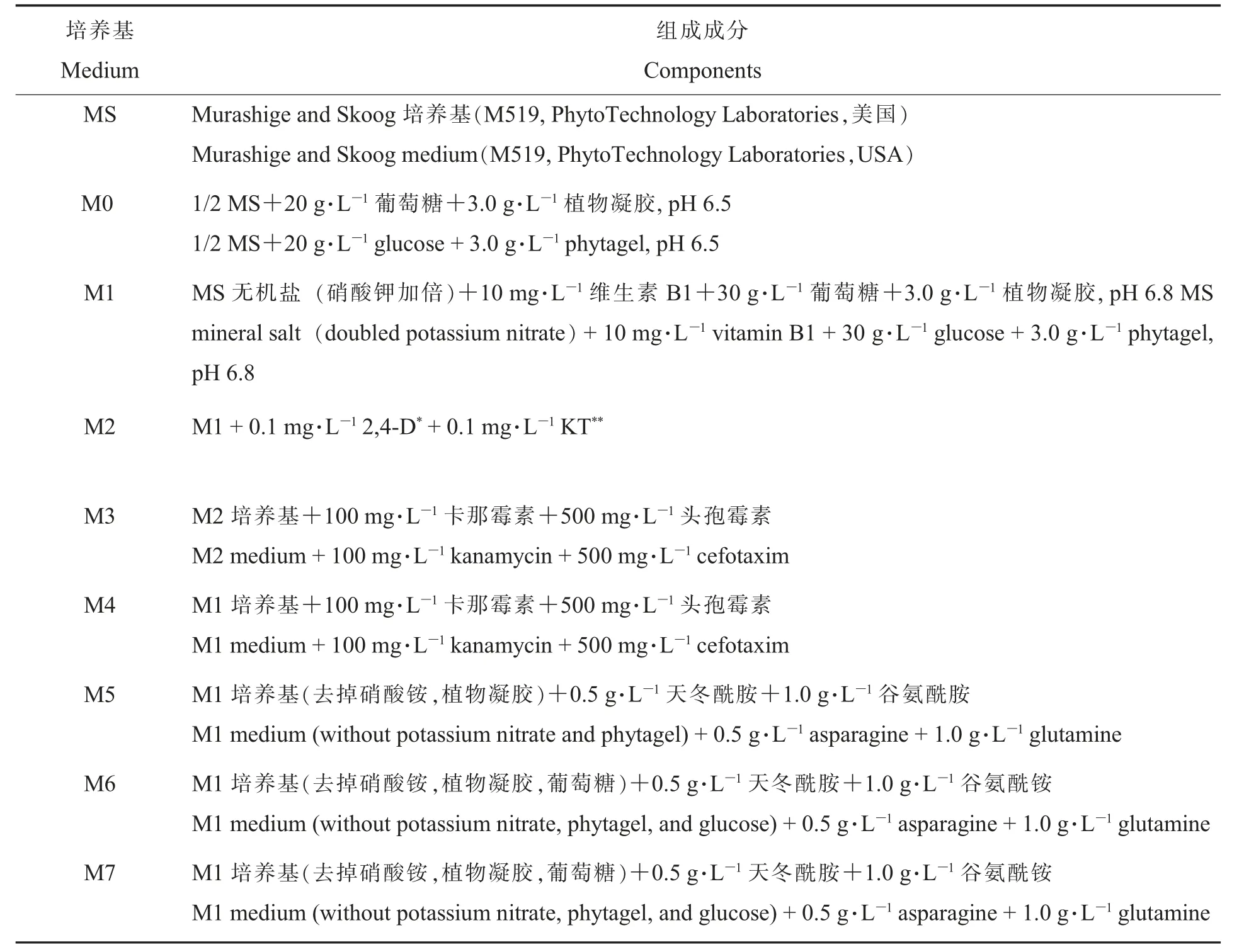
表1 棉花组织培养所用培养基Table 1 The medium for culture
1.1.3植物表达载体。本试验所用植物表达载体来源于中国农业科学院棉花研究所郑州科研中心刘传亮课题组。利用聚合酶链式反应(polymerase chain reaction,PCR)和酶切技术进行目标载体的构建,农杆菌菌株均为LBA4404,植物表达载体详细信息见表2,载体构建所用引物信息见表3。
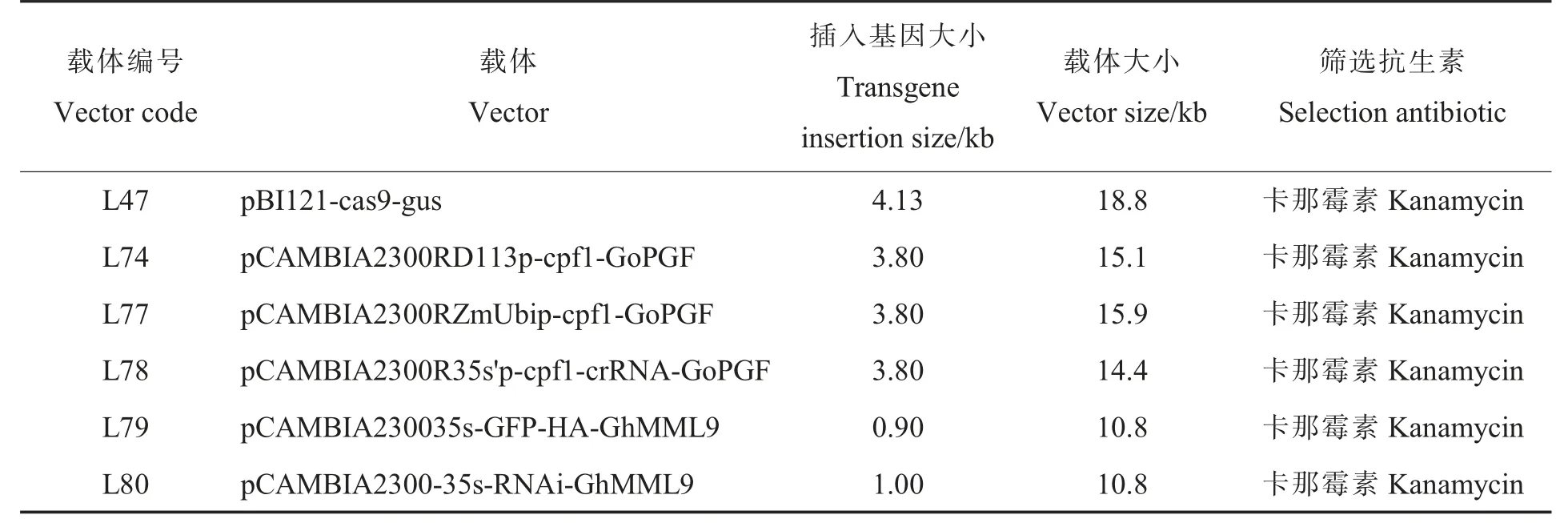
表2 植物表达载体信息Table 2 Information of plant expression vectors

表3 转基因植株鉴定所用的引物Table 3 Primers for detecting transgenic plants
1.1.4农杆菌菌液的制备。分别挑取携带目的基因的农杆菌菌落接种于LB 液体培养基中,28 ℃振荡培养过夜至OD600值为0.3~0.7,将培养过夜的农杆菌稀释数百倍后在含有50 mg·L—1卡那霉素和25 mg·L—1利福平的LB 固体培养基上划线,在28 ℃条件下培养24 h 后保存,每隔2个月继代活化一次。转化前挑取混合单菌落,接种到LB 液体培养基(含50 mg·L—1卡那霉素和25 mg·L—1利福平),26~28 ℃振荡培养 (180~200 r·min—1)过夜(约24 h)至对数生长期(OD600值为0.3~0.5 为宜,肉眼观察利福平的红色正好褪去)。将培养至对数生长期的农杆菌菌液用液体LB 稀释100 倍,加入50 mg·L—1乙酰丁香酮(acetosyringone,AS),26~28 ℃振荡培养(180~200 r·min—1)0.5~1.0 h 备用。
1.2 试验方法
本研究参考已发表的转化方法和棉花组织培养方法[14-16],以下胚轴切段为外植体将表2 中6个转化载体进行转化,经过共培养、筛选、愈伤组织诱导、胚性愈伤组织分化、体细胞胚胎发生、植株再生、再生植株嫁接等过程,最终获得转基因植株。
1.2.1组织培养试验操作。于2018 年11 月13日、11 月27 日、12 月11 日分别对6 个载体进行了3 次转化(即3 次重复),每次重复每个载体转化的外植体数为320(下胚轴切段数)。农杆菌浸染后的下胚轴外植体在M2 培养基共培养后转入诱导筛选培养基M3 中黑暗培养1 个月、光培养1 个月,这个时期下胚轴外植体膨大并有愈伤组织生长,将直径1~2 cm 的愈伤组织转入M4筛选培养基中二次筛选培养1 个月,而小于1 cm的愈伤组织再次转入M3 筛选培养基中进行二次诱导筛选培养1 个月,获得的阳性愈伤组织继代于增殖培养基M1 中。将增殖培养期间分化的胚性愈伤组织转入M5 培养基中,记录每个转化体(独立的胚性愈伤组织)的分化时间并编号,未分化的愈伤组织继续在增殖培养基M1 中继代培养至分化。在M3(二次诱导筛选)或M4(二次筛选)培养基上继代培养期间有些转化体直接在外植体上产生胚性愈伤组织或体细胞胚胎,这些胚性愈伤组织或体细胞胚胎不需要在M1 培养基中的增殖培养,而是直接转入M5 培养基上进行分化培养(这些转化体产生的再生植株所需的分化- 再生的时间往往小于110 d)。将在150 d以内形成的胚性愈伤组织转入M5 分化培养基中,继代培养至愈伤组织分化长成胚状体后转入M6 培养基中,在M6 培养基中培养形成的小植株在无菌条件下继代转入成苗培养基M7 中,继代培养至小植株生长成7~9 cm 的正常再生植株后移栽或嫁接。开花期分别统计不同转化体后代的不育株数,并对雄性不育株作人工辅助授粉。转化材料不同阶段继代培养所用的培养基、继代次数及一次继代培养的时间见表4。

表4 不同阶段培养时间及继代次数Table 4 Culturing time and subculturing times at various stages
1.2.2转化再生植株鉴定和育性调查。选取转基因再生株顶部幼嫩叶片,使用Promega 公司植物DNA 提取试剂盒(离心柱法)进行DNA 提取。用Nanodrop 分光光度计2000/2000C 进行DNA 浓度检测,将DNA 稀释成100 μg·L—1作为PCR 的模板。PCR 反应体系:10 μL PCR 缓冲液、0.5 μL DNA 模板、1.0 μL 引物和ddH2O 混合成20 μL。PCR 扩增程序为:95 ℃预变性5 min;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸30 s,35 个循环,72 ℃延伸5 min。6 个载体的阳性植株PCR 鉴定所用引物序列见表3。对获得的阳性再生植株分别进行育性调查和统计分析,其中再生植株不育率(%)=(某载体转基因T0不育株数/ 某载体转基因T0总株数)×100。
定义嫁接获得的再生植株全部可育的转化体为可育转化体,再生植株全部不可育的转化体为不育转化体,部分再生植株可育的转化体为混合转化体。统计分析同一载体的转化体育性差异,转化体不育率的计算公式:转化体不育率(%)=[不育转化体数/(不育转化体数+可育转化体数+混合转化体数)]×100。
1.2.3愈伤组织增殖阶段的组培时间对再生植株育性的影响。记录每个载体的转化时间和出愈时间以及每个转化体的分化时间、见苗时间、转基因植株的嫁接时间。将出愈-分化的时间分为90 d 以内、90~110 d、110~130 d、130~150 d 和150 d 以上5 个时间段,分别统计相应的转化体数目。对每个转化体获得的阳性再生植株的育性分别进行统计,分析将转化体的分化-再生时间控制在170 d 以内的条件下愈伤组织增殖阶段的组培时间对再生植株育性的影响。
1.2.4胚性愈伤组织分化至再生培养时间对再生植株育性的影响。记录每个转化体的见苗时间,并将分化-再生时间段分为110 d 以内、110~130 d、130~150 d、150~170 d 和170 d 以上5 个时间段,分析转化体的出愈- 分化时间控制在150 d 以内的条件下胚性愈伤组织分化- 再生植株培养时间对再生株育性的影响。
1.3 数据分析
棉花遗传转化组织培养到植株再生等试验处理均为3 次重复,数据由Microsoft Excel 2018应用软件进行数据整理(不育率在显著性检验时进行了sin-1转换),然后使用SPSS 19.0 软件进行方差分析,用Duncan 新复极差法进行多重比较。
2 结果与分析
2.1 转基因棉花再生植株不育性的表型
对转基因棉花再生不育植株进行调查发现,不育植株表现为雌性不育、雄性不育和雌雄不育3 种。正常情况下,棉花现蕾后30 d 左右花器各部分发育成熟,发育正常的花在开花前一天的下午,花冠急剧生长,露出苞叶顶部,次日上午7—9时花冠张开,花药开裂并散出花粉(图1A)。而雄性不育为花药无花粉(图1B),或柱头高出花药许多而无法接受花粉(图1C);雌性不育一般为花柱异常,无法接受花粉完成受精,即使人工授粉也不能结实(图1D);雌雄不育的一般有花蕾,不开花,花蕾生长一段时间脱落(图1E);或者无花蕊等(图1F)。
图1 转基因棉花再生植株不育性表型Fig.1 Various sterility phenotypes of transgenic regenerated plants
2.2 不同载体的转基因再生植株育性结果分析
利用农杆菌介导法将6 个植物表达载体转化到棉花植株,从转化外植体到获得正常的转基因再生株需要8~16 个月;3 次重复共获得1 078多个再生植株,3 次重复分别获得418、376、284株再生植株,通过PCR 筛查,3 个重复平均有262.4 株为转基因植株,开花期对转基因植株进行育性调查和鉴定,结果显示平均有105.7 株不育(表5)。L47 载体全长18.8 kb(表4),目的基因为4.1 kb,在6 个载体中最大,其不育率36.81%,在6 个载体中居第4 位。其他5 个植物表达载体均为pCAMBIA2300,插入的目的基因大小为0.9~3.8 kb,最终构建的载体大小为10.8~15.9 kb,相应转基因植株的不育率为26.20%~64.59%,差异显著,其中L79 和L80 载体和目的基因大小相近,但转基因再生植株不育率差异显著,L79 不育率为26.20%,L80 不育率高达40.09%。L74 与L77、L78 载体和基因大小相近,其转基因植株不育率也呈现差异显著。综上,转基因再生植株育性与载体大小、目的基因或片段大小可能不存在相关性,这暗示不同载体转化植株的不育率间的显著差异可能来自于其它影响因子。
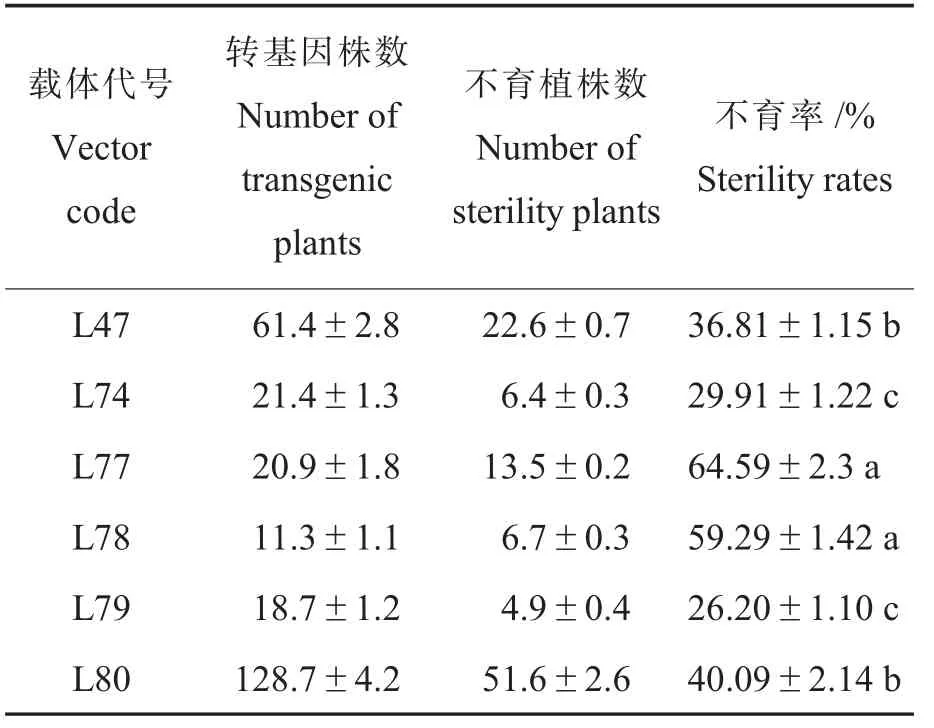
表5 不同载体转化再生植株育性Table 5Fertility analysis of various transgenic regenerated plants from 6 vectors
2.3 不同转化体之间育性分析
每个转化体产生的再生植株数不等,有些转化体产生的再生植株全部可育为可育转化体,有些全部不育为完全不育转化体,有些是部分再生植株可育部分不育的混合转化体。如表6 所示,6个载体共计形成125.3 个转化体,41.5 个完全不育转化体,58.6 个可育转化体,25.2 个混合转化体,混合转化体视为可育转化体,L80 载体转化体不育率最低(26.48%),其次是L74 载体(31.70%),不育率最高的是L77 载体(55.97%);不同载体转化体的不育率呈显著差异。同时也观察到,同一载体不同转化体之间的育性也不同,尤其是混合转化体前期产生的再生植株可育,后期形成的再生植株不育,猜测再生植株的育性可能与继代培养时间有关。

表6 6 个载体转化体育性分析Table 6 Fertility analysis of transformant from 6 vectors
2.4 组织培养时间对转基因植株育性影响分析
分析2 个阶段培养持续时间对各个转化体不育株的影响发现:出愈-分化的5 个时间段的转基因再生株不育率在41.6%~51.2%之间,但是不同持续时间之间的的不育率差异不显著。不育率并没有随着出愈- 分化时间的延长而增加(图2),两者的相关系数R2仅为0.002 5,表明转基因再生植株的不育性与出愈-分化时间的长短没有相关性。

图2 出愈到分化不同持续时间的转基因植株不育率Fig.2 Sterility analysis of transgenic plants with different durations from calli emerging to embryogenesis
在本次试验条件下,很少的胚性愈伤组织从分化后能很快进行再生(<90 d),大部分胚性愈伤组织从分化到形成再生植株需110~170 d,少部分需170~190 d 获得转基因再生株,对分化-再生不同培养时间转基因再生植株的不育率进行比较分析发现:分化-再生持续不同时间的再生植株的不育率存在着显著差异,且再生植株不育率与分化- 再生时间显著正相关(R2为0.98),转基因再生植株不育率随着分化-再生时间的延长而上升(图3)。当分化- 再生的持续培养时间小于110 d,转基因再生植株的不育率仅为19.6%,胚性愈伤组织分化-再生培养110~130d,130~150 d,150~170 d 的再生植株不育率分别为45.5%、63.8%、72.3%,当分化- 再生培养时间在170 d 以上时,转基因再生植株几乎全为不育株,不育率达94.5%。
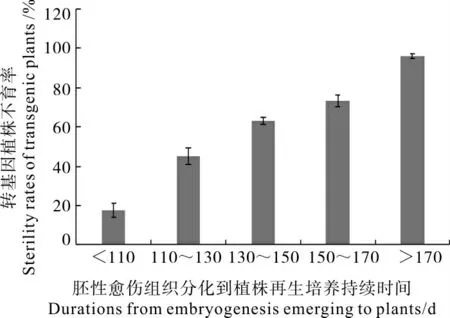
图3 胚性愈伤组织分化到植株再生培养不同持续时间转基因植株不育性Fig.3 Sterility rate of transgenic plants with different durations from embryogenesis to regenerating plantlets
3 讨论
棉花转基因再生植株不育率高已经严重影响棉花功能基因鉴定和生物技术的发展,对其产生的原因虽有一些相关报道[6-7,13],但是影响其发生的因素有待进一步分析。本研究结果表明棉花转基因再生植株不育率在不同转化载体之间存在显著差异,但不同载体或插入片段大小与植株不育率没有明显的相关关系。此外,不同载体所形成的转化体数目不同,其原因首先是转化亲本单株个体之间体细胞再生能力有差异,其次是受侵染的下胚轴切段来自下胚轴不同的部位,而不同部位的体细胞其再生能力也有差异。
进一步研究发现胚性愈伤组织从分化到再生植株的时间长短显著影响不育率,而愈伤组织诱导到胚性愈伤组织分化时间长短对不育率无显著影响。前期研究发现愈伤组织增殖培养阶段时间的长短与T0再生植株育性之间没有相关性,长期继代胚性愈伤组织导致再生植株的不育率大幅度提高,达极显著的相关关系[17],本研究再次证明了这一点,当分化-再生植株的培养时间超过170 d 时,其转基因再生植株不育率达到94.5%以上。分化时间对再生植株不育率产生影响的可能原因是体细胞脱分化为胚性细胞后,具有胚胎分化发育能力,而胚性细胞分化发育成再生植株时间的长短影响染色体数目变异、结构变异和基因变异[6,12]。也有报道表明,影响转基因再生植株育性的因素很多,如目标基因功能、T-DNA 插入位点、胚性愈伤组织培养的温度,培养基的pH 等[4-5],转化再生植株不育的产生与形成是多因素共同作用的结果。改良棉花遗传转化体系可以提高棉花转基因再生植株的育性,如调整培养条件,缩短分化-再生的培养时间:(1)使用无激素的增殖培养基对诱导筛选培养后的愈伤组织进行增殖培养;(2)增加胚性愈伤组织继代培养透气性 (使用透气膜封口);(3)提高分化培养基固化剂含量(3.5 g·L—1植物凝胶);(4)胚状体形成后降低培养基中糖含量(25 g·L—1葡萄糖)[17-20]。
4 结论
本研究对转基因棉花再生植株育性影响因素研究:农杆菌介导的转基因棉花再生植株育性与愈伤组织诱导形成-胚性愈伤组织分化的持续培养时间没有相关性,与胚性愈伤组织分化-植株再生的持续培养时间呈显著正相关,胚性愈伤组织持续培养时间的长短显著地影响转基因再生植株的育性,将胚性愈伤组织分化-植株再生的持续培养时间控制在110 d 以内,转基因再生植株不育率可降低至20%以下。
