肿瘤坏死因子受体相关周期性发热综合征研究进展
2023-08-20李睿综述杨帆审校
李睿综述 杨帆审校
肿瘤坏死因子受体相关周期性发热综合征(tumor necrosis factor receptor-associated periodic syndrome,TRAPS)最初于1982年在一个爱尔兰家庭中被发现,其临床特点是反复发热,有时持续数周,伴有严重腹痛、肌痛、关节痛、迁移性红斑疹和眼部炎性反应,但中枢神经系统(CNS)通常不受影响,故当时被命名为家族性Hibernian发热,并且怀疑其可能是家族性地中海热 (FMF)的一种变异表现[1]。肾脏淀粉样变(SAA)是疾病的严重后果,与高发病率和病死率相关,同时也是最严重的长期并发症。通常在急性期炎性反应标志物升高,但间歇期恢复正常。TRAPS通常在儿童时期被诊断出来,成人期发病或诊断罕有报道。此外,国内外文献中关于中国人口存在TRAPS的报道较少,为进一步提高对TRAPS的认识,本文就其研究进展做一综述。
1 发病机制
TRAPS与编码TNFR1(肿瘤坏死因子受体1)受体的TNFRSF1A基因在12p13处发生错义突变有关,这些突变主要影响TNFRSF1A的细胞外结构域,从而修饰作为受体空间结构基础的半胱氨酸残基,并影响受体结构和与TNF配体的结合。TNFRSF1A由金属蛋白酶介导并从细胞膜脱落,若该基因发生突变将导致TNFR1从细胞表面脱落减少,从而减弱通过TNFR1受体的信号传导。TNFα与TNFR1的结合导致信号通路的激活,最终上调许多促炎细胞因子的基因表达。除此之外,细胞内积累的错误折叠突变蛋白会导致内质网应激,并通过各种免疫途径的结构性激活增强炎性反应[2-3]。
2 临床表现
TRAPS的临床症状特异性不高,根据国内学者文献报道分析我国TRAPS患者的临床特点[4-7]:该病常发生在儿童早期(平均4.3岁),而大约10%的患者(30岁以上)出现了成人TRAPS。最常见的临床表现包括发热(反复发热发作,每4~6周发生一次,持续5 d~3周)、肌痛、关节痛、红斑疹、腹痛、急性结膜炎、眶周水肿、关节炎、淋巴结病、肝脾肿大、胸痛和头痛。继发于炎性反应发作的浆膜炎性反应可导致心包炎、腹膜炎、胸膜炎和睾丸炎性反应的反复发作。情绪和身体压力、轻微感染、创伤、激素变化、疲劳、接种疫苗可能会导致这些发作,但大多数情况下,触发因素仍然未知[8-9]。
在疾病活动期,症状几乎总是与急性期反应物的增加有关[10]:C反应蛋白和红细胞沉降率、血清淀粉样蛋白A、纤维蛋白原、结合珠蛋白和中性粒细胞白细胞增多症、血小板增多症和正常红细胞性贫血(继发于慢性炎性反应)。定期评估肾功能和蛋白尿的发生情况可以作为评估临床活动和治疗反应的有用参数。发作期间出现急性时相反应,C反应蛋白升高,外周血中性粒细胞计数高,补体消耗适度。血清免疫球蛋白水平,尤其是IgA水平可能会升高。IgD水平也可能升高,但仍低于100 IU/ml,这是与高IgD综合征的一个重要区别。
AA淀粉样变是未经治疗的TRAPS患者最严重的并发症,与发病率和病死率增加有关。蛋白尿和肾功能衰竭发生在80%~90%的淀粉样变病例中,而甲状腺、心肌、肝脏和脾脏沉积则不太常见。具有影响半胱氨酸残基的致病性变体或携带p.T79M(T50M)变体的患者发生淀粉样变的风险更高,可能继发于较长的发作持续时间和更严重的炎性反应。血清AA蛋白水平高表明淀粉样蛋白沉积。SAA淀粉样变的预后与疾病活动有关,需要有效控制炎性反应[11]。大多数患者发病期间可溶性TNFRSF1A水平低于1 ng/ml,在发病期间保持较低水平或短暂增加至正常值,同时伴随TNF水平升高。
3 诊断
目前, TRAPS的诊断通常是通过结合临床症状和实验室检查结果进行的,并得到基因检测的支持[12-13]。2019年,Gattorno等[14]提出诊断TRAPS的新标准:存在确证的TNFRSF1A基因型和至少以下特征之一:发作持续时间超过7 d/肌痛/迁移性皮疹/眶周水肿/阳性家族史。在没有确证的TNFRSF1A基因型的情况下,必须满足该疾病下列临床表现中的至少2种:持续时间超过7 d/肌痛/迁移性皮疹/眶周水肿/阳性家族史。此诊断标准首次包括基因型和临床特征,其敏感度为95%,特异度为99%,准确度为99%。而对于无法进行基因检测的患者,欧热小组成员建议采用第二套标准,即存在若干临床变量,包括阳性或阴性关联,得分高于5分的敏感度为87%,特异度为92%,准确度为96%。有以下临床特征加分:发热≥7 d(2分),发热5~6 d(1分),迁移性皮疹(1分),眶周水肿(1分),肌痛(1分),阳性家族史(1分)。无口腔炎、咽扁桃体炎者各加1分。
4 鉴别诊断
TRAPS应与引起发热的疾病相鉴别,如家族性地中海综合征、Muckle-Wells综合征和家族性寒冷性荨麻疹、高IgD综合征等,见表1。
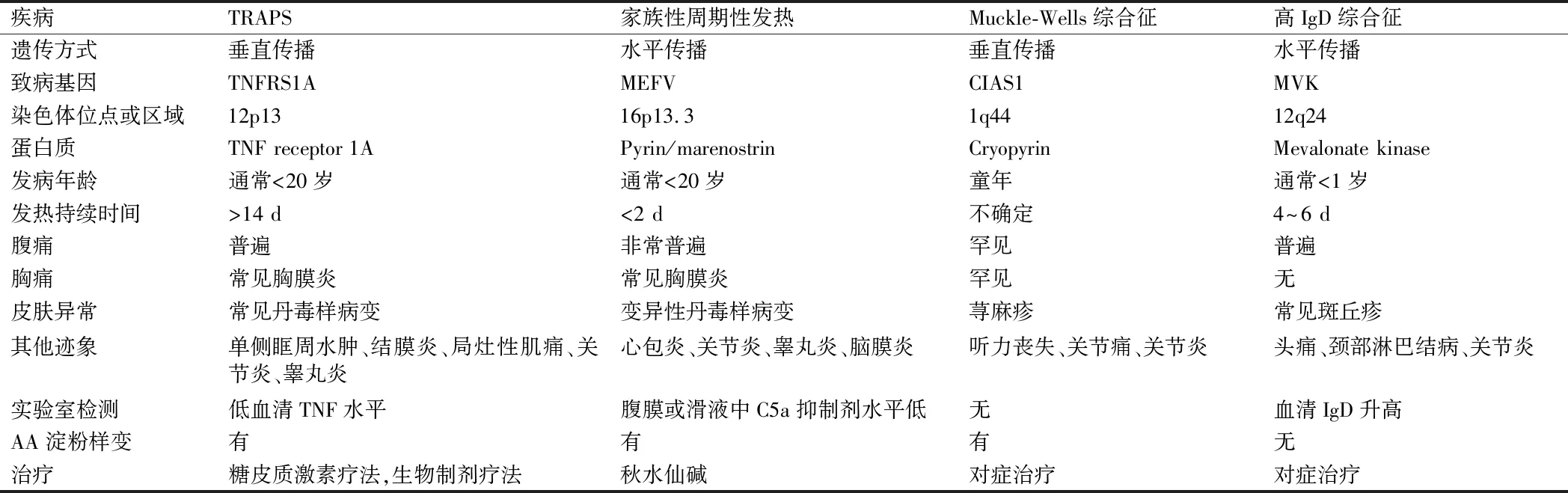
表1 TRAPS与其他发热疾病鉴别诊断
4.1 家族性地中海热 TRAPS和家族性地中海综合征(FMS)都以关节、腹部和胸部(胸膜腔)的发热和疼痛发作为特征,并伴有急性期反应、AA淀粉样变性风险和男性患者可能发生阴囊炎性反应。FMF通常作为一种不完全外显的常染色体隐性疾病遗传,因此病例在家庭中以单代水平分布,至少影响患者的一个兄弟姐妹。而TRAPS垂直分布,这一模式表明常染色体显性遗传:该疾病存在于父母一方或双方,或至少一位叔叔或婶婶。临床表现上:FMF通常表现为在几个小时内温度升高1~3℃并伴有寒战,随后出现在12~36 h内或最多几天内消退。关节症状在大约1周内消失,并且眼眶周围水肿和疼痛性结膜炎都不是FMF的特征。FMF皮损可出现在躯干或面部,而在TRAPS中常常不会出现面部皮肤损伤。治疗上秋水仙碱每日剂量为1 mg,最多1.5~2 mg/d,通常能有效预防AA淀粉样变的发作和发展[15]。
4.2 Muckle-Wells综合征和家族性寒冷性荨麻疹 Muckle-Wells综合征和家族性寒冷性荨麻疹是周期性发热的综合征,具有常染色体显性遗传模式。发作包括发热、关节痛或关节炎,以及急性期反应。其他表现包括荨麻疹、进行性感音神经性耳聋和选择性累及肾脏的淀粉样变风险,抗炎药几乎无效。家族性寒冷性荨麻疹常发生在儿童早期,表现为暴露于寒冷后数小时出现荨麻疹,且伴有疼痛、寒战、关节痛、关节炎和结膜炎的发热发作。家族性寒冷性荨麻疹患者有患AA淀粉样变的风险。可能会出现斑点、红斑斑块和瘀点[16]。
4.3 高IgD综合征 高IgD综合征与TRAPS有许多共同的临床特征,包括发热发作(无周期性)、关节痛、关节炎、密集间隔的严重腹痛,通常还有腹泻、恶心和呕吐。通常在几天内,临床表现逐渐消失,但有些发作可能持续数周。体格检查包括双侧腹股沟、腋窝和颈部淋巴结肿大,一些患者的肝脏和脾脏肿大。每隔1个月2次测IgD水平超过100 mmol/L(140 mg/L)是该疾病的标志。大部分患者血清IgA水平升高,同时不会发生淀粉样变[17]。
5 治疗及预后
5.1 糖皮质激素 大剂量的激素通常对减轻炎性反应有效,为了控制慢性症状往往需要延长治疗时间和增加剂量,但激素的长期治疗在预防淀粉样变的发展或减少炎性反应发作的频率或强度方面效果并不明显。每日剂量大于20 mg的糖皮质激素治疗可降低病死率和发热的持续时间[18]。
5.2 TNF-α抑制剂依那西普(Etanercept) 依那西普是一种融合蛋白,将人TNF-R2(p75)的2个分子与IgG1 Fc片段结合在一起。需要根据表现的性质调整剂量,常规推荐每周2次皮下注射25 mg用于治疗TRAPS。依那西普可作为糖皮质激素的替代品或糖皮质激素替代剂用于治疗TRAPS发作。该药已在多个病例系列中显示出有效性和安全性。在一项针对TRAPS患者的研究中,观察到症状显著减轻,发作频率和持续时间呈剂量依赖性下降,但症状并未完全缓解。依那西普还降低了无症状期间急性期反应物的水平,并减少了非甾体类抗炎药和糖皮质激素的使用。同时,依那西普可有效预防AA淀粉样变[19]。
5.3 IL-6抑制剂托珠单抗(Tocilizumab) IL-6与炎性反应小体(如IL-1β或IL-18)没有直接关系,但它在自身炎性反应性疾病的发病机制中起着重要作用。对自身炎性反应性疾病(如家族性地中海热、冷吡啉相关周期性综合征和肿瘤坏死因子受体相关周期性综合征)的研究表明,IL-6 是一种有希望的治疗靶点。也有学者提出,抑制IL-6可能对淀粉样变性有治疗作用,淀粉样变性通常与这些慢性炎性反应性疾病有关[20]。
5.4 IL-1β拮抗剂阿那白滞素(Anakina)及卡那单抗(Canakinumab) 最初,IL-1抑制剂用于对依那西普药物无效的患者。阿那白滞素是一种重组非糖基化的人白介素-1受体拮抗剂(IL-1Ra),已被证明能有效控制TRAPS的临床表现,使炎性反应标志物正常化,并预防疾病复发和并发症。有研究报道,阿那白滞素给药后,即使按需给药,TRAPS症状也得到了显著缓解[21-22]。
卡那单抗是一种人类抗白介素-1β单克隆抗体,经FDA批准用于治疗多种自身炎性反应性疾病(包括CAP、MKD/高免疫球蛋白D综合征和秋水仙碱抗性FMF),并于2013年批准用于TRAPS。有研究报道TRAPS患者接受卡那单抗治疗后,所有临床症状完全缓解,炎性反应标志物正常化[23]。Gattorno等[24]在一项为期4个月的Ⅱ期临床试验中,对20例TRAPS患者进行了卡那单抗的疗效评估,随后停药5个月,并在疾病发作时再次引入卡那单抗进行了24个月的长期治疗,主要终点是第15天的临床缓解和完全或部分血清学缓解。大多数患者(95%)达到了主要终点,在停用卡那单抗后,所有患者均复发,中位复发时间为91.5 d。在重新使用卡那单抗后,所有患者都得到了临床和血清学缓解,这表明在长期治疗中获得了临床益处[25]。
综上所述,TRAPS的治疗目标主要为控制症状,改善患者的生活质量及降低淀粉样变性风险。IL-1抑制剂(阿那白滞素或卡那单抗)被认为是一线治疗。另一种治疗选择是使用 TNF 抑制剂(最常见的是依那西普),对难治性患者可考虑使用。在急性发作期间,根据需要使用皮质类固醇可能有用,但不足以用于长期治疗或预防淀粉样变性[26]。TRAPS的预后与其是否发生SAA淀粉样变密切相关,25%~40%的TRAPS患者会发生AA淀粉样变。肾脏和肝脏是最常见的并发部位。蛋白尿检测应每6~12个月进行一次,以筛查淀粉样变[27-28]。
6 结论与展望
TRAPS是影响全世界患者的较常见的单基因自身炎性反应性疾病之一。尽管在TRAPS的遗传原因表征方面取得了重大进展,但该疾病的分子病理生理学机制仍有待进一步阐明。临床医生必须认识到患者的临床特征。儿童期起病的长期反复发热伴严重腹痛、肌痛/关节痛、皮疹和阳性家族史表明存在TRAPS,所有疑似有TRAPS的患者应通过TNFRSF1A种系变异的基因检测进行评估。具有结构变异和高CRP的患者应使用生物制剂(IL-1或IL-6阻滞剂、依那西普)治疗,并定期筛查蛋白尿。
