磁性固定化辣根过氧化物酶脱除玉米赤霉烯酮的研究
2023-08-18屈岩峰于殿宇
屈岩峰,于殿宇
(1 哈尔滨学院 哈尔滨 150086 2 东北农业大学食品学院 哈尔滨 150030 3 九三粮油工业集团有限公司 哈尔滨 150090 4 屈岩峰高技能人才(劳模)创新工作室 哈尔滨 150086)
玉米赤霉烯酮(ZEN)是一种著名的F2毒素,由镰刀菌产生[1-2],主要污染玉米、小麦、大麦、燕麦等谷物及其制品,是世界上分布最广泛的霉菌毒素之一[3-5],不仅影响食品安全,而且在食物链中积累,对动物甚至人类造成严重伤害[6-7]。
目前ZEN 的脱除方法主要有物理[8]、化学[9]和生物法[10],以削除或削弱其中毒性。然而,物理和化学方法具有选择性弱、成本高、不可回收等缺点[11]。生物酶法由于具有低毒、高效的优点,因此过氧化物酶如辣根过氧化物酶、锰过氧化物酶和漆酶的氧化降解被认为是一种潜在环保的方法[12]。辣根过氧化物酶(HRP)是一种血红素酶,具有易得和高比活性的优点,在过氧化氢作用下,能够催化氧化多种化合物[13],如芳香胺化合物、酚类化合物、吲哚类和有毒物质的催化氧化[14]。Sabrina 等[15]利用从米糠中提取并纯化的辣根过氧化物酶,成功应用于呕吐毒素的降解。然而,游离酶具有在高温和强酸碱条件下容易失活,重复使用性低,应用条件苛刻等问题,严重制约了其广泛使用。
固定化是克服以上问题的常用方法。近几年,酶的固定化被广泛应用于生物催化中,酶经过固定化后,有效提高了酶的热稳定性和重复使用性,拓宽了pH 使用范围。Mirjana 等[16]将辣根过氧化物酶固定在生物炭上,用于去除水中的苯酚,洗涤4 次后,辣根过氧化物酶的活性保持在79%以上。二氧化硅因较小的扩散限制,较高的单位质量表面积和酶负载能力,故常作为固定化酶的载体[17]。近期,具有核壳结构的磁性纳米粒子被广泛作为载体并应用于生物催化剂。磁性载体具有超顺磁性,磁响应强,毒性低等优势,可实现快速分离和回收。Reza 等[18]将漆酶共价固定在核壳结构的Fe3O4-SiO2,并将其作为高效非均相催化剂,成功应用于芝麻油中酚类物质的生物降解,降解效率为74.5%。
磁性纳米粒子在长期使用过程中可能会发生聚集或沉淀,可以通过修饰表面的化学基团的方法来提高其生物相容性和化学稳定性。一种有效的方法是用亲水聚合物,如聚丙烯酸、聚酰胺酸和超支链聚甘油(HPG)改性到纳米粒子表面。HPG是具有高度支化结构的高分子材料,属于第4 代生物相容性聚合物,含有大量的活性羟基,良好的水溶性和易用性[19]。近几年,羧基化磁性载体被广泛应用于酶的固定化,羧基可与酶上的氨基共价结合,解决了传统固定化方法的固定化位点随机,固定化后酶活性大幅降低的问题。Kazenwadel等[20]将葡萄糖氧化酶的-NH2定向固定化在经过EDC 活化的磁性载体上,制备的定向固定化酶相对酶活力比非定向固定化酶高36%。
本试验将制备的Fe3O4-SiO2-HPG-COOH 作为载体,并将HRP 共价固定在磁性纳米颗粒上,对固定化酶进行表征分析,应用于ZEN 的降解,并测试固定化HRP 的稳定性和重复使用性,以ZEN 降解效率为指标,研究固定化HRP 对模型溶液中ZEN 的降解作用。利用单因素实验确定反应温度、溶液pH 值、过氧化氢浓度、反应时间等最佳条件,为连续性去除ZEN 提供理论依据。
1 材料与方法
1.1 材料与试剂
辣根过氧化物酶(HRP,酶代码EC 1.11.1.7,酶活性>300 units/mg),上海麦克林生化科技有限公司;ZEN 标准品(纯度>99%)、缩水甘油、愈创木酚、乙二醇、FeCl3·6H2O、FeCl2·4H2O、丁二酸酐、H2O2(30%),甲醇钾(CH3OK),氨水(NH3·H2O),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC),美国Sigma-Aldrich 公司;乙腈(色谱级),甲醇(色谱级),氯仿(色谱级),其它化学试剂均为分析纯级,无需进一步纯化即可使用。
1.2 仪器与设备
AXTD5A 型台式离心机,盐城市安信实验仪器有限公司;MixPlus 型旋涡震荡器,合肥艾本森科学仪器有限公司;SB25-12DT 型超声波清洗机,宁波新芝生物科技股份有限公司;MTN-28000D型氮吹浓缩装置,天津奥德赛恩斯仪器有限公司;TQZ-312 型恒温振荡培养箱,上海精宏有限公司;Agilent-7104 型高效液相色谱仪,美国安捷伦科技有限公司;F-7100 型荧光检测器,日本日立公司;BRUKERTENSOR-27 型红外光谱仪,德国布鲁克公司;JSM-6610 型扫描电子显微镜,日本岛津公司;NANOPHOX 型振动样品磁强计,美国MicroSense 公司;Siemens D5005 型X 射线衍射仪,美国FEI 公司;CJB-DS 型数显定时磁力搅拌器,郑州南北仪器设备有限公司;HYL-1076 型激光粒度分布仪,丹东市皓宇科技有限公司。
1.3 试验方法
1.3.1 Fe3O4-SiO2的HPG 活化与羧基修饰 按照Deng 等[21]的方法制备Fe3O4-SiO2磁性纳米粒子,并稍作修改。将Fe3O4-SiO2进行HPG 活化,具体步骤如下:将0.1 g Fe3O4-SiO2加入30 μL CH3OK和2.5 mL 二甲基酰胺溶液中,在50 ℃,100 r/min条件下搅拌反应1 h,加入10 mL 无水二氧六环,于95 ℃反应,然后缓慢向溶液中滴加2.0 g 缩水甘油,并将混合物保持搅拌4 h,加入甲醇分散,利用磁铁分离,用甲醇反复冲洗,得到的固体颗粒在真空烘箱中干燥12 h。接着用琥珀酸酐修饰Fe3O4-SiO2-HPG,将0.1 g Fe3O4-SiO2-HPG 加入100 mg 三乙胺和10 mL 二甲基甲酰胺混合溶液中,加入70 mL 丁二酸酐,将该混合体系在氮气气氛及黑暗中搅拌5 h。随后,通过施加外部磁铁收集产物,并用甲醇冲洗3 次。固体物质在真空干燥箱中干燥12 h[22]。
1.3.2 辣根过氧化物酶的固定化 取1 g 上述制备好的载体在50 mL PBS 缓冲溶液(100 mmol/L)中浸泡24 h,磁分离后,缓慢加入25 mg/mL 的EDC,在温度50 ℃,转速为100 r/min 的条件下搅拌2 h。再加入400 U/mL HRP 溶液。随后以50 r/min 的转速在45 ℃下搅拌,反应5 h 后,利用磁铁分离收集纳米颗粒。用磷酸盐缓冲溶液洗涤固定化HRP 除去未结合的酶,得到的固定化酶在4 ℃条件下贮藏备用。
1.3.3 载体表征方法
1.3.3.1 扫描电子显微镜(SEM)参考苏鹏飞等[23]的方法。取适量样品粉末,经过冻干后分散在导电胶上,经过真空条件对样品进行镀金处理,利用日本岛津公司生产的JSM-6610 进行扫描电镜观察磁性样品固定化前、后的形貌变化。
1.3.3.2 傅里叶红外光谱分析(FTIR)参考Fang等[24]的方法使用蒸馏水洗涤样品,放在55 ℃真空干燥箱中干燥至恒重,使用研钵将干燥后的200 mg KBr 粉末和2 mg 上述制备的样品(200 ℃下脱水处理24 h)混合研磨均匀,在10 kPa 的压力下将其制成1 mm 厚,直径为13 mm 的透明薄片,使用红外光谱仪在室温(25 ℃)条件下,于400~4 000 cm-1波长范围内扫描32 次收集样品光谱信息。
1.3.3.3 X-射线衍射分析(XRD)参照马云辉等[25]的方法预先将样品在55 ℃真空烘干至恒重,研磨100 mg 样品制成粉末后压成平面,X 射线衍射仪在Cu 靶,Ni 滤波,Si-Li 探测器,40 kV×40 mA,扫描范围:15~80°,扫描速度:2°/min,测试制得的磁性载体和磁酶颗粒内分子排列结构。
1.3.3.4 粒径分析 参照Xia 等[26]的方法,取适量上述制备的样品放在容器中,使用乙醇作为分散剂,超声10 min 进行分散,将分散均匀的样品放入激光衍射仪中进行检测。
1.3.3.5 磁性能 参照李梅基[27]的方法,将上述制备的磁性载体和磁性固定化酶以比饱和磁化强度作为磁强度检测的指标,分析样品的磁性能。热封住一段7 mm 带棉签的塑料管的一端,将样品压实在其中,用棉花将另一端塞住。通过振荡样品磁强计进行测定。
1.3.4 酶活力的测定 按照Tonami 等[28]的方法测定辣根过氧化物酶的催化活性,并计算酶的相对活性。用紫外可见分光光度计在波长510 nm 处测定酶活性。一个酶活力单位表示为:30 ℃时1 min 催化氧化1 μmol 愈创木酚所消耗的酶量。
1.3.5 酶学特性的研究 研究了不同温度和pH值条件下游离酶和固定化酶活性的差异。以温度为影响因素,在最适pH 值的条件下,将游离酶和固定化酶分别在不同温度下(20,30,40,50,60℃)贮藏1 h。溶剂为磷酸盐缓冲溶液(100 mmol/L,pH 7.0),得到了不同温度下酶活性的效应曲线;以pH 值为影响因素,在最适温度下,在不同pH值(4~8)的磷酸盐缓冲液(100 mmol/L)中进行酶活性试验,得到不同pH 值下酶活性的效应曲线。
1.3.6 固定化酶降解ZEN 的单因素实验 首先用乙腈制备质量浓度为500 μg/mL 的ZEN 作为储备溶液。然后用乙腈梯度稀释至一定浓度,在-20 ℃避光保存。为实现ZEN 的高效降解,对反应条件(反应温度、溶液pH 值、过氧化氢浓度、反应时间)进行优化。具体操作如下:将磷酸盐缓冲液(100 mmol/L)、水和一定浓度的过氧化氢组成模型溶液,将ZEN 标准溶液在氮气气氛中蒸发溶剂,然后与模型溶液涡旋搅拌30 s 并超声3 min使其完全溶解,搅拌后加入0.6 U/mL 的固定化酶。将模型溶液置于TQZ-312 型恒温振荡培养箱中,在150 r/min 的轨道搅拌下反应,分别选取反应温度25,30,35,40,45 ℃,过氧化氢浓度13,26,39,52,65 mmol/L,溶液pH 值4.0,5.0,6.0,7.0,7.5,反应时间0,30,60,90,120,150,210,320,480,1 440 min,研究对ZEN 降解率的影响。
反应结束后通过磁铁分离固定化酶来终止反应,用0.5 mL 氯仿加入到1 mL 样品中,并涡旋搅拌2 min,用氯仿重复萃取3 次,每次收集有机相。然后超声20 min,将样品中的氯仿用氮吹仪吹干,并用1 mL 乙腈复溶,经过0.45 μm 有机滤膜过滤,溶液通过高效液相色谱荧光检测器(HPLCFL)进行检测和定量。测定不同条件下ZEN 的降解率,所有试验重复3 次。
ZEN 的脱除效率E(%)通过公式(2)计算:
式中,Zi——反应溶液中ZEN 的初始质量浓度(μg/mL);Zf——反应溶液ZEN 的最终质量浓度(μg/mL)。
1.3.7 ZEN 检测和方法验证 ZEN 含量测定参考《食品安全国家标准-食品中玉米赤霉烯酮的测定》(GB 5009.209-2016)[29]并稍作修改,利用HPLC-FL 测定样品中ZEN 含量。
色谱条件:色谱柱为Agilent Zorbax Eclipse Plus C18 柱,柱长100 mm×4.6 mm;流动相:乙腈∶甲醇∶水(46∶46∶8,V/V);流动相流速:1 mL/min;进样量:10 μL,柱温:35 ℃;运行时间:7 min;荧光检测器的激发波长:270 nm,发射波长:455 nm。ZEN 测定的验证参数为线性度、分析曲线、相关系数、检测限(LD)、定量限(LQ)和精度。
1.3.8 固定化酶的可重复使用性 为考察固定化酶的可重复性,对酶活性进行7 次重复测定。每次借助外部磁铁得到固定化酶,然后用去离子水和磷酸盐缓冲液(100 mmol/L,pH 7.0)洗涤3 次,以去除反应中留下的溶液,根据上述最佳方法测量酶活性。
1.4 数据统计分析
所有试验一式三份,结果表示为“平均值±标准偏差”。数据采用Origin 2018 进行分析和绘制。使用SPSS 26.0 进行方差分析,并进行Duncan's test(P<0.05)以评估数据差异的显著性。
2 结果与分析
2.1 纳米复合材料的表征
2.1.1 FTIR 分析 Fe3O4-SiO2、Fe3O4-SiO2-HPGCOOH、Fe3O4-SiO2-HPG-COOH-HRP、HRP 的 傅里叶红外光谱如图1 所示,575 cm-1处的谱带对应于Fe3O4中Fe-O 的伸缩振动,3 420 cm-1处为-OH 的吸收峰,证明Fe3O4组分存在,这和Feng等[30]的研究一致。799 cm-1和1 089 cm-1处分别为Si-OH 和Si-O-Si 的对称和不对称伸缩振动吸收峰,说明SiO2包覆良好。经过超支化聚合后,曲线(b)中2 860 cm-1和2 927 cm-1处出现了HPG 的亚甲基的吸收峰,证明HPG 已成功改性。并且在1 730 cm-1处出现了羧基中C=O 的吸收峰,证明羧基已经成功修饰到载体表面。

图1 样品的FTIR 光谱图像Fig.1 The FTIR spectra of the samples
曲线(d)中2 959 cm-1处的条带代表了HRPNH2的拉伸振动。在1 655 cm-1和1 310 cm-1处的特征峰与酰胺I 和酰胺II 振动的拉伸带有关。辣根过氧化物酶固定在Fe3O4-SiO2-HPG-COOH 后,曲线(c)在1 393 cm-1处出现较弱的酰胺特征峰,表明HRP 成功固定在载体上,这和Basem 等[31]的研究一致。
2.1.2 XRD 分析 Fe3O4-SiO2、Fe3O4-SiO2-HPGCOOH 和Fe3O4-SiO2-HPG-COOH-HRP 的XRD谱如图2 所示。3 种纳米粒子的衍射峰位置和强度结果都与粉末衍射标准联合委员会数据库(JCPDS-19-0629)的标准数据相一致,分别在30°,36°,42.5°,53.5°,57.3°,62.7°出现尖锐的特征峰。该现象证明3 种磁性纳米粒子均含有Fe3O4。同时也表明在包覆SiO2、改性及固定化HRP 的过程中,纳米粒子的晶型依然保持稳定,然而由于改性剂和酶涂层具有一定厚度,样品的结晶度略有降低[32]。

图2 样品的XRD 图Fig.2 XRD images of the samples
2.1.3 SEM 分析 如图3a 所示,合成的Fe3O4-SiO2纳米粒子为球形,粒径一般在90~120 nm 左右,表面较为光滑,分散性略差,这与二氧化硅表面存在羟基有关,羟基之间的氢键作用降低了纳米粒子之间的分散性。图3b 为Fe3O4-SiO2-HPGCOOH 载体的表面形态,从图中可以看出载体分散情况较好,有少数团聚现象,这可能是由于磁性Fe3O4-SiO2--HPG-COOH 复合载体表面引入了羧基;具有较为均一的粒径,载体表面较为粗糙且凹凸不平,磁性载体的表面积增大,有利于固定化。由图3c 所示,HRP 经固定化后部分发生团聚[33],这可能是由于固定化过程中载体与酶的交联作用,而整体仍保持良好的分散性,有利于固定化酶和底物发生反应。

图3 样品的SEM 图像Fig.3 SEM images of the samples
2.1.4 磁性能 Fe3O4-SiO2、磁性Fe3O4-SiO2-HPG-COOH 复合载体、磁性固定化HRP 的磁性性能如图4 所示,Fe3O4-SiO2的饱和磁强度为(31.70±0.60)emu/g,而磁性复合Fe3O4-SiO2-HPGCOOH 载体和磁性固定化HRP 的饱和磁强度分别为(25.80±0.60)emu/g 和(24.60±0.80)emu/g。3种磁性纳米颗粒剩磁和矫顽力均为0,磁滞回归线呈现“S”型,符合闭合的特征均具有超顺磁性[34]。结果表明Fe3O4-SiO2经过改性和固定化HRP 后,其饱和磁化值略有降低,而负载酶后仍可以在外加磁场下被很好的磁化,在反应体系中均可以被快速而简单的分离出来。
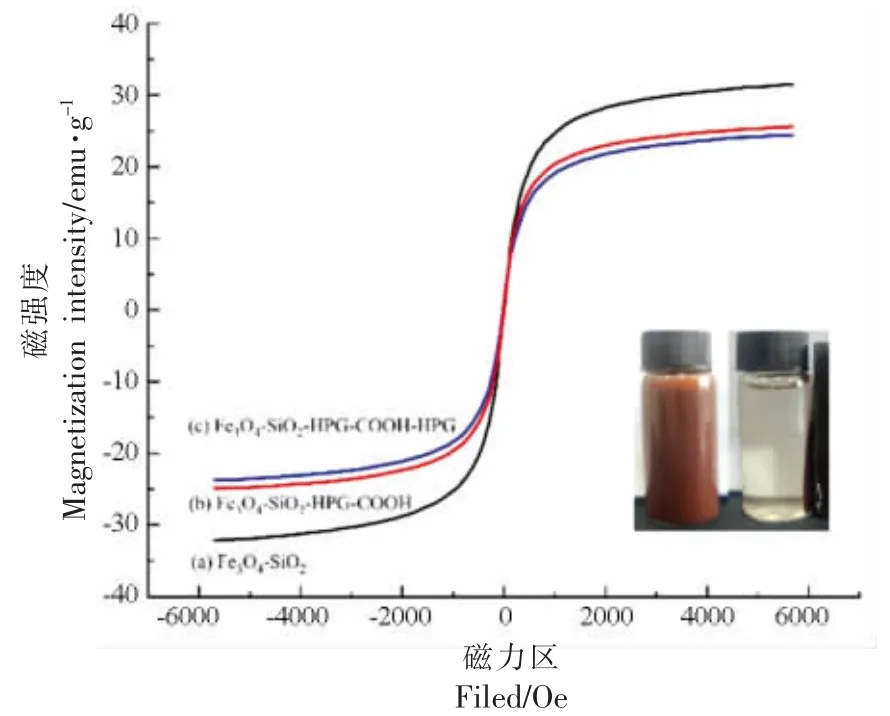
图4 样品的磁性能分析Fig.4 Analysis of magnetic properties of samples
2.1.5 粒径分析 磁性复合载体和磁性固定化HRP 的粒径测定结果如图5 所示。由图5a 可知,磁性Fe3O4-SiO2-HPG-COOH 复合载体平均粒径为(103.15±1.90)nm,分布范围为79.40~118.88 nm,粒径均较小,且分布范围较窄,较小的粒径有利于提高固定化酶的比表面积,有利于酶和底物的接触,促进反应的进行[35]。由图5b 可知,磁性固定化HRP 的粒径分布是均匀的,粒径分布范围为93.02~131.03 nm,平均粒径为(109.20±1.10)nm。酶经固定化后平均粒径增大,粒径分布也向右移动,粒径变化表明HRP 已经成功负载到磁性载体上。

图5 样品的粒径分析Fig.5 Particle size analysis of samples
2.2 酶学性质分析
2.2.1 最适温度 温度对游离和固定化酶活性的影响如图6 所示。游离酶的最适温度为30 ℃,经固定化后温度转移到35 ℃,酶是一种蛋白质,高温可导致酶失活。从图中可知,当温度超过30 ℃时,游离HRP 的活性急剧下降,而固定化HRP 的活性则缓慢下降。固定化HRP 的最适温度较游离酶高,主要是由于酶与磁性载体共价结合后,降低了HRP 分子的运动活性,以及构象的自由变化[36],因此固定化酶比游离酶具有更好的热稳定性。

图6 游离酶和固定化酶的最适温度Fig.6 Optimal temperature for the free and immobilized enzymes
2.2.2 最适pH pH 对游离和固定化辣根过氧化物酶相对活性的影响如图7 所示。从图中可以看出,当酸性或碱性过强时,游离酶和固定化酶的相对活性降低。在pH 值为6.5 和7.0 时,游离酶和固定化酶表现出最大的催化活性。与pH 值为6.5 和7.0 相比,pH 值为8 时,游离HRP 和固定HRP 的最大活性分别显著降低了约30%和10%。酶在磁性载体上固定后,固定化HRP 在更宽的pH 值范围内表现出更高的酶活性,这是因为固定化酶对酶的构象有一定限制,从而保护了酶的空间结构,此结论与Clarissa 等[37]的研究一致。

图7 游离酶和固定化酶的最适pHFig.7 Optimal pH for the free and immobilized enzymes
2.3 固定化辣根过氧化物酶降解模型溶液中ZEN 单因素实验结果
2.3.1 反应温度对玉米赤霉烯酮降解率的影响 模型溶液中固定化酶添加量为0.6 U/mL,过氧化氢浓度为26 mmol/L,溶液pH 值为7.0,反应时间为480 min 的条件下,反应温度对ZEN 降解率的影响见图8。

图8 反应温度对ZEN 降解率的影响Fig.8 Effect of temperature on the degradation of ZEN
如图8 所示,ZEN 降解率随着温度的升高呈先升高后降低的趋势。当温度在25~35 ℃时,ZEN降解率随着温度的升高而增大,这是因为温度升高使得自由能水平增加而导致反应活化能降低,从而增大降解效率[38],当温度为35 ℃时,降解率最高为64.35%。当温度超过35 ℃后,随着反应温度的升高,ZEN 的降解率反而下降,这是由于温度过高导致酶部分发生变性,因此选择模型溶液温度为35 ℃。
2.3.2 过氧化氢浓度对玉米赤霉烯酮降解率的影响 模型溶液中固定化酶添加量为0.6 U/mL,反应温度为35 ℃,溶液pH 值为7.0,反应时间为480 min 的条件下,过氧化氢浓度对ZEN 降解率的影响见图9。
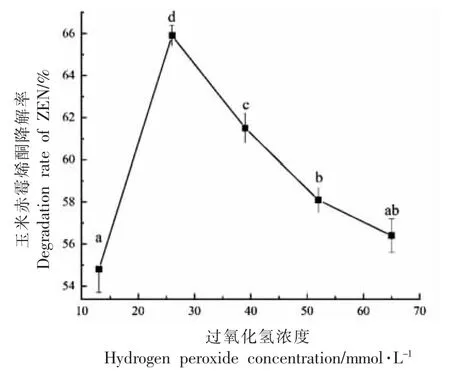
图9 过氧化氢浓度对ZEN 降解效率的影响Fig.9 Effect of hydrogen peroxide concentration on the degradation of ZEN
如图9 所示,随着过氧化氢浓度的增加,ZEN降解率呈先升高后降低的趋势。当过氧化氢浓度为26 mmol/L 时,ZEN 降解率最高为65.67%。当过氧化氢浓度超过26 mmol/L 后,ZEN 降解率逐渐下降。过氧化氢促使酶促反应过程中产生过氧化物酶中间体,然而当过氧化氢浓度过高时,过氧化氢可以通过氧化或破坏HRP 的天然构象而使酶失去活性[39],因此模型溶液中过氧化氢最佳浓度为26 mmol/L。
2.3.3 溶液pH 值对玉米赤霉烯酮降解率的影响模型溶液中固定化酶添加量为0.6 U/mL,反应温度为35 ℃,过氧化氢浓度为26 mmol/L,反应时间为480 min 的条件下,溶液pH 值对ZEN 降解率的影响见图10。
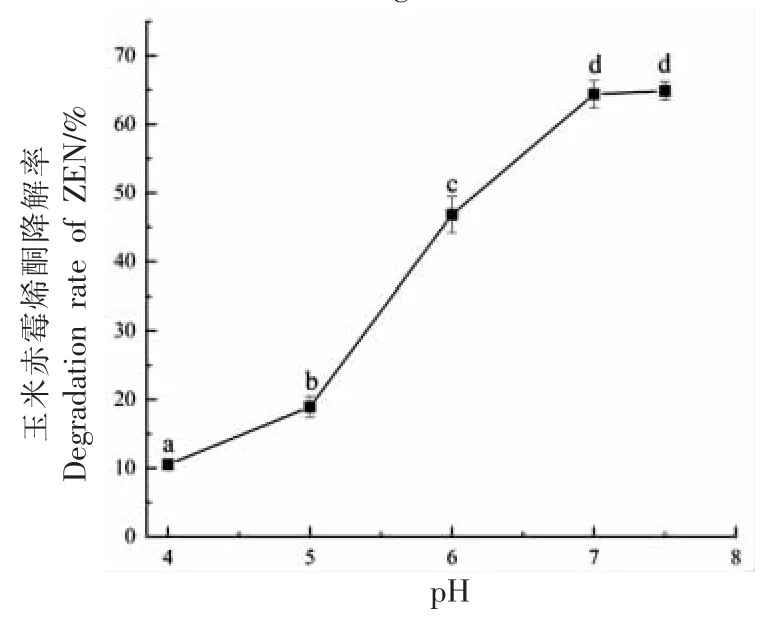
图10 溶液pH 值对ZEN 降解效率的影响Fig.10 Effect of solution pH value on the degradation of ZEN
如图10 所示,ZEN 的降解效率随溶液pH 值的变化趋势为先快速升高后趋于平稳。当pH 值小于7.0 时,ZEN 降解率随溶液pH 值的增加而显著升高;当溶液pH 值为7.0 时,ZEN 的降解率最高为63.96%,随溶液pH 值继续增加,ZEN 降解率趋于稳定,并没有显著变化。造成这种现象的原因可能是由于pH 值的变化会影响酶的相对活性和酶活性中心氨基酸链的电离形式,继续增加pH值会导致固定化酶的活性降低[40],因此模型溶液的最佳pH 值为7.0。
2.3.4 反应时间对玉米赤霉烯酮降解率的影响 模型溶液中固定化酶添加量为0.6 U/mL,反应温度为35 ℃,过氧化氢浓度为26 mmol/L,溶液pH 值为7.0 的条件下,反应时间对ZEN 降解率的影响见图11。

图11 反应时间对ZEN 降解率影响Fig.11 Effect of reaction time on the degradation of ZEN
由图11 所示,当反应时间小于480 min 时,随着反应时间的延长,ZEN 降解率呈逐渐升高的趋势,在480 min 后降解率最高为67.37%,磁性固定化HRP 与ZEN 几乎达到完全反应。随着反应时间持续延长,酶解反应达到平衡,ZEN 降解率的变化较小,降解率趋于平衡可能是由于反应产物对酶反应产生抑制或部分酶发生失活,继续增大反应时间并不能取得更好的结果,因此固定化HRP 降解ZEN 的最佳时间为480 min。
2.4 重复使用性
与游离酶相比,固定化酶可以通过施加外部磁场使其很容易的从反应溶液中分离。如图12 所示,酶的相对活性随使用次数增加呈下降趋势。重复使用5 次后,HRP 的相对活性仍保持了79.85%的催化活性。酶活性减少的原因可能是由于酶经过反复洗涤,不可避免的导致了酶从载体上部分脱落[41]。此外,酶的活性中心附近反应产物的增加,也会导致酶活性降低。由此可知,HRP 经过固定化后,具有良好的重复使用性。

图12 固定化HRP 的重复使用性Fig.12 Reusability of immobilized HRP
2.5 液相色谱分离谱图
采用高效液相色谱法对反应溶液进行分析,ZEN 的液相色谱图如图13 所示,图13a 表示ZEN标准溶液质量浓度为2 μg/mL 时的色谱图,ZEN的出峰时间为1.2 min。如图13b 所示,经固定化HRP 酶解后,ZEN 的含量明显下降,并在1.0 min附近出现了新的峰。结果表明,在过氧化氢的存在下,过氧化物酶可以有效催化ZEN 的降解。由于ZEN 的检测和定量浓度较低,为了确保精确的结果,使用的高效液相色谱结合荧光检测器检测ZEN 定量方法的验证参数见表1,结果表明,曲线方程的相关系数R2为0.9982,其值可用于微量元素的分析。因此,经过验证该方法可以可靠地用于监测模型溶液中HRP 对ZEN 的降解作用。

表1 HPLC-FL 评价ZEN 分析方法的验证参数Table 1 Validation parameters of the analytical method evaluated in HPLC-FL for ZEN detection

图13 ZEN 标准品(a)和酶解产物(b)的色谱图Fig.13 Chromatograms of ZEN standard(a)and enzymolysis product(b)
3 结论
本试验提供了一种降低ZEN 的方法,将游离HRP 共价固定在磁性复合载体Fe3O4-SiO2-HPGCOOH 上,酶与磁性载体结合后,平均粒径为纳米级,呈现超顺磁性。固定化酶的pH 耐受性和热稳定性均高于游离酶。ZEN 降解试验表明在固定化酶浓度为0.6 U/mL,反应温度为35 ℃,过氧化氢浓度为26 mmol/L,溶液pH 值为7.0,反应时间为480 min 的最优条件下,ZEN 降解效率为68%,高效液相色谱显示经磁性固定化HRP 处理后模型溶液ZEN 含量明显降低。磁性固定化HRP 具有良好的重复使用性,经5 次循环后,固定化HRP的相对活性仍较高。本试验研究表明磁性固定化HRP 可实现对模型溶液中ZEN 的有效降解,为促进HRP 在真菌毒素降解中的应用提供理论依据。
