几种常见黄酮靶向FTO 蛋白对RNA m6A 甲基化修饰的影响
2023-08-18李文文邓泽元郑溜丰
甘 婷,李文文,李 男,邓泽元,郑溜丰
(南昌大学 食品科学与技术国家重点实验室 南昌 330047)
慢性代谢性疾病严重危害现代人类健康,特别是肥胖和糖尿病的发病率急剧增加[1]。据世界卫生组织估计,全球有超过10 亿人肥胖及5 亿人患糖尿病。肥胖和胰岛素作用异常与一系列健康问题相关,包括2 型糖尿病、脂肪肝、肝胆和胆囊疾病、心血管病理、神经退行性疾病、哮喘和各种癌症的风险也显著增加[2]。虽然其发病机制复杂,但是炎症被认为是包括肥胖和糖尿病在内的多种慢性代谢性疾病发生的典型特征之一[3]。通过靶向抑制炎症,是缓解这些代谢性疾病发生、发展的有效解决方案[4-6]。除了NF-κB 这条经典的炎症信号通路之外[5],最新的研究表明,表观遗传修饰与炎症反应有关,其修饰的异常是多种慢性病发生的重要诱因[7]。
N6-甲基腺苷(m6A)是RNA 分子最常见和最丰富的表观遗传修饰。m6A 修饰受酶催化的动态调节,由甲基转移酶复合物(包括WTAP、METTL3 和METTL14)催化生成,并可在去甲基化酶FTO 和ALKBH5 的作用下被“擦除”[8]。研究表明,m6A 可调节葡萄糖/脂质代谢和免疫/炎症反应,其异常升高是肥胖、2 型糖尿病和心血管疾病等代谢性疾病发生、发展的重要诱因[9]。为此,通过激活去甲基化酶活性来“擦除”m6A,降低其水平,可能是预防多种代谢性疾病的新策略[10]。与脂肪含量和肥胖相关的蛋白FTO 是关键的去甲基化酶,该酶功能的紊乱会导致肥胖及癌症等多种疾病的发生,有望成为诸多慢性代谢性疾病预防的新靶点[11-17]。目前基于晶体结构的化合物设计等手段,合成了影响FTO 活性的小分子,如FB23-2[18-19],而膳食中的活性成分是否会直接靶向FTO 发挥功能效应尚未见报道。
植物化学物对代谢性疾病的预防作用在细胞培养、动物活体及人体临床试验中得到很好的证实[20]。同时从植物化学物库中也相继鉴定出一些新的抗炎活性天然产物[21-22]。目前,以天然产物作为先导化合物的起点已成为现代医学药物开发的重要研究领域,在批准上市的药物中有相当数量含有天然产物片段[23-24]。近年来,黄酮类化合物是被公认的具有有效生物活性的植物化合物,其功效包括抗氧化、抗炎、降胆固醇、降血压等[25-28]。从膳食中鉴定出的具有抗炎功效的黄酮类化合物包括:姜黄素、高良姜素及漆黄素等[29-35]。然而,这些黄酮类化合物是否靶向FTO 并影响RNA m6A 甲基化修饰需要进一步研究。
本研究利用药物亲和反应目标荧光猝灭分析(MARFQ)、细胞热位移(CETSA)、药物亲和反应靶向稳定性分析(DARTS)等非标记的生物分子互作技术[36],研究3 种常见的黄酮类化合物(姜黄素、高良姜素及漆黄素)与FTO 蛋白的相互作用,并采用计算机分子对接技术揭示其机理,明确其中的氨基酸结合位点。在体外低水平细胞炎症模型下,探究这种相互作用对RNA m6A 甲基化修饰的影响,以期为黄酮类化合物预防代谢性疾病的作用靶点提供理论依据。
1 材料与方法
1.1 材料与试剂
高良姜素、漆黄素和姜黄素标准品(≥98%),北京索莱宝科技有限公司;FTO 蛋白,武汉三鹰生物技术有限公司;链霉蛋白酶E(7 000 U/g),北京索莱宝科技有限公司;人脐静脉内皮细胞,武汉普诺赛生命科技有限公司;炎症细胞因子IL-17、肿瘤坏死因子TNFα,美国PeproTech 公司;BCA 试剂盒,上海碧云天生物技术有限公司;细胞总RNA 提取试剂盒、RT-PCR 试剂盒、qPCR 试剂盒,日本Takara 公司;FTO 抗体,上海艾博抗贸易有限公司。
1.2 仪器与设备
JY-86-2-50 型-80 ℃冰 箱、Neofuge 15R 型台式高速冷冻离心机,香港力康发展有限公司;Agilent 6430 QQQ 三重串联四极杆质谱仪,安捷伦科技有限公司;AR1140 电子分析天平,奥豪斯仪器有限公司;TC512 型梯度PCR 仪,英国TECHNE 公司;CFX96 Touch 型荧光定量PCR仪、DYCP-31DN 型电泳仪,美国伯乐公司;EXL800 全自动酶标仪,美国Biotek Instruments有限公司;F-4600 型荧光分光光度计,日立高新技术公司。
1.3 方法
1.3.1 药物亲和反应目标荧光猝灭分析 高良姜素、漆黄素和姜黄素用二甲亚砜(DMSO)配制成50 mmol/L 的储备液,置于4 ℃冰箱密封、避光保存,在试验过程中根据需求稀释成相应浓度。FTO蛋白保存于-80 ℃冰箱内,试验时用PBS 缓冲液将FTO 配成浓度为1.43×10-5mol/L 的溶液备用。所用缓冲溶液为含0.1%NaCl 的PBS 缓冲液(0.1 mol/L)。
向1 cm 的石英比色皿中依次加入300 μL 的PBS 缓冲溶液和20 μL 的FTO 蛋白稀释液,加水至2 mL,再向溶液中依次等体积加20 μL 黄酮储备液。扫描前均充分混合并在37 ℃恒温水浴锅中放置10 min,以保证体系反应达到平衡。激发波长为275 nm,扫描范围为280~450 nm,激发和发射的狭缝宽度均为10 nm。
1.3.2 细胞热位移分析 细胞接种在15 cm 直径的大皿中,用50 μmol/L 的高良姜素、姜黄素和漆黄素分别处理12 h。用PBS 清洗2 次,再用消化液消化细胞(2 mL),倒掉消化液,加入10 mL 培养基将细胞吹下来,收集细胞,1 200 r/min 离心5 min,倒掉培养基,加入含有1%蛋白酶抑制剂的800 μL 的PBS 重悬细胞。将细胞等量分装在200 μL PCR 管中,每管100 μL,然后在PCR 仪中以不同温度(37,47,52,57,62,67,72,77 ℃)加热5 min,室温冷却3 min。再将细胞裂解液转移到1.5 mL EP 管中,在液氮和室温反复冻融裂解细胞,每次10 min,12 000 r/min 离心15 min 提取蛋白,用BCA 试剂盒测定蛋白质浓度,然后用抗FTO 抗体进行免疫印迹。免疫印迹的条带强度被量化并随温度绘制(每组初始值设为100%)。
1.3.3 药物亲和反应靶向稳定性分析
1)细胞收集和裂解 将培养好的细胞用预冷PBS 清洗2~3 次,然后加入预冷的M-PER 裂解缓冲液,要尽量避免使用含有强变性剂的放射免疫沉淀试验(Radio immunoprecipitation assay,RIPA)裂解液。同时,反应中最好含有合适的蛋白酶抑制剂,防止细胞裂解液自身降解。用细胞刮铲将细胞轻轻刮下,置于预冷的离心管内,上下颠倒几次,混匀后于冰上静置裂解10 min。
2)制备细胞裂解液 将预冷的细胞液于12 000 r/min,4 ℃高速离心15 min,将上清液转移至新的离心管中,用BCA 蛋白定量法测定蛋白浓度。然后用预冷的肌钙蛋白C(Troponin C,TNC)缓冲液稀释蛋白,调节质量浓度至约2 g/L。
3)化合物与裂解液孵育结合 每管200 μg蛋白,两个对照管中加入等体积的TNC 缓冲液,药品管中加入不同浓度的黄酮(50,200,500 μmol/L,TNC 缓冲液稀释),混匀后于室温孵育1 h。
4)蛋白酶解 预先配好蛋白酶储存液(10 g/L),临用前用TNC 缓冲液稀释至适当浓度(根据蛋白酶与裂解液中总蛋白质的比例为1∶1 500 进行稀释)。按比例加入蛋白酶,室温孵育30 min(对照组不加蛋白酶)。30 min 后加入十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)上样缓冲液终止反应,将反应管置于沸水中煮10 min 使蛋白变性。
5)结合蛋白的鉴定 需依据试验要求采用Western Blot 蛋白质印迹等多种方法检测并鉴定结合蛋白。GAPDH 作为阴性对照。
1.3.4 FTO 与黄酮的分子对接 从PDB 蛋白数据库中下载人源FTO 蛋白的三维结构,PDB ID为3LFM,去除蛋白模型中的固有小分子及水分,添加极性氢。高良姜素、漆黄素及姜黄素的结构则从小分子结构数据库ChemSpider 中下载。采用分子对接软件AutoDockTools 对FTO 与CLB 进行对接,使用Flexible Docking 模块,计算结合的对接能及作用三维模型。基于此模型,通过Protein-Ligand Interaction Profiler 工具描绘黄酮与FTO的作用方式及作用位点[37]。
1.3.5 细胞内m6A 水平分析 按照操作说明书介绍使用通用RNA 提取试剂盒从细胞中分离总RNA。用S1 核酸酶(2 U)在含有2.5 μL S1 核酸酶缓冲液(10×)的25 μL 反应体系中酶切5~10 μg mRNA,37 ℃反应2 h,然后加入4 μL 碱性磷酸酶缓冲液(10×)和碱性磷酸酶(0.5 U),37 ℃孵育2 h。最后将样品稀释至总体积为1 mL,0.22 μm 孔径过膜。采用Agilent 6430 QQQ 三重串联四极杆质谱仪检测RNA 中m6A 的总量。根据测定浓度计算m6A 与腺嘌呤(Adenine,A)的比值。
色谱条件:液相色谱柱型号为Agilent ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm),流动相A 液为甲醇,B 液为0.1%甲酸水溶液,梯度洗脱条件为0~2.5 min,4%A;2.5~2.7 min,4%~31%A;2.7~6 min,31%A;6~6.2 min,31%~95%A;6.2~9.3 min,95%A;9.3~9.6 min,95%~4%A;9.6~14.5 min,4%A。流速0.4 mL/min,色谱柱温度40℃,进样量10 μL。
质谱鉴定:酶解后的RNA 片段经色谱分离后用Agilent 6430 QQQ 三重串联四极杆质谱仪进行质谱分析。检测方式:正离子+MRM 模式;离子源:电喷雾离子化源(ESI)。A 的定量条件为:母离子268.1 m/z,子离子136.1 m/z,裂解电压30 V,碰撞能9 eV;进样量10 μL。m6A 的定量条件为:母离子282.1 m/z,子离子150.1 m/z,裂解电压70 V,碰撞能23 eV;进样量10 μL。定量使用由纯A和m6A 标准(A 为50~2 000 nmol/L,m6A 为0.1~10 nmol/L)生成的标准曲线,并在同一批样品中进行3 次试验。根据计算的浓度,确定m6A 与A 的比值。
1.4 统计分析
采用SPSS 26.0 软件进行统计学分析,统计学处理结果以“”表示,组间比较采用独立-T检验,P<0.05 为差异具有统计学意义。
2 结果与分析
2.1 药物亲和反应目标荧光猝灭分析
由于m6A 的丰度和FTO 与代谢疾病的高度相关性,推测FTO 是将黄酮类化合物与RNA 修饰联系起来的一个强有力的靶点。考虑到黄酮类化合物可能需要高结合能力来直接调控FTO 活性,首先通过黄酮类化合物亲和响应目标荧光猝灭(MARFQ)分析评估了黄酮类化合物与FTO 蛋白的结合能力。MARTFQ 检测是基于配体诱导的靶色氨酸含蛋白(如FTO)的内在荧光猝灭[36],通过测定蛋白质以及反应体系的荧光强度,从而研究蛋白质构象、氨基酸微环境等的变化。以荧光峰的位置及其对应的波长作定性分析,以荧光强度与浓度的线性关系作定量分析。首先得到蛋白质的内源荧光光谱,在蛋白质溶液中依次加入一定体积的小分子,若此时得到的的荧光强度降低,说明小分子对蛋白质的荧光具有猝灭作用。如图1a所示,黄酮类化合物以70∶1(黄酮类化合物∶FTO)的摩尔比猝灭FTO 的荧光,具有明显的抑制FTO发射荧光的能力,且高良姜素的猝灭作用最强,其次是姜黄素。如图1b~1d 所示,随着黄酮类化合物浓度的升高,FTO 固有荧光强度降低,且最大荧光发射波长出现偏移,表明黄酮类化合物与FTO 发生了结合。这与前人报道的小分子与FTO 结合后改变了FTO 蛋白质残基周围的微环境结果一致[38-39]。
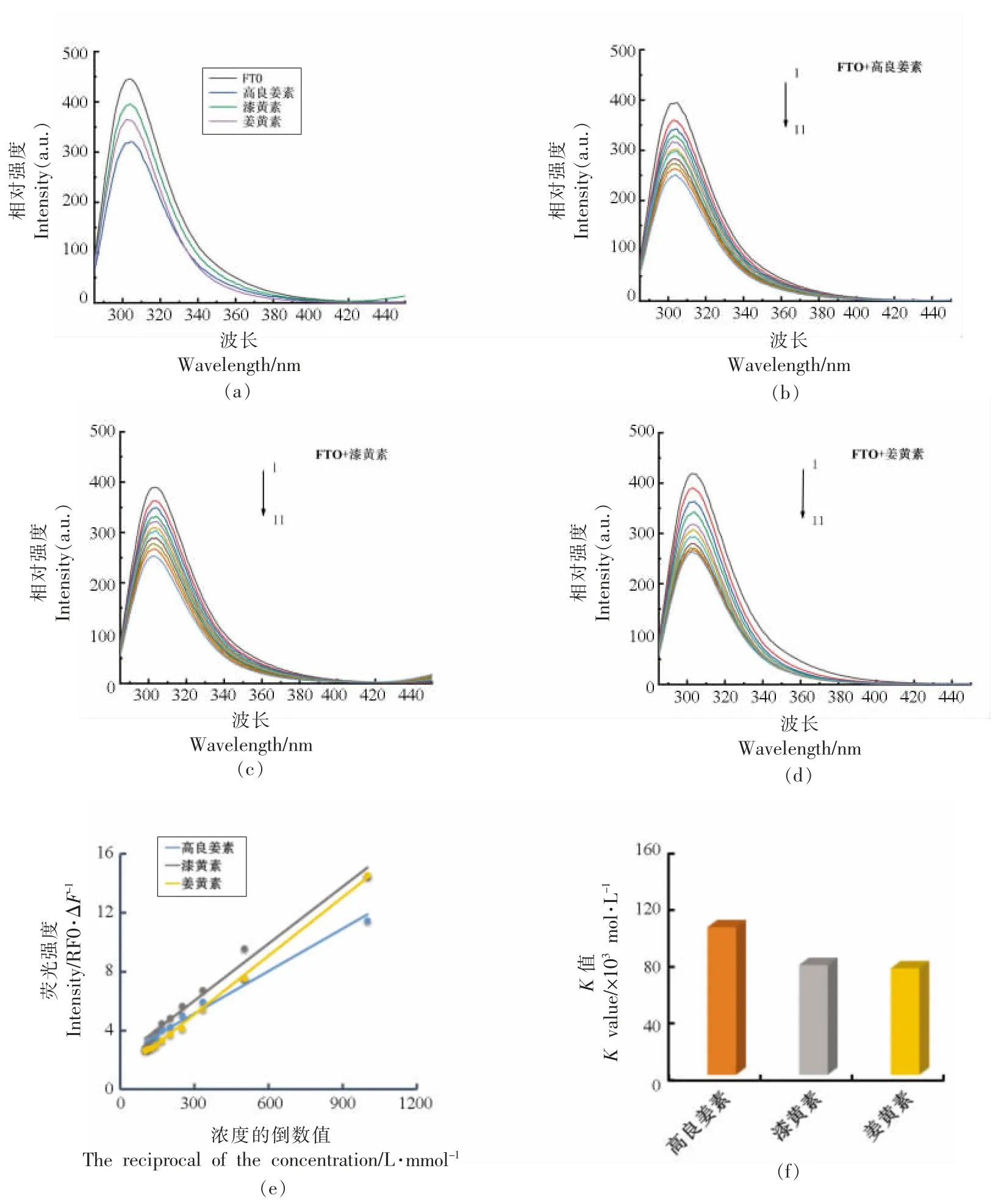
图1 3 种黄酮类化合物对FTO 荧光光谱的影响(T=37 ℃,pH=7.4,λex=275 nm)Fig.1 Effect of three flavonoids on FTO fluorescence spectra(T=37 ℃,pH=7.4,λex=275 nm)
为了进一步估计黄酮类化合物与FTO 的结合常数(K 值),在一系列黄酮类化合物稀释中进行了MARTFQ 测定,以构建修正的Stern Volmer曲线。如图1e 和1f 所示,根据Stern Volmer 方程得出的K 值表明,高良姜素的K 值高于漆黄素和姜黄素,且这3 种黄酮类化合物的K 值高于已知的FTO 激动剂NADPH[36]。
2.2 药物亲和性响应目标稳定性分析和细胞热位移分析
为进一步评估黄酮类化合物结合FTO 的能力,进行了药物亲和性响应目标稳定性(DARTS)试验和细胞热转移试验(CETSA)。DARTS 检测是基于配体结合于靶蛋白后可提高其耐蛋白酶的水解能力[40],是一种可以快速和直接识别小分子药物潜在靶点蛋白的技术,即靶蛋白与药物结合后,保护靶蛋白不被蛋白酶水解,进而维护靶蛋白的活性和功能。在高良姜素、漆黄素或姜黄素存在的情况下,用链酶蛋白酶E 体外消化细胞裂解物。如图2a~2c 所示,高良姜素、漆黄素和姜黄素均能显著降低FTO 的蛋白酶敏感性,说明3 种黄酮类化合物直接结合FTO,使FTO 的耐酶解性增加。然后进行CETSA 评估3 种黄酮类化合物结合细胞内FTO 的能力。CETSA 是基于配体结合于靶蛋白后可增强其热稳定性,是检测小分子与蛋白质结合的新技术[41]。这项技术是根据热展开蛋白在细胞中迅速沉淀后通过监测热变后剩余的可溶性蛋白来测量融化曲线的。这与使用纯化蛋白的经典热转移试验类似,配体结合通常会导致蛋白稳定和熔融温度的正向转移。免疫印迹的条带强度被量化,并绘制出与温度的关系图。结果如图3 所示,CETSA 也表明3 种黄酮类化合物显著增强了FTO 的热稳定性,与MARFQ 和DARTS 的分析结果一致,进一步在体外及细胞水平证实了高良姜素、漆黄素和姜黄素与FTO 的直接结合。
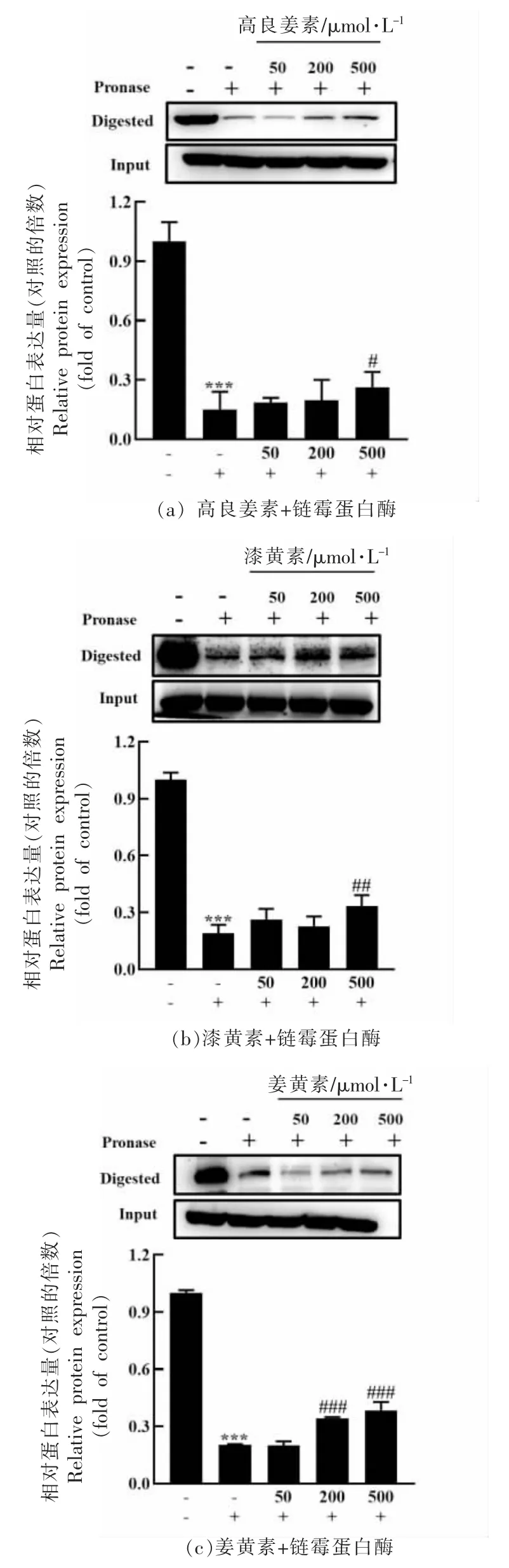
图2 3 种黄酮类化合物与FTO 结合的药物亲和性响应目标稳定性分析Fig.2 Drug affinity response target stability analysis for the interactions of the three flavonoids with FTO
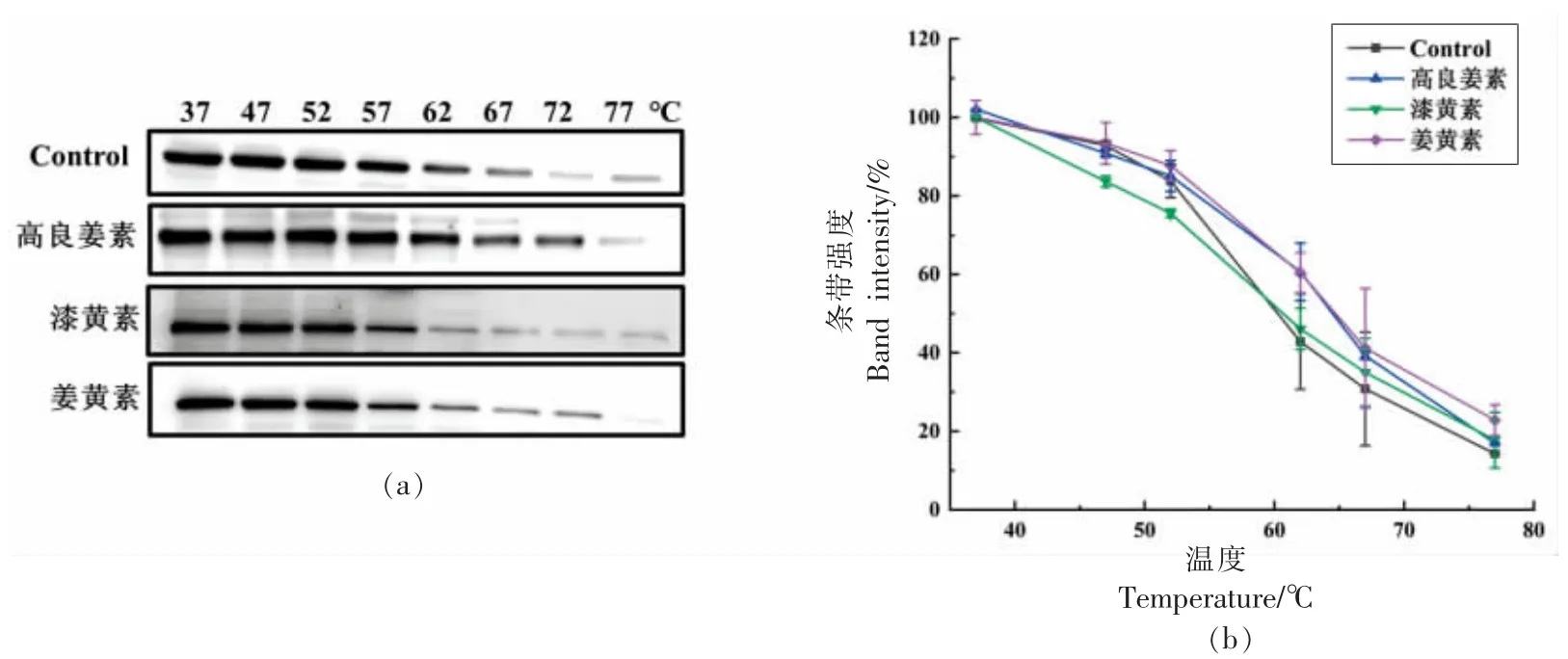
图3 3 种黄酮类化合物与FTO 结合的细胞热位移分析Fig.3 Cellular thermal shift assays for the interactions of the three flavonoids with FTO
2.3 计算机分子对接
蛋白质分子与药物小分子主要通过疏水作用、静电作用、氢键和范德华力等非共价作用相结合。蛋白质的结构比较复杂,在与药物小分子作用过程中,易受体系中溶剂分子或其它共存离子的影响,因此其作用过程可能不是只存在一种作用力,而是几种作用力共同作用。3 种黄酮类化合物的分子对接结果如表1 所示,3 种黄酮类化合物均与FTO 结合(对接能均小于-7 kcal/mol),且疏水性氨基酸残基(Leu,Tyr,Met,Pro)与高良姜素、漆黄素和姜黄素接近,表明疏水相互作用是黄酮与FTO 结合的关键驱动力。图4~6 分别显示了高良姜素、漆黄素和姜黄素结合FTO 蛋白的位置以及与蛋白相关的氨基酸残基。结果表明,3种黄酮类化合物均进入FTO 的催化活性空腔,而不是底物结合空腔。除疏水相互作用之外,3 种黄酮类化合物与部分残基之间还存在氢键和π-阳离子作用,说明3 种黄酮类化合物与FTO 的相互作用力有多种类型,结合牢固。此外,黄酮类化合物与FTO 结合的关键氨基酸位点包括:Arg96、His231、His232、Asp233、His307、Arg322,而这些氨基酸残基对于FTO 发挥去甲基化酶活性至关重要[42]。故黄酮类化合物与FTO 的结合很可能潜在影响其去甲基化酶活性,从而影响细胞内m6A 水平。

表1 3 种黄酮类化合物与FTO 蛋白的对接结果Table 1 The docking results of three flavonoids with FTO protein
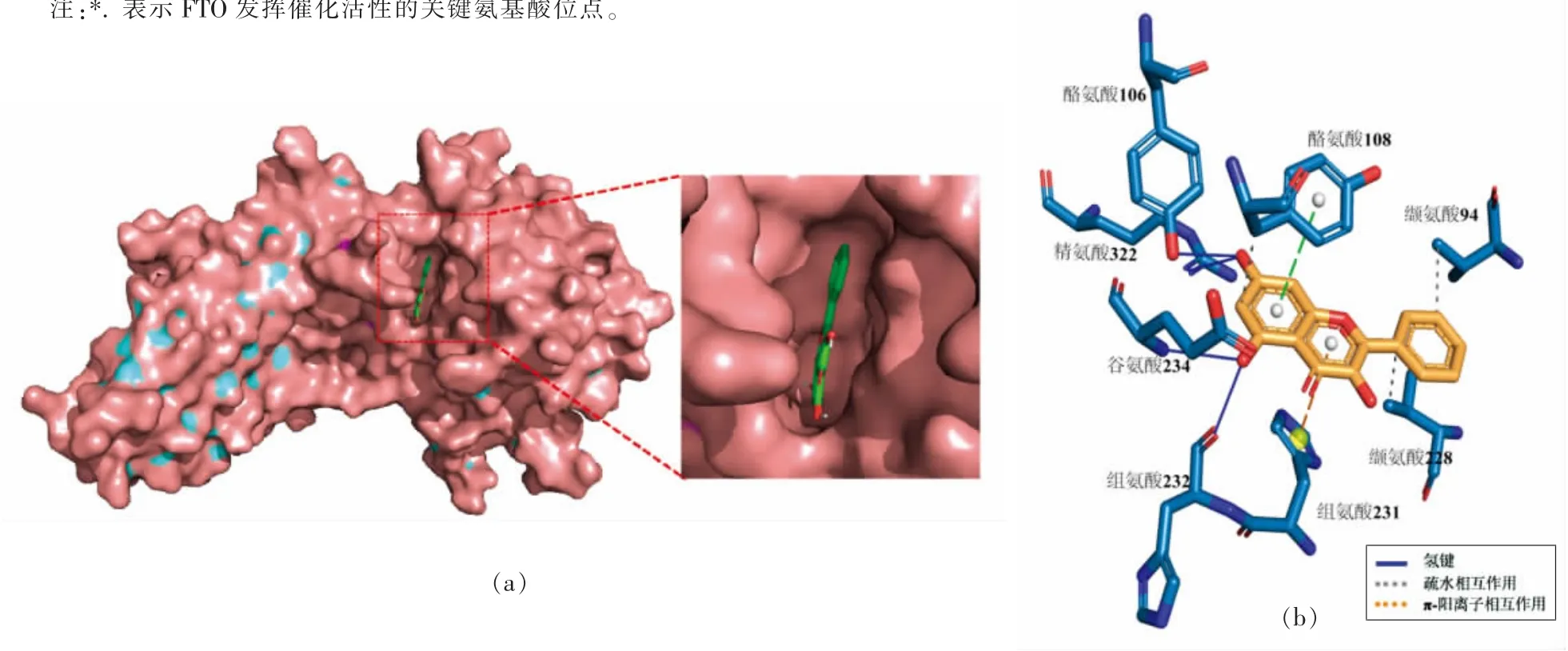
图4 高良姜素与FTO 蛋白相互作用的三维模型(a)及作用方式与位点(b)Fig.4 Three-dimensional model of interaction between galangin and FTO protein(a)and their interaction mode and site(b)
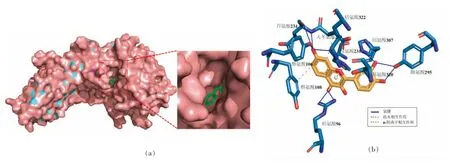
图5 漆黄素与FTO 蛋白相互作用的三维模型(a)及作用方式与位点(b)Fig.5 Three-dimensional model of interaction between fisetin and FTO protein(a)and their interaction mode and site(b)
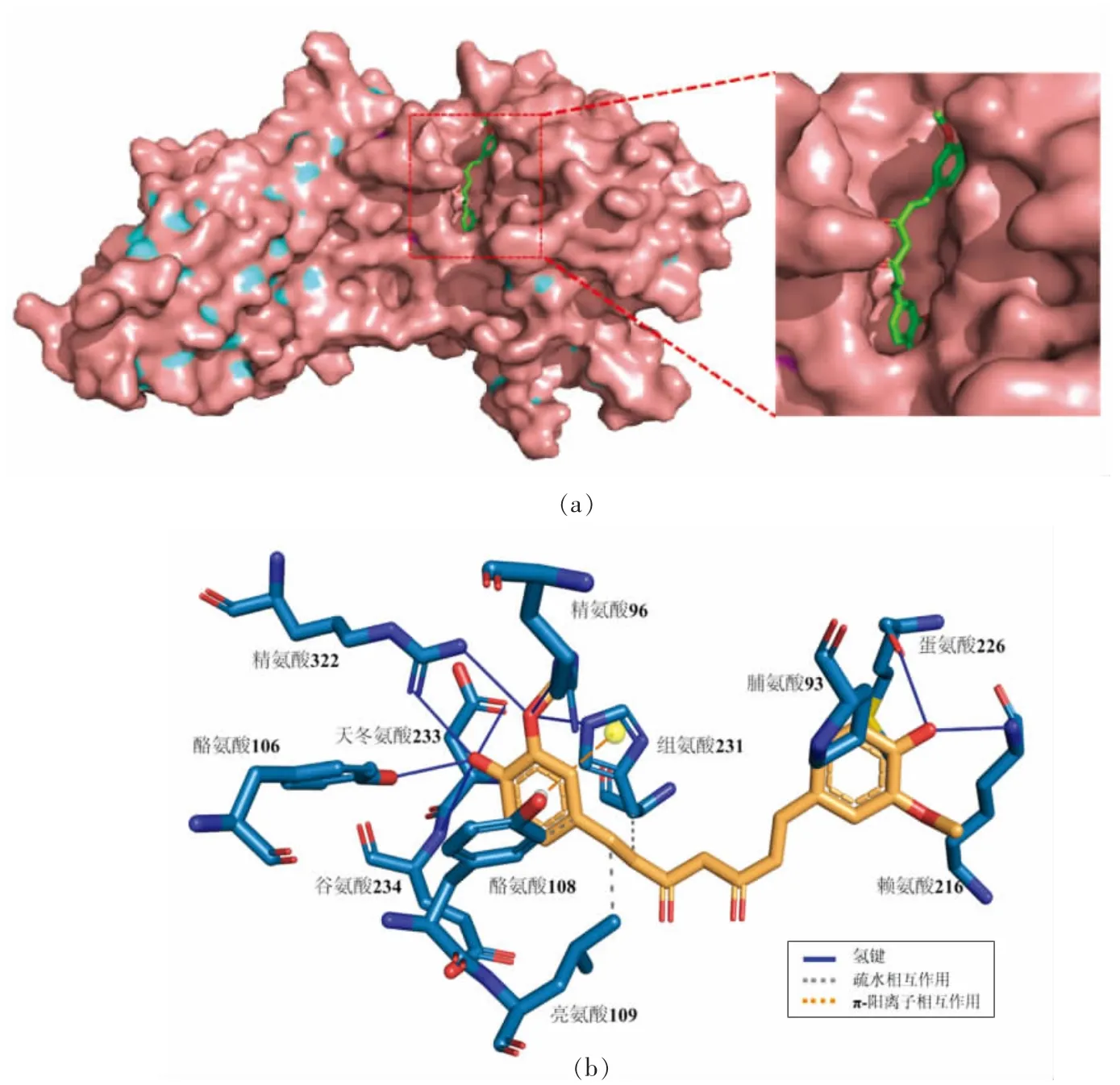
图6 姜黄素与FTO 蛋白相互作用的三维模型(a)及作用方式与位点(b)Fig.6 Three-dimensional model of interaction between curcumin and FTO protein(a)and their interaction mode and site(b)
2.4 3 种黄酮类化合物对细胞内m6A 水平的影响
研究表明,m6A 水平的异常升高促进了细胞炎症反应并引发慢性代谢性疾病[43]。因此,为了确定3 种黄酮类化合物是否可以调节细胞中FTO介导的m6A 去甲基化,评估了在低水平炎症模型下黄酮类化合物对细胞内mRNA m6A 水平的影响。用高良姜素、漆黄素或姜黄素处理人脐静脉内皮细胞,通过Agilent 6430 QQQ 三重串联四极杆质谱仪,把RNA 打碎成核苷和碱基,通过质谱谱图和峰强度计算出m6A 和总A 的比例,从而得知m6A 的整体水平。图7a 为3 种黄酮类化合物处理细胞后的m6A 质谱谱图,结果显示姜黄素的峰面积最小,m6A 水平最低。如图7b 所示,在IL-17 和TNFα 联合诱导的低水平炎症模型下,细胞内mRNA m6A 水平显著升高,而3 种黄酮类化合物均能降低mRNA m6A 的水平,其中姜黄素对m6A 水平的降低作用最为显著。
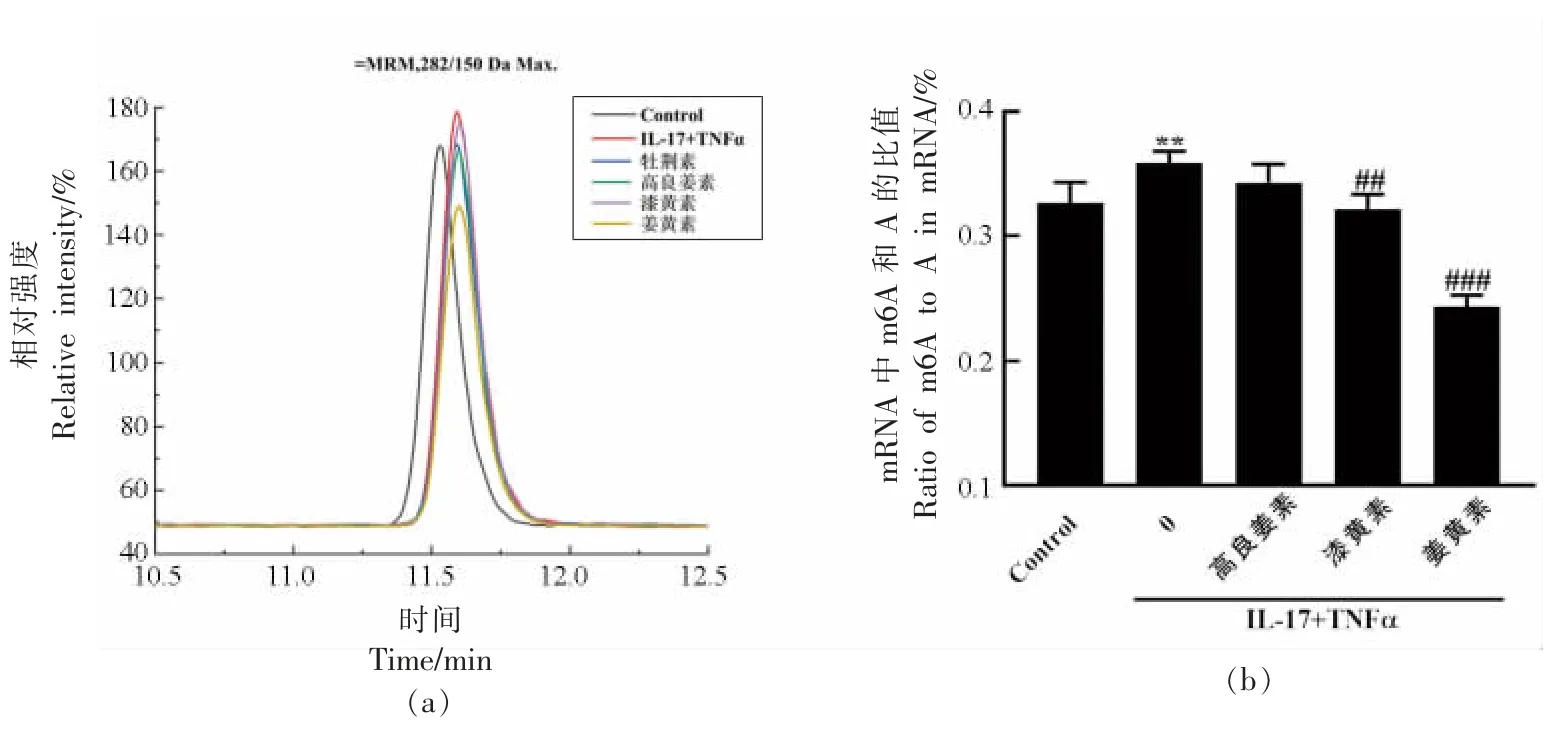
图7 3 种黄酮类化合物处理后细胞内m6A 的质谱图(a)和m6A/A 的比值(b)Fig.7 Mass spectrogram(a)and m6A/A ratio(b)of m6A in cells treated with the three flavonoids
3 结论
姜黄素、漆黄素、高良姜素均能与FTO 蛋白结合,且提高了蛋白耐酶解能力及热稳定性;这3种黄酮类化合物均结合在FTO 蛋白的催化活性空腔,重要的氨基酸结合位点包括:Arg96、His231、His232、Asp233、His307、Arg322,从而通过潜在活化FTO 活性来降低细胞内的RNA m6A 甲基化水平,其中姜黄素的作用效果最好。本研究结果为FTO 作为黄酮类化合物预防代谢性疾病的作用靶点提供理论依据,并为以FTO 为靶点寻找新的预防代谢性疾病的药物或膳食补充剂提供科学数据,而FTO 下游具体的去甲基化靶RNA 有待进一步研究。
