植物甾醇己二酸单酯对胆固醇胶束的沉淀作用
2023-08-18胡毓元马传国郭姝婧
胡毓元,马传国,刘 君,白 歌,郭姝婧
(河南工业大学 小麦与玉米深加工国家工程研究中心 郑州 450001)
植物甾醇是植物中的一类天然化学物质,广泛分布于植物油、坚果和谷物中[1]。自20 世纪50年代以来,植物甾醇因优良的降胆固醇活性和预防心血管疾病的作用而受到广泛关注[2]。食用含有植物甾醇的食物,有利于降低血清低密度脂蛋白胆固醇(LDL-C)水平,从而降低心血管疾病的风险。一般来说,推荐的植物甾醇摄入量约为1.5~3 g/d,可以使LDL-C 水平下降7%~12%[3]。然而,由于油溶性差、水不溶性和高熔点等特性,因此游离植物甾醇在食品工业中的应用受到限制。构建新型植物甾醇衍生物,通过结构修饰来提高游离植物甾醇的理化特性和生物利用率是解决方法之一。
目前,有许多研究尝试对植物甾醇进行结构修饰。以植物甾醇二酸单酯为中间体,将取代基引入植物甾醇是一种常用的方法。由于独特的分子结构,新型植物甾醇衍生物可能具有突出的功能特性。例如,植物甾醇琥珀酸聚乙二醇酯具有良好的表面活性[4]。β-谷甾醇琥珀酸儿茶素酯在乳液中表现出一定的抗氧化性[5]。此外,植物甾醇琥珀酸单酯能够有效降低动物模型血液中的胆固醇和LDL-C 水平且对肝脏没有明显的负面影响[6],说明植物甾醇二酸单酯保留了植物甾醇的降胆固醇活性且未表现出毒性。
植物甾醇酯的合成方法主要有化学法和生物酶法。然而,以植物甾醇和二元酸或二元酸酐为底物,植物甾醇二元酸单酯的酶促合成效率非常低[7]。Chung 等[8]以4-二甲基氨基吡啶为催化剂,在甲苯中,将β-谷甾醇与琥珀酸酐进行偶联。在回流温度下反应6 h,植物甾醇琥珀酸单酯的产率为81%。王慧慧[9]以甲苯为溶剂,以离子液体为催化剂制备植物甾醇琥珀酸单酯。结果表明,1-丁基磺酸-3-甲基咪唑硫酸氢盐([BSO3HMim][HSO4])为最适宜催化剂,在100 ℃下反应2 h,酯化率达94%。Klumphu 等[10]以甲苯和三乙胺为溶剂和催化剂,在60 ℃下制备植物甾醇琥珀酸单酯,产率达98%。植物甾醇和琥珀酸酐在干燥甲苯中,氮气氛围下,120 ℃无催化剂合成植物甾醇琥珀酸单酯,产率为95%[11]。虽然这些方法都有效,但是化学方法往往涉及催化剂残留和植物甾醇高温易氧化等风险。
生物酶催化剂被越来越多地用于非水溶剂中,催化非天然酯化和酯交换反应[12]。前期研究发现,以β-谷甾醇和己二酸二乙烯酯为反应底物制备β-谷甾醇己二酸乙烯酯时,β-谷甾醇己二酸乙烯酯会发生部分水解,生成β-谷甾醇己二酸单酯[13],这有望成为一条温和的高效制备植物甾醇己二酸单酯的酶促路线。同时,在体外胃肠道消化模拟过程中,β-谷甾醇己二酸多元醇酯也会被胰脂酶水解成β-谷甾醇己二酸单酯,最大水解率超过25%,因此有必要评估β-谷甾醇己二酸单酯是否保留了重要的降胆固醇活性。本文拟对β-谷甾醇己二酸单酯的制备工艺进行优化,考察其物理特性,探讨其体外降胆固醇的可能机制。
1 材料与方法
1.1 材料与试剂
β-谷甾醇(>75%)、油酸(分析纯)、胆固醇(99%),阿拉丁试剂(上海)有限公司;己二酸二乙烯酯(>99.0%)、牛磺胆酸钠(>95.0%),西亚化学科技(山东)有限公司;Novozym 435(来自南极念珠菌的脂肪酶B,10 U/mg)、Lipozyme RM(来自米黑根霉的脂肪酶,250 IUN/g)、Lipozyme TL IM(来自疏毛嗜热丝孢菌的脂肪酶,250 IUN/g),诺维信(中国)有限公司;皱褶假丝酵母脂肪酶(Type VII,≥700 U/mg),西格玛奥德里奇(上海)贸易有限公司。
正己烷、异辛烷、叔丁醇,天津市科密欧化学试剂有限公司;甲醇(色谱纯),德国Meker 公司;甲酸(色谱纯),阿拉丁试剂(上海)有限公司;所有反应用有机溶剂均为国产分析纯级。
1.2 仪器与设备
1260 高效液相色谱系统(配有蒸发光检测器),美国Agilent 公司;SHA-CA 数显水浴恒温振荡器,上海华燕仪器有限公司;AL104-IC 电子分析天平,梅特勒-托利多仪器(上海)有限公司;DZF 真空干燥箱,北京市永光明医疗仪器有限公司;TGL-16C 高速离心机,上海安亭科学仪器厂;D8 Advance X 射线衍射仪,德国Bruker 公司;DSC 204F1 差示扫描量热仪,德国Netzsch 公司;DSA-100 接触角测量仪,德国KRUSS 公司;Axioscope 5 偏振光显微镜,德国ZEISS 公司;Zetasizer Nano ZSP 动态光散射,英国马尔文仪器公司;HT7700 透射电子显微镜,日本日立高新技术公司。
1.3 试验方法
1.3.1 β-谷甾醇己二酸单酯的制备 参照前期研究方法[13],以β-谷甾醇和己二酸二乙烯酯为原料,皱褶假丝酵母脂肪酶(CRL)为催化剂,通过酯交换反应制备β-谷甾醇己二酸乙烯酯。待β-谷甾醇完全反应完后,过滤回收酶。滤液旋转蒸发,除去溶剂。将析出的固体加入10 mL 溶剂,溶解完全后加入20 mg/mL 脂肪酶置于50 ℃水浴恒温振荡器中,以200 r/min 的速率振荡。反应1 h 后,过滤回收酶。滤液旋转蒸发,除去溶剂。析出的固体加入热蒸馏水(60 ℃)洗涤,以洗脱过量的己二酸。所得固体经真空干燥过夜,密封保存备用。β-谷甾醇己二酸单酯的合成反应路线图见图1。
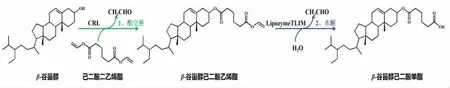
图1 β-谷甾醇己二酸单酯的合成反应路线图Fig.1 Synthetic route of β-sitosterol adipate monester
1.3.2 高效液相色谱仪(HPLC)条件 参照任明星[14]的方法,采用Zorbax 300SB-C18 反相色谱柱(5 μm,4.6 mm×150 mm),35 ℃柱温箱温度,10 μL进样量,甲醇/甲酸(V/V,1 000/1)流动相,1 mL/min流速,60 ℃蒸发光检测器温度。利用各组分相应的纯化产物建立标准曲线,用于定量分析。
1.3.3 X 射线衍射仪(XRD)条件 在检测池中放置适量的样品,以铜X 射线管作为X 射线源。以每分钟0.5 次的速度扫描,衍射扫描区域为5°~40°。
1.3.4 差示扫描量热仪(DSC)条件 样品(5~10 mg)被放入铝锅中,以10 ℃/min 的速度从50 ℃加热到150 ℃。在20.0 mL/min 的氮气氛围下记录热分析曲线以及数据。一个空的铝制锅作为空白。
1.3.5 接触角测量仪条件 配制高浓度样品的二氯甲烷溶液,滴于预热的载玻片上使溶剂蒸发的同时样品延展成膜。将载玻片固定于接触角测定仪操作台,滴加10 μL 去离子水于样品上,测量其固液接触角。
1.3.6 偏振光显微镜(PLM)条件 将粉末样品分散在水中滴到载玻片上,分别使用10 倍(10×)和100 倍(100×)的物镜观察。至少捕获5 张图像来确定样本的特征。
1.3.7 胆固醇模型胶束的制备 采用Wang 等[15]的方法制备模型胶束,略做调整。将含有5 mmol/L牛磺胆酸钠、2 mmol/L 胆固醇、4 mmol/L 油酸、132 mmol/L 氯化钠的15 mmol/L 磷酸钠缓冲液(PBS,pH 7.4)超声处理30 min,然后置于35 ℃的水浴恒温振荡器中,过夜平衡。所得悬浮液以15000 r/min 离心20 min 后,进一步用0.22 μm 的膜过滤器过滤。滤液即为胆固醇模型胶束,现配现用。
1.3.8 体外降胆固醇活性的测定 将4 mg 样品加入4 mL 模型胶束中,然后在35 ℃孵育至少24 h。同时,将不添加样品的模型胶束作为对照组,在相同条件下进行孵育。最后,经离心和过滤后,得到胶束相和沉淀相。采用HPLC 测定样品在胶束相的溶解度。此外,降胆固醇的活性(%)根据公式(1)[15]计算:
式中,A空白——对照组的胆固醇峰值面积;A——试验组的胆固醇峰值面积。
1.3.9 胶束相平均粒径的测定 胶束相的平均粒径测定范围为0.6~10 000 nm,样品在25 ℃下平衡2 min,扫描11 次。所有样品均直接测定,不稀释。
1.3.10 透射电子显微镜(TEM)条件 为了观察胶束相和沉淀相的微观形态,通过TEM 获得高分辨率图像。取少量胶束相溶液直接滴在300 目碳支撑网格上,沉淀相需预分散在PBS 溶液中再滴在碳网上,在室温下干燥,然后进一步分析。
1.4 数据分析
所有测量均独立重复至少3 次,以“平均值±标准偏差(SD)”表示。使用SPSS 17.0(美国IBM公司)进行单因素方差分析,显著性水平设定值为0.05。使用Origin 8.6(美国OriginLab 公司)绘制图形。
2 结果与分析
2.1 β-谷甾醇及其衍生物的定量分析
在前期研究[13]中,已采用红外光谱、核磁共振、液质联用等手段确定了β-谷甾醇己二酸乙烯酯和β-谷甾醇己二酸单酯的化学结构。各组分的液相色谱图见图2。其中,胆固醇、β-谷甾醇、β-谷甾醇己二酸单酯和β-谷甾醇己二酸乙烯酯的保留时间分别为5.5,6.2,6.8,9.2 min。可以看出,所选的液相条件可以有效的分离各组分物质。有文献指出,保留时间与物质疏水性有关[16]。所以,胆固醇极性较大,β-谷甾醇己二酸单酯和β-谷甾醇的极性相近,β-谷甾醇己二酸乙烯酯的极性最小。为了能够对各组分进行定量分析,配制了一系列具有浓度梯度的溶液制作标准曲线。水解率及胶束溶解度根据胆固醇含量的标准曲线(y=1.6318x+8.3474,R2=0.9998)、β-谷甾醇含量的标准曲线(y=1.3711x+7.2558,R2=0.9990)、β-谷甾醇己二酸单酯含量的标准曲线(y=1.5449x+7.8429,R2=0.9991)和β-谷甾醇己二酸乙烯酯含量的标准曲线(y=1.6541x+8.2307,R2=0.9997)来确定。
2.2 脂肪酶和反应溶剂对β-谷甾醇己二酸乙烯酯水解的影响
已知CRL 和正己烷是制备β-谷甾醇己二酸乙烯酯最适宜的生物酶催化剂和反应溶剂[13]。本文考察了4 种商业脂肪酶和4 种常用反应溶剂对β-谷甾醇己二酸乙烯酯水解的影响。从表1 可以看出,叔丁醇更有利于β-谷甾醇己二酸乙烯酯的水解。可能的原因是,只有叔丁醇可以与水互溶,促进了β-谷甾醇己二酸乙烯酯的水解过程。另外,Lipozyme TL IM 在β-谷甾醇己二酸乙烯酯的水解反应中表现出最高活性。因此,Lipozyme TL IM 和叔丁醇分别为β-谷甾醇己二酸乙烯酯水解的最适生物酶催化剂和溶剂。值得注意的是,水解后在反应体系中未发现游离植物甾醇的生成,说明植物甾醇C-3 位酰基并未发生水解,可能是因为乙烯酯具有高酯交换活性,在发生酯交换的过程中会生成乙醛,优先水解。
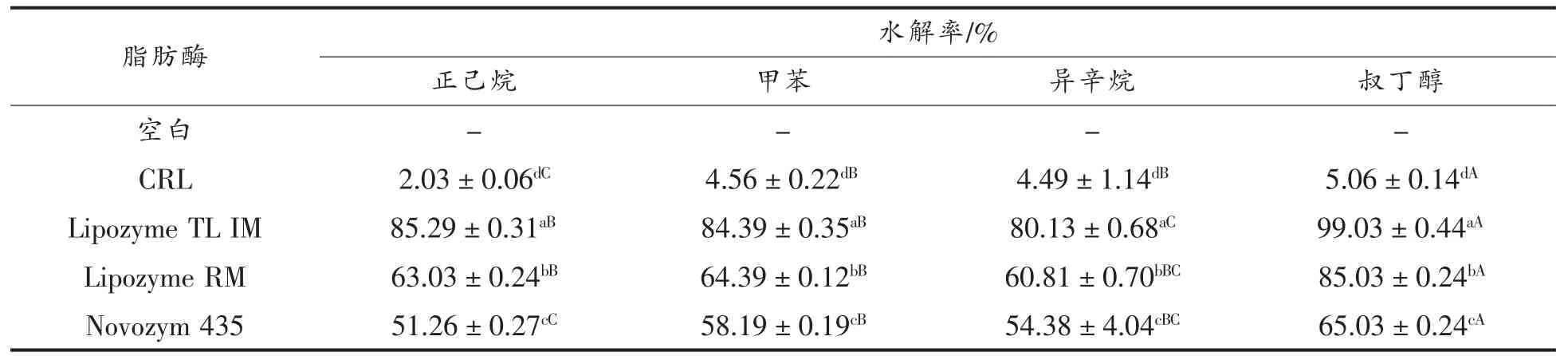
表1 脂肪酶和反应溶剂对β-谷甾醇己二酸乙烯酯水解的影响Table 1 Effect of lipase and solvent on the hydrolysis of β-sitosterol vinyl adipate
2.3 β-谷甾醇及其衍生物的物理特性
为深入研究β-谷甾醇改性前、后物理特性的变化,采用XRD、DSC、PLM 和接触角对β-谷甾醇及其衍生物的结晶性、润湿性和微观形貌进行表征(见图3 和图4)。
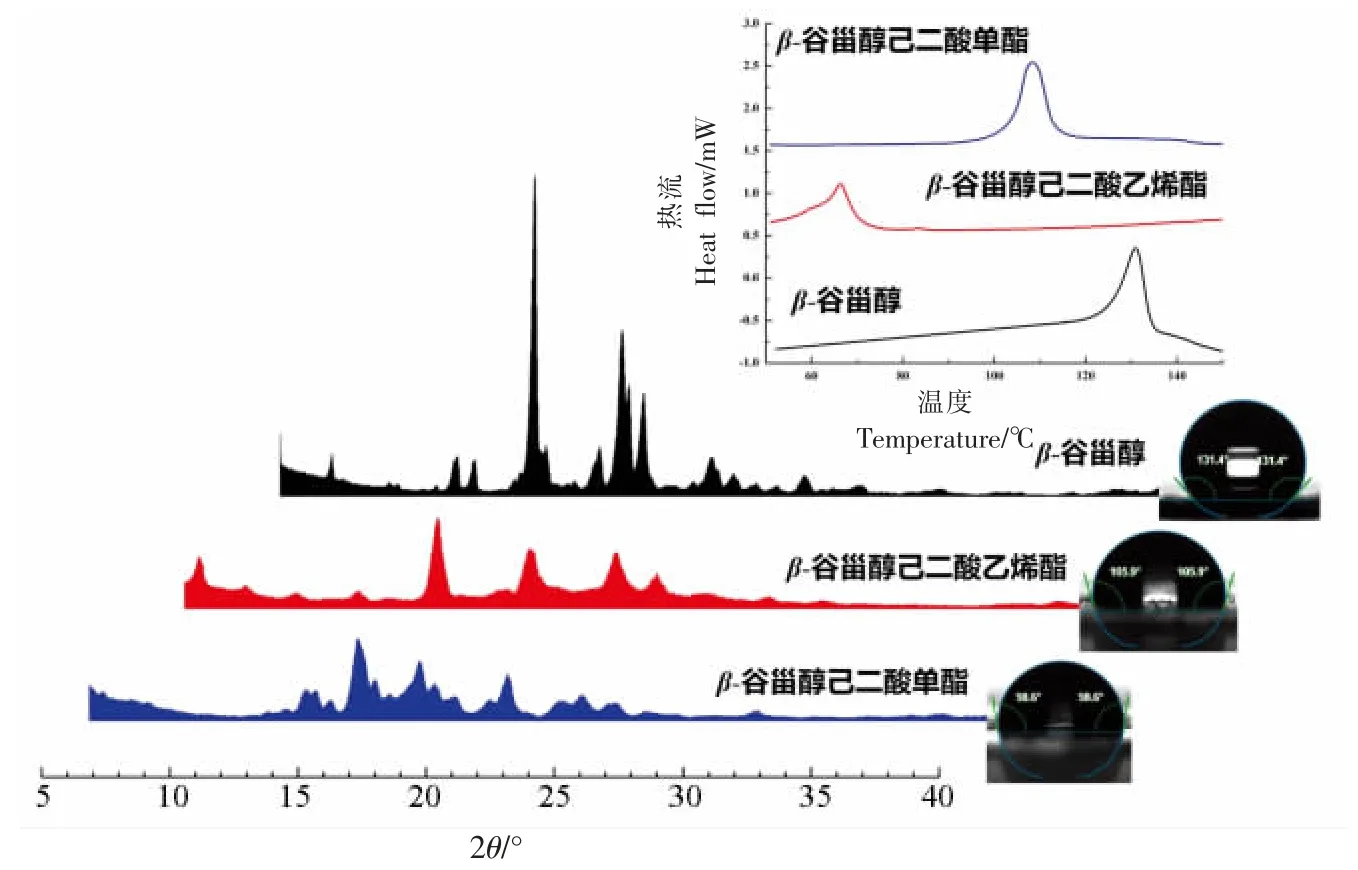
图3 β-谷甾醇及其衍生物的XRD 图谱、DSC 曲线和接触角Fig.3 XRD pattern,DSC curves and contact angle of β-sitosterol and their derivatives

图4 β-谷甾醇及其衍生物的PLM 图像Fig.4 PLM images of β-sitosterol and their derivatives
在XRD 图谱中,游离β-谷甾醇显示出一系列与文献一致的特征衍射峰[17],其中2θ=15.0°处出现衍射峰,其强度最高且在所有衍射图谱中不遮盖,因此选择此峰来估计β-谷甾醇及其衍生物的结晶度。可以看出,β-谷甾醇己二酸乙烯酯和β-谷甾醇己二酸单酯依然具有尖峰,表明晶体的存在。而特征峰强度变弱,说明改性后的β-谷甾醇晶体结构发生变化,结晶度下降。这一结果与文献[18]一致,植物甾醇酯的结晶度与游离植物甾醇相比较低,这可能是由于植物甾醇经结构修饰后降低了分子间的有序性。
在DSC 曲线中,β-谷甾醇及其衍生物均表现出一个熔点范围,说明在受热过程中不存在相态的转变。比较β-谷甾醇及其衍生物的热行为时,发现改性后的β-谷甾醇衍生物的熔融温度显著降低。结果表明:β-谷甾醇己二酸乙烯酯和β-谷甾醇己二酸单酯的结晶度低于β-谷甾醇,这与XRD 的结果一致。
样品的润湿性主要通过接触角来表征。从图3 可以看出,β-谷甾醇与水的接触角为131.4°,属于超疏水材质。β-谷甾醇己二酸乙烯酯和β-谷甾醇己二酸单酯具有相似的接触角,并且都低于β-谷甾醇。然而,两种β-谷甾醇衍生物的接触角依旧大于90°,说明仅文中改性的效果是有限的,后期可以尝试继续用亲水基团对植物甾醇己二酸单酯进行结构修饰。
利用偏振光显微镜(PLM)技术进一步表征样品的结晶。从PLM 图像中可以看出,β-谷甾醇和β-谷甾醇己二酸乙烯酯具有高结晶度,分散在水中时,呈板状晶体,与文献[19]一致。值得注意的是,β-谷甾醇己二酸单酯的小晶体聚集或静电附着在大晶体的表面,且表面存在明显缺陷,边缘出现虚化。结果表明,β-谷甾醇己二酸单酯在水相体系下的结晶度下降,可能是由于其化学结构中存在的端羧基与水分子相互作用,形成氢键,促进水合作用而形成低晶基质。
2.4 体外降胆固醇的可能作用机制
植物甾醇经结构修饰后,结晶度和润湿性等物理特性的改变,可能会影响其生物利用率和降胆固醇活性。多项研究表明,降低血浆胆固醇水平的作用机制主要包括两个方面:(1)抑制肠道胆固醇吸收;(2)影响胆固醇代谢的基因表达。He 等[20]已在高脂动物模型中发现,植物甾醇琥珀酸单酯通过影响调控胆固醇稳态相关基因的表达降低胆固醇水平。抑制肠道胆固醇吸收是降低血液胆固醇水平的前瞻性靶点。由于胆固醇是通过掺入胆盐胶束而被吸收的,考察胆盐胶束中胆固醇的溶解度常被用作评估物质降胆固醇活性的指标。因此,本文利用胆固醇模型胶束,重点探究β-谷甾醇及其衍生物体外降胆固醇的可能作用机制。
如表2 所示,胆固醇在单一胶束相中的初始溶解度为(2.145±0.001)mmol/L。β-谷甾醇及其衍生物加入模型胶束后构成二元混合胶束体系,且在一定程度上降低胆固醇的胶束溶解度。与预期结果一致,β-谷甾醇具有显著的降胆固醇活性。β-谷甾醇的降胆固醇活性为(16.72±1.51)%,略高于Jia 等[21]的试验结果。β-谷甾醇己二酸乙烯酯的降胆固醇活性最低。Brown 等[22]观察到一致的现象:完整的植物甾醇脂肪酸酯不能溶解到胆盐胶束中,不能改变胆固醇的胶束溶解度。β-谷甾醇己二酸单酯的降胆固醇活性为(14.29±0.81)%,证明其对混合胶束中胆固醇的溶解具有抑制作用。值得注意的是,β-谷甾醇和β-谷甾醇己二酸乙烯酯在二元混合胶束体系中的溶解度小于0.1 mmol/L,而β-谷甾醇二酸单酯在混合胶束中具有良好的溶解度(超过1.7 mmol/L)。掺入胃肠道胆盐混合胶束的部分与生物利用率有关[23]。β-谷甾醇二酸单酯的结晶度降低和润湿性增强,有利于其掺入混合胶束,提高其生物利用率。猜测β-谷甾醇二酸单酯进入混合胶束后,可能会引起胶束疏水核膨胀,胶粒尺寸增大,导致混合胶束沉淀,从而降低胆固醇的胶束溶解度。为了验证猜测,利用DLS 和TEM对混合胶束微观形貌进行表征。DLS 显示无论单一体系还是混合体系,胶束相的平均粒径在110~140 nm 之间,与TEM 观察到的结果(图5a~5d)一致,说明试验过程采取的分离胶束相和沉淀相的方法比较稳定。混合胶束的微观形态近似球形,与文献中显示的TEM 图像相似[24]。如图5e~5f 所示,β-谷甾醇与胆固醇的混合体系的沉淀相呈类似于β-谷甾醇的板状。Zeng 等[25]报道,β-谷甾醇可与胆固醇共结晶,形成不溶性混合晶体,减少胆固醇在小肠中的吸收。这一结果可以解释为什么β-谷甾醇与胆固醇形成的二元混合体系的胶束相尺寸最小。此外,观察到添加β-谷甾醇己二酸乙烯酯和β-谷甾醇己二酸单酯获得的二元混合体系沉淀相的微观形态与单一体系沉淀相的微观形态相似,而胶粒尺寸急剧膨胀(图5g~5h)。结果表明,β-谷甾醇己二酸单酯由于加入到混合胶束中,扩大胶束疏水核尺寸,导致混合胶束沉淀,降低了胶束中胆固醇水平。虽然β-谷甾醇己二酸乙烯酯同样扩大了混合胶束的尺寸,但它没有较强的胶束掺入能力,对混合胶束的沉淀作用较弱,因此几乎不影响胆固醇在胶束相中的溶解度。

表2 单一和混合体系中各组分参数Table 2 Parameters of each component in single and binary mixed micelles systems

图5 胶束相和沉淀相的TEM 图像Fig.5 TEM images of micellar phase and precipitation phase
3 结论
采用生物酶促水解制备β-谷甾醇己二酸单酯,条件温和,产品易于分离纯化,水解率达到99%以上。XRD、DSC、PLM 和接触角的测定结果表明,与β-谷甾醇相比,β-谷甾醇己二酸单酯的结晶度降低和润湿性增强(接触角从131.4°降至98.6°)。胆固醇模型胶束的结果表明,β-谷甾醇己二酸单酯具有一定的降胆固醇潜力,可能的作用机制是由于其物理特性的改变,增强其掺入胶束的能力,引起胶束疏水核的膨胀,胶粒尺寸增大,导致模型胶束沉淀,从而降低胆固醇的胶束溶解度。植物甾醇二元酸单酯的优良性能表明其在食品工业中具有一定的应用前景。
