玉米黄素对内质网应激引发的SH-SY5Y 细胞凋亡的保护作用
2023-08-18商迎辉李梦洁刘芸如黄汉昌劳凤学
商迎辉,魏 俊,李梦洁,刘芸如,黄汉昌,劳凤学
(北京市生物活性物质和功能食品重点实验室 北京联合大学功能因子与脑科学研究院 北京 100191)
阿尔茨海默症(Alzheimer's disease,AD)是一种退行性疾病。全球每3 s 会有1 位痴呆症患者产生,目前至少有5 000 万痴呆症患者,到2050年,预计将达到1.52 亿人,其中60%~70%是AD患者[1]。在中国目前约有1 000 万阿尔茨海默症患者,到2050 年,预计将超过4 000 万人[2]。目前阿尔茨海默症的发病机制不明,并缺乏有效的预防、诊断及治疗方法[3]。阿尔茨海默症病理征状出现前,内质网应激(Endoplasmic reticulum stress,ERS)被激活,错误折叠蛋白质增多,引发内质网内稳态的失衡,是AD 的早期事件[4]。当神经元中发生内质网应激后,未折叠蛋白反应(Unfoldedprotein response,UPR)被激活,并引起下游一系列相关蛋白信号的表达[5-7]。3 种感受器参与UPR,包括PKR 样ER 调节激酶(PKR-like ER kinase,PERK)、抑制物阻抗性酯酶1α(Inositol-requiring enzyme-1α,IRE1α)和活化转录因子6(Activating transcription factor 6,ATF6)[8]。
类胡萝卜素是天然的脂溶性抗氧化剂,在水果和蔬菜中作为彩色色素大量存在,至少有600种类胡萝卜素是天然存在的[9]。其中,玉米黄素(Zeaxanthin,Zea)是一种具有强抗氧化活性的类胡萝卜素[10],以中药枸杞子中含量最多[11]。玉米黄素有3 种立体异构体,分别是(3R,3'R)型、(3R,3'S)型和(3S,3'S)型,自然界中绝大多数以(3R,3'R)型存在(分子结构见图1)。其分子中的11 个共轭双键与尾端基团的羟基,使得它们具有较强的抗氧化能力。研究表明,叶黄素/玉米黄素异构体能通过改善神经营养因子和突触蛋白以及大脑皮层的氧化能力来有效减少神经变性[12]。玉米黄素具有穿过血脑屏障并在神经组织中积累的能力,且存在β 环,可能会防止形成或破坏β-淀粉样蛋白的聚集,因此玉米黄素等类胡萝卜素具有预防和治疗AD 的巨大潜力[13]。

图1 玉米黄素分子结构式Fig.1 Molecular structural formula of zeaxanthin
衣霉素(Tunicamycin,TM)作为天然抗生素现已广泛应用于内质网应激模型[14-15],进而引起细胞凋亡[16-17]。研究表明,TM 诱导的持续UPR 表达导致软骨细胞凋亡,并激活自噬与GRP78 的结合[18]。课题组前期研究发现[19],TM 质量浓度为5 μg/mL时,可对SH-SY5Y 细胞造成损伤;建立有效ERS模型,2~10 μmol/L 玉米黄素可明显减轻TM 损伤,其中浓度为5 μmol/L,预处理6 h,保护效果最好。本试验采用5 μg/mL TM 处理建立ERS 细胞模型,5 μmol/L 玉米黄素对其进行干预,研究玉米黄素通过PERK/CHOP 通路对SH-SY5Y 细胞凋亡的影响,对AD 的靶点治疗提供科学依据。
1 材料与方法
1.1 材料与试剂
玉米黄素(纯度为85.7%,无水乙醇溶解,配制成30 mmol/L 的储存液,避光于-20 ℃保存),上海源叶生物科技有限公司。
TM 用DMSO 溶解,配制成5 μg/μL 的储存液,-20 ℃保存,北京华越洋生物科技有限公司;神经母瘤细胞(SH-SY5Y),中国医学科学院细胞资源中心;3-甲基腺嘌呤,美国Selleckchem 公司;胎牛血清、1640 培养基,美国Gibco;L-谷氨酰胺、羟乙基哌嗪乙硫磺酸、双抗,北京Solarbio 公司;BCA试剂盒,北京鼎国昌盛生物技术有限责任公司;Caspase 3 活性检测试剂盒,上海碧云天生物技术有限公司;Anti-PERK、Anti-p-eIF2α、Anti-ATF4、Anti-β-actin 和Anti-CHOP 抗体,美国Sigma 公司;Anti-GRP78 抗体,美国Bioworld Technology公司;Anti-Beclin 抗体,跨国BD Transduction Laboratories 公司;辣根过氧化物酶山羊抗鼠IgG(H+L),中杉金桥公司。
1.2 仪器与设备
E191IR 型CO2细胞培养箱,美国金西盟公司;CKX41 倒置显微镜,Olympus 公司;Varioskan Flash 多功能酶标仪,美国赛默飞世尔科技公司;5043BR57802 转膜装置,BIO-RAD 公司;凝胶成像分析仪,Image Quant RTECL 公司。
1.3 方法
1.3.1 SH-SY5Y 细胞培养 复苏SH-SY5Y 细胞,在含有10%胎牛血清的RPIM 1640 培养基中,37 ℃,5%CO2培养,选择对数生长期的细胞进行传代培养。
1.3.2 细胞内质网应激损伤模型的建立 将SHSY5Y 细胞用胰酶消化、细胞计数,接种于培养皿内,37 ℃,5%CO2条件下培养24 h,以达到贴壁状态,弃去上清液,加入由RPIM 1640 培养液配制的TM 溶液。TM 处理36 h 后,提取细胞蛋白,进行后续试验。
1.3.3 细胞试验分组 细胞培养过程同1.3.1 所述方法,细胞试验分为空白对照组、玉米黄素保护组、TM 损伤组、损伤加保护组,TM 损伤组使用5 μg/mL TM 处理36 h,玉米黄素保护组使用5 μmol/L 玉米黄素预处理6 h,损伤加保护组为5 μmol/L 玉米黄素预处理6 h 后再加入5 μg/mL TM 处理36 h。
1.3.4 检测Caspase 3 活性 细胞培养及处理过程同1.3.1 和1.3.3 节,Caspase 3 活性根据检测试剂盒说明书进行检测。收集经处理后的SH-SY5Y细胞,并用细胞裂解液收集总蛋白,Bradford 法对总蛋白定量后与Caspase 3 底物Ac-DEVD-pNA于37 ℃反应2 h,发现颜色变化比较明显时,用酶标仪在405 nm 波长处测量吸光度OD 值。将TM组的Caspase 3 的活性定义为100%。使用公式(1)计算Caspase 3 活性。
1.3.5 Western Blot 分析 使用预冷的PBS 将药物处理后的细胞洗涤2~3 次,加入适量RIPA 细胞裂解液(含蛋白酶抑制剂),置于冰上30 min,12 000 r/min,4 ℃离心15 min,收集上清,BCA 方法测定蛋白浓度。按体积比1∶4 将5×SDS 上样缓冲液加入到剩余上清液中,煮沸5 min,-20 ℃保存蛋白样品。样品采用SDS-PAGE 电泳分离,转移到PVDF 膜上,5%脱脂奶粉室温封闭1 h,一抗孵育4 ℃过夜。TBST 洗涤3 次,室温下用二坑孵育2 h,TBST 慢速摇动10 min,洗涤3 次。ECL 发光液检测PVDF 膜上条带的光密度值,用β-actin作为内参,分析条带的灰度值。
1.4 数据分析
数据测定结果采用“平均值±标准差”表示,每组试验做3 组平行,SPSS 19.0 数据分析,Origin 7.5 绘制图表。试验组与对照组比较采用单因素方差分析(One-Way ANOVA),用Bonferroni 法多重比较,P<0.05 为差异显著,P<0.01 极显著差异。
2 结果与分析
2.1 玉米黄素对ERS 细胞模型中Caspase 3的影响
促进凋亡的Caspase(Cysteine-requiring aspartate protease)家族在ERS 导致的细胞凋亡过程中也起到重要作用,Caspase 在细胞凋亡中发挥关键性作用,是哺乳动物细胞中研究较多的一个蛋白,当细胞受损时,可激活Caspase 3,Caspase 3激活后能够特异性剪切许多特定的凋亡底物,引发细胞凋亡。除此之外,Caspase 3 可导致染色质固缩、DNA 片段化等一系列导致细胞核凋亡的事件。因此,用Caspase 3 试剂盒对各组细胞进行检测,并按要求将TM 处理后的ERS 细胞模型组的Caspase 3 活性定义为100%。结果如图2 所示,可以看出,经过5 μmol/L 玉米黄素处理后,其Caspase 3 活性显著低于ERS 模型组(P<0.01)。因此可以初步判断,玉米黄素能抑制TM 引起的Caspase 3 活性的上升,对凋亡具有一定的作用。至于对凋亡早期阶段和晚期阶段的影响还需试验进一步说明。

图2 玉米黄素对TM 诱导后的SH-SY5Y细胞Caspase 3 活性的影响Fig.2 Effect of zeaxanthin on caspase 3 activity of SH-SY5Y cells damaged by TM
2.2 玉米黄素作用于ERS 细胞模型后对凋亡的影响
2.2.1 玉米黄素通过抑制PERK 通路来缓解ERS引起的凋亡 PERK 蛋白是细胞内一种重要的UPR 近端感受器,当神经元中引发内质网应激后,PERK 会与GRP78 解离,并且可通过跨膜磷酸化而传到ERS 反应信号。并通过磷酸化下游翻译起始因子(Eukaryotic initiation factor 2,elF2)的α亚基进而抑制细胞内蛋白质合成,同时活化转录活化因子4(ATF4),上调促凋亡因子CHOP,促进细胞的程序性死亡。
因此在ERS 产生后,PERK 通路的异常变化对神经细胞的凋亡产生重要影响。为探究玉米黄素能否在ERS 细胞模型中对PERK-elF2α 通路产生影响,用Western Blot 同时检测了PERK 及其下游的elF2α 蛋白和ATF4 蛋白的表达情况。结果如图3 所示,与TM 模型组相比,当5 μmol/L 的玉米黄素作用于ERS 模型细胞后,结果显示PERK 及其下游调控蛋白elF2α 和ATF4 的表达能显著下降(P<0.01),说明玉米黄素可通过调控PERK 通路来缓解SH-SY5Y 细胞的内质网应激,可能机制是阻止PERK 蛋白与GRP78 的分离。

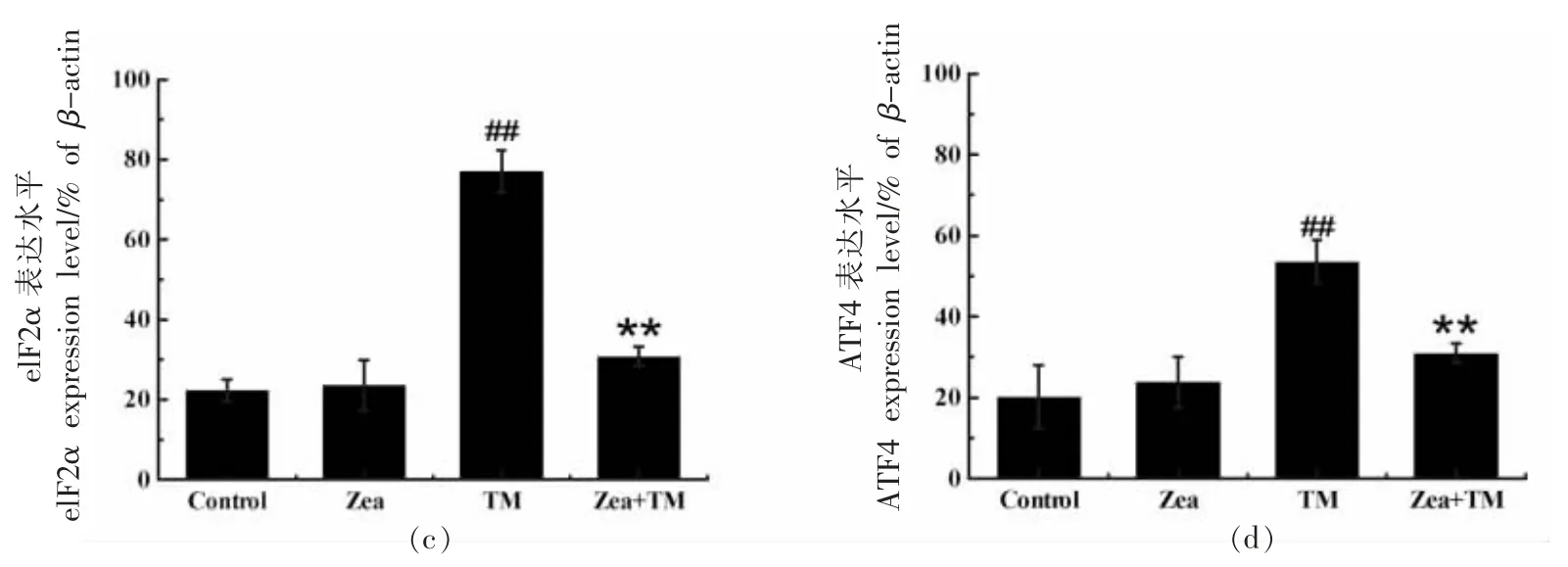
图3 玉米黄素对ERS 模型中PERK 通路的影响Fig.3 Effect of zeaxanthin on PERK pathway in ERS model
2.2.2 玉米黄素抑制促凋亡因子CHOP 的产生CHOP 是PERK 通路下游的蛋白,是细胞从抗凋亡向促凋亡转换的一种关键信号因子。为进一步探究玉米黄素对ERS 细胞模型的保护作用机制,同时对各组的CHOP 蛋白进行分析,Western Blot结果如图4 所示,与对照组相比,TM 模型组的CHOP 蛋白的表达水平极显著升高(P<0.005),而玉米黄素处理组CHOP 蛋白的表达水平极显著低于TM 模型组(P<0.01),这说明玉米黄素可以通过调控PERK 通路来抑制ERS 细胞模型中促凋亡蛋白CHOP 的升高。
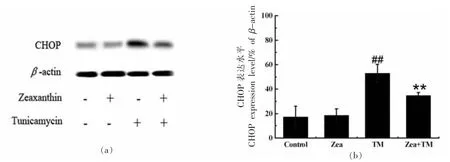
图4 玉米黄素对ERS 模型中CHOP 表达水平的影响Fig.4 Effect of zeaxanthin on CHOP expression in ERS model
2.3 玉米黄素作用于ERS 细胞模型后对自噬的影响
2.3.1 玉米黄素缓解ERS 引起的自噬 自噬溶酶体系统是清除错误蛋白和损伤细胞器的一个复杂的系统,对维持细胞内稳态平衡发挥着重要作用。越来越多的研究表明,内质网应激可诱导自噬[20],并且指出自噬是发生在内质网应激过程中的一种适应性反应,然而这些研究相继报道了自噬在细胞死亡中的双重作用,即它可以保护细胞使其免于凋亡,而自噬的过度激活也会促进内质网应激诱导细胞死亡[21-22]。
为了阐明玉米黄素作用于ERS 细胞模型后的保护作用与自噬之间的关系,深入研究了玉米黄素作用于ERS 细胞模型后自噬标志性蛋白Beclin 1 的变化。Beclin 1 基因是被证实的哺乳动物的自噬基因,在自噬体的形成过程中至关重要[23]。如图5 所示,TM 作用24 h 后玉米黄素组的Beclin 1 水平明显高于TM 组,结果有极显著差异(P<0.01),说明在初期阶段玉米黄素组自噬水平显著增强,然而当TM 作用36 h 后,TM 组Beclin 1 的水平持续升高,没有降低的趋势,而玉米黄素组的Beclin 1 水平与TM 组相比极显著降低(P<0.01),由此可以说明玉米黄素能在ERS 初始阶段促进自噬,当ERS 持续存在时,玉米黄素又能稳定自噬水平。可能的原因是,在ERS 初期阶段,错误折叠及未折叠蛋白增多,此阶段玉米黄素能促进自噬对错误蛋白或未折叠蛋白进行清除降解,此时的自噬是作为细胞的一种保护性机制,然而当ERS 长期且持续进行时,细胞内产生的错误蛋白及未折叠蛋白增多至超出负荷,细胞应激失去控制,激活的自噬无法正常发挥功能,为防止自噬功能紊乱导致的细胞死亡,玉米黄素在此阶段可以降低自噬,避免自噬导致的细胞死亡。而TM 组由于没有玉米黄素的调控,自噬持续增加,最终导致失控而引起细胞死亡。
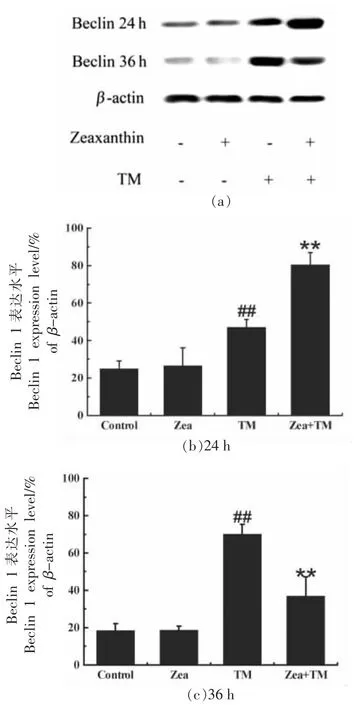
图5 玉米黄素对ERS 模型中Beclin 1表达水平的影响Fig.5 Effects of zeaxanthin on Beclin 1 expression in ERS model
2.3.2 抑制自噬会减弱玉米黄素对ERS 的缓解作用 为了进一步明确玉米黄素对ERS 细胞模型的保护作用与自噬之间的关系,研究采用自噬抑制剂3-甲基腺嘌呤(3-Methyladenine,3MA)进一步检测自噬被抑制后玉米黄素对细胞内ERS的影响。3MA 是细胞试验中常用的自噬抑制剂,可抑制自噬体的形成[24]。用自噬抑制剂3MA 抑制自噬后,分析Beclin 1 和GRP78 的变化情况,以深入探究玉米黄素在ERS 细胞模型中与自噬的关系。细胞分组后,自噬抑制组用10 mmol/L 3MA预处理6 h 后,加入5 μg/mL TM 继续处理36 h。由图6 的Western Blot 结果可知,加入3MA 后,无论是TM 组还是玉米黄素组(Zea+TM)Beclin 1的表达水平均降低,表明自噬被抑制,且内质网应激标志性蛋白GRP78 的表达水平均高于未添加组。从图6b 柱形图也可直观的看出,加入3MA 抑制自噬后,玉米黄素组的GRP78 水平与未加3MA的玉米黄素组相比极显著升高(P<0.01),说明自噬被抑制后玉米黄素缓解ERS 的能力被减弱。综合以上结果证明玉米黄素对SH-SY5Y 细胞中内质网应激的缓解作用与自噬的调控有关,抑制自噬会减弱玉米黄素对ERS 的缓解作用。

图6 自噬抑制剂会减弱玉米黄素对ERS 的缓解作用Fig.6 Autophagy inhibitor decreased the alleviative effect of zeaxanthin on ERS cell model
3 讨论
AD 作为一种中枢神经系统退行性疾病,是威胁老年人群健康的较常见的危险疾病。多数在65岁之后发病,少于5%的患者在65 岁之前发病。中国在步入老龄化阶段后,AD 的患病率将逐年升高,尤其随着人均寿命延长,这不仅会使AD 患者生活质量下降,还会给照顾者、家庭和公共卫生部门造成巨大负担[25]。针对AD 治疗的药物无法完全治愈本病,对AD 的治疗策略更加注重早期预防[26]。蛋白质构象变化和蛋白质错误折叠是AD 病理生理学的关键事件,因此,ERS 也是其一[27],且发生在AD 早期,是一种早期的应激性反应[28]。长期过度的ERS 会激活凋亡和自噬且发挥反面作用导致自噬功能紊乱,过度的自噬也会引起细胞死亡[29]。因此探讨通过有效的生物活性物质来调控ERS,进而抑制早期AD 病理,具有重要意义。
多项研究表明类胡萝卜素对AD 具有保护作用,最近一项通过系统评价和荟萃分析的研究显示,血浆中的玉米黄素浓度与AD 风险呈负相关[30]。此外,类胡萝卜素的酮β-环和κ-环,可能防止或抑制β-淀粉样蛋白的聚集。研究显示,玉米黄素通过激活AKT 信号通路抑制氧化应激缓解高糖诱导的系膜细胞凋亡[31],也可以通过调控细胞周期等信号途径抑制细胞凋亡[32]。一项流行性调查发现,膳食类胡萝卜素可能会限制自由基对神经元的损伤,增加叶黄素和玉米黄素的摄入量可能有助于预防或减缓认知能力下降[33]。因此,玉米黄素可能具有预防或治疗AD 的潜力。
本研究用TM 建立SH-SY5Y 细胞内质网应激模型,研究玉米黄素对ERS 引起的细胞凋亡的机制,进而探究其在预防AD 中的潜力。试验结果表明,玉米黄素能抑制TM 引起的凋亡蛋白Caspase 3 的活性;下调ERS 模型中PERK 及其下游调控蛋白elF2α 和ATF4 的表达,抑制促凋亡蛋白CHOP 的升高。在ERS 初期阶段,自噬作为细胞的一种保护性机制,玉米黄素能促进自噬,然而当ERS 长期且持续进行时,激活的自噬失常,为防止自噬功能紊乱导致的细胞死亡,玉米黄素在此阶段可以降低自噬,避免自噬功能紊乱造成的细胞死亡。
综上所述,玉米黄素对内质网应激引起的神经细胞损伤具有保护作用,具体机制可能是通过调控PERK/CHOP 通路,缓解并抑制细胞凋亡来实现的。
