病程相关蛋白基因GmPR1-6 的克隆及其在大豆抵抗SMV 侵染过程中的功能初探
2023-08-17苏伟华赵志华齐梦楠孙天杰王冬梅
苏伟华,赵志华,齐梦楠,孙天杰,王冬梅,张 洁
(华北作物改良与调控国家重点实验室/河北省植物生理与分子病理学重点实验室/河北农业大学 生命科学学院,河北 保定 071000)
大豆[Glycine max(L.)Merr.]是我国重要的粮油经济作物,但因其产能不足,导致供需严重不平衡[1]。由大豆花叶病毒(Soybean mosaic virus,SMV)引起的大豆花叶病毒病是我国大豆主产区普遍发生且破坏性强的重要病害,往往造成大豆叶片卷曲、皱缩、花叶、坏死,致使大豆品质、产量急剧下降,甚至绝收[2],且采用物理或化学方法对大豆花叶病毒病进行防治十分困难。因此,深入探讨大豆抵抗SMV 侵染的分子机制、挖掘主效抗病基因、培育抗病大豆新品种,对提高大豆的产量和品质,促进农业发展具有重要意义。
受病原物侵害后,植物体能够诱导产生并积累一类病程相关蛋白(Pathogenesis related proteins,PRP/PRs),从而增强植物抗病能力[3]。早在1970年,PR 蛋白首次在感染烟草花叶病毒(Tobacco mosaic virus, TMV)的烟草叶片中被检测到,并发现其与过敏性反应(Hypersensitive response, HR)相关[4],随后在单子叶和双子叶植物中均被挖掘。根据其生物学功能、蛋白质序列相似性、亲缘关系、酶活性等将其分为17 个家族,不同家族的PR 蛋白在植物生长发育过程中发挥不同作用[3]。大量研究表明PR 蛋白具有广泛的抗细菌和真菌活性,如番茄中PR1 能对疫霉菌、白粉病菌和蚕豆单胞锈菌等致病真菌产生抑制作用[5];PR2 蛋白属于β-1,3-葡聚糖酶,能够催化葡聚糖降解,分解真菌细胞壁,在猕猴桃中过表达PR2 蛋白增强其对猕猴桃溃疡病菌的抗性[6];百合中的LhSorPR4-2 受水杨酸等植物激素的诱导从而提高百合对灰霉病的抗性[7];PR6 作为1 种蛋白酶抑制剂,在植物抵抗细菌、真菌、线虫或食草性昆虫的过程中发挥作用[8]。PR9蛋白作为过氧化物酶,能够催化木质素、木栓质的生物合成以加固植物细胞壁进而抵御病原菌[9];PR10 具有较弱的核糖核苷酸酶活性,能够介导高粱对炭疽菌的抵抗能力[10]。此外,PR 蛋白在植物抗病毒过程中具有重要作用,如PR2 的诱导表达能够增强辣椒对黄瓜花叶病毒(Cucumber mosaic virus,CMV)的抗性[11]。
PR1 蛋白作为植物系统获得性抗性(SAR)防御信号增强的标志,在植物防御反应中起关键作用[12]。小麦中病程相关蛋白TaPR1 与TaTLP1 能够发生相互作用提高小麦对叶锈菌的抗性[13];分泌型StPR1 能够抑制病原菌的Ser/Thr 蛋白激酶AMPK 复合体的磷酸化活性,从而抑制病原菌生长,提高马铃薯对致病疫霉菌的抗性[14];棉花中GhMYB36 能够与GhPR1的启动结合,激活其表达,提高棉花对黄萎病的抗性[15];在大豆中过表达GmPR1L能够增强大豆对灰斑病菌的抗性[16],GmMAPK4-1 能够诱导GmPR1-6上调表达,参与大豆抵抗大豆胞囊线虫的防御反应[17],而有关PR1蛋白在植物与病毒互作中的功能研究鲜有报道。
课题组长期致力于大豆与SMV 互作机制的研究,已证明H2O2信号分子通过参与调控胼胝质(Callose, β-l,3-葡聚糖)在胞间连丝颈区的沉积从而参与非亲和互作过程,并构建了清除H2O2前后大豆响应SMV 的高通量转录组数据库[18]。本研究从转录组数据库中筛选得到1 个差异表达的基因Glyma.15G062400.1,通过NCBI 数据库进行序列比对,结果表明该基因为GmPR1-6。利用病毒介导的基因沉默(Virus induced gene silencing, VIGS)技术沉默GmPR1-6基因,通过分析基因沉默植株叶片接种SMV 后胼胝质的积累水平及病毒的扩散情况,解析该基因在大豆抵抗SMV 侵染过程中的功能,为深入研究病程相关蛋白在大豆抵御SMV 侵染的分子机制奠定基础。
1 材料与方法
1.1 试验材料
SMV 毒株N3、SC8 与大豆品种‘冀豆7号’分别组成非亲和组合以及亲和组合。其中,SMV 毒株N3、SC8 以及大豆品种‘南农1138-2’由南京农业大学智海剑教授惠赠,‘冀豆7号’由河北农林科学院粮油作物研究所张孟臣研究员提供。
1.2 GmPR1-6 的克隆与生物信息学分析
使 用UNlQ-10 柱 式Trizol 总RNA 抽 提 试 剂盒(货号:B511321, Sangon)提取‘冀豆7 号’叶片中的总RNA,经反转录试剂(货号:RR047,TaKaRa)反转为cDNA 待用。从在线基因组数据库网站Phytozome(http://Phytozome.jgi.doe.gov/pz/portal.html)中提取GmPR1-6(Glyma.15G062400.1)基因的编码区序列,利用SnapGene 软件设计特异 引 物(表1),通 过PCR(Polymerase chain reaction)扩增其编码区(长度为495 bp),连接至克隆载体pEASY-Blunt Zero,并转化至大肠杆菌感受态,筛选阳性单克隆送至北京华大基因科技有限公司(以下简称华大)测序。使用Protparam(https://web.expasy.org/protparam/)、NCBI(https://www.ncbi.nlm.nih.gov/)、ProtScale(https://web.expasy.org/protscale/)、TMHMM Server v.2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)、ProtComp(http://www.softberry.com/berry.phtml?topic=index&group=progr ams&subgroup=proloc)、SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP-5.0)网站分别对GmPR1-6 氨基酸的理化性质、保守结构域、疏水性、跨膜结构域、亚细胞定位和分泌信号肽进行分析预测。

表1 本研究中所用引物序列Table 1 Primer sequences used in this study
1.3 实时荧光定量检测大豆抵抗SMV 侵染过程中GmPR1-6 基因的表达
参考邓恩新研究[19]中的简易注射装置,将50 mol/L 咪唑溶液(质膜NADPH 氧化酶的专一性抑制剂,Imidazole)注射到大豆第一轮真叶中作为试验组,以注水处理的叶片材料作为对照组(Water)。在注射24 h 后,将SMV 毒株N3 接种于叶片表面,并分别在接种病毒后0 、4 、12 、24 和48 h 对大豆叶片中GmPR1-6表达水平进行检测,RT-qPCR 检测引物见表1。以GmEF1b作为内参基因,采用2-ΔΔCt法计算基因的相对表达量[20]。
1.4 GmPR1-6 基因VIGS 载体的构建
以含有GmPR1-6全长序列的大肠杆菌菌液提取的质粒为模板,使用特异性引物(表1)扩增GmPR1-6的特异性沉默区段,将其连接至使用BamH I 和XhoI 酶切的pTRV2 载体中,构建pTRV2-GmPR1-6重组质粒,将其转化到大肠杆菌,送至华大测序。将测序正确的重组载体质粒转化到农杆菌GV3101 中,并使用BamH I 和XhoI 对重组质粒进行双酶切验证。
1.5 病毒转染及基因沉默效率检测
将含有pTRV1 质粒和pTRV2-GmPR1-6重组质粒的农杆菌菌株等体积混合作为试验组(TRV:GmPR1-6),将含有pTRV1 质粒和pTRV2 质粒的农杆菌菌株等体积混合作为对照组(TRV:00),浇灌到去除顶芽后的大豆根部进行病毒转染,并对病毒转染后的植株进行沉默效率检测,具体方法参考孙天杰等人的研究[21]。采用摩擦接种方法将SMV接种于大豆叶片表面,对接种病毒叶片进行苯胺蓝染色,对胼胝质荧光强度进行观察,并利用ImageJ软件对30 个接种点处胼胝质的面积进行量化分析。采用点接种方法将SMV 接种于大豆叶片表面,利用RT-PCR 技术检测SMV 外壳蛋白转录产物,具体操作参考本实验室Sun 等的研究[18]。
2 结果与分析
2.1 GmPR1-6 基因克隆与生物信息学分析
本研究在转录组数据库中筛选到的差异表达基因GmPR1-6,以‘冀豆7 号’叶片cDNA 为模板进行扩增,获得预期大小的扩增片段(图1A),测序确认获得正确的CDS 序列,该基因全长为495 bp,编码164 个氨基酸。该基因编码的蛋白产物相对分子质量为17.55 kD,等电点为5.14,预测含有1 个CAP 结构域和1 个SCP 结构域(图1B),属于典型的病程相关蛋白。在三维结构上,发现该蛋白具有3 个β 折叠、3 个α 螺旋(图1C)。利用TMHMM、SignalP 和ProtComp 在线分析软件对GmPR1-6 的跨膜结构域、分泌信号肽和亚细胞定位进行分析,结果表明GmPR1-6没有跨膜结构域,但具有信号肽(图1D),且该蛋白可能定位于细胞外。

图1 GmPR1-6 的克隆及生物信息学分析Fig.1 Cloning and bioinformatics analysis of GmPR1-6
2.2 GmPR1-6 在大豆抵抗SMV 侵染过程中的表达模式
为了探讨GmPR1-6在大豆抵抗SMV 侵染过程中的功能,本研究检测其在亲和组合与非亲和组合中受SMV 侵染后不同时间点的表达量。结果显示,GmPR1-6在非亲和组合中的表达量显著高于亲和组合;与病毒接种后的0 h 相比,GmPR1-6的表达量在12 h 开始逐渐升高,48 h 达到高峰(图2A)。此外,在非亲和组合的叶片上预注射咪唑(Imidazole)清除H2O2信号后,发现GmPR1-6的表达量在12 h 和48 h 显著上升(图2B)。综上说明,GmPR1-6在转录水平响应SMV 的侵染,并且在非亲和组合中的表达明显高于亲和组合。

图2 GmPR1-6 在大豆接种SMV 后的表达模式Fig.2 Expression pattern of GmPR1-6 after SMV inoculation
2.3 GmPR1-6 基因沉默后降低了大豆对SMV 侵染的抗性
2.3.1GmPR1-6基因VIGS 载体的构建及沉默效率
检测 课题组前期建立了烟草脆裂病毒介导(TRVVIGS)大豆基因沉默技术体系[21],本研究进一步利用该体系验证GmPR1-6基因在大豆抵御SMV 侵染过程中的功能。首先,借助NCBI BLAST 工具选取GmPR1-6基因的特异性片段作为沉默区段(图3A),利用特异性引物(表1)进行扩增,得到与预期分子大小(216 bp)一致的条带,经华大测序正确后连接至pTRV2 载体,使用BamHI 和XhoI对重组载体GmPR1-6-VIGS 质粒进行酶切验证(图3B),利用验证正确的质粒载体系统沉默GmPR1-6基因。取接种SMV 毒株N3 的大豆第一轮叶片,利用RT-qPCR 技术对GmPR1-6的沉默效率进行检测,结果显示,与对照植株(TRV:00)相比,沉默植株(TRV:GmPR1-6)中GmPR1-6的表达量均下降了50%以上(图3C),表明GmPR1-6沉默效率良好,可用于功能研究。

图3 GmPR1-6 沉默载体构建及沉默效率检测Fig.3 The construction of TRV:GmPR1-6 vectors and detection of the silencing efficiency
2.3.2GmPR1-6沉默植株的胼胝质积累情况检测 实验室前期研究表明,胼胝质在胞间连丝颈部沉积是大豆抵抗SMV 侵染的关键[22],本试验采用摩擦接种的方法将SMV 毒株N3 接种于GmPR1-6沉默植株的大豆叶片上,利用苯胺蓝对接种病毒叶片进行染色,观察叶片中胼胝质变化情况。结果显示,在同一时间点,与对照组(TRV:00)相比,沉默植株(TRV:GmPR1-6)胼胝质荧光强度相对减弱(图4A),胼胝质面积有所增加(图4B)。
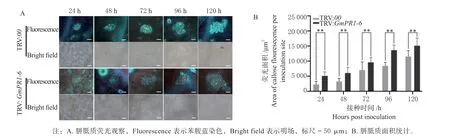
图4 GmPR1-6 沉默植株的胼胝质荧光观察与面积统计Fig.4 Observation and area statistics of callose fluorescence in GmPR1-6 silenced plants
实验室前期工作证明,预注射咪唑抑制H2O2的产生,能够导致由SMV 侵染诱导的胼胝质荧光水平降低,同时病毒在胞间的扩散增强[18]。由此推测,沉默GmPR1-6基因增加了大豆对SMV 的敏感性。
2.3.3GmPR1-6在大豆抵抗SMV 胞间运输中的作用 为进一步分析GmPR1-6的沉默是否影响SMV的胞间运输,本研究采用点接种法将SMV 毒株N3接种于GmPR1-6沉默植株叶片表面,以接种点为中心,分别取向外延展1、2、3 以及4 mm 叶片,对叶片中SMV 外壳蛋白(CP)在转录水平的表达情况进行检测,以此来判断基因沉默后病毒的扩散情况。结果发现,对照组(TRV:00)叶片在接种点外始终未检测到SMV CP 基因的表达,而GmPR1-6沉默植株叶片在接种SMV 后48 h 病毒开始向外扩散至1 mm,120 h 时病毒已扩散至4 mm(图5),说明沉默GmPR1-6基因更有利于病毒在胞间的扩散。

图5 GmPR1-6 沉默植株叶片上SMV 的胞间运输检测Fig.5 Detection of intercellular transport of SMV in GmPR1-6 silent leaves
2.3.4GmPR1-6在大豆抵抗SMV 长距离运输中的作用 实验室前期研究表明SMV 可在韧皮部装载,通过筛管进行长距离运输,最终实现系统性侵染[23]。本研究采用摩擦接种法将SMV 毒株N3 接种到GmPR1-6沉默植株叶片上,对接种病毒叶片的上位叶片进行观察和SMVCP基因表达情况的检测,发现在接种后14 d,GmPR1-6沉默植株接种病毒叶片的上位叶出现不同程度的花叶、失绿、卷曲等感病症状,且上位叶中检测到SMVCP基因的表达,而对照中未观察到明显症状,同时未检测到SMVCP基因的表达(见图6)。说明在SMV 毒株N3 与‘冀豆7 号’组成的非亲和组合中,沉默GmPR1-6后病毒可以通过长距离运输实现系统侵染,进一步说明GmPR1-6在大豆抵御SMV 侵染过程中发挥重要作用。
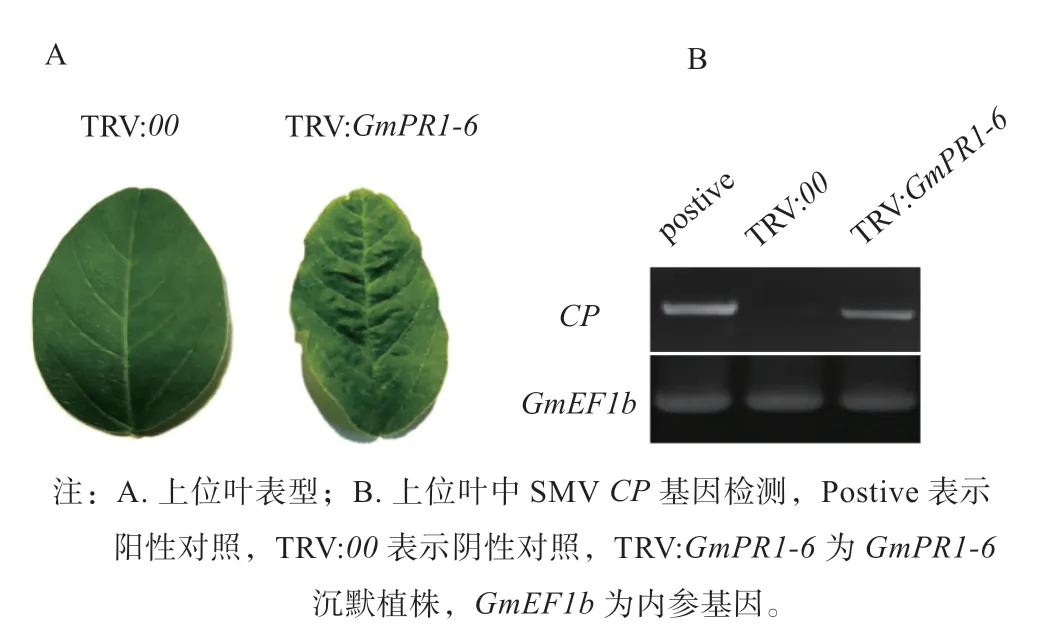
图6 GmPR1-6 沉默植株接种SMV 叶片上位叶表型观察及病毒检测Fig.6 Phenotype and virus detection in the upper leaves of GmPR1-6 silenced plants inoculated with SMV
3 结论与讨论
病程相关蛋白家族种类繁多,其中PR1家族基因最丰富,其结构也十分保守[12]。在拟南芥中有22 个[24]、水稻中有12 个[25]、葡萄中10 个[26],本研究根据PR1 的结构域文件,通过HMMER 查找大豆基因组中的PR1 蛋白,结果发现大豆中有19 个PR1家族基因。大量研究表明,病程相关蛋白PR1基因广泛参与植物防御反应,如棉花GhPR1受GhMYB36 的激活参与棉花对黄萎病抗性[15];大豆中过表达GmPR1L增强大豆对大豆灰斑病菌的防御反应[16],GmMAPK4-1 能够诱导GmPR1-6的表达从而参与大豆抵抗大豆包囊线虫的过程[17]。本研究从大豆响应SMV 侵染的转录组数据库中筛选得到1 个差异表达的大豆病程相关蛋白基因GmPR1-6,沉默该基因增加大豆对SMV 的敏感性,说明该基因在大豆抵御SMV 侵染过程中发挥正调控作用。
有研究表明,PR1基因是多种物种中水杨酸(SA)介导免疫的标志[27],SA 信号能够诱导PR1基因的表达从而参与植物的防御反应。而SA 信号能够与H2O2信号相互作用参与植物抵御逆境胁迫,如拟南芥中介体复合体亚基MED8 作为H2O2诱导基因表达的负调控因子,能够增强水杨酸信号途径[28];S-亚硝基谷胱甘肽还原酶(GSNOR)作用于H2O2下游激活SA 信号转导机制,且编码过氧化氢酶的基因CAT2突变能够诱导SA 的生成,从而显著激活SA 下游防御基因(如PR1)表达增强植物抗性[29]。实验室前期研究表明,早期的H2O2信号能够提高大豆对SMV 的防御能力,而本研究发现清除H2O2后GmPR1-6的转录水平表达量却有所升高,并且在大豆抵抗SMV 的侵染过程发挥正调控功能。分析可能是H2O2信号途径与SA 信号途径存在交叉,而GmPR1-6是否受SA 调控从而参与大豆与SMV的互作过程还有待进一步验证。
病毒主要通过胞间连丝(Plasmodesmata, PD)向邻近细胞转运以及通过筛管系统进行长距离运输,实现成功侵染[30]。而植物可以通过调节胼胝质在胞间连丝颈区沉积,降低胞间连丝的通透性,有效阻断病毒胞间运输[31]。实验室前期研究发现,胼胝质在胞间连丝颈部的沉积能够限制SMV 在大豆的胞间转运[22];Zhang 等人[23]利用嫁接技术进一步证明胼胝质在韧皮部的沉积能够有效限制SMV的长距离运输,充分说明胼胝质的沉积是大豆抵抗SMV 侵染的关键因素。另有研究发现,病程相关蛋白能够在胼胝质的沉积过程中发挥重要作用,拟南芥PR2 能够编码1 种β-1,3-葡聚糖酶,从而抑制胼胝质的合成,当拟南芥与病原物互作时,ABA 信号途径则通过抑制PR2 的表达使胼胝质沉积增加,进而提高对病原物的抗性[32];在玫瑰中,RcPR4/1和RcPR5/1 通过影响PR2 和胼胝质合酶的表达来调控胼胝质的沉积,从而提高玫瑰对盐胁迫的抗性[33]。本研究利用VIGS 技术沉默GmPR1-6基因,沉默植株病毒侵染处胼胝质荧光面积增大而强度减弱,可能是由于GmPR1-6的沉默降低了大豆对SMV 胞间转运的限制,使得病毒在胞间的转运相较于对照加快,尽管在一定程度上降低了SMV 感染细胞中胼胝质的积累水平,但是没能够充分限制病毒的胞间运输,因此病毒的移动导致了邻近受侵染细胞中胼胝质的产生。
