基于T7 转录系统的谷氨酸棒杆菌重组蛋白高效表达系统的创建
2023-08-17任晓昕韩琳琳武子淇徐大庆
任晓昕,韩琳琳,武子淇,谷 敏,徐大庆
(1.河北农业大学 生命科学学院,河北 保定071000;2.河北省蠡县农业农村局,河北 保定 071400)
重组蛋白高效表达系统是进行具有成本竞争力的目标蛋白工业化生产的基础。优秀的微生物重组蛋白表达系统需要1 个合适的宿主菌株及1 个高效的基因表达载体。另外,重组蛋白的胞外分泌,因其能够简化分离纯化步骤,降低生产成本[1],是优秀的微生物重组蛋白表达系统的又一关键特征。谷氨酸棒杆菌(Corynebacterium glutamicum)是1 种革兰氏阳性、不产芽孢和菌丝体的符合食品安全生产标准的食品级微生物[2],已广泛应用各种小分子物质,包括氨基酸、维生素、乙醇和某些有机酸等的发酵生产[3]。谷氨酸棒杆菌因其具有培养条件要求简单,细胞生长速度快,能够向培养基中分泌胞外蛋白[4],胞外蛋白酶活性极低以及能够进行高密度发酵等特点[5],是一种适用于重组蛋白生产的优秀宿主菌。然而,谷氨酸棒杆菌表达载体拷贝数低并且缺乏强启动子,致使重组蛋白在谷氨酸棒杆菌中的表达水平普遍偏低[6]。因此,构建高效分泌型谷氨酸棒杆菌表达系统,对于进行重组蛋白的经济、高效生产具有十分重要的意义。
源自大肠杆菌T7 噬菌体的T7 转录系统具有特异性(指T7 RNA 聚合酶只特异性识别T7 启动子,而不与细菌中的其他启动子互作)、简单性(指从T7 RNA 聚合酶识别T7 启动子开始,到转录终止的整个转录过程中,不需任何其他的蛋白因子参与)和转录高效性的特点,已经在异源细菌中成功用于重组蛋白的高效表达[7]。信号肽是转运蛋白前体N-末端的一小段氨基酸,其最终被细胞膜上的信号肽酶切割并不出现在成熟的分泌蛋白中。信号肽的强弱决定着蛋白跨膜分泌效率[8]。目前为止,一系列强信号肽,诸如cgl_2070、cgl_0904 等,已经在谷氨酸棒杆菌中被鉴定[9-10]。本研究拟以谷氨酸棒杆菌为宿主菌,构建以T7 转录系统控制基因转录,cgl_2070 强信号肽介导重组蛋白分泌的分泌型基因高效表达载体,创建一套谷氨酸棒杆菌重组蛋白高效表达系统,以期为重组蛋白的经济、高效生产提供新途径。
1 材料与方法
1.1 引物和细菌培养条件
本试验所需引物序列见表1。

表1 本试验所用引物及其序列Table 1 Primers and their sequences used in this work
大肠杆菌220 r/min、37 ℃条件下培养于LB 液体培养基中(tryptone 1%、Yeast extract 0.5%、NaCl 1%)或37 ℃条件下培养于LB 固体培养皿中;谷氨酸棒杆菌200 r/min、30 ℃条件下培养于LBHI 液体培养基中(tryptone 0.5%、Yeast extract 0.25%、NaCl 0.5%、Brain Heart Infusion 1.85 %)或30 ℃条件下培养于LBHI 固体培养皿中; 谷氨酸棒杆菌转化子筛选200 r/min、30 ℃条件下培养于LBHIS 液体培养基中(tryptone 0.5%、Yeast extract 0.25%、NaCl 0.5%、Brain Heart Infusion 1.85 %、D-Sorbitol 9.1%)或30 ℃条件下培养于LBHIS 固体培养皿中。
1.2 谷氨酸棒杆菌分泌型基因表达载体pAU29KS的构建
首先,以E.coliBL21(DE3)基因组DNA为模板,T7-F1/T7-R1 和T7-F2/T7-R2 为引物进行T7 RNA聚合酶编码基因T7 gene 1的PCR 扩增;使用限制性内切酶PstI 和SalI 对T7 gene 1基因片段和本实验室前期构建的载体pAU2(E.coli-C.glutamicum基础穿梭载体,Kmr)进行双酶切并纯化,纯化产物通过DNA Ligation Kit Ver.2.1 试剂盒进行连接,连接产物转化E.coliDH5α 感受态细胞,涂布于含有卡那霉素的LB 固体培养基中,置于37 ℃条件下过夜培养;挑选转化子,提取质粒进行PstI 单酶切和PstI、SalI 双酶切验证,验证正确的质粒命名为谷氨酸棒杆菌质粒pAU29K。然后,使用BamHI 和StuI 分别双酶切质粒pUC57-S-Box1 和pAU29K,经连接、转化、卡那霉素抗性平板筛选,对转化子进行以29K-YZ-F/29K-YZ-R 为引物的菌落PCR 验证,验证正确的转化子提取质粒进一步的测序验证,测序验证正确的质粒即为谷氨酸棒杆菌质粒分泌型表达载体pAU29KS。
1.3 重组表达载体pAU29KS-amyF 的构建及其谷氨酸棒杆菌转化
使用人工合成的经过谷氨酸密码子偏爱性优化嗜热脂肪土芽孢杆菌α-淀粉酶编码基因amyF作为报告基因。首先,应用在线信号肽预测软件SignalP5.0(SignalP-5.0-Services-DTU Health Tech)对amyF基因进行信号肽编码序列分析,以质 粒pUC57-amyF为 模 板,amyF-F/amyF-R 为 引物进行去除自身信号肽编码序列的amyF报告基因的PCR 扩增;然后,使用限制性内切酶EcoRI 和HindIII 对表达载体pAU29KS 和amyF基因分别进行双酶切;第三步,分别将双切并纯化后的质粒pAU29KS 与amyF基因进行片段连接,通过热激法将上述连接产物转化至E.coliDH5α 感受态细胞中,并涂布于含有卡那霉素的LB 固体培养基中,置于37 ℃恒温培养箱中过夜培养;最后,长出清晰可见的转化子后,挑选转化子进行双酶切以及进一步的测序验证,验证正确的重组表达载体,命名为pAU29KS-amyF。
参照Liebl 等的电转化法[11],将重组表达载体pAU29KS-amyF电转化至谷氨酸棒杆菌C.glutamicumATCC13032 感受态细胞,涂布于含有卡那霉素的LBHIS 固体培养基上,于30 ℃培养箱中过夜培养;对转化子进行质粒提取验证,验证正确的谷氨酸棒杆菌转化子即为pAU29KS-amyF 转化成功的谷氨酸棒杆菌工程菌,命名为C.glutamicum/pAU29KS-amyF。
1.4 α- 淀粉酶AmyF 在谷氨酸棒杆菌表达系统C. glutamicum/pAU29KS-amyF 中的分泌表达及检测
1.4.1 透明圈法检测α-淀粉酶分泌情况 利用透明圈法,对工程菌C.glutamicum/pAU29KS-amyF分泌表达AmyF 情况进行分析,具体步骤如下:首先,将C.glutamicum/pAU29KS-amyF在含卡那霉素的LBHI 液体培养基中培养过夜;然后,将C.glutamicum/pAU29KS-amyF以及不含载体的野生型菌株C.glutamicumATCC13032 划线于含2% 淀粉的LBHI 平板培养基上,置于30 ℃条件下培养36 h;最后,将培养后的平板用配置好的碘液均匀涂抹平皿,观察有无透明圈现象。
1.4.2C.glutamicum/pAY29KS-amyF 培养物上清液中α- 淀粉酶的SDS-PAGE 检测 对照菌株C.glutamicumATCC13032 和工程菌株C.glutamicum/pAU29KS-amyF分别接种LBHI 培养基12 h 过夜培养,按照1∶10 比例转接到50 mL LBHI 培养基中培养36 h,12 000 r/min、4 ℃条件下离心2 min,收集培养物上清液。按照常规方法制备SDS-PAGE的变性聚丙烯酰胺凝胶,将上述谷氨酸棒杆菌培养物上清液按比例加入5 倍上样缓冲液,煮沸10 min,按照15 μL/孔上样量上样,然后进行电泳。将SDS-PAGE 凝胶使用考马斯亮蓝R250 染色后进行脱色,可清晰看到凝胶上的蛋白条带后终止脱色反应。
1.4.3C.glutamicum/pAU29KS-amyF菌体胞内及培养物上清中α-淀粉酶活性检测 菌体沉淀重悬液超声波破碎,离心除去细胞碎片,制备细胞裂解上清液,用于胞内α-淀粉酶活性检测。应用QB/T1803-1993 国标法[12],对菌体胞内及培养物上清中α-淀粉酶进行活性检测。具体方法如下:第一步将诱导表达完成后的样品12 000 r/min、4 ℃离心2 min,并将菌体沉淀进行超声破碎后收集破碎液上清;第二步设置6 个试验组,取6 支试管,放入20 mL 可溶性淀粉溶液,然后加入5 mL pH6.0缓冲液混匀后60 ℃水浴5 min;第三步将待测酶溶液进行梯度稀释后,各取1 mL 加入至相应编号的离心管中混匀,及时反应5 min,再加入1 mL反应液和5 mL 稀碘液混匀;以稀碘液为对照组,使用分光光度计测定样品OD660;按照QB/T1083–1993 表A1 计算待测样品的酶浓度;待测样品酶活力=查表A1 求得酶浓度×稀释倍数。一单位淀粉酶活性(U/mL)被指定为1 g 固体酶粉(或1 mL 液体酶),于60 ℃、pH=6.0 条件,1 h 液化1 g 可溶性淀粉,即为1 个酶活力单位,以U/mg(U/mL)表示。试验设3 个生物学重复。
2 结果与分析
2.1 分泌型基因表达载体pAU29KS 的构建
以实验室前期构建的大肠杆菌-谷氨酸棒杆菌穿梭质粒pAU2(4 713 bp)为骨架,将T7 RNA聚合酶编码基因T7 gene 1片段(2 818 bp)插入到pAU2 的PstI 和SalI 两个限制酶位点之间,构建质粒pAU29K(7 531 bp)。在质粒pAU29K 的BamHI 和StuI 位点之间,插入465 bp 的人工合成的克隆/表达盒S-Box1,构建谷氨酸棒杆菌分泌型基因表达载体pAU29KS(7 978 bp)。琼脂糖凝胶电泳检测及测序验证与预期结果相一致,表明成功构建谷氨酸棒杆菌分泌型基因表达载体pAU29KS,见图1。克隆表达盒S-Box1 多克隆位点MCS 由EcoRI、NotI、BglII、NheI 和HindIII 组成,主要使用T7 启动子来控制目的基因的转录,使用谷氨酸棒杆菌强核糖体结合位点RBS 和强信号肽序列cgl_2070 来控制蛋白质的翻译及介导蛋白质的胞外分泌。
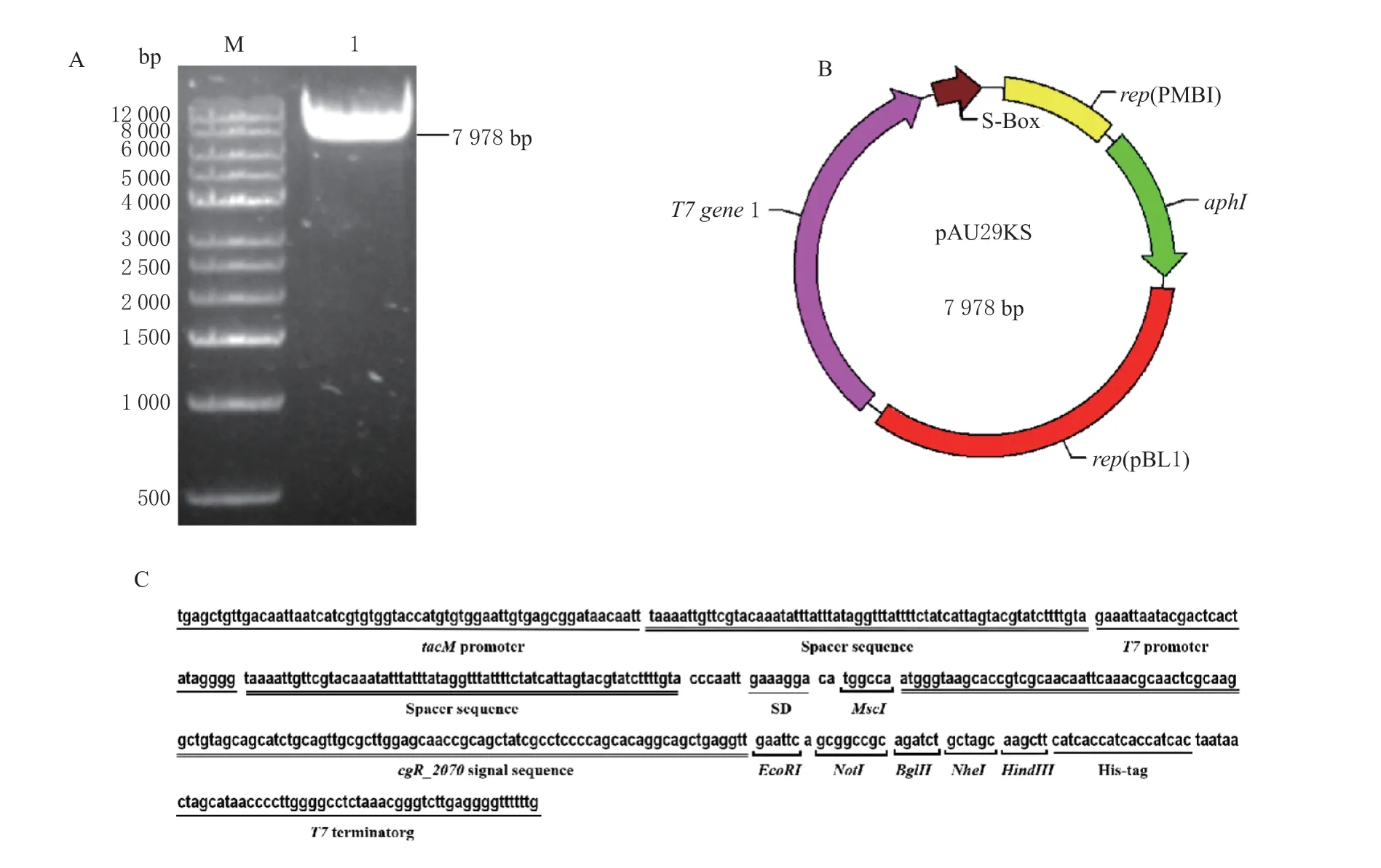
图1 谷氨酸棒杆菌分泌型基因表达载体pAU29KS 的构建Fig.1 Construction of the secretion-type gene expression vector pAU29KS in C. glutamicum
2.2 谷氨酸棒杆菌重组蛋白表达系统C. glutamicum/pAU29S-amyF 的构建
嗜热脂肪土芽孢杆菌α-淀粉酶AmyF 能够在谷氨酸棒杆菌中以Sec(the general secretion pathway)和Tat(the twin arginine translocation pathway)2 种不同分泌途径进行活性分泌,本研究选择使用AmyF 作为报告蛋白来检测谷氨酸棒杆菌C.glutamicum/pAU29KS 表达系统的蛋白生产能力。将经过谷氨酸密码子偏爱性优化,且去除自身信号肽编码序列的amyF连接到表达载体pAU29KS 上,转化大肠杆菌,获得重组表达载体pAU29KS-amyF。对照载体pAU29KS 及重组载体pAU29KS-amyF分别转化谷氨酸棒杆菌,提取谷氨酸棒杆菌转化子质粒进行酶切验证。琼脂糖凝胶电泳检测(图2)及测序验证与预期结果相一致,表明成功获得谷氨酸棒杆菌重组蛋白表达系统C.glutamicum/pAU29KSamyF。

图2 谷氨酸棒杆菌重组表达载体pAU29KS-amyF的电泳检测Fig.2 Agarose gel electrophoresis assay of recombinant vector pAU29KS-amyF of C. glutamicum
2.3 C.glutamicum/pAU29KS-amyF 分泌表达报告蛋白α-淀粉酶AmyF 的检测
2.3.1 α-淀粉酶透明圈法活性检测 应用透明圈法
可方便快速地对C.glutamicum/pAU29KS-amyF能否分泌表达α-淀粉酶AmyF 进行判定。试验结果显示,C.glutamicum/pAU29KS-amyF经过在平板培养物上培养,产生了清晰可见的透明圈,而对照菌株C.glutamicum/pAU29KS 未见透明圈的产生(图3),说明C.glutamicum/pAU29KS-amyF能够表达并向胞外分泌α-淀粉酶。

图3 C. glutamicum/pAU29KS-amyFα-淀粉酶分泌的透明圈法检测Fig.3 Activity analysis of C. glutamicum/pAU29KS-amyF by α-amylase transparent circle method
2.3.2 α-淀粉酶SDS-PAGE 法分析 为确认C.glutamicum/pAU29KS-amyF的α- 淀 粉 酶AmyF 胞 外 分 泌 表达水平,对工程菌培养物上清液中AmyF 含量进行了SDS-PAGE 检测。SDS-PAGE 考马斯亮蓝染色检测结果显示,相比于对照菌株C.glutamicum/pAU29KS 培养物上清液,C.glutamicum/pAU29KSamyF培养物上清液样品清晰地呈现1 条特异性的蛋白条带,且其分子量大小与预测的AmyF 蛋白分子量57 kD 大小相一致(图4)。这些结果证明了C.glutamicum/pAU29KS-amyF在T7 转录系统的作用下进行了报告蛋白α-淀粉酶的高效表达。

图4 C. glutamicum/pAU29KS-amyF 培养物上清液SDS-PAGE 分析Fig.4 SDS-PAGE analysis of culture supernatant of C. glutamicum /pAU29KS-amyF
2.3.3 α-淀粉酶比酶活测定 为检测胞内表达的AmyF 是否完全分泌到胞外培养基中,进行了C.glutamicum/pAU29KS-amyF菌体胞内及培养物上清中α-淀粉酶活性检测试验。酶活检测结果显示培养物上清液具有高淀粉酶活力,而细胞裂解上清液未检测到淀粉酶活力(图5),说明高效表达的α-淀粉酶在由强信号肽cgl_2070 的介导下完全分泌到胞外培养基中。以上检测结果,共同证明了本研究构建的基于T7 转录系统的C.glutamicum/pAU29KS能够对目标蛋白进行高效分泌生产,是一套优秀的谷氨酸棒杆菌分泌型重组蛋白高效表达系统。
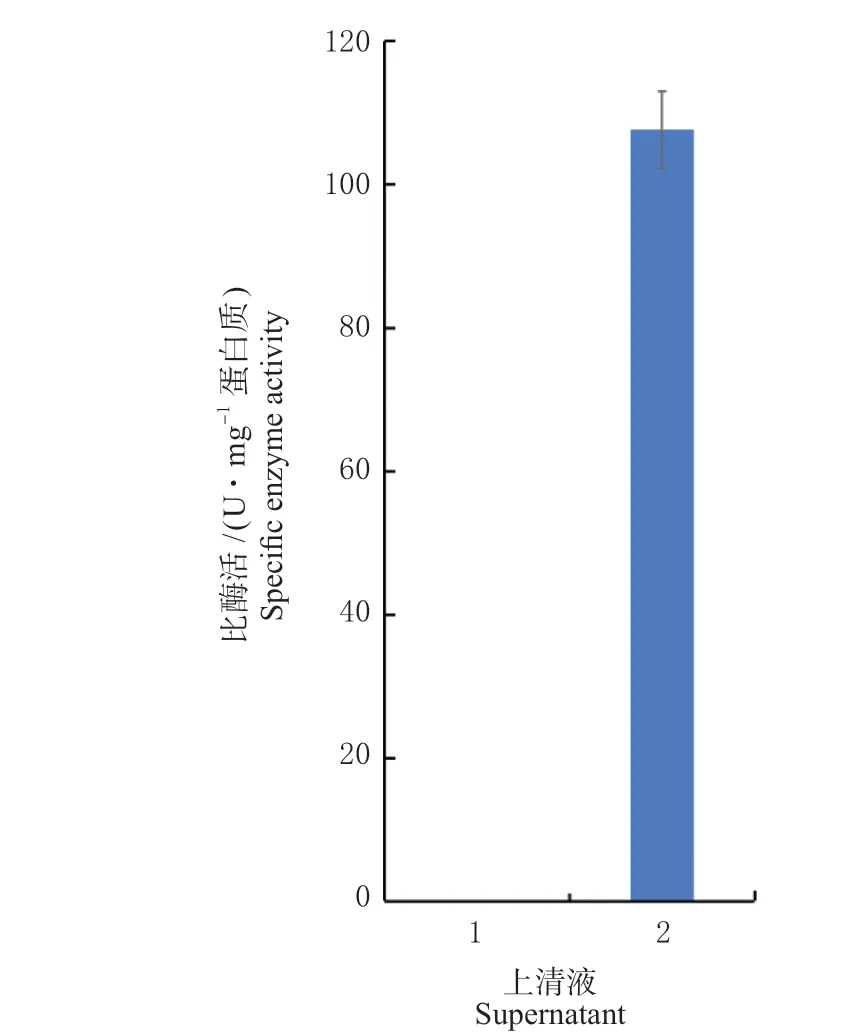
图5 C. glutamicum/pAU29KS-amyF 的α-淀粉酶活性测定Fig.5 The specific activities of AmyF production in C. glutamicum/pAU29KS-amyF
3 结论与讨论
基因转录是通过RNA 聚合酶与启动子相互作用来实现的,启动子的强弱决定了结构基因的表达效率。目前发现的谷氨酸棒杆菌天然质粒都是低拷贝质粒,表达载体在谷氨酸棒杆菌中的低拷贝数,使得强启动子应用于重组蛋白表达载体的构建具有更关键的意义。可能是由于在谷氨酸棒杆菌自身转录系统中,其自身RNA 聚合酶需要负责3 000 多个基因的转录,目前在谷氨酸棒杆菌中还没有发现天然强启动子。在源自大肠杆菌T7 噬菌体的T7 转录系统中,T7 RNA 聚合酶只单一负责T7 启动子,能够高效转录T7 启动子下游基因[7]。有研究表明,将T7 RNA 聚合酶编码基因整合到谷氨酸棒杆菌染色体DNA 上构建工程宿主菌,并通过构建表达载体形成表达系统,证明了T7 转录系统在谷氨酸棒杆菌中的可用性[13-14]。与上述表达系统相比,本研究构建的C.glutamicum/pAU29KS 表达系统,将T7转录系统的2 个组分,即T7 RNA 聚合酶编码基因和T7 启动子共同构建在同一表达载体上来高效表达目的基因,据目前所知尚属首次报道。其优势在于,表达载体pAU29KS 可以使用具有不同天然特性或经遗传改造的谷氨酸棒杆菌作为宿主菌株,拓宽了C.glutamicum/pAU29KS表达系统的宿主使用范围,更加方便其应用于特定条件下的蛋白生产。
使用双启动子来控制基因转录,已经被证明是增加异源蛋白产量的1 种有效方式[15]。在真核生物中,可将同一目的基因插入表达载体上相互分离的2 个强启动子下形成双启动子系统来进行高效转录,而由于细菌同源重组系统活性强,其双启动子转录系统都是将目的基因插入到2 个串联启动子下[16]。在前期研究中,通过对在大肠杆菌中使用的tac 启动子进行理性设计而获得的1 个谷氨酸棒杆菌强启动子tac-M,并且应用于谷氨酸棒杆菌表达载体的构建[17-18]。本研究中,除了使用T7 启动子外,表达载体pAU29KS 还使用了tac-M 启动子来共同转录目的基因。与已知的双启动子使用报道中的每一个启动子都是通过与宿主菌自身RNA 聚合酶互作来控制基因的转录不同[17],本研究使用的双启动子分别属于2 个不同的转录系统,即T7 转录系统和谷氨酸棒杆菌自身转录系统,tac-M 启动子的使用是进一步增加目的基因转录产物的有效方式。一般而言,大多数蛋白都只能通过Sec 或Tat 1 种途径进行活性分泌[19],因此,在构建Sec 分泌型表达载体pAU29KS 的同时,也构建了使用Tat 型强信号肽cgl_0904 的表达载体pAU30KT,二者不同之处仅在于使用了不同的信号肽序列。试验证明C.glutamicum/pAU30KT 也是1 个高效谷氨酸棒杆菌重组蛋白分泌型表达系统,其可用于依赖Tat 途径进行活性分泌的重组蛋白的高效分泌生产。
