狗尾草转酮醇酶抑制剂筛选方法的构建与应用
2023-08-17栗猛超杨冬臣王彦恩张金林
郑 宇,王 帅,栗猛超,杨冬臣,王彦恩,张金林
(1.河北农业大学 植物保护学院,河北 保定 071000;2.河北农业大学 理学院,河北 保定 071000)
杂草与农作物争抢水份、营养、光和空气,严重损害粮食作物的生产和品质,给农作物生产带来重大损失。除草剂的应用解决了这一难题,为农业生产提供了保障。然而随着除草剂的不合理使用,杂草的除草剂抗性问题随之而来,现已有百余种抗性杂草被报道[1-2],抗性产生的原因则分为氨基酸突变、蛋白表达量增大、促进代谢作用等多种抗性机理[3-7]。新型高效、环境友好农药的开发需求越发迫切[8-11]。
转酮醇酶是1 种潜在的除草剂靶标,广泛存在于各种动物、植物、微生物之中,此蛋白对植物生长发育起着重要调控作用[12-14]。本课题组以转酮醇酶为靶标进行了较为深入的研究。本实验室前期从黄顶菊中分离出一种作用于转酮醇酶靶标的除草活性物质α-三联噻吩[15],并通过双向电泳技术和处理缺陷型拟南芥突变体检测对α-三联噻吩的敏感性证实了拟南芥AT3G60750 蛋白为其作用靶点,并通过虚拟筛选的方法,以转酮醇酶为药剂靶点,对化合物数据库进行过筛,再配合活性测定进行验证,筛选出了1 个具有除草活性的新化合物。以这种化合物为基础,拓展合成出了一系列新型除草剂,得到了除草效果更佳的转酮醇酶抑制剂,为新农药的发现奠定了基础[16-19]。但是,目前以转酮醇酶为靶标的除草活性分子的研究报道还很少,因此,以该酶为靶标开发新型除草剂具有很好的创新性[20-21]。
本研究以狗尾草为试验材料,扩增获得其转酮醇酶基因并进行原核表达,对Yi D 等[22]离体转酮醇酶蛋白的酶活检测方法进行改进,通过药剂与蛋白互作试验及其验证试验,构建1 种快速大量筛选转酮醇酶特异性抑制剂的方法,以期为开发新型除草剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试植株及菌株 狗尾草(Setaria viridis)、大肠杆菌DH5α 感受态、大肠杆菌Rosetta(DE3)感受态细胞、pET28a 原核表达载体由河北农业大学植物保护学院农药系提供。
1.1.2 供试试剂 植物RNA 快速提取试剂盒购自北京博迈德基因技术有限公司;DNA 分子量标准与蛋白分子量标准购自索莱宝科技有限公司;引物合成及基因测序由生物工程(上海)有限公司完成;转酮醇酶辅因子的竞争性抑制剂对羟基苯丙酮酸(HPP)和阴性对照药吡唑醚菌酯购自上海源叶生物科技有限公司;医药领域的转酮醇酶抑制剂隐丹参酮购自上海笛柏生物科技有限公司;本试验合成衍生化合物合40 种。
1.2 狗尾草转酮醇酶的原核表达
1.2.1 狗尾草的培育 先把自来水和营养土混匀,121 ℃灭菌30 min,待土放凉至室温,装至直径10 cm花盆中3/5 处,选取健康、饱满的狗尾草种子,每个花盆植入10 粒,覆土2 cm 左右,加水调节湿度,于人工气候室培养,保证室内温度为26 ℃,光照适宜,适时补水,保持湿度超过50%最适宜种子萌发。
1.2.2 狗尾草转酮醇酶基因的提取 采用液氮研磨法获取狗尾草叶片裂解液上清后,依据生工植物总RNA 快速提取试剂盒进行狗尾草RNA 的提取。按照康为世纪反转录试剂盒并结合实验略作调整进行cDNA 第一条链的合成。
1.2.3 狗尾草转酮醇酶基因的克隆 PCR 基因扩增:根据转酮醇酶蛋白CDS 基因序列以及pET28a 的多克隆位点,利用DNAMAN 软件设计出转酮醇酶蛋白的特异引物PrimerF-Ned I 和PrimerR-Bam H I,以狗尾草的cDNA 为模板进行扩增,结束之后即可得到转酮醇酶蛋白的CDS 基因序列。
1.2.4 狗尾草转酮醇酶表达载体的构建 将扩增得到的转酮醇酶基因片段和pET28a 载体片段进行双酶切(NdeI,BamH I)并连接,连接产物,采用热激法将其转入E.coliDH5a 感受态细胞中,将转化后的感受态细胞加入500 μL LB 培养基,然后220 r/min,37 ℃,活化1 h,摇菌期间提前将LB 平板(含有50 μg/mL 的卡那霉素)配置好放凉,将100 μL 活化后的菌液涂布到含卡那霉素的LB 平板上,37 ℃倒置培养16 h 左右。培养完成后,从中挑取阳性单克隆,进行菌落PCR 验证后提取质粒。命名重组质粒为pET28a-TKL。
1.2.5 转酮醇酶的原核表达与纯化 将转入重组载体pET28a-TKL 的大肠杆菌Rosetta 在37 ℃,220 r/min条件下培养至OD600≈0.6;在培养基中分别加入IPTG 0.1 ~0.6 mmol/L 进行最佳诱导条件筛选,经过低温16 ℃诱导16 h 后进行菌体的富集与破碎从而获得粗蛋白液;粗蛋白液通过镍柱纯化,使用含有不同浓度咪唑的缓冲液进行洗脱,配合SDSPAGE 凝胶电泳技术,确定蛋白最佳洗脱浓度,并得到目的蛋白纯化液。
1.2.6 转酮醇酶纯化液的酶活试验前处理 取蛋白纯化液进行超滤,通过不断加入三乙醇胺缓冲液,除去咪唑,并同时将蛋白液的溶剂由洗脱液更换为三乙醇胺缓冲液。可用酚红指示剂检测蛋白浓缩液pH 情况,由此判断咪唑是否去除完毕。完成脱盐和溶剂更换后,根据所需蛋白浓度对超滤浓缩液进行稀释即可用于酶活检测。
1.3 狗尾草转酮醇酶与药剂的分子互作研究
1.3.1 酶活检测方法的构建 参考Yi D 等[22]的转酮醇酶酶活检测方法进行优化,基于pH 值进行酶活检测。转酮醇酶酶活测定体系(200 μL)为:适量转酮醇酶、D-甘油醛200 mmol/L、TPP 2.4 mmol/L、MgCl29.0 mmol/L、三 羟 基 乙 醇 胺2.0 mmol/L(pH=7.5)和酚红0.028 mmol/L,振荡混匀。最后加入β-羟基丙酮酸锂50 mmol/L,在30 ℃条件下启动反应,且在10 s 内使用酶标仪测定560 nm 处吸光值,利用酶标仪每隔10 s 读1 次,检测HCO3–随时间变化导致的吸光度变化,以此表征酶活的强弱。HCO3–标准曲线的制作是通过滴定不同浓度NaHCO3(0 ~0.8 mmol/L)完成的。
为了定量解释吸光度与产物HCO3–浓度之间的关系,将随时间变化的吸光度数据代入HCO3–校准曲线,转换为HCO3–的绝对浓度。根据下方公式(1),利用合成曲线的斜率来计算TKL 的比酶活。1 U 被定义为在分析条件下,每分钟产生1 mmol HCO3–所需的转酮醇酶的量。
1.3.2 转酮醇酶筛选药剂体系的构建 将上述酶活检测方法应用于以转酮醇酶为靶标的特异性药剂的筛选,首先将纯化蛋白与上述供试药剂(药剂终浓度2 mg/L,溶剂为丙酮)在30 ℃孵育15 min,然后再将不同处理的蛋白进行酶活检测,设空白对照与溶剂对照,每个处理重复3 次。
将不同药剂处理后的蛋白进行酶活测定,根据80 s 时的△OD560值数据,计算HC浓度,与空白对照作对比,计算酶活抑制率。药剂处理后的比酶活(U/mg)=药剂处理后80 s 时的HC浓度/空白对照80 s 时HC浓度×空白对照的比酶活。
比酶活抑制率=(空白对照比酶活-药剂处理的比酶活)/空白对照的比酶活×100%。
本试验以丙酮为溶剂,设置转酮醇酶底物的竞争性抑制剂对羟基苯丙酮酸(HPP)为阳性对照药剂,医学领域针对人类转酮醇酶的抑制剂隐丹参酮为阴性对照药,另外增加广谱除草剂烟嘧磺隆、广谱杀菌剂吡唑醚菌酯为阴性对照药,用以验证本方法是否具有良好的特异性。
1.3.3 筛选出的药剂的反向验证 利用实时荧光定量PCR 技术分析药剂对狗尾草转酮醇酶转录水平表达量的影响,将筛选出的抑制效果良好化合物对狗尾草叶片进行茎叶喷雾处理(终浓度为200 mg/L,溶剂为丙酮),6 h 后剪取叶片提总RNA,经反转录得到cDNA 后,进行荧光定量PCR 分析,反应条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火30 s,共40 个循环。每个模板3 次重复,试验重复3 次。其目的基因为狗尾TKL,内参基因为Actin,并利用2-ΔΔCt公式计算方法来进行结果分析。所用引物如表1 所示。
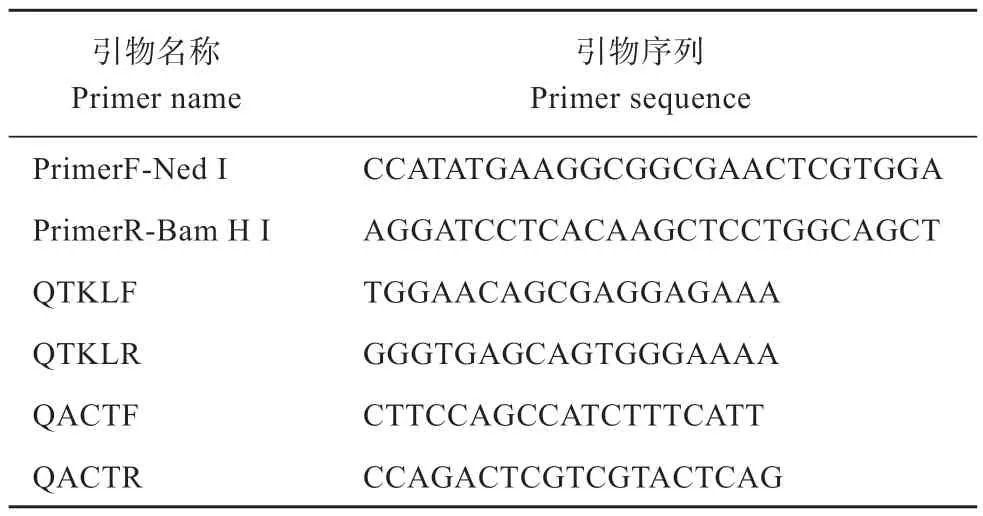
表1 本研究中所用引物序列Table 1 Primer sequences used in this study
2 结果与分析
2.1 狗尾草转酮醇酶的原核表达
以狗尾草cDNA 为模板,利用PCR 扩增转酮醇酶基因,得到转酮醇酶完整基因片段。使用限制性内切酶NedI 和BamH I 对转酮醇酶基因片段和表达载体pET28a 进行双酶切,经T4 连接酶连接重组,转化到DH5α 感受态后挑选阳性克隆,菌液PCR验证如图1a 所示。pET28a-TKL 质粒送测序结果显示序列无误。

图1 转酮醇酶蛋白的原核表达Fig.1 Prokaryotic expression gel map of Transketolase protein
将pET28a-TKL 质粒转化Rosetta 感受态,并将构建好的表达菌株在37 ℃下培养,经诱导条件筛选,确定在OD600≈0.6 时加入终浓度为0.1 mmol/L 的IPTG,低温16 ℃诱导16 h 为最佳诱导条件,然后进行纯化,用分别含有50、100、300 和500 mmol/L咪唑的Tris-HCL 洗脱液进行洗脱,SDS-PAGE 电泳检测如图1b 所示,得到与预期相符的目的蛋白,大小约为86 kD。
2.2 酶活测定体系的构建及药剂对酶活的影响
通过滴定试验结果数据,绘制NaHCO3测定标准曲线如图2a 所示,NaHCO3标准曲线表达式为y=0.108 49x-0.000 32,R2=0.998 04。原核表达的野生型转酮醇酶蛋白在酶活测定体系中吸光度差值随时间变化如下图2b 所示。将吸光度差值数据代入HCO3–校准曲线公式,得到转酮醇酶蛋白酶活标准曲线如图2c 所示,得到转酮醇酶的酶活标准曲线为y=0.003 50x-0.018 34,R2=0.959 59。由转酮醇酶的酶活标准曲线的斜率计算得到转酮醇酶的比活力为:1.4 U/mg,与Yi D 等人的研究中同样以D-甘油醛为受体底物时转酮醇酶的酶活力处于同一水平[22],说明本试验中转酮醇酶活性良好,可用于转酮醇酶抑制剂筛选。

图2 酶活体系构建各数据曲线Fig.2 Construction of various data curves for enzyme activity system
2.3 药剂对酶活的影响
将蛋白与药剂孵育处理后测定酶活力,并计算各处理组的酶活抑制率,结果如表2 所示。
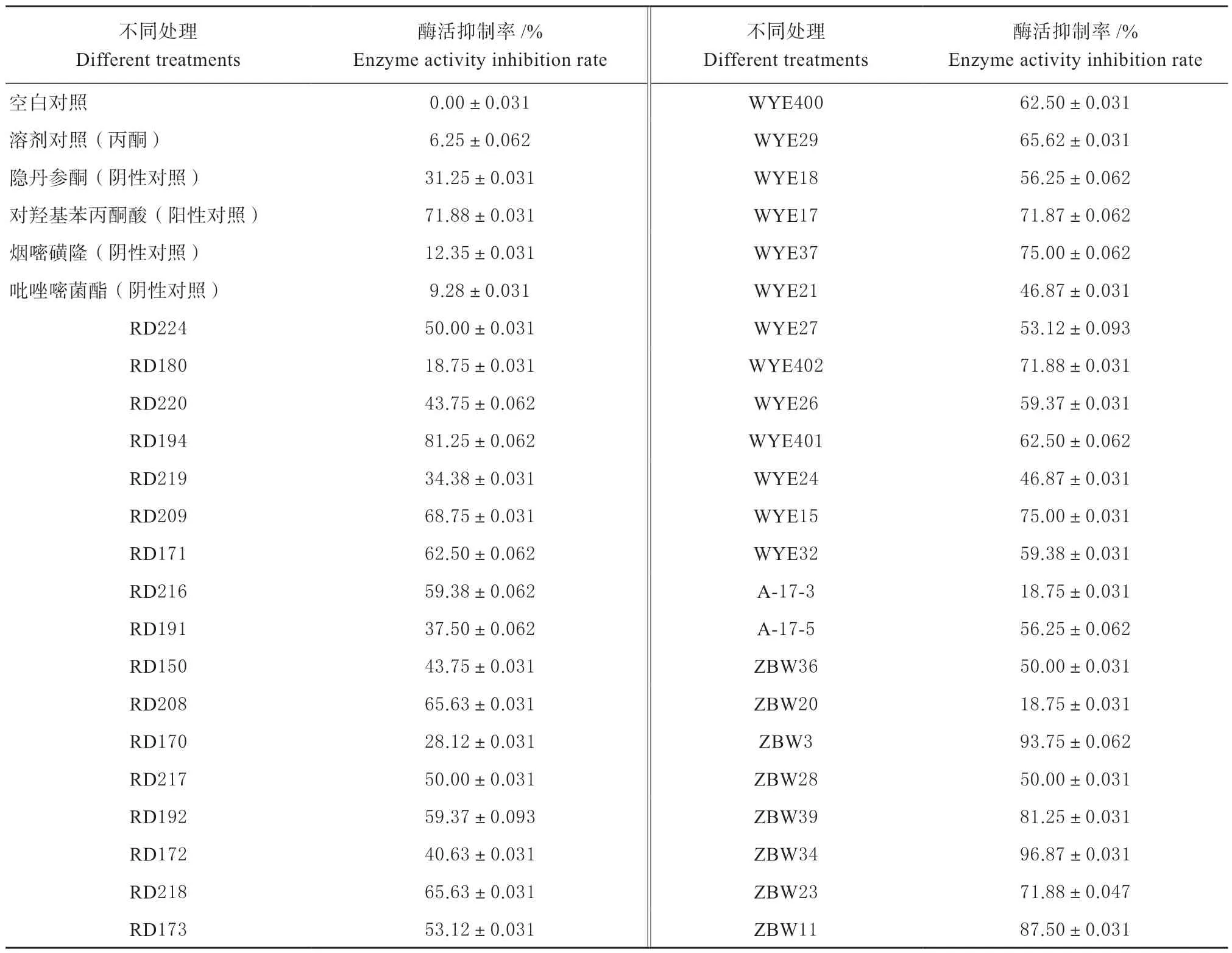
表2 药剂处理对蛋白酶活抑制作用Table 2 Results of protease activity after chemical treatment
由表中数据可知,在这46 种不同处理中,阴性对照药对转酮醇酶的酶活抑制效果普遍较差,与预期相符;酶活抑制率高于阳性药剂对羟基苯丙酮酸(HPP)的化合物RD194、WYE37、WYE15、ZBW3、ZBW39、ZBW34、ZBW11 均为本实验前期合成的转酮醇酶特异性抑制剂,且在P=0.05 水平上差异显著;从中选取酶活抑制效果较高的5 种化 合 物:RD194(81.25%),ZBW3(93.75%),ZBW39(81.25%),ZBW34(96.88%),ZBW11(87.50%)来进行后续试验。
2.4 筛选药剂的验证试验
将上述筛选所得的5 种药剂处理狗尾叶片,6 h后提取RNA,再经反转录试剂盒用其合成cDNA,然后通过转酮醇酶荧光定量引物和内参基因荧光定量引物进行定量扩增及分析,之后用2-ΔΔCt公式法进行分析,得到基因相对表达量如图3 所示。

图3 不同药剂处理后转酮醇酶基因相对表达量Fig.3 Schematic diagram of relative expression of Transketolase gene after treatment with different chemicals
由图3 中相对表达量水平可知,与清水对照(CK)相比,5 种化合物处理组及阳性对照药剂HPP 处理组均促使狗尾草转酮醇酶转录水平有所上调,其中化合物ZBW3、ZBW39、ZBW34 和ZBW11 相对于清水对照(CK)在P=0.05 水平上差异显著。
3 结论与讨论
通过酶活试验筛选出的RD194(81.25%),ZBW3(93.75%),ZBW39(81.25%),ZBW34(96.88%),ZBW11(87.50%)这5 种化合物,对狗尾草转酮醇酶的酶活力有显著的抑制作用,这可能是因为这些化合物具有较多的苯环,能在蛋白催化中心与关键氨基酸产生更多的π-π 相互作用[25],由于这些化合物是相对于转酮醇酶天然底物的竞争性抑制剂,会干扰转酮醇酶发挥生理功能,使植物体内卡尔文循环受阻,植物因生理代谢过程被破坏而死亡,起到除草的作用。
由荧光定量试验得出的相对表达量数据可知,5 种化合物均导致狗尾草转酮醇酶的转录水平有所上调。本实验室前期研究已发现转酮醇酶基因表达和蛋白表达存在这一特点,当药剂作用于转酮醇酶活性空腔抑制其酶活后,基因表达量会呈现上调,分析其原因为转酮醇酶活性被抑制,植物正常生理功能被抑制,植物为恢复其正常生理代谢水平,于是上调其转录水平。本试验结果与本实验室前期的研究相符合。对羟基苯丙酮酸和RD194 对狗尾草酮醇酶表达量的影响较弱可能是因为该药剂对植物叶片的渗透性较差,导致能够到达蛋白靶标处进行结合的药剂量过低[26],因而未表现出应有的效果。考虑后续可对化合物RD194 进行剂型优化,以免药剂漏筛。
本研究采用pH-based 法对狗尾草转酮醇酶进行酶活力测定,评价不同药剂处理下酶活抑制率,并通过荧光定量PCR 实验分析药剂对转酮醇酶转录水平的影响应证筛选结果,筛选得到ZBW3,ZBW39,ZBW34,ZBW11 这4 种良好的转酮醇酶抑制剂,成功构建了1 种快速筛选狗尾草转酮醇酶蛋白抑制剂的方法。
