通过遗传转化Rfo获得青花菜Ogura CMS恢复系
2023-08-15邢苗苗许园园卢昱宇严继勇曾爱松
邢苗苗,许园园,卢昱宇,严继勇,曾爱松
通过遗传转化获得青花菜Ogura CMS恢复系
邢苗苗,许园园,卢昱宇,严继勇,曾爱松
江苏省农业科学院蔬菜研究所/江苏省高效园艺作物遗传改良重点实验室,南京 210014
【目的】将来自萝卜的胞质不育恢复基因导入到青花菜Ogura细胞质雄性不育(cytoplasmic male sterility,CMS)主栽商业品种‘耐寒优秀’(命名为SFB45)中,获得Ogura CMS恢复系,打破Ogura CMS材料在生产上无法再利用的现状,为优异种质的创制和改良提供新途径。【方法】利用基因合成的方法克隆萝卜的CDS及其启动子序列,构建表达载体::。通过农杆菌介导的遗传转化方法侵染SFB45的具柄子叶和下胚轴,进行再生、抗性苗筛选和PCR鉴定获得阳性植株,开花期观察转基因植株的育性恢复情况;用亚历山大染液分析对照组及阳性株的花粉活力;分别提取对照组及阳性株<3 mm和>3 mm花蕾的RNA并反转录成单链cDNA,设计特异引物,利用RT-PCR分析及绒毡层和花粉壁发育相关基因在SFB45及对应的育性恢复材料花蕾中的表达差异。【结果】通过遗传转化共获得10个阳性株系,其中8个株系育性得到不同程度的恢复,花粉活力为84.2%—90.4%。RT-PCR分析结果表明,育性恢复植株花蕾中表达,绒毡层发育关键调节因子和及花粉壁主要成分孢粉素合成所必需的基因在育性恢复植株<3 mm花蕾中上调表达。绒毡层降解相关基因、四分体胼胝质壁及花粉外壁发育所必需的基因和在育性恢复植株>3 mm花蕾中上调表达。分析阳性株系和自交及杂交后代发现转入的能稳定遗传,符合孟德尔遗传。【结论】通过遗传转化获得了优良青花菜Ogura CMS商品种SFB45的育性恢复系,且的转入使绒毡层及花粉壁发育相关基因恢复正常表达。
青花菜;遗传转化;Ogura CMS;;绒毡层和花粉壁发育相关基因
0 引言
【研究意义】青花菜(L. var.)又名西兰花,属于十字花科芸薹属甘蓝种中的一个变种,其营养成分含量高,富含蛋白质、矿物质、维生素C等,还含有3-甲基吲哚基硫苷和4-甲基硫氧丁基硫苷等抗癌、防癌活性物质,被誉为“蔬菜皇冠”[1-5]。近年来我国青花菜产业发展迅速,种植面积已超过8.7万公顷[6]。但是,我国青花菜种质资源匮乏,与国外进口品种相比,我国自主育成的品种在花球商品性、耐贮性和适应性等方面存在较大差距。目前,我国青花菜栽培面积中,国外进口品种约占85%,且均表现为Ogura类型的细胞质雄性不育(cytoplasmic male sterility,CMS)。由于CMS为母系遗传的不育类型,其优异性状无法被分离出来,阻碍了优异育种材料的创新。因此,恢复Ogura CMS材料的育性,打破其优良性状无法利用的壁垒,对于青花菜种质创新具有重要的意义和价值。【前人研究进展】青花菜起源于欧洲,在我国的栽培始于20世纪80年代,栽培时间短、育种起步晚、优异种质资源匮乏[7]。目前,市场上优良的青花菜多为进口品种,在抗逆性、广适性、花球商品性、耐贮性等方面具有明显的优势,但均为Ogura CMS不育类型,无法进行种质资源再利用[8],亟需创制Ogura CMS的育性恢复系。Ogura CMS不育源是Ogura在萝卜群体中发现的自然突变体[9],由于其线粒体重排产生的嵌合基因导致花药不能产生正常花粉而败育[10]。青花菜Ogura CMS不育系是研究者通过萝卜与甘蓝属间进行远缘杂交结合胚挽救以及原生质体非对称融合并结合多代回交转育等方法创制[11]。由于Ogura CMS系败育彻底、不育性稳定,成为目前青花菜杂交制种中应用最广泛的不育亲本。Ogura CMS类型的恢复系只存在于萝卜中,其育性恢复基因包含18个pentatricopeptide repeat基序[12-13]。直接或者间接与的mRNA结合,影响其转录后的稳定性,降低其蛋白含量,使育性恢复[14-15]。研究者已通过远缘杂交等手段将成功转入到了甘蓝型油菜中[16-17]。为了将导入甘蓝类蔬菜,于海龙[11]利用Ogura CMS芥蓝为母本与甘蓝型油菜(含)远缘杂交获得恢复单株,并通过连续回交得到形态与亲本芥蓝相近的恢复材料。黄静静等[18]利用Yu等[19]获得的远缘杂交材料,与Ogura CMS青花菜进行杂交、回交,获得了株型接近青花菜的恢复系。LI等[20]通过农杆菌介导的甘蓝转基因体系将Rfo转入了甘蓝Ogura CMS系CMS2016,获得了育性恢复转基因株系。【本研究切入点】通过远缘杂交手段创制Ogura CMS恢复系的策略存在耗时长、供体基因背景难以消除、传递率低等问题[21]。而通过转基因手段将转入甘蓝能快速、稳定地获得Ogura CMS育性恢复系[20]。但目前并未有报道通过转基因手段直接将转入青花菜Ogura CMS材料,以快速获得青花菜Ogura CMS的恢复系。【拟解决的关键问题】本研究通过农杆菌介导的青花菜遗传转化方法将整合至主栽优良青花菜CMS品种SFB45基因组中,并以此为父本创制优异种质资源。
1 材料与方法
1.1 植物材料及栽培条件
青花菜商品种‘耐寒优秀’(命名为SFB45)、‘米修斯’(命名为MXS)购自青岛官明天成种业有限公司(青岛,中国)。
表达载体由中国农业科学院蔬菜花卉研究所甘蓝青花菜课题组惠赠。
农杆菌介导的青花菜遗传转化试验于2020— 2021年在江苏省农业科学院蔬菜研究所进行,将野生型和鉴定为阳性的植株移栽至营养钵(10 cm×10 cm),在光照培养室里生长(25℃,日照16 h/黑暗8 h),待根成团后于2021年10月底移栽至江苏省农业科学院六合试验基地大棚,越冬春化后,2022年4月开花。
1.2 pRfo::Rfo表达载体构建
在NCBI(National Center for Biotechnology Information)搜索并下载萝卜的启动子2 000 bp及CDS序列2 064 bp(NCBI序列号为AJ550021),利用基因合成的方法合成其序列,并连接到PUC57中间载体上,设计带酶切位点(I和B I)的引物,以PUC57载体质粒为模板进行扩增,经B I酶切后,启动子与CDS序列进行连接,通过I酶切位点将载体pBWA (V) BS的目的区域切开,启动子及CDS序列构建至载体pBWA(V)BS上,获得表达载体::。利用热激法将构建好的载体转入农杆菌GV3101中,挑取10个单菌落进行PCR鉴定和一代测序,利用LB液体培养基(含50 mg∙L-1利福平及100 mg∙L-1卡那霉素)保存::序列正确的农杆菌。所有方法步骤均参照试剂盒说明书进行。
1.3 农杆菌介导的遗传转化
农杆菌介导的遗传转化方法及培养基配方(表1)参照崔慧琳[22]的方法并稍作改变。具体步骤如下:
(1)种子消毒:将200—300粒种子放在干净的50 mL离心管中,75%酒精消毒2 min、7%—10%次氯酸钠消毒10 min,灭菌的ddH2O清洗3次(3—5 min/次),将种子放在灭菌的滤纸上吸掉表面水分;
(2)播种:用灭菌后的镊子将种子移到MS培养基里,在培养室中培养4—6 d,培养条件为16 h光照/8 h黑暗,25 ℃;
(3)外植体预培养:灭菌后用手术刀或者手术剪刀将具柄子叶及下胚轴切下(下胚轴长度约为1 cm),并及时将外植体放在预培养基上,正常培养2 d;
(4)农杆菌液制备:取4 ℃保存的带目的载体的农杆菌菌液加入LB液体培养基(含50 mg∙L-1利福平及100 mg∙L-1卡那霉素),在28 ℃摇床上培养10—14 h,至OD600为0.4—0.6,6 000 r/min离心8 min,弃上清,用MS液体培养基重悬清洗一次,再次离心(6 000 r/min,8 min),用等量的MS溶液重悬备用;
(5)侵染:提前在培养皿中放入15 mL的MS溶液,随后将外植体放入培养皿中,再加入15 mL MS重悬的菌液;轻轻晃动10 min;
(6)共培养:倒掉菌液,将外植体在滤纸上晾干,在共培养培养基中黑暗培养36—48 h;
(7)延迟培养:将共培养培养基上的外植体转入延迟培养基上培养4—7 d;
(8)选择培养:将外植体转入选择培养基上培养,每14 d更换一次培养基,筛选2—3次;
(9)抗性芽培养:将外植体上长出的抗性芽切下来放入长苗培养基中,培养条件同步骤(2);
(10)生根培养:将PCR鉴定为阳性的植株转入生根培养基中,培养20 d。
1.4 转基因株系的鉴定及绒毡层、花粉壁相关基因的表达
利用改良的CTAB法提取抗性植株的DNA,使用标记(-F/R)进行PCR扩增,检测转基因阳性株系。利用朱琴等[23]开发的Ogura CMS相关的标记Bo138-FR确认转基因株系为Ogura CMS不育。20 μL PCR反应体系包含PCR mix 10 μL,10 µmol∙L-1上、下游引物各1 μL,Template 2 μL,ddH2O 6 μL。PCR mix为2×TSINGKE Master Mix(blue)(擎科生物,北京,中国)。PCR反应条件为预变性94 ℃,5 min;变性94 ℃,30 s;退火55 ℃,30 s;延伸72 ℃,1 min;35个循环;终延伸72 ℃,5 min。
使用RNeasy®Plant Mini Kit试剂盒(Qiagen,Hilde,Germany)提取对照及阳性植株花蕾的RNA,反转录为cDNA,操作步骤参照使用说明。以甘蓝(GenBank号:XM_013731369.1)为内参,利用qRT-PCR分析及绒毡层、花粉壁发育相关基因在对照及阳性植株花蕾中的表达情况(每个样本3次生物学重复)。使用的DNA Marker为DL2000 DNA marker(擎科生物,北京,中国),货号:TSJ011-100。相关引物(表2)利用Primer 3.0(http://bioinfo.ut.ee/ primer3-0.4.0/)在线设计。
1.5 花粉活力检测
利用亚历山大染色液(Leagene,北京佰凯生物科技有限公司)对育性恢复植株的花粉进行活力检测,方法参考说明书:在开花盛期取新开的5朵花,将花粉弹至载玻片上,用200 μL的枪滴加8滴染色液,盖上盖玻片进行染色,30 min后在显微镜(OLYMPUS BX41,日本)下观察。
2 结果
2.1 pRfo::Rfo载体构建
经I酶切后,载体上的毒性基因被切除,然后与经I和B I酶切后的启动子和CDS片段进行连接,形成::表达载体。空载体和构建好的载体见图1。
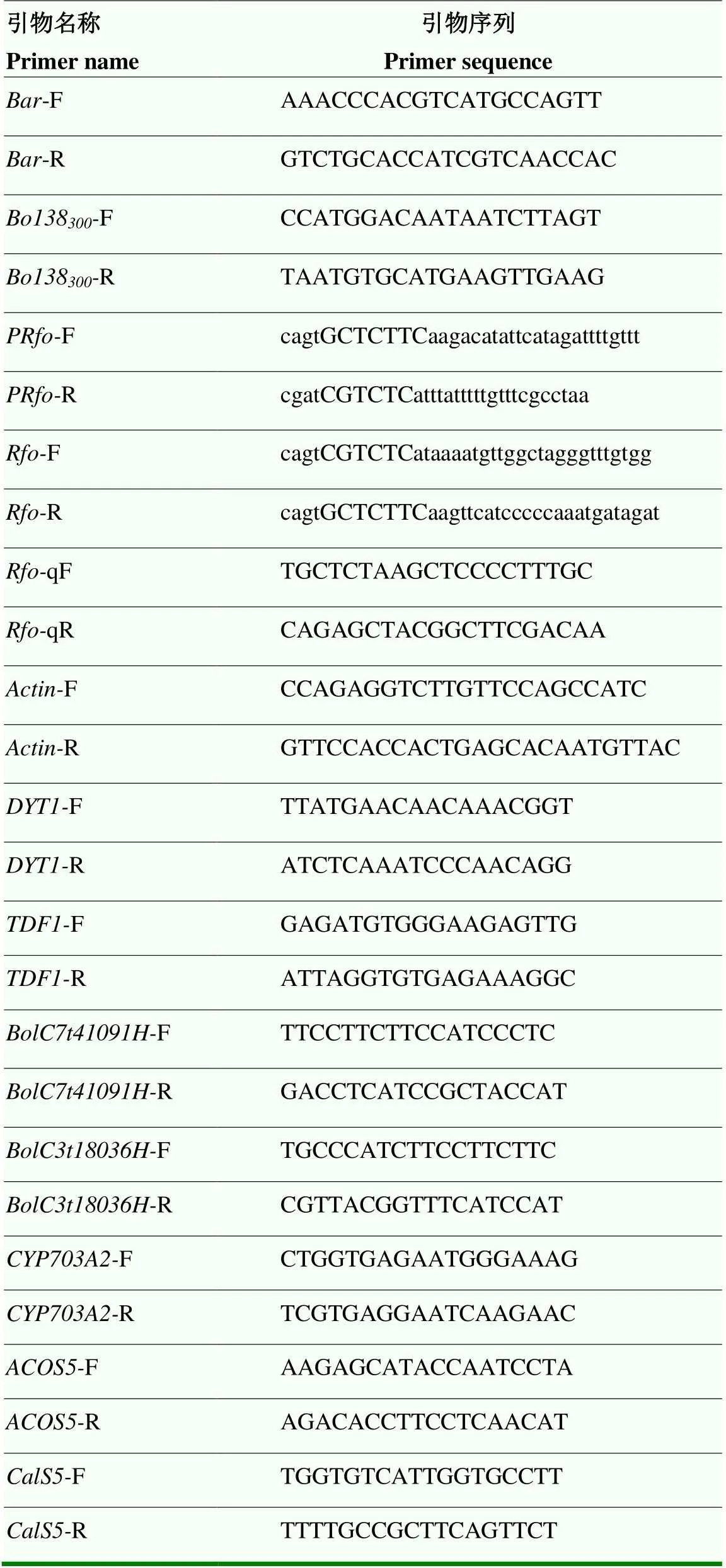
表2 本研究所使用的引物
2.2 Rfo转基因阳性株系的获得及鉴定
将构建的表达载体::转入青花菜SFB45的下胚轴及具柄子叶,通过再生、筛选后获得了抗性植株(图2)。提取抗性植株的DNA,扩增抗除草剂标记基因及胞质不育基因片段,鉴定出10个阳性植株,及扩增片段大小分别为300和428 bp,表明恢复基因已整合至Ogura CMS青花菜SFB45的基因组中(图3)。
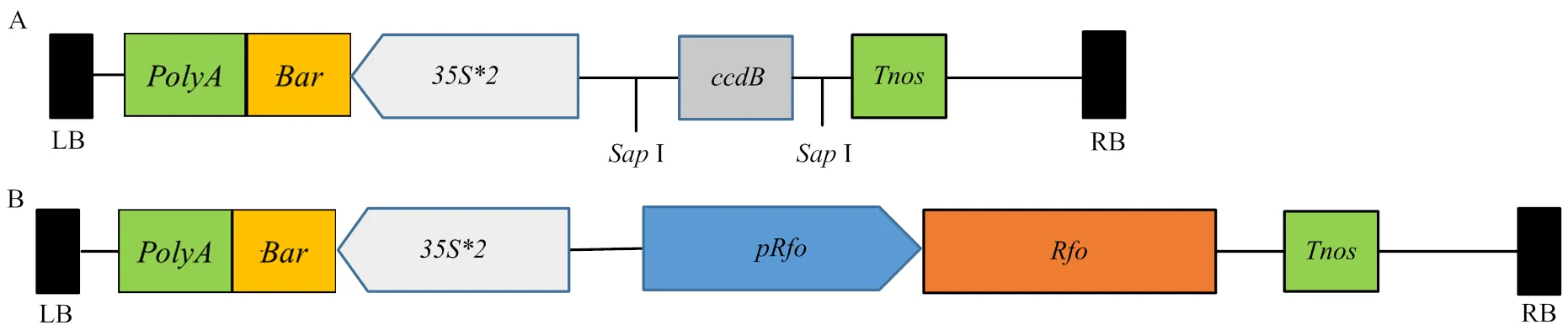
A:pBWA (V) BS空载体表达元件TDNA的结构示意图;B:表达载体pRfo::Rfo的TDNA表达元件结构示意图

A:MS培养基播种;B:具柄子叶和下胚轴预培养;C:抗性芽筛选培养;D:抗性苗筛选培养;E:阳性植株;F:阳性植株开花期
2.3 阳性植株表型及花粉活力鉴定
盛花期观察发现10个转基因株系中有8个育性得到恢复,另外2个仍为完全不育。相比Ogura CMS植株,育性恢复植株的花丝花药显著伸长(图3)。8个恢复系的育性恢复程度不同,其中有2个株系(编号-1、-2)育性得到了完全恢复。其他6个植株仅部分花朵的部分雄蕊产生花粉。根据雄蕊的育性恢复情况,可分为5种类型:(1)6个雄蕊均有花粉;(2)4个雄蕊有花粉;(3)3个雄蕊有花粉;(4)2个雄蕊有花粉;(5)无花粉(图4)。
利用亚历山大染液对代表不同育性恢复程度的植株(-1、-3、-6、-8)的花粉进行染色,有活力的花粉粒饱满,颜色染为红色;无活力的花粉粒畸形、颜色浅或者为白色(图5),花粉活力平均值分别为90.4%(-1)、86.7%(-3)、87.5%(-6)、84.2%(-8)。
2.4 阳性植株花蕾中Rfo及绒毡层花粉壁相关基因的表达
分析在转基因育性恢复材料-1中<3 mm和>3 mm花蕾的表达发现,在>3 mm花蕾中的表达明显升高,是在<3 mm花蕾中表达水平的11.26倍(图6)。由于Ogura CMS胞质不育是由绒毡层异常、花粉壁不能正常形成所导致,本研究选取一些调控绒毡层发育、凋亡及花粉壁形成的关键基因[24],利用荧光定量PCR分析其在不育对照材料SFB45和-1中的表达情况(图6)。绒毡层发育关键调节因子()和()在不育对照材料SFB45花蕾(<3 mm)中表达极低,而在转基因育性恢复材料花蕾(<3 mm)中表达水平升高了近10倍。()同源基因在水稻中突变表现为绒毡层延迟降解,该表型与Ogura CMS胞质不育败育特征类似[25]。这两个AMS基因在-1花蕾(>3 mm)中表达明显升高,与不育材料SFB45相比,分别升高了近20倍和40倍。花粉外壁的主要成分孢粉素合成所必需的基因()[26]和()[27]在-1花蕾(<3 mm)和(>3 mm)中的表达水平均明显升高。四分体胼胝质壁及花粉外壁发育所必需的基因()[28]在-1花蕾(>3 mm)中比SFB45的表达水平约升高了53倍。表明的转入使绒毡层及花粉壁发育相关的基因得以正常表达。
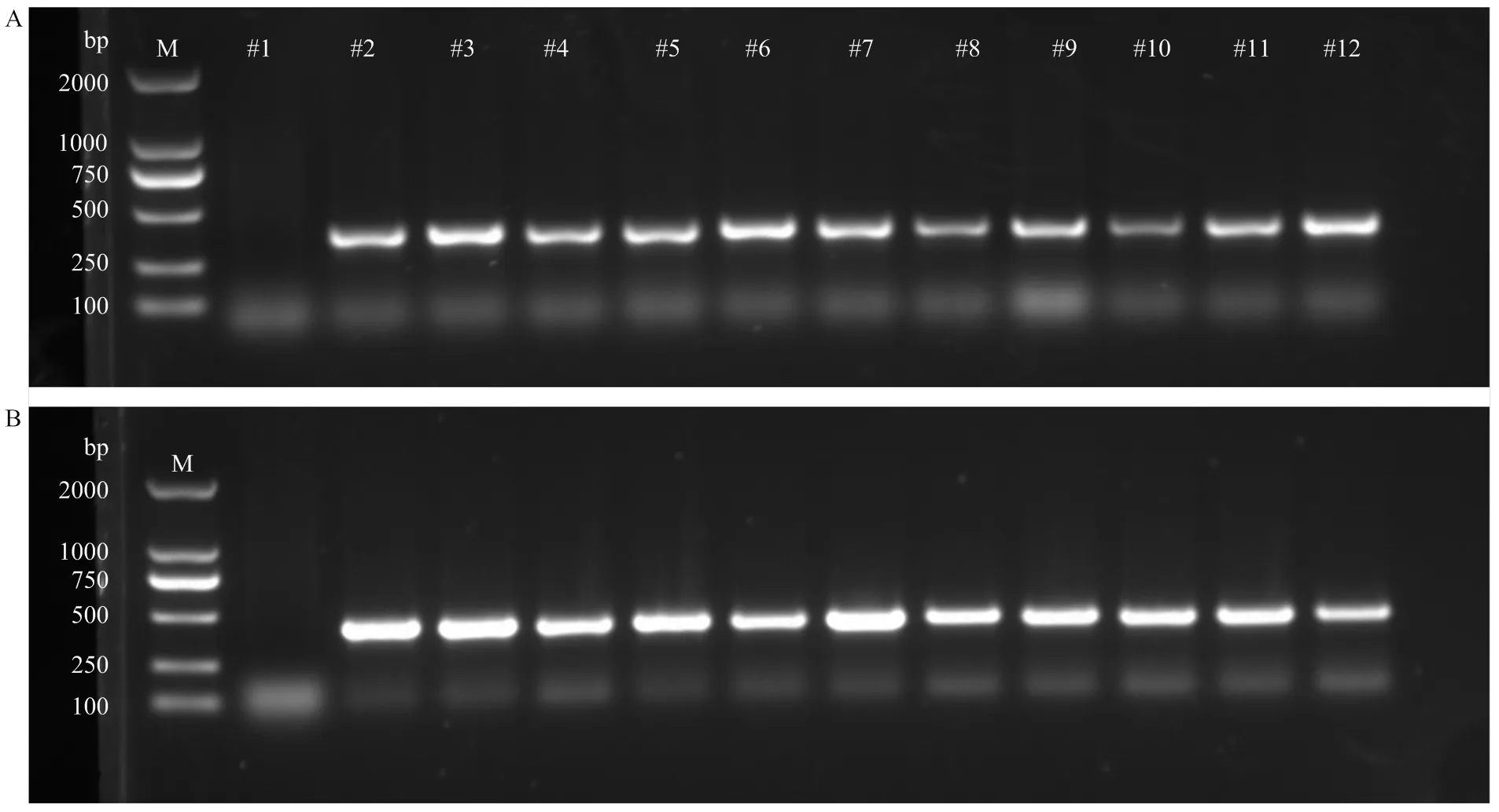
A:Ogura CMS orf138标记检测。泳道#1为阴性对照,模板为甘蓝转基因植株e-10(含Bar);泳道#2为阳性对照,模板为SFB45。B:除草剂抗性基因Bar标记检测。泳道#1为阴性对照,模板为SFB45;泳道#2为阳性对照,模板为e-10。A和B中#3—#12泳道为阳性植株(R-1—R-10)

图中比例尺为50 μm Scale bar is 50 μm

图中R-1s和R-1L分别代表恢复系R-1的<3 mm及>3 mm花蕾;45s和45L分别代表Ogura CMS SFB45的<3 mm及>3 mm花蕾
2.5 阳性植株自交及杂交后代分析
利用标记对阳性植株自交及杂交后代进行鉴定,统计阳性植株及检测总数。经卡方检验,结果表明χ2均小于3.84,说明育性恢复材料-1、-3和-6的自交后代中含标记的植株与不含标记的植株符合3﹕1分离比;以-3为父本与青花菜Ogura CMS商品种MXS的杂交后代中含标记的植株与不含标记的植株符合1﹕1分离比(表3)。结果表明整合进-1、-3和-6基因组的在其T1后代中的分离符合孟德尔遗传,能够稳定遗传。
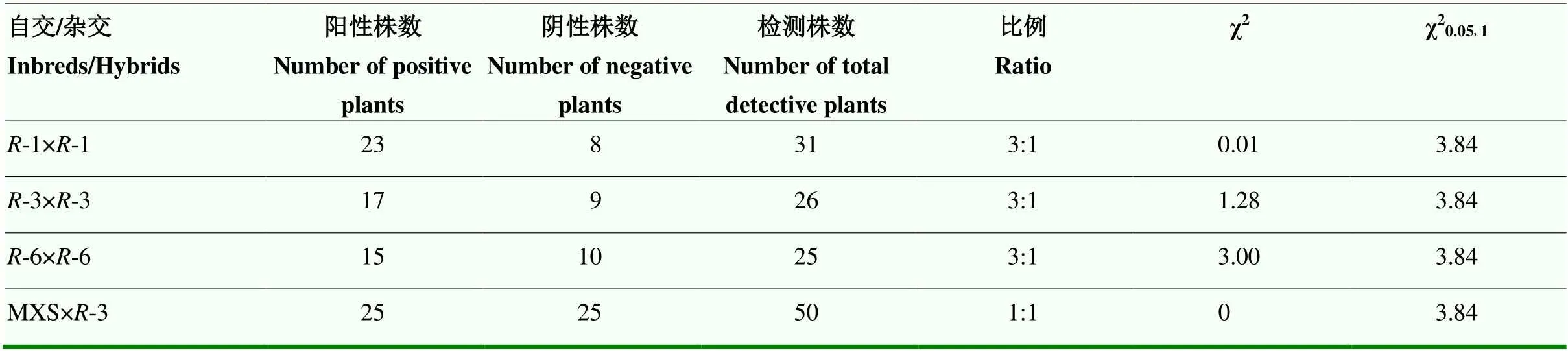
表3 R-1、R-3和R-6转基因株系后代阳性植株遗传分离统计
3 讨论
3.1 不同阳性株系育性恢复程度存在差异
转基因植株中外源基因随机插入其基因组内,插入的拷贝数和插入位点会影响基因的表达。所有植物转基因都存在不同株系中基因差异表达或沉默等导致的表型差异现象[29]。崔慧琳[22]将控制白花的基因转入甘蓝植株中,不同阳性株系中该基因表达量及花色变白的程度不同。Qin等[13]研究Ogura CMS甘蓝型油菜转基因株系发现不同转基因株系产生有活力花粉的量与转入的拷贝数以及Ogura CMS相关蛋白ORF138水平的降低有关,产生大量有活力花粉的转基因株系中存在2—3个拷贝而花粉活力低的株系中仅存在1个拷贝。但针对拷贝数不同的研究有不同的结论。转基因株系中基因表达量及达到预期表型的程度不仅与拷贝数多少有关,也与重复插入或T-DNA重排有关。研究表明表达水平和-葡萄糖醛酸酶活性在转入1个拷贝的烟草株系中比在同一位点插入2个反向、重复拷贝的株系中要高[30]。De Buck等[31]研究表明大多数单拷贝拟南芥转基因株系的基因表达量高,并且发现单拷贝转基因株系中基因表达与插入位置(如基因间区、基因内、内含子、外显子、正、反向插入等)关系不大。虽然单拷贝转基因株系表达量高,但也有研究表明会存在转录后或表观沉默现象,另外插入位点也会影响表达及表型[32-34]。由此可见,转基因株系中基因表达量及表型差异是一个非常复杂的转化问题。本研究中不同阳性植株育性恢复程度的差异可能与的拷贝数及其插入位点、是否重复插入、重排、转化过程中其他因素等有关。
3.2 Rfo的转入使绒毡层及花粉壁发育相关基因恢复正常表达
十字花科的模式植物拟南芥花药发育分为14个时期[35]。1—5时期是从花药原基分化出雄蕊原基开始至形成花粉母细胞;6—8时期包括花粉母细胞质膜和细胞壁之间形成胼胝质层,减数分裂完成形成四分体,绒毡层细胞开始降解,包围四分体的胼胝质壁和花粉母细胞壁降解,小孢子释放;9—14时期包括小孢子壁形成,小孢子经历两次有丝分裂,三核花粉粒形成,花药开裂,花粉释放[35]。康俊根[36]通过透射显微镜观察发现萝卜Ogura CMS的主要败育特征是从减数分裂后期开始(即花药发育的第6—8时期),绒毡层细胞进行性加厚而不降解,这一异常增生挤压被释放的小孢子致其败育,花粉粒细胞壁延迟形成。本研究中荧光定量分析结果与这一败育特征一致,即调控绒毡层发育及凋亡和调控花粉壁合成相关的基因在不育材料中均表达极低甚至不表达,而在育性恢复的转材料中表达明显升高。是如何调控这些下游基因的表达尚待进一步研究。前人的研究均关注到恢复材料中ORF138蛋白水平与育性恢复程度成反比,但并未详细研究的表达情况与育性恢复的关系,仅Brown等[37]分析了在萝卜恢复系材料的子叶、叶片、花中表达,而在根中不表达,而Qin等[13]的研究说明表达水平需要达到一定的阈值才能使育性恢复。本研究发现在育性恢复材料>3 mm的花蕾中的表达水平明显高于在<3 mm花蕾中的表达,表明相较于花药发育前期,后期发育可能需要更多的参与。调控Ogrua CMS育性恢复的机制尚待进一步研究。
4 结论
利用农杆菌介导的方法将萝卜Ogura CMS的育性恢复基因转入青花菜商业品种SFB45中,获得了8个育性恢复系,可稳定遗传,为青花菜种质改良提供了资源;的转入使绒毡层及花粉壁发育相关基因恢复正常表达,花粉育性得到恢复。
[1] 李占省, 刘玉梅, 韩风庆, 方智远, 张扬勇, 杨丽梅, 庄木, 吕红豪, 王勇, 季家磊. “十三五”我国青花菜遗传育种研究进展. 中国蔬菜, 2021(1): 33-40.
LI Z S, LIU Y M, HAN F Q, FANG Z Y, ZHANG Y Y, YANG L M, ZHUANG M, LÜ H H, WANG Y, JI J L. Research progress on broccoli genetic breeding during ‘The Thirteenth Five-Year Plan’ in China. China Vegetables, 2021(1): 33-40. (in Chinese)
[2] TALALAY P, FAHEY J W. Phytochemicals from cruciferous plants protect against cancer by modulating carcinogen metabolism. The Journal of Nutrition, 2001, 131(11): 3027S-3033S.
[3] WENG J R, TSAI C H, KULP S K, CHEN C S. Indole-3-carbinol as a chemopreventive and anti-cancer agent. Cancer Letters, 2008, 262(2): 153-163.
[4] RAMIREZ M C, SINGLETARY K. Regulation of estrogen receptorexpression in human breast cancer cells by sulforaphane. The Journal of Nutritional Biochemistry, 2009, 20(3): 195-201.
[5] 刘倩男, 黄伟, 丁云花, 王亚钦, 胡丽萍, 赵学志, 何洪巨, 刘光敏. 青花菜中硫代葡萄糖苷RAA和GBC的近红外光谱快速测定. 中国农业科学, 2020, 53(21): 4497-4506. doi: 10.3864/j.issn.0578-1752. 2020.21.017.
LIU Q N, HUANG W, DING Y H, WANG Y Q, HU L P, ZHAO X Z, HE H J, LIU G M. Rapid determination of RAA and GBC in broccoli by near infrared spectroscopy. Scientia Agricultura Sinica, 2020, 53(21): 4497-4506. doi: 10.3864/j.issn.0578-1752.2020.21.017. (in Chinese)
[6] 李占省, 戚如诗, 刘玉梅, 韩风庆. 我国青花菜生产布局、价格变化及趋势. 长江蔬菜, 2021(4): 1-5.
LI Z S, QI R S, LIU Y M, HAN F Q. Production layout, price change and trend of broccoli in China. Journal of Changjiang Vegetables, 2021(4): 1-5. (in Chinese)
[7] 李占省, 刘玉梅, 方智远, 杨丽梅, 庄木, 张扬勇, 吕红豪, 王勇. 我国青花菜产业发展现状、存在问题与应对策略. 中国蔬菜, 2019(4): 1-5.
LI Z S, LIU Y M, FANG Z Y, YANG L M, ZHUANG M, ZHANG Y Y, LÜ H H, WANG Y. Present situation, existing problems and countermeasures of broccoli industry in China. China Vegetables, 2019(4): 1-5. (in Chinese)
[8] SHU J S, LIU Y M, LI Z S, ZHANG L L, FANG Z Y, YANG L M, ZHUANG M, ZHANG Y Y, LÜ H H. Detection of the diversity of cytoplasmic male sterility sources in broccoli (var.) using mitochondrial markers. Frontiers in Plant Science, 2016, 7: 927.
[9] OGURA H. Studies on the new male-sterility in Japanese radish, with special reference to the utilization of this sterility towerds the practical raising of hybrid seeds. Memoirs of the Faculty of Agriculture Kagoshima University, 1968, 6: 39-78.
[10] GRELON M, BUDAR F, BONHOMME S, PELLETIER G. Ogura cytoplasmic male-sterility (CMS)-associated orf138 is translated into a mitochondrial membrane polypeptide in male-sterilecybrids. Molecular and General Genetics, 1994, 243(5): 540-547.
[11] 于海龙. 甘蓝类蔬菜Ogura CMS恢复材料的创制及其遗传构成分析[D]. 杨凌: 西北农林科技大学, 2018.
YU H L. Creation and genetic composition analysis of Ogura CMS restoration materials for cabbage vegetables [D]. Yangling: Northwest A & F University, 2018. (in Chinese)
[12] DESLOIRE S, GHERBI H, LALOUI W, MARHADOUR S, CLOUET V, CATTOLICO L, FALENTIN C, GIANCOLA S, RENARD M, BUDAR F, SMALL I, CABOCHE M, DELOURME R, BENDAHMANE A. Identification of the fertility restoration locus, Rfo, in radish, as a member of the pentatricopeptide-repeat protein family. EMBO Reports, 2003, 4(6): 588-594.
[13] QIN X K, WARGUCHUK R, ARNAL N, GABORIEAU L, MIREAU H, BROWN G G.functional analysis of a nuclear restorer PPR protein. BMC Plant Biology, 2014, 14(1): 313.
[14] BELLAOUI M, GRELON M, PELLETIER G, BUDAR F. The restorer Rfo gene acts post-translationally on the stability of theu00a0ORF138 Ogura CMS-associated protein in reproductive tissues of rapeseed cybrids. Plant Molecular Biology, 1999, 40(5): 893-902.
[15] UYTTEWAAL M, ARNAL N, QUADRADO M, MARTIN- CANADELL A, VRIELYNCK N, HIARD S, GHERBI H, BENDAHMANE A, BUDAR F, MIREAU H. Characterization ofpentatricopeptide repeat proteins encoded by the fertility restorer locus for Ogura cytoplasmic male sterility. The Plant Cell, 2008, 20(12): 3331-3345.
[16] PRIMARD-BRISSET C, POUPARD J P, HORVAIS R, EBER F, PELLETIER G, RENARD M, DELOURME R. A new recombined double low restorer line for the Ogu-INRA cms in rapeseed (L.). Theoretical and Applied Genetics, 2005, 111(4): 736-746.
[17] 陈卫江, 李莓, 王同华, 惠荣奎, 涂金星, 傅廷栋. 甘蓝型油菜萝卜细胞质雄性不育恢复材料的创制. 中国农业科学, 2012, 45(8): 1465-1474. doi: 10.3864/j.issn.0578-1752.2012.08.002.
CHEN W J, LI M, WANG T H, HUI R K, TU J X, FU T D. Creative process of a new restorer material with ogu CMS in. Scientia Agricultura Sinica, 2012, 45(8): 1465-1474. doi: 10.3864/j.issn.0578-1752.2012.08.002. (in Chinese)
[18] 黄静静, 刘伟, 刘玉梅, 韩风庆, 方智远, 杨丽梅, 庄木, 张扬勇, 吕红豪, 王勇, 季家磊, 李占省. Ogura CMS青花菜育性恢复材料创制及其遗传背景研究. 园艺学报, 2022, 49(3): 533-547.
HUANG J J, LIU W, LIU Y M, HAN F Q, FANG Z Y, YANG L M, ZHUANG M, ZHANG Y Y, LÜ H H, WANG Y, JI J L, LI Z S. Creation of fertility restorer materials for Ogura CMS broccoli and the study of its genetic background. Acta Horticulturae Sinica, 2022, 49(3): 533-547. (in Chinese)
[19] YU H L, FANG Z Y, LIU Y M, YANG L M, ZHUANG M, LÜ H H, LI Z S, HAN F Q, LIU X P, ZHANG Y Y. Development of a novel allele-specificmarker and creation of Ogura CMS fertility- restored interspecific hybrids in. Theoretical and Applied Genetics, 2016, 129(8): 1625-1637.
[20] LI Q F, XU B B, DU Y M, PENG A, REN X S, SI J, SONG H Y. Development of Ogura CMS restorers insubspecies via directRfogene transformation.Theoretical and Applied Genetics, 2021, 134(4): 1123-1132.
[21] 任文静, 于海龙, 陈立, 张斌, 陈文迪, 方智远, 杨丽梅, 庄木, 吕红豪, 王勇, 季家磊, 张扬勇. 甘蓝Ogura CMS育性恢复基因的传递效率解析及育种应用. 园艺学报, 2021, 48(11): 2197-2210.
REN W J, YU H L, CHEN L, ZHANG B, CHEN W D, FANG Z Y, YANG L M, ZHUANG M, LÜ H H, WANG Y, JI J L, ZHANG Y Y. High-throughput screening of transmission rate for Qgura CMS fertility restorer geneby HRM technique in cabbage. Acta Horticulturae Sinica, 2021, 48(11): 2197-2210. (in Chinese)
[22] 崔慧琳. 结球甘蓝YL-1遗传转化体系的建立及花色基因BolC.cpc-1的功能验证[D]. 合肥: 安徽农业大学, 2018.
CUI H L. Establishment of genetic transformation system of YL-1 in cabbage and functional verification of color gene BolC.cpc-1 [D]. Hefei: Anhui Agricultural University, 2018. (in Chinese)
[23] 朱琴, 康宗利, 简元才, 丁云花, 康俊根. 甘蓝细胞质雄性不育相关基因orf138的分子特性分析. 中国农学通报, 2012, 28(4): 104-109.
ZHU Q, KANG Z L, JIAN Y C, DING Y H, KANG J G. The molecular characteristics of ogura cytoplasmic male sterility related gene orf138 in cabbage (var. capitata). Chinese Agricultural Science Bulletin, 2012, 28(4): 104-109. (in Chinese)
[24] SHI J X, CUI M H, YANG L, KIM Y J, ZHANG D B. Genetic and biochemical mechanisms of pollen wall development. Trends in Plant Science, 2015, 20(11): 741-753.
[25] LI N, ZHANG D S, LIU H S, YIN C S, LI X X, LIANG W Q, YUAN Z, XU B, CHU H W, WANG J, WEN T Q, HUANG H, LUO D, MA H, ZHANG D B. The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development. The Plant Cell, 2006, 18(11): 2999-3014.
[26] XIE H H, CHEN L, XU F Q, GUO W S, WANG S, YANG Z N, ZHANG S. ACOS5 is required for primexine formation and exine pattern formation during microsporogenesis in.Journal of Plant Biology, 2017, 60(4): 404-412.
[27] XIONG S X, LU J Y, LOU Y, TENG X D, GU J N, ZHANG C, SHI Q S, YANG Z N, ZHU J. The transcription factors MS188 and AMS form a complex to activate the expression offor sporopollenin biosynthesis in. The Plant Journal, 2016, 88(6): 936-946.
[28] DONG X Y, HONG Z L, SIVARAMAKRISHNAN M, MAHFOUZ M, VERMA D P S. Callose synthase (CalS5) is required for exine formation during microgametogenesis and for pollen viability in. The Plant Journal, 2005, 42(3): 315-328.
[29] ZIEMIENOWICZ A. Plant Transgenesis. Plant Epigenetics. Totowa, NJ: Humana Press, 2010: 253-268.
[30] HOBBS S L A, WARKENTIN T D, DELONG C M O. Transgene copy number can be positively or negatively associated with transgene expression. Plant Molecular Biology, 1993, 21(1): 17-26.
[31] DE BUCK S, WINDELS P, de LOOSE M, DEPICKER A. Single- copy T-DNAs integrated at different positions in thegenome display uniform and comparable-glucuronidase accumulation levels. Cellular and Molecular Life Sciences, 2004, 61(19/20): 2632-2645.
[32] ELMAYAN T, VAUCHERET H. Expression of single copies of a strongly expressed 35S transgene can be silenced post-transcriptionally. The Plant Journal, 1996, 9(6): 787-797.
[33] MATZKE A J M, MATZKE M A. Position effects and epigenetic silencing of plant transgenes. Current Opinion in Plant Biology, 1998, 1(2): 142-148.
[34] DAY C D, LEE E, KOBAYASHI J, HOLAPPA L D, ALBERT H, OW D W. Transgene integration into the same chromosome location can produce alleles that express at a predictable level, or alleles that are differentially silenced. Genes & Development, 2000, 14(22): 2869-2880.
[35] SCOTT R J. Stamen structure and function. The Plant Cell, 2004, 16: S46-S60.
[36] 康俊根. 四种类型甘蓝雄性不育系花药败育特征及基因表达谱分析[D]. 北京: 中国农业科学院, 2006.
KANG J G. Analysis of anther abortion characteristics and gene expression profile of four types of cabbage male sterile lines [D]. Beijing: Chinese Academy of Agricultural Sciences, 2006. (in Chinese)
[37] BROWN G G, FORMANOVÁ N, JIN H, WARGACHUK R, DENDY C, PATIL P, LAFOREST M, ZHANG J F, CHEUNG W Y, LANDRY B S. The radishrestorer gene of Ogura cytoplasmic male sterility encodes a protein with multiple pentatricopeptide repeats. The Plant Journal, 2003, 35(2): 262-272.
Development of Ogura CMS Restorers of Broccoli via Genetic Transformation of
XING MiaoMiao, XU YuanYuan, LU YuYu, YAN JiYong, ZENG AiSong
Institute of Vegetable Crops, Jiangsu Academy of Agricultural Sciences/Jiangsu Key Laboratory for Horticultural Crop Genetic Improvement, Nanjing 210014
【Objective】The broccoli restorers were developed by transforming the matching fertility restorer gene offrom radish into the leading cultivar Ogura CMS line of Nai Han You Xiu (named as SFB45), so as to efficaciously use Ogura cytoplasmic male sterility (CMS) hybrids in breeding and to provide resources for genetic improvement of germplasm.【Method】The sequence of CDS with its preceding promoter ofwere synthesized and the::plant expression vector was constructed to infect the cotyledon with petiole, and hypocotyl explants of the SFB45 through-mediated transformation method. After regeneration and screening of herbicide resistant seedlings, transgenic plants were identified by detection of theresistant marker. The fertility of transgenic plants were observed at flowering stage. The pollen viability of SFB45 and the transgenic plants were analyzed using the alexander stain. Total RNA of <3 mm and >3 mm flower buds from SFB45 and the transgenic plants were isolated and transcribed into cDNA. Thespecific primers were designed, and RT-PCR was performed to analyze the expression levels ofand also the genes related to tapetum and pollen wall development in flower buds of SFB45 and its restorer lines.【Result】A total of 10 transgenic plants were obtained by genetic transformation. Among which, the fertilities of 8 were restored to varying degrees with the average pollen viability ranging from 84.2% to 90.4%. RT-PCR analysis showed thatwas expressed in flower buds of fertility restored plants. The key regulators of tapetum development (and) and the essential gene () for the synthesis of sporopollenin, a major component of the pollen wall were up-regulated in <3 mm flower buds of Ogura CMS restore lines. The tapetum degradation related gene AMS and tetrad callose wall and pollen outer wall development relatedgenesandwere up-regulated in >3 mm flower buds of the restore lines. The analysis of the self- and hybrid-crossing progenies of the positive transgenic lines-1,-3 and-6 showed that the introducedcould be stably inherited, which was consistent with the Mendelian inheritance.【Conclusion】The fertility restorer lines of Ogura CMS SFB45 were obtained by genetic transformation of, and the integration ofinto the genome of SFB45 recovered the expression of genes associated with tapetum and pollen wall development.
broccoli; genetic transformation; Ogura CMS;; tapetum and pollen wall development-related genes

10.3864/j.issn.0578-1752.2023.15.011
2022-12-02;
2023-05-22
江苏省农业科学院探索性颠覆性创新计划(ZX(21)1204)
邢苗苗,E-mail:20200021@jaas.ac.cn。通信作者曾爱松,E-mail:20000005@jaas.ac.cn
(责任编辑 赵伶俐)
