湿度调控设施黄瓜棒孢叶斑病菌产孢和释放规律及防治技术
2023-08-15柴阿丽杨红敏王少骅赵昆高苇石延霞谢学文李磊范腾飞李宝聚
柴阿丽,杨红敏,2,王少骅,赵昆,高苇,石延霞,谢学文,李磊,范腾飞,李宝聚
湿度调控设施黄瓜棒孢叶斑病菌产孢和释放规律及防治技术
柴阿丽1,杨红敏1,2,王少骅1,赵昆1,高苇3,石延霞1,谢学文1,李磊1,范腾飞1,李宝聚1
1中国农业科学院蔬菜花卉研究所/蔬菜生物育种全国重点实验室,北京 100081;2沈阳农业大学植物保护学院,沈阳 110866;3天津市农业科学院植物保护研究所,天津 300381
【目的】由多主棒孢()侵染引起的棒孢叶斑病给黄瓜产业带来了巨大的经济损失。产孢和释放是多主棒孢实现再侵染的关键环节。论文旨在探究设施栽培条件下多主棒孢产孢、释放规律,湿度对多主棒孢产孢、释放的影响,以及黄瓜棒孢叶斑病防治的最佳施药方式和施药时间。【方法】通过测定黄瓜发病叶片0:00、3:00、6:00、9:00、12:00、15:00、18:00和21:00产孢量,分析多主棒孢的产孢规律;在春、夏、秋、冬不同季节,分别测定一天之内0:00、3:00、6:00、9:00、12:00、15:00、18:00、21:00时棚室空气样本中多主棒孢浓度,分析多主棒孢释放的日变化规律;在人工气候暴露仓和塑料拱棚内,分别设置持续高湿(相对湿度>90%,24 h)、持续干燥(相对湿度<60%,24 h)、先高湿12 h后干燥12 h、先干燥12 h后高湿12 h等不同的湿度水平,研究不同湿度条件对多主棒孢产孢、释放的影响。比较60%多菌灵·乙霉威可湿性粉剂和5亿活菌/g荧光假单胞杆菌可湿性粉剂,喷雾法和弥粉法施药方式,不同施药时间对黄瓜棒孢叶斑病的防治效果和对空间病原菌的杀灭效果。【结果】多主棒孢产孢、释放数据显示,一天内不同时间,黄瓜发病叶片病斑产孢量和棚室空间孢子浓度均存在显著性差异,而且二者存在此消彼长的互补关系。夜间18:00之后,随着高湿(相对湿度>90%)持续时间延长,叶片病斑产孢量增大,次日早上6:00病斑孢子数达峰值1 344个孢子/cm2;开风口后,棚室内湿度降低(相对湿度<60%),孢子释放到棚室空间,中午12:00空气中多主棒孢浓度达峰值12 445—110 697个孢子/m3。不同季节棚室空间多主棒孢孢子浓度日变化规律一致,均表现为夜间高湿(相对湿度>90%)产孢、白天低湿(相对湿度<60%)释放的趋势。在人工气候暴露仓和塑料拱棚内,干湿交替条件下多主棒孢的产孢、释放量更高,病情扩展更快,显著高于持续高湿或持续干燥条件。用60%多菌灵·乙霉威可湿性粉剂和5亿活菌/g荧光假单胞杆菌可湿性粉剂在傍晚19:00弥粉法施药,对黄瓜棒孢叶斑病防治效果最好,分别达到80.60%和75.08%,对空间病原菌的杀灭效果达84%以上。【结论】湿度是影响多主棒孢产孢和释放的关键环境因子,设施栽培干湿交替环境加快了多主棒孢的传播和扩散,弥粉法施药的防治效果优于喷雾施药,最佳施药时间为孢子大量繁殖前的傍晚或晚上。研究结果有助于制定黄瓜棒孢叶斑病的高效防控策略。
黄瓜棒孢叶斑病;多主棒孢;湿度;产孢;释放;弥粉法施药;施药时间
0 引言
【研究意义】由多主棒孢()引起的棒孢叶斑病是近20年黄瓜产区危害最重的病害,该病害传播速度快,田间流行规律不清楚,已有的防治措施效果较差[1-3]。多主棒孢寄主范围广泛,可侵染53科380属530多种植物[4-8]。1993年,该病害在我国辽宁、河南保护地内大面积发生[9],至今已遍及山东、河北、北京等19个省(市、区),田间发病率一般10%—25%,严重时可达60%—70%,甚至100%,对产业发展构成严重威胁,已成为设施黄瓜主要病害之一[10-11]。病原菌的产孢和释放是病害短时间、大面积暴发的先决条件[12],明确设施环境中的湿度对多主棒孢产孢、释放的影响和调控,将有助于提出科学有效、切实可行的生态防控策略,对设施黄瓜优质、绿色、安全生产具有重要指导意义。【前人研究进展】目前,高湿被认为对许多病害的发生有重大影响,相对湿度超过85%维持8 h以上,番茄灰霉病菌()才能连续侵染[13];黄瓜霜霉病菌()侵染需要至少2 h的高湿条件[14]。另外,当叶片湿润或空气相对湿度为100%时,黄瓜霜霉病菌产生大量孢子囊;相对湿度低于70%时,几乎不产生孢子囊[15]。子囊菌在高湿或遇水条件下子囊吸水膨胀,囊壁破裂继而将子囊孢子弹射释放[16];相对湿度降到75%以下,苔藓植物蒴齿开放,孢子从孢蒴释放而出[17]。丁香假单胞菌()等引起的细菌性病害一般在雨后或持续高湿后暴发[18],恶疫霉()完成显症发病至少需要持续40 h的湿润时间[19]。课题组前期研究发现,湿度是影响多主棒孢产孢量和孢子大小的主要因素,最适产孢相对湿度为100%。在高湿(相对湿度100%)条件下,多主棒孢产孢量大,分生孢子细长,对黄瓜植株有致病性;在低湿(相对湿度75%)条件下,多主棒孢产孢量小,分生孢子短宽,对黄瓜植株无致病性[20]。【本研究切入点】然而设施栽培条件下,多主棒孢的产孢、释放规律,以及湿度对其产孢、释放的调控机制尚不清楚。目前生产中黄瓜棒孢叶斑病的防治以喷雾法施药为主,不但费时费力,而且增加棚内湿度,病害防治效果较差。【拟解决的关键问题】探究设施栽培条件下,昼夜干湿交替环境对多主棒孢产孢、释放的影响,明确黄瓜棒孢叶斑病防治的最佳施药方式和施药时间。
1 材料与方法
试验于2021—2022年在中国农业科学院蔬菜花卉研究所国家蔬菜改良中心和中国农业科学院寿光蔬菜研发中心温室完成。
1.1 供试菌株和黄瓜品种
供试菌株为黄瓜多主棒孢HG14102524,保存于中国农业科学院蔬菜花卉研究所蔬菜病害综合防治课题组。黄瓜‘中农6号’,购自中蔬种业科技(北京)有限公司。
1.2 主要设备和药剂
ABI 7500实时荧光定量PCR仪(美国ABI公司);3K15型高速离心机(德国Sigma公司);微量移液器(德国Eppendorf公司);VB-55型高压湿热灭菌器(德国赛斯太克高压灭菌技术有限公司)。
60%多菌灵·乙霉威可湿性粉剂,5亿孢子/g荧光假单胞杆菌可湿性粉剂,精量电动弥粉机(中蔬生物(寿光)科技有限公司)。
1.3 多主棒孢产孢规律
1.3.1 接种 产孢动态规律研究在活体发病黄瓜植株上完成。供试黄瓜种子55 ℃温汤浸种30 min后进行催芽,待露白后播种至育苗钵,每钵1株。挑选两片真叶期长势一致的植株进行接种。供试菌株在马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)28 ℃黑暗培养10 d后,在培养皿中加入10 mL 0.05%吐温20,使用无菌毛刷轻刷菌落,将菌丝和分生孢子混合液通过4层纱布过滤,血球计数板调节悬浮液浓度至1×105个孢子/mL备用。
采用点滴法接种,使用微量移液枪吸取10 μL孢子悬浮液,接种至黄瓜叶片正面,每个叶片以主脉为对称轴从叶尖到叶基均分为6个区域,每个区域中心接种1滴菌悬液,每株接种两片真叶,每个叶片接种6滴。接种后的黄瓜植株在25 ℃、相对湿度(98±2)%人工气候室培养48 h后,转移至15—18 ℃(夜晚)/24—27 ℃(白天)的温室继续培养5 d,待黄瓜植株表现明显的棒孢叶斑病症状后备用。
1.3.2 产孢日变化规律 挑选6株发病一致的黄瓜植株,首先使用小风扇从不同方向吹风,去除病斑表面已存在的孢子,然后转移至日光温室产孢柜(70 cm×60 cm×60 cm)内,分别于0:00、3:00、6:00、9:00、12:00、15:00、18:00和21:00统计病斑孢子数。具体方法:使用透明胶带轻轻粘贴病斑正面,以添加0.15%酸性品红的甘油溶液作为浮载剂,在光学显微镜(Nikon 80i,日本)100倍视野下统计孢子个数。每个处理设置3次重复,每次重复统计18个病斑产孢量。通过公式B=N/S计算单位病斑面积多主棒孢的孢子数。式中,B为单位病斑面积多主棒孢的孢子数(个孢子/cm2);N为显微镜下多主棒孢的分生孢子数;S为病斑面积(cm2)。病斑面积通过记录病斑的最长(L)和最宽(W)(长和宽垂直),利用公式S=1/4×π×L×W来统计。每个产孢柜中放置温湿度记录仪(DL- WS210,杭州尽享科技有限公司),每隔5 min记录温湿度数据。
1.4 日光温室多主棒孢孢子释放规律
1.4.1 自然发病温室空气微生物样本采集 分别于2021年5月(春季)、8月(夏季)、11月(秋季)、2022年2月(冬季)在中国农业科学院寿光蔬菜研发中心黄瓜棒孢叶斑病自然发病温室进行。使用病原菌收集仪[21]采集棚室空间微生物样本,采集时间为每天00:00、3:00、6:00、9:00、12:00、15:00、18:00、21:00,每个季节分别采集3 d作为3次重复,每次重复间隔1 d。采样前,将600 μL无菌矿物油(MACKLIN)均匀涂抹在直径90 mm无菌铝箔上,制备油膜平板[21],置于病原菌收集仪样本采集仓内,用于棚室空气微生物样本采集。收集仪放置在发病黄瓜植株周围,距离地面1.5 m,采样时间为10 min,流量为1 000 L·min-1。采样完毕后,样本置于冰盒中带回实验室,用于空气中多主棒孢浓度的qPCR定量分析。同时,调查黄瓜棒孢叶斑病的病情指数。采用空气温湿度记录仪(DL-WS210,杭州尽享科技有限公司),每隔5 min记录黄瓜棚室内温湿度数据,并对空气中多主棒孢浓度与棚室内温湿度进行相关性分析。
1.4.2 空气微生物样本中多主棒孢检测 将铝箔油膜置于50 mL离心管中,用管盖压住油膜少许,8 000 r/min离心5 min;将离心管底部的石蜡油转至1.5 mL离心管,加无菌水至1 mL,12 000 r/min离心2 min;弃上层石蜡油,底部沉淀用于DNA提取。DNA提取采用真菌基因组DNA提取试剂盒(DP305-03,博迈德,北京)。使用课题组前期筛选的多主棒孢特异性引物ga4F1(5′-ATTGATGGGAATTGCTCTGC-3′)和ga4R1(5′-CCTGCTCCGACTTTGTTGA-3′)进行qPCR扩增[12],引物由北京博迈德科技有限公司合成。qPCR反应体系(20 μL):SYBR qPCR Master Mix(博迈德,北京)10 μL,上、下游引物各0.4 μL,50×Reference Dye ROX加入0.4 µL,DNA模板1 µL。反应条件:95 ℃预变性15 min,95 ℃变性10 s,60 ℃退火32 s,共40个循环。反应结束后分析扩增曲线及熔解曲线,每个qPCR反应进行3次重复。
1.5 湿度对多主棒孢产孢和释放的影响
1.5.1 人工模拟湿度对多主棒孢产孢和释放的影响 试验在人工气候暴露仓内完成,暴露仓由有机玻璃制成,长、宽、高分别为70、60、60 cm。4个暴露仓分别设置不同的湿度条件:持续高湿(相对湿度>90%,24 h)、持续干燥(相对湿度<60%,24 h)、先干燥后高湿(相对湿度<60%,12 h;相对湿度>90%,12 h)、先高湿后干燥(相对湿度>90%,12 h;相对湿度<60%,12 h)。暴露仓内空气温度由空调控制在(25±2)℃;湿度调控主要通过加湿器(SC-EB35B,北京亚都环保科技有限公司)产生的湿润气流经HEPA滤膜进入暴露仓加湿,干燥通过在暴露仓内放置吸附干燥剂变色硅胶(S821279,上海麦克林生化科技股份有限公司)进行调控。每个暴露仓分别放置温湿度记录仪,每隔5 min记录黄瓜棚室内温湿度数据。
黄瓜幼苗2—3叶期,采用点滴法接种后,挑选发病一致的植株转移至暴露仓内,不同湿度条件下处理3 d后,采用病原菌收集仪,收集暴露仓内空气样本到铝箔油膜上,qPCR定量检测多主棒孢浓度。同时,调查各处理黄瓜的发病情况。按病斑占叶片面积的百分率进行分级。0级:无病斑;1级:0—5%;3级:6%—25%;5级:26%—50%;7级:51%—75%;9级:76%—100%。病情指数=∑(各级病叶数×相对级数值)/(调查总叶数×9)。试验设置3次重复,每个暴露仓为1次重复。
1.5.2 温室湿度对多主棒孢产孢和释放的影响 试验在中国农业科学院寿光蔬菜研发中心塑料拱棚完成,每个拱棚长18 m、宽6 m,拱棚两侧设有通风口。黄瓜5—6片真叶期,喷雾接种浓度1×105个孢子/mL的孢子悬浮液,保湿培养2 d,待黄瓜植株均匀发病后进行试验。3个拱棚分别设置不同的湿度条件:持续高湿(棚室24 h封闭,相对湿度>90%)、持续干燥(相对湿度<60%,风口24 h打开)、干湿交替(8:00—18:00风口打开,相对湿度<60%;18:00至次日8:00棚室封闭,相对湿度>90%)持续处理3 d。每个拱棚分别于处理前及处理后,用病原菌收集仪收集拱棚内空气样本到铝箔油膜上,qPCR定量检测空气中多主棒孢浓度。同时,调查各处理黄瓜的发病情况。3个拱棚分别放置温湿度记录仪,每隔5 min记录黄瓜拱棚内温湿度数据。试验分别于2022年3月、4月、5月进行3次重复。
1.6 不同施药方式和施药时间对黄瓜棒孢叶斑病的防治效果
试验在中国农业科学院寿光蔬菜研发中心塑料拱棚完成,待黄瓜长至10片真叶时,喷雾接种浓度1×105个孢子/mL的孢子悬浮液。接种后第2天,用化学农药60%多菌灵·乙霉威可湿性粉剂和生物农药5亿活菌/g荧光假单胞杆菌可湿性粉剂进行防治,分别采用喷雾法和弥粉法两种施药方式,在8:00、16:00和19:00施药,调查对黄瓜棒孢叶斑病的防治效果以及对空间病原菌的杀灭效果。空间病原菌孢子灭杀效果=(不施药处理棚室空间孢子浓度-施药后棚室空间孢子浓度)/不施药处理棚室空间孢子浓度。以接病原菌,不施药为对照。试验于2022年3月、5月、10月分别重复3次。
喷雾法施药使用背负式电动喷雾器(3WBD-20L,山东先瑞智能科技有限公司),弥粉法施药使用手持式精量电动弥粉机(中蔬生物寿光有限公司),喷粉前将拱棚风口关闭,喷粉管与地面呈45°对空施药,以防止微粉飘散。喷雾法和弥粉法施药,每次用药量均为50 g/667 m2,喷雾法施药按60 L/667 m2兑水量进行叶面喷雾。待对照开始发病后,采用病原菌收集仪,收集各处理拱棚内空气样本到铝箔油膜上,qPCR定量检测空气中多主棒孢浓度。同时,调查各处理黄瓜的发病情况,计算防治效果。防治效果(%)=100×(对照病情指数-处理病情指数)/对照病情指数。
1.7 数据分析
数据采用Microsoft Excel 2021整理汇总、SigmaPlot 14.0作图,使用SPSS 23.0统计分析软件进行方差分析,运用Duncan法进行显著性检验。
2 结果
2.1 多主棒孢产孢规律
黄瓜棒孢叶斑病病株置于产孢柜,分别于不同时间点统计病斑产孢量。湿度数据显示,下午15:00之后,产孢柜内温度逐渐降低,相对湿度逐渐上升,18:00至次日6:00,产孢柜内相对湿度持续在90%以上;早上9:00开始,产孢柜内温度逐渐上升,相对湿度逐渐下降,至12:00—15:00,相对湿度达到最低(图1-A)。
产孢数据显示,夜间18:00后,随着高湿(相对湿度>90%)持续时间延长,单位面积病斑产孢数逐渐增多,到次日早上6:00叶片病斑上的孢子数量最多,达1 344个孢子/cm2;之后,随着温度逐渐升高,相对湿度逐渐降低,病斑孢子数又趋于降低,下午15:00叶片病斑产孢数降至最低值。整体分析,白天低湿(相对湿度<60%)叶片病斑上多主棒孢的产孢量少,夜间高湿(相对湿度>90%)病斑产孢量多(图1-B)。因此,高湿是多主棒孢产孢繁殖的必要条件。
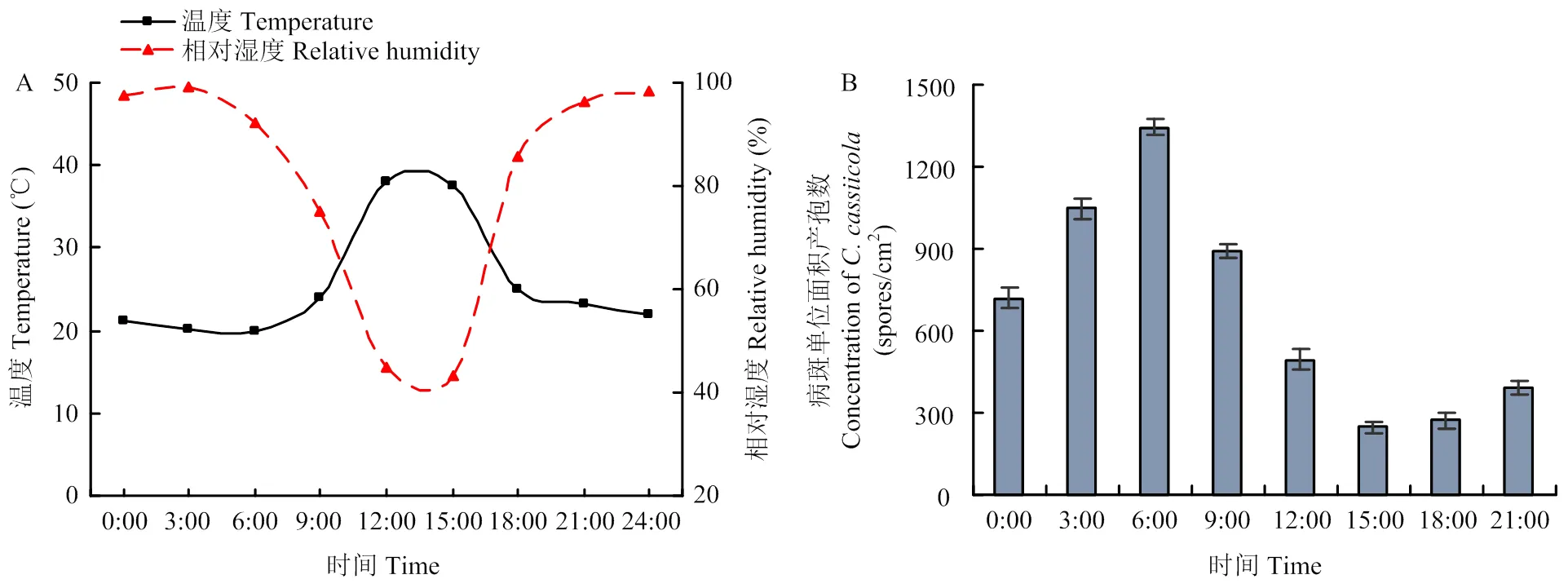
A:产孢柜内温湿度变化Temperature and relative humidity in artificial sporulation cabinet;B:黄瓜棒孢叶斑病单位面积病斑孢子数The concentration of C. cassiicola on leave lesions of cucumber target leaf spot
2.2 日光温室多主棒孢孢子释放规律
qPCR检测结果表明,一天内不同时间棚室空气中多主棒孢孢子浓度存在显著性差异,与相对湿度呈负相关(2:-0.643—-0.859),与温度呈正相关(2:0.614—0.972)。从上午6:00开始,棚室内温度逐渐升高、相对湿度逐渐降低,空气中多主棒孢浓度也随之逐渐增加,到中午12:00,棚室内温度达到峰值(30.3—41.9 ℃),相对湿度达到低谷(31.7%— 53.0%),棚室空气中多主棒孢孢子浓度也达到最高值,春季、夏季、秋季、冬季分别为23 368、110 697、64 882和12 445个孢子/m3。之后,随着温度逐渐降低,棚室内相对湿度逐渐增大,空气中多主棒孢浓度也随之逐渐降低;夜间0:00—3:00温度达到最低值(14.6—22.7 ℃),相对湿度最高(>90%),空气中多主棒孢浓度也降至最低,不同季节孢子浓度范围为780—1 201个孢子/m3。不同季节棚室内相对湿度和孢子浓度变化均呈相反趋势,表现为夜间相对湿度升高,空间病原菌孢子浓度降低;白天相对湿度降低,空间病原菌孢子浓度升高(图2、表1)。因此,推测湿度降低是多主棒孢孢子主动释放的必要条件。
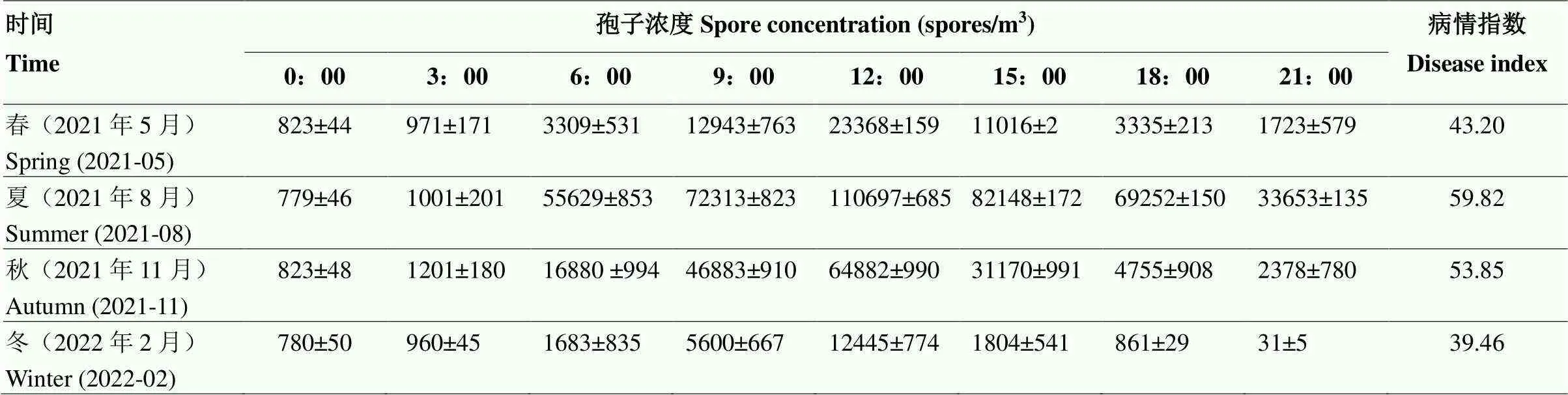
表1 不同季节日光温室多主棒孢孢子释放规律及病情指数
表中数据为平均值±标准差(n=3)。表2同Data are shown as the mean ± standard deviation (SD). The same as Table 2
2.3 湿度条件对多主棒孢产孢和释放的影响
分析了人工模拟不同湿度条件对多主棒孢产孢、释放和病情发展的影响。结果显示,先高湿后干燥条件下,暴露仓空气中多主棒孢浓度最高49 892个孢子/m3,病情最严重,病情指数为63.22;其次为先干燥后高湿和持续高湿条件下,暴露仓内多主棒孢浓度分别为23 301和12 463个孢子/m3,病情指数为58.29和54.45;持续干燥条件下,暴露仓内多主棒孢浓度最低,为3 836个孢子/m3,病情指数为51.72(图3)。说明先高湿后干燥条件有利于多主棒孢产孢、释放和病害传播。
塑料拱棚内干湿交替处理条件下,拱棚内夜间相对湿度63.28%—95.17%,白天相对湿度32.67%—63.28%,棚室空气中多主棒孢孢子浓度增加值最大,为16 868个孢子/m3,病情指数由处理前24.28增至40.76。持续高湿(拱棚内相对湿度63.93%—100.00%)或持续干燥(拱棚内相对湿度28.97%—65.37%)条件下,多主棒孢浓度和病情指数变化差异不显著,多主棒孢浓度增大值分别为9 911和10 195个孢子/m3,病情指数分别由25.00增至31.27,24.11增至34.08(图4)。说明设施栽培昼夜干湿交替环境促进了多主棒孢的夜间高湿产孢繁殖和白天低湿释放,加快了病菌的传播和扩散,加剧了病害的发生。
2.4 不同施药方式和施药时间下黄瓜棒孢叶斑病的防治效果
依据棚室内的温度、空气中孢子量及农户习惯性选择上午8:00、下午16:00和傍晚19:00 3个施药时间,在棚室内比较喷雾法和弥粉法两种施药方式对黄瓜棒孢叶斑病的防治效果和对空间病原菌的杀灭效果。
施药量相同,弥粉法施药对黄瓜棒孢叶斑病的防治效果和孢子灭杀效果显著高于喷雾法施药。60%多菌灵·乙霉威可湿性粉剂8:00、16:00和19:00弥粉法施药,对黄瓜棒孢叶斑病的防治效果分别为63.45%、74.64%和80.60%,显著高于喷雾法施药的防治效果41.58%、42.26%和43.45%;弥粉法施药对空间病原菌杀灭效果在71.81%以上,显著高于喷雾法施药杀灭效果52.52%—58.12%。同样,5亿活菌/g荧光假单胞杆菌可湿性粉剂8:00、16:00和19:00弥粉法施药,对黄瓜棒孢叶斑病的防治效果分别为59.13%、66.14%和75.08%,显著高于喷雾法施药的防治效果38.69%、40.67%和41.55%,弥粉法施药对空间病原菌杀灭效果在72.28%以上,显著高于喷雾法施药杀灭效果64.81%—70.53%。因此,弥粉法适时施药提高了化学农药和生物农药的田间防治效果(表2)。
施药量相同,傍晚或晚上施药对黄瓜棒孢叶斑病的防治效果和棚室空间孢子灭杀效果高于白天施药。60%多菌灵·乙霉威可湿性粉剂和5亿活菌/g荧光假单胞杆菌可湿性粉剂傍晚19:00弥粉法施药,对黄瓜棒孢叶斑病的防治效果分别为84.12%和85.80%,显著高于上午8:00弥粉法施药的防治效果71.81%和72.28%。因此,病害防治的最佳施药时间为孢子大量繁殖前的傍晚或晚上(表2)。
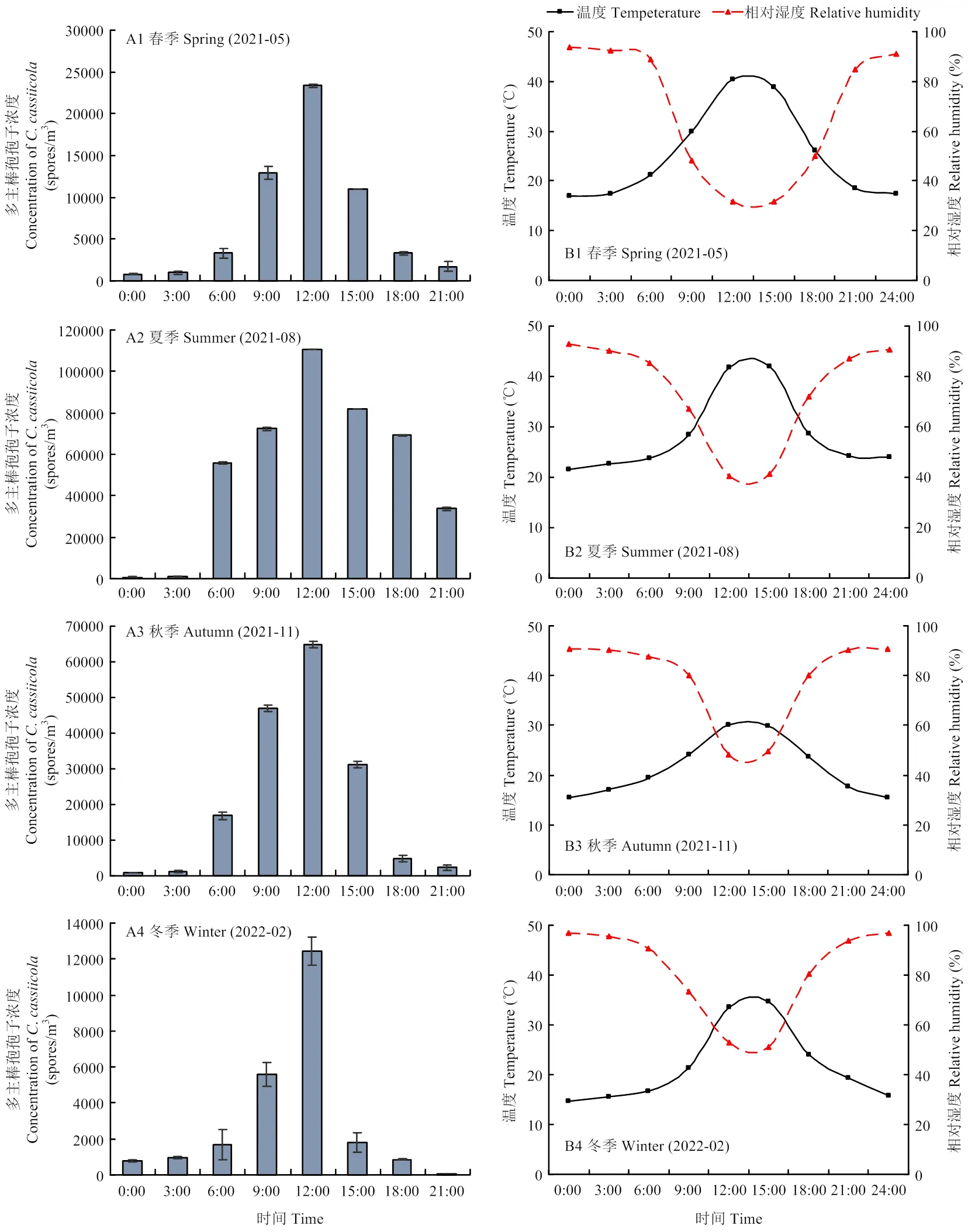
试验于春(2021年5月)、夏(2021年8月)、秋(2021年11月)、冬(2022年2月)在黄瓜棒孢叶斑病自然发病棚室内进行。A1—A4分别为不同季节黄瓜棚室内多主棒孢浓度的日变化规律;B1—B4分别为不同季节黄瓜棚室内温湿度变化
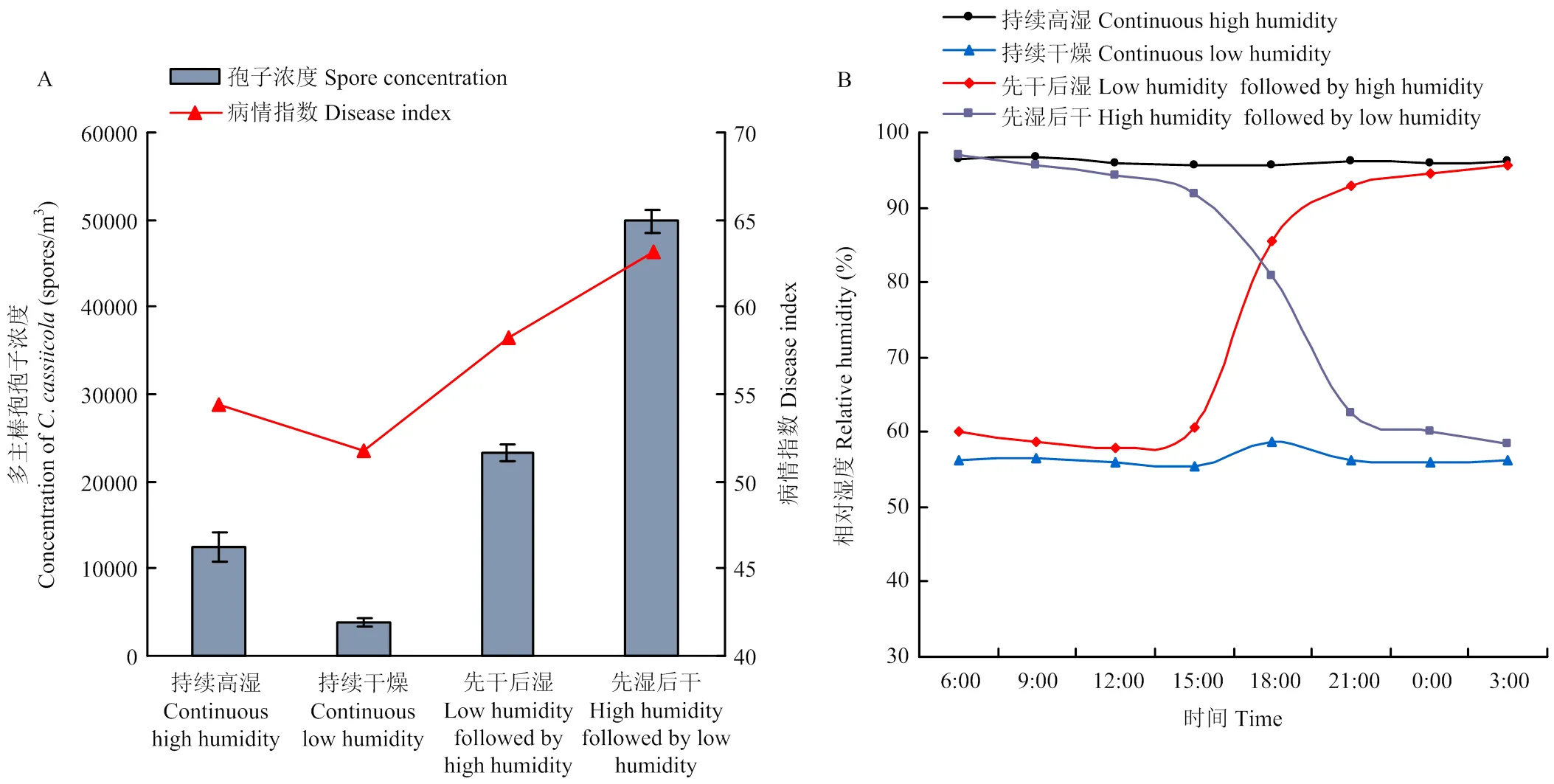
A:不同湿度条件下人工气候暴露仓内多主棒孢浓度The concentration of C. cassiicola in artificial climate exposure chambers under different humidity conditions;B:暴露仓内湿度变化情况Relative humidity in artificial climate exposure chambers
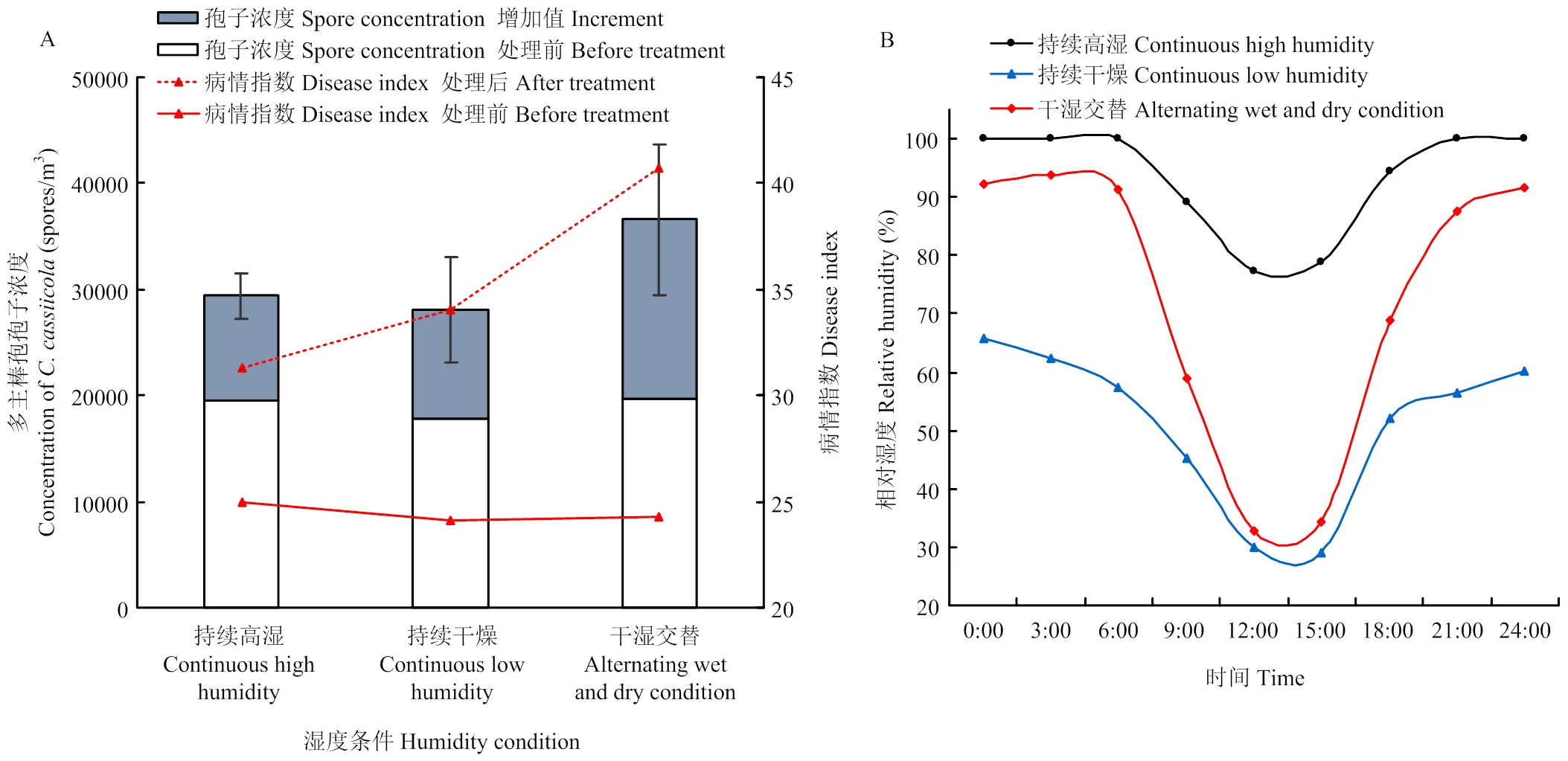
A:不同湿度条件下塑料拱棚内多主棒孢浓度The concentration of C. cassiicola in plastic greenhouses under different humidity conditions;B:塑料拱棚内湿度变化情况Relative humidity in plastic greenhouses
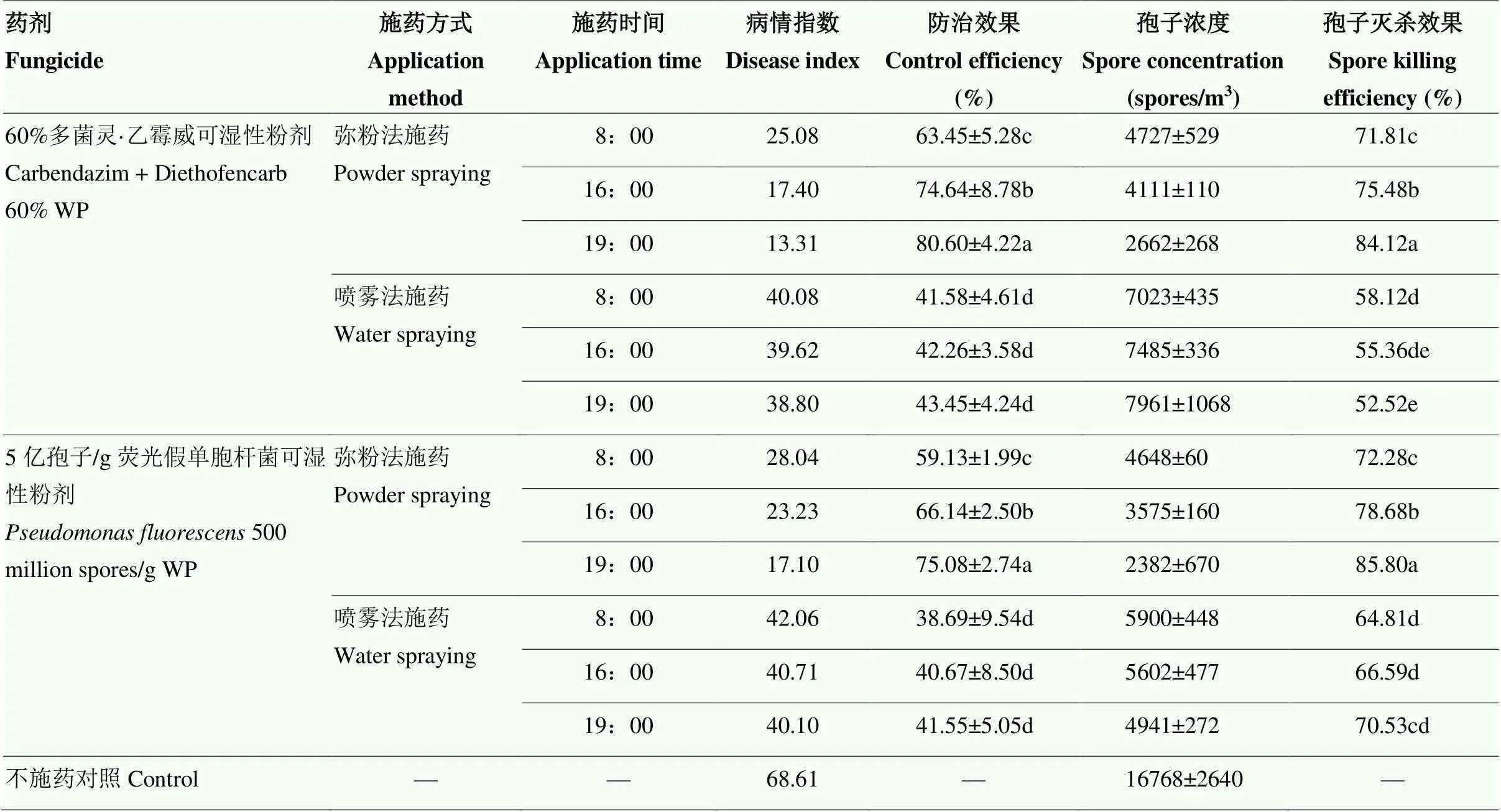
表2 不同施药方式和施药时间下黄瓜棒孢叶斑病的防治效果
同一列数据后不同小写字母表示0.05水平上差异显著
Data with different lowercase letters inthe same column indicated significant difference at 0.05 level
3 讨论
3.1 产孢和释放是病害短时间、大面积暴发的先决条件
病原菌的繁殖、传播和侵染是病害流行的三大环节。当环境条件适宜时,病原菌的繁殖和传播直接决定了病害的发展和蔓延。产孢直接决定再侵染病原菌的数量,释放使病原菌不断传播扩散,病原菌产孢繁殖是传播扩散的前提,在病原真菌大规模传播扩散中起着重要作用。真菌孢子可以随气流进行远距离传播和扩散,空气传播一直被认为是植物病害短时间、大暴发的关键途径[22-25]。多主棒孢产孢是传播扩散的先决条件。多主棒孢气传速度快、强度大、传染性强,是病害始终难以得到有效防控的根本原因。如果设施栽培环境条件适宜,多主棒孢分生孢子在一个生长季节可以多次重复产生,使其能够在较短的时间内迅速繁殖、蔓延和扩散,加速了黄瓜棒孢叶斑病的传播。田间调查发病温室和人工接种模拟试验均表明,从出现中心病株到整棚发病,一般需要5 d,最快2 d即可完成整个过程。显微观察可见病斑上着生大量分生孢子,病株周围空气中能够检测并收集到多主棒孢;植株发病程度与空气中多主棒孢菌量呈正相关。
3.2 湿度是影响多主棒孢产孢繁殖的关键因子
温湿度条件对病原真菌产孢繁殖有重要影响[26-27],基于Richards或Weibull方程建立了高湿持续期影响病原真菌产孢的预测模型[15,28-29]。不同病原菌产孢的最适湿度条件有很大差异,就白粉病菌而言,不同种的最适产孢湿度也不相同,比如禾白粉菌()的最适产孢相对湿度为100%[30],而南瓜白粉病菌()的最适产孢相对湿度为45%—50%[31]。另外,黄瓜红粉病菌()适宜产孢的相对湿度为70%—95%[32],而茄镰孢()和黄瓜霜霉病菌的最适产孢相对湿度为100%[15,33]。本研究中,设施栽培条件下,夜间18:00之后随着高湿持续时间延长,叶片病斑产孢量增大,次日早上6:00病斑孢子数达峰值1 344个孢子/cm2,多主棒孢的最适产孢条件为夜间高湿环境。本研究结果与前人研究一致,黄瓜棒孢叶斑病是一种高湿病害,最适产孢相对湿度为100%[20]。
3.3 低湿是设施黄瓜多主棒孢释放的诱导因素
本研究发现,在人工气候暴露仓或塑料拱棚,在持续高湿环境下,发病黄瓜植株释放的分生孢子较少,病害扩展较慢;而在干湿交替环境下,发病黄瓜植株释放大量分生孢子,病害扩展快。另外,棚室空间孢子浓度日变化规律研究发现,温室空气中收集的多主棒孢浓度上午逐渐增多,中午达到峰值,晚上较少。温室白天接受太阳辐射,上午升温、湿度降低,午后开始降温、湿度增加,夜间没有热量收入时,温度不断下降、湿度进一步增加,夜间高湿条件下,病原菌开始进行繁殖。因此,笔者推测湿度降低在多主棒孢分生孢子释放过程发挥着关键作用。多主棒孢分生孢子单生或串生于分生孢子梗上,环境干燥时,湿润的分生孢子蒸发失水,单个孢子或孢子链轻微摇曳摆动,导致孢子链断裂,分生孢子脱落释放。此外,笔者还发现干燥环境中分生孢子内会出现一些气泡,结合“气相假说”[34]分析可知,孢子蒸发失水体积缩小,细胞壁和孢内溶液相互作用产生气泡,此过程释放的能量有可能作用于孢子释放;或许产生气泡瞬间弹性细胞壁恢复到原来的形状,这种突然的反弹使得孢子被释放到棚室空间。因此推测,湿度降到一定程度时,多主棒孢分生孢子大量释放,传播到新的适宜生境延续种群进行病害传播。
3.4 弥粉法施药防治设施蔬菜病害
黄瓜棒孢叶斑病属于高湿病害,由于设施栽培条件环境密闭,导致棚室内湿度过大,因此病害发生严重。湿度控制也成为设施蔬菜生产中的关键环节。采用喷雾法施药不仅劳动强度大、费工费时,还会人为地增加棚室内湿度,导致病害控制不住,越防越重,形成恶性循环,特别是阴雨天极易造成病害的迅速流行。采用弥粉法施药,不增加棚室湿度,操作方便,且药剂喷出后通过静电吸附作用沉积在叶片正反面,提高了对病害的防治效果[35-38]。本研究发现相同施药量情况下,弥粉法施药对黄瓜棒孢叶斑病的防治效果显著高于喷雾法施药。而且,施药的最佳时间为孢子大量繁殖前的傍晚。60%多菌灵·乙霉威可湿性粉剂和5亿孢子/g荧光假单胞杆菌可湿性粉剂弥粉法傍晚19:00施药,与早上8:00施药相比,防治效果分别提高了17.15和15.95个百分点。
4 结论
湿度是调控多主棒孢产孢和释放的关键环境因子。设施栽培条件下,多主棒孢在夜间高湿(相对湿度>90%)条件下大量产孢,在白天低湿(相对湿度<60%)条件下孢子大量释放到棚室空间。设施栽培昼夜干湿交替环境促进了多主棒孢的产孢和释放,加速了病害传播,弥粉法施药的防治效果优于喷雾施药,最佳施药时间为病原菌孢子大量繁殖前的傍晚或晚上。研究结果为制定黄瓜棒孢叶斑病高效防控策略提供了依据,对设施黄瓜高效、绿色生产具有重要指导意义。
[1] 王泉城, 武军, 李磊, 石延霞, 谢学文, 李宝聚, 柴阿丽. 多主棒孢菌对黄瓜的致病机理分析. 园艺学报, 2023, 50(3): 569-582.
WANG Q C, WU J, LI L, SHI Y X, XIE X W, LI B J, CHAI A l. Exploration on the function of pathogenicity-related genefrom cucumber. Acta Horticulturae Sinica, 2023, 50(3): 569-582. (in Chinese)
[2] SANCHEZ CASTRO M A. Leaf blight caused by: a new disease on cucumber () in the Valley of Culiacan, Sinaloa, Mexico, and its chemical control. Plant Disease Reporter,1979, 63(7): 599-601.
[3] DIXON L J, SCHLUB R L, PERNEZNY K, DATNOFF L E. Host specialization and phylogenetic diversity of. Phytopathology, 2009, 99(9): 1015-1027.
[4] BOOSALIS M G, HAMILTON R I. Root and stem rot of soybean caused by(Berk. & Curt.). Wei. Plant Disease, 1957, 41: 696-698.
[5] BOWEN K L, HAGAN A K, PEGUES M, JONES J, MILLER H B. Epidemics and yield losses due toon cotton. Plant Disease, 2018, 102(12): 2494-2499.
[6] CHEE K H. Studies on sporulation, pathogenicity and epidemiology ofon. Natural Rubber Research, 1988, 3: 21-29.
[7] CHUNG S R, LEE H S, YOU I C. Fungal keratitis caused by, a plant pathogen. Journal of Mycology and Infection, 2018, 23: 24-26.
[8] MIYAMOTO T, ISHII H, SEKO T, KOBORI S, TOMITA Y. Occurrence ofisolates resistant to boscalid on cucumber in Ibaraki Prefecture, Japan. PlantPathology, 2009, 58(6): 1144-1151.
[9] 李宝聚, 高苇, 石延霞, 谢学文. 多主棒孢和棒孢叶斑病的研究进展. 植物保护学报, 2012, 39(2): 171-176.
LI B J, GAO W, SHI Y X, XIE X W. Progress in researches onleaf spot. Acta Phytophylacica Sinica, 2012, 39(2): 171-176. (in Chinese)
[10] 陈璐, 石延霞, 谢学文, 柴阿丽, 李宝聚. 黄瓜棒孢叶斑病菌PCR检测方法的建立. 园艺学报, 2014, 41(3): 585-592.
CHEN L, SHI Y X, XIE X W, CHAI A L, LI B J. PCR assay for detection of, the causal agent ofleaf spot of cucumber. Acta Horticulturae Sinica, 2014, 41(3): 585-592. (in Chinese)
[11] SUN B, ZHU G, XIE X, CHAI A, LI L, SHI Y, LI B. Double mutations in succinate dehydrogenase are involved in SDHI resistance in. Microorganisms, 2022, 10(1): 132.
[12] ZHAO Q, SHI Y X, WANG Y H, XIE X W, LI L, GUO L Y, CHAI A L, LI B J. Quantifying airborne dispersal route ofin greenhouses. Frontiers in Microbiology, 2021, 12(12): 716758.
[13] 李宝聚, 陈立芹, 孟伟军, 王福建. 湿度调控对番茄灰霉病菌侵染的影响. 植物病理学报, 2003, 33(2): 167-169.
LI B J, CHEN L Q, MENG W J, WANG F J. Effects of humidity regulation on the infection ofto tomato. Acta Phytopathologica Sinica, 2003, 33(2): 167-169. (in Chinese)
[14] 石延霞, 李宝聚, 刘学敏. 黄瓜霜霉病菌侵染若干因子的研究. 应用生态学报, 2005, 16(2): 257-261.
SHI Y X, LI B J, LIU X M. Several infection factors of. Chinese Journal of Applied Ecology, 2005, 16(2): 257-261. (in Chinese)
[15] SUN S L, LIAN S, FENG S L, DONG X L, WANG C X, LI B H, LIANG W X. Effects of temperature and moisture on sporulation and infection by. Plant Disease, 2017, 101(4): 562-567.
[16] TRAIL F, XU H X, LORANGER R, GADOURY D. Physiological and environmental aspects ofascospore discharge in(anamorph). Mycologia,2002, 94(2): 181-189.
[17] JOHANSSON V, LONNELL N, RANNIK Ü, SUNDBERG S, HYLANDER K. Air humidity thresholdstrigger active moss spore release to extend dispersal in space and time. Functional Ecology,2016, 30(7): 1196-1204.
[18] XIN X F, NOMURA K, AUNG K, VELASQUEZ A C, YAO J, BOUTROT F, CHANG J H, ZIPFEL C, HE S Y. Bacteria establish an aqueous living space in plants crucial for virulence. Nature,2016, 539(7630): 524-529.
[19] LIU F, LI B H, LIAN S, DONG X L, WANG C X, ZHANG Z F, LIANG W X. Effects oftemperature and moisture on the infection and development of apple fruit rot caused by. Plant Disease, 2018, 102(9): 1811-1819.
[20] ZHAO Q, SHI Y X, WANG Y K, XIE X W, LI L, FAN T F, GUO L Y, CHAI A L, LI B J. Temperature and humidity regulate sporulation ofthat is associated with pathogenicity in cucumber (L). Biology, 2022, 11(11): 1675.
[21] CHAI A L, YUAN L F, LI L, SHI Y X, XIE X W, WANG Q, LI B J. Aerosol transmission ofpv.in greenhouses. Science of the Total Environment, 2020, 748: 141433.
[22] ABDEL-HAMEED A A, KHODER M I, IBRAHIM Y H, SAEED Y, OSMAN M E, GHANEM S. Study on some factors affecting survivability of airborne fungi. Science of the Total Environment, 2012, 414: 696-700.
[23] BROWN J K, HOVMOLLER M S. Aerial dispersal of pathogens on the global and continental scales and its impact on plant disease. Science, 2002, 297(5581): 537-541.
[24] MEYER M, COX J A, HITCHINGS M D T, BURGIN L, HORT M C, HODSON D P, GILLIGAN C A. Quantifying airborne dispersal routes of pathogens over continents to safeguard global wheat supply. Nature plants, 2017, 3(10): 780-786.
[25] NELSON R R, TUNG G. Influence of some climatic factors on sporulation by an isolate of race T ofon a susceptible malesterile corn hybrid. Plant Disease Reporter, 1973, 57: 304-307.
[26] ARTHURS S, THOMAS M B. Effects of temperature and relative humidity on sporulation ofvar.in Mycosed Cadavers of. Journal of Invertebrate Pathology, 2001, 78(2): 59-65.
[27] LAWRENCE E G, ZEHR E I. Environmental effects on the development and dissemination ofon peach. Phytopathology, 1982, 72(7): 773-776.
[28] LALANCETTE N, FOSTER K A, ROBISON D M. Quantitative models for describing temperature and moisture effects on sporulation ofon peach. Phytopathology, 2003, 93(9): 1165-1172.
[29] LALANCETTE N, MCFARLAND K A, BURNETT A L. Modeling sporulation ofon nectarine twig lesions: Relative humidity and temperature effects. Phytopathology, 2012, 102(4): 421-428.
[30] WARD S V, MANNERS J G. Environmental effects on the quantity and viability of conidia produced by. Transactions of the British Mycological Society, 1974, 62(1): 119-128.
[31] REUVENI R, ROTEM J. Effect of humidity on epidemiological patterns of the powdery mildew (on squash. Phytoparasitica, 1974, 2(1): 25-33.
[32] LI X, LI B H, LIAN S, DONG X L, WANG C X, LIANG W X. Effects of temperature, moisture and nutrition on conidial germination, survival, colonization and sporulation of. European Journal of Plant Pathology, 2019, 153(2): 557-570.
[33] JAT M K, AHIR R R. Effect of temperature, relative humidity and pH on mycelial growth and sporulation ofcausing root rot of Indian Aloe (Mill.). Journal of Pineal Research, 2013, 29: 181-183.
[34] INGOLD C T. A gas phase in viable fungal spores. Nature, 1956, 177(4522): 1242-1243.
[35] 揣红运, 石延霞, 柴阿丽, 杨杰, 谢学文, 李宝聚. 10%乙霉威·腐霉利微粉剂的研制及其对黄瓜棒孢叶斑病的防治效果. 中国农业科学, 2019, 52(6): 1009-1020. doi: 10.3864/j.issn.0578-1752.2019. 06.005.
CHUAI H Y, SHI Y X, CHAI A L, YANG J, XIE X W, LI B J. Development of 10% diethofencarb·procymidone micropowder and its control efficacy to cucumberleaf spot. Scientia Agricultura Sinica, 2019, 52(6): 1009-1020. doi: 10.3864/j.issn.0578- 1752.2019.06.005. (in Chinese)
[36] 揣红运, 谢学文, 石延霞, 柴阿丽, 李宝聚. 枯草芽胞杆菌微粉剂的研制及其对黄瓜白粉病的防治效果. 植物病理学报, 2019, 49(5): 660-669.
CHUAI H Y, XIE X W, SHI Y X, CHAI A L, LI B J. Preparation of micropowder ofand its control effect on cucumber powdery mildew. Acta Phytopathologica Sinica, 2019, 49(5): 660-669. (in Chinese)
[37] 谢学文, 揣红运, 李磊, 柴阿丽, 石延霞, 李宝聚. 10%乙霉威·腐霉利微粉剂在设施黄瓜上的沉积分布及残留消解动态. 农药学学报, 2020, 22(2): 378-387.
XIE X W, CHUAI H Y, LI L, CHAI A L, SHI Y X, LI B J. Deposition distribution and dissipation dynamics of 10% diethofencarb + procymidone micropowder in facility cucumber. Chinese Journal of Pesticide Science, 2020, 22(2): 378-387. (in Chinese)
[38] 苑宝洁, 李磊, 李新宇, 杨文, 石延霞, 柴阿丽, 张红杰, 谢学文, 李宝聚. 解淀粉芽胞杆菌ZF57微粉剂的研制及对黄瓜棒孢叶斑病的防治效果. 植物病理学报, 2022, 52(2): 235-246.
YUAN B J, LI L, LI X Y, YANG W, SHI Y X, CHAI A L, ZHANG H J, XIE X W, LI B J. Preparation ofZF57 micropowder and its control effect on cucumber coryneform leaf spot. Acta Phytopathologica Sinica, 2022, 52(2): 235-246. (in Chinese)
Effect of humidity on sporulation and release ofand control technology
CHAI ALi1, YANG HongMin1,2, WANG ShaoHua1, ZHAO Kun1, GAO Wei3, SHI YanXia1, XIE XueWen1, LI Lei1, FAN TengFei1, LI BaoJu1
1Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences/State Key Laboratory of Vegetable Biobreeding, Beijing 100081;2College of Plant Protection, Shenyang Agricultural University, Shenyang 110866;3Institute of Plant Protection, Tianjin Academy of Agricultural Sciences, Tianjin 300381
【Objective】Cucumber target leaf spot, caused by, has brought great economic losses to the cucumber industry. Sporulation and release of.sporesplay a significant role in the epidemiology of the disease. In this study, the regularity andthe effect of humidity on sporulation and release of, and the optimal application method and time for control of cucumber target leaf spot were evaluated.【Method】The sporulation regularity ofwas evaluated by quantifying the spore concentration on lesions of diseased cucumber leaves at 0: 00, 3: 00, 6: 00, 9: 00, 12: 00, 15: 00, 18: 00, and 21: 00, respectively. The release regularity ofwas evaluated in different seasons of spring, summer, autumn and winter, air samples were collected from naturally infested cucumber greenhouse at 0: 00, 3: 00, 6: 00, 9: 00, 12: 00, 15: 00, 18: 00, and 21: 00, respectively, and the concentrations ofin the air were evaluated. The effect of relative humidity on sporulation and release ofwas also assessed in artificial climate exposure chambers and plastic greenhouses at four different humidity conditions of continuous high humidity (RH>90%, 24 h), continuous low humidity (RH<60%, 24 h), high humidity for 12 h followed by low humidity for 12 h, and low humidity for 12 h followed by high humidity for 12 h. The control efficiency of 60% carbendazim·diethofencarb wettable powder (WP) and 500 million spores/gWP on cucumber target leaf spot disease was compared, by using powder spraying and water spraying at different application times in the field.【Result】The study on the daily variation regularity of sporulation and release ofshowed significant differences in the quantity of spores on diseased leaves and in the greenhouse air at different times of the day. there was a complementary relationship between the number of spores on diseased leaves and in the greenhouse air at the same time. After 18: 00, as the duration of high humidity (RH>90%) prolonged, the number of spores on diseased leaves increased, reaching a peak of 1 344 spores/cm2at 6: 00 the next day. Then, the humidity decreased gradually to RH<60% after opening the air vent of the greenhouse, and spores were released into the greenhouse space. At 12: 00, the spore concentrations in the greenhouse air reached a peak of 12 445-110 697 spores/m3. In different seasons of spring, summer, autumn, and winter, the daily variation regularity of sporulation and release is consistent, showing that.produced a large amount of spores under high humidity (RH>90%) at night, and released to greenhouses under low humidity (RH<60%) during the day. In artificial climate exposure chambers and plastic greenhouses, the highest quantity ofspores was detected under alternating wet and dry conditions, which was significantly higher than that under continuous high humidity or continuous low humidity condition. By powder spraying at 19: 00, 60% carbendazim·diethofencarb WP and 500 million spores/gWP gave the best control efficiency of 80.60% and 75.08%, respectively, and the spore inhibition efficiency was higher than 84%.【Conclusion】Humidity is a key environmental factor affecting the spore reproduction and release of. The alternating day-dry and night-wet environment in the greenhouse promotes the reproduction and diffusion of., and accelerates the spread of cucumber target leaf spot. Powder spraying method is better than water spraying method for disease control, and the best application time is the evening before spore reproduction. The results of this study will contribute to the development of new strategies for the effective alleviation and control of cucumber target leaf spot.
cucumber target leaf spot;; humidity; sporulation; release; powder spraying; application time

10.3864/j.issn.0578-1752.2023.15.006
2023-04-26;
2023-06-06
国家自然科学基金(31972482)、国家重点研发计划(2022YFD1601500)、中国农业科学院科技创新工程(CAAS-ASTIP-IVFCAAS)、国家大宗蔬菜产业技术体系(CARS-23)
柴阿丽,E-mail:chaiali@caas.cn。杨红敏,E-mail:2575964580@qq.com。柴阿丽和杨红敏为同等贡献作者。通信作者李宝聚,E-mail:libaojuivf@163.com
(责任编辑 岳梅)
