免疫沉淀联合LC-MS/MS筛选猪肝星状细胞中葡萄糖调节蛋白GRP94的互作蛋白
2023-08-15王枭鸿邢明杰顾宪红郝月
王枭鸿,邢明杰,顾宪红,郝月
免疫沉淀联合LC-MS/MS筛选猪肝星状细胞中葡萄糖调节蛋白GRP94的互作蛋白
王枭鸿,邢明杰,顾宪红,郝月
中国农业科学院北京畜牧兽医研究所/畜禽营养与饲养全国重点实验室,北京 100193
【背景】随着规模化、集约化生产程度的不断提高,养殖过程中饲养空间受限、冷热环境不适等因素常使猪处于应激状态。内质网应激(endoplasmic reticulum stress, ERS)可能是最早期的应激反应,与细胞凋亡、代谢等方面有密切联系。肝脏是机体的主要代谢器官,猪养殖过程中由于人工操作(如断奶)、饲料霉变、温度变化和吸入有害气体等因素都会造成猪肝脏的ERS,不仅会造成肝脏损伤,还会引发肝脏的脂肪代谢紊乱和广泛的炎症反应,影响生产性能和繁殖性能。因此,深入探讨缓解ERS的有效措施,有助于减少猪养殖过程中的隐性损失。【目的】利用免疫沉淀联合质谱技术,从猪肝星状细胞中筛选在ERS条件下与葡萄糖调节蛋白94(GRP94)相互作用的细胞蛋白,为进一步探讨GRP94对猪肝星状细胞生物学功能的保护作用机理奠定基础。【方法】首先将GRP94抗体固定在谷胱甘肽亲和磁珠上,用亲和磁珠与ERS条件下或正常条件下猪肝星状细胞总蛋白进行孵育,与GRP94诱饵蛋白结合的蛋白复合物洗脱收集后,进行SDS-PAGE凝胶电泳验证。将验证成功的样品洗脱液进行液相色谱串联质谱(LC-MS/MS)检测,鉴定出正常条件和ERS条件下GRP94的互作蛋白。运用生物信息学在线软件对筛选的互作细胞蛋白进行 GO 富集、KEGG 信号通路注释和蛋白互作网络分析,并对其中的互作蛋白之一波形蛋白(vimentin)进行免疫共沉淀验证。【结果】筛选到正常条件下与GRP94存在互作关系的蛋白146个,ERS条件下与GRP94存在互作关系的蛋白76个,在两种情况下都存在互作关系的蛋白44个。ERS条件下有互作关系的76个蛋白质主要参与凋亡过程负调控、肽段交联、泛素依赖型ERAD(endoplasmic reticulum associated degradation)过程和过氧化氢分解代谢等过程。其中参与凋亡过程负调控的GRP94互作蛋白有albumin、catalase、filament A、heat shock protein family A member 5、keratin 18和prohibin 2,说明GRP94可能与这些蛋白共同发挥抗凋亡作用。除此之外组成中间丝纤维的vimentin蛋白参与多个GO富集的通路,可能与GRP94有重要的互作关系。进一步的免疫共沉淀试验也证实,ERS条件下vimentin和GRP94之间确实存在互作关系。此外,某些ERS条件下特异性表达的GRP94互作蛋白(如peroxiredoxin、death inducer obliterator 1、catalase、glandular kallikrein、pyruvate kinase等)与抗凋亡有密切联系。【结论】ERS条件下,猪肝脏GRP94互作蛋白主要参与抗凋亡、对未折叠蛋白进行折叠和维护细胞内稳态相关的信号通路。该结论为下一步开展GRP94参与肝脏ERS调控机制的研究打下基础。
ERS;肝细胞;GRP94;互作蛋白;猪
0 引言
【研究意义】畜禽生产中,规模化、集约化程度越来越高,饲养空间受限[1]、冷热环境不适[2]、饲料结构[3]、生产操作[4]等常常会导致畜禽产生应激,影响其健康状态和生产性能,给养殖业造成巨大的隐性损失。广泛存在的应激反应会导致细胞应激,影响细胞存活。当机体处于应激状态时,细胞内质网出现大量的未折叠蛋白和错误折叠蛋白,引发细胞的内质网应激(endoplasmic reticulum stress, ERS)。有研究指出,ERS可能是细胞应激状态下最早期的反应[5]。在ERS下未折叠蛋白反应(unfold protein response, UPR)由3种经典途径激活,包括肌醇需要酶1、激活转录因子6、和蛋白激酶R样内质网激酶,激活内质网伴侣蛋白等保护分子表达,减少内质网负荷和未折叠及错误折叠蛋白的数量,以保护细胞,对抗应激[6-7]。温度变化[8]、断奶应激[9]、营养物质缺乏或过剩[10]、饲料污染[11]和细菌感染[12]等都被证实会引发家畜的ERS反应。目前ERS在肠道上的研究相对较多,已经发现ERS会引发动物肠道的屏障和黏膜受损,造成腹泻和细胞的凋亡,不仅影响营养物质的消化吸收,还与肠道炎症关系密切[13]。而肝脏作为动物体内最大的代谢器官,含有丰富的内质网,与糖脂代谢联系密切,因此,近年来对于肝脏ERS的研究也逐渐增多。生产过程(如仔猪的断奶应激)会引发肝脏的ERS反应,导致肝脏重量显著下降,肝脏中总胆固醇和总甘油三酯含量上升,进而引起肝脏的脂肪变性。饲料中过多微量物质的摄入也会导致猪肝脏的ERS,造成肝脏的炎症反应、成脂基因的上调,甚至促进细胞凋亡[14]。养殖环境中常见的硫化氢气体也被证明能诱发猪肝脏的ERS,伴随着肝脏的脂代谢紊乱。营养上以高脂饮食诱导的脂肪肝猪模型中也发现,肝脏上出现ERS和胶原堆积[15]。笔者团队前期利用衣霉素(Tunicamycin,TM)在仔猪上建立ERS模型,发现肝脏出现ERS的同时还伴随脂肪变性、黄疸和炎症等病理现象,仔猪表现为采食量明显下降、肝损伤严重和脂代谢紊乱[16]。因此,明确ERS对猪肝脏的负面影响,为生产上制定切实有效的ERS调控策略提供理论依据。【前人研究进展】研究发现,在肝细胞上用在热休克蛋白90(heat shock protein 90, HSP90)抑制剂抑制HSP90表达后,细胞增殖能力受到抑制,细胞凋亡上升。并且在TM诱导的ERS下,细胞凋亡上升程度更为显著[17],说明HSP90在ERS下对细胞的存活十分重要。葡萄糖调节蛋白94(glucose regulated protein 94, GRP94)又称HSP90B1(heat shock protein 90 B1),是HSP90家族的分子伴侣。作为已知的ERS标志蛋白之一,GRP94参与蛋白的折叠和加工,在应激状态下维持内质网的稳定[18],保护细胞[19-20]。GRP94可通过与多种蛋白互作,发挥其蛋白质量控制和应激响应的功能。如敲除小鼠肌肉中GRP94,发现小鼠出现轻微ERS的同时,肌肉中胰岛样生长因子1(IGF-1)的基因表达水平降低,骨骼肌重量明显下降[21],表明肌肉是主要依靠GRP94来产生IGF-1。【本研究切入点】蛋白质通常作为复合体的一部分发挥功能,复合体又是由几个或几种蛋白组成在一起,因此了解哪些蛋白质相互作用对于探究蛋白质生物功能是重要的一步[22]。液相色谱-质谱联用(LC-MS)技术成为蛋白质相互作用研究的首选,广泛应用于互作蛋白的筛选[23-25]。它使人们能够在相对较短的时间内检测出低丰度蛋白质,并从单个样品中高通量鉴定数百种蛋白质。笔者所在团队在前期利用衣霉素建立猪肝星状细胞ERS模型[26]的基础上,发现ERS下敲低猪肝星状细胞中GRP94的表达会导致细胞凋亡和UPR通路蛋白磷酸化的改变。进一步的蛋白互作网络预测表明,ERS下GRP94和IGF-1、PDIA3(protein disulfide-isomerase a3)等蛋白间存在互作[27]。但目前尚不清楚GRP94与其互作蛋白如何作用来实现其生物学功能,有必要开展相关试验进一步探索GRP94在ERS发挥生物学功能的分子机理。【拟解决的关键问题】基于GRP94可能在ERS条件下发挥对猪肝脏的保护作用,利用LC-MS质谱联合免疫沉淀技术,从猪肝星状细胞蛋白中筛选与GRP94相互作用的蛋白并进行功能分析,以期为深入研究GRP94参与肝脏ERS调控机制的研究提供理论依据。
1 材料与方法
1.1 试验进行时间及地点
试验于2020年7—12月在中国农业科学院北京畜牧兽医研究所畜禽营养与饲养全国重点实验室完成。
1.2 材料与试剂
IP蛋白抽提试剂(天德瑞 WB0024),BCA蛋白定量试剂盒(天德瑞 WB0028),2 mg·mL-1BSA标准品(天德瑞 WB0030),2×还原样品缓冲液(天德瑞 WB0031),10×Tris-Glycine-SDS电泳缓冲液(天德瑞 WB0035),10×TBST pH8.0(天德瑞 WB0043),湿转缓冲液(天德瑞 WB0039),NC膜,0.45 μm孔径(Millipore HATF00010),丽春红染色液(天德瑞 WB0042),BSA(Amresco 0332),PMSF(Amresco 0754),Acrylamide(Amresco 0341),Bis-Acrylamide(Amresco 0172),APS(Amresco 0486),Tween-20(Amresco 0777),TEMED(Amresco 0761),Ponceau S(Amresco 0860),Bromphenol Blue(Amresco 0449),DTT(Amresco 0281),NP-40(Amresco M158),Trizma base(Sigma T1503),Glycine(Sigma G8898),SDS(Sigma L4390),Sodium deoxycholate(Sigma D6750),蛋白酶抑制剂(Roche 11697498001),脱脂奶粉(伊利 Q/NYLB 0039S),ECL(Millipore WBKLS0500),甲醇(国药10014118),璜基水杨酸(国药10021516),TCA(国药80132618),氯化钠(国药10019392),山羊抗大鼠IgG(H+L),HRP(天德瑞S007)。
1.3 实验仪器
Fresco低温冷冻离心机(Thermo FRESCO21),MultiSkan3酶标仪(Thermo MULTISKAN MK3),Mini P-4电泳槽(Cavoy MP8001),湿转电泳槽(Cavoy MP3035),电泳仪(Bio-Rad 1645052),水平脱色摇床(其林贝尔 TS-2),酸度计(Sartorius PB-10)。
1.4 永生化猪肝星状细胞
细胞来自中国农业科学院北京畜牧兽医研究所畜禽营养与饲养全国重点实验室自备的永生化猪肝星状细胞系(专利号:CN201910084613.0)。
1.5 细胞蛋白抽提
用含10%胎牛血清、1%双抗和1%生长因子的ICELL星状细胞基础培养基,于含5%CO2完全饱和湿度的37 ℃恒温培养箱,培养永生化猪肝星状细胞。预冷IP-RIPA蛋白抽提试剂,加入蛋白酶抑制剂。在蛋白抽提开始前加入0.1 mol·L-1PMSF母液,PMSF终浓度1 mmol·L-1。按细胞量加入一定比例的裂解液,用枪头吹打充分悬起细胞,完成后在冰上孵育20 min,4℃离心,13 000 r/min,20 min。离心后取上清液,分装保存,待测。收集加入5 μg·mL-1的TM处理24 h后的细胞抽提蛋白作为ERS组(参数参照中国农业科学院北京畜牧兽医研究所畜禽营养与饲养全国重点实验室前期研究[26]),收集未加入TM的细胞抽提蛋白作为对照组。
1.6 BCA法蛋白定量
准备BCA工作液 A液﹕B液=50﹕1,稀释好各个提取BSA标准品。样品用PBS进行10倍稀释后定量。
样品﹕BCA工作液=1﹕8,混匀后37℃孵育30 min,酶标仪570 nm波长滤光片读取OD值。
1.7 IP样品制备
从1.3步骤中提取的两组蛋白液中分别取两份500 μL蛋白液,用BCA法测定溶液浓度。用PBS稀释至1 μg·μL-1左右,每一组蛋白液一份加GRP94抗体5 μL,一份设置为阴性对照空白IgG,4 ℃旋转混匀12 h,再各加入60 μL ProteinA/G悬液,4 ℃摇床孵育3 h。在4 ℃以2 500 r/min离心5 min,弃去上清液,收集磁珠沉淀;用预冷IP裂解液洗涤G-Agarose-抗体-蛋白复合物,3次,4 ℃离心,1 500×,3 min,收集沉淀。加入60 μL 2×还原loading,变性10 min,离心,收集上清液。
1.8 目的蛋白免疫印迹试验
取WB样本10 μg/孔,IP样品和对照样本8 μL/孔进行10% SDS-PAGE分析,用湿转法将蛋白条带转印到0.45 μm孔径NC膜上。将膜完全浸没3% BSA- TBST中室温封闭30 min;4 ℃过夜孵育GRP94抗体(1﹕50 000稀释),TBST洗膜5次;再用HRP-羊抗鼠二抗(1﹕10 000稀释)在 37 ℃孵育40 min,TBST洗膜6次,最后滴加显影剂曝光并分析结果。
1.9 质谱与生物信息学分析
分别切取对照组和ERS组IP样品短胶中与GRP94特异性结合的蛋白条带,送北京博奥麦斯科技有限公司进行分析。酶解蛋白条带后,利用液相-串联质谱(LC-MS/ MS)进行串联质谱测序。所得质谱数据经过MaxQuant(version 2.0.1.0)检索。检索参数为:猪蛋白数据库,胰蛋白酶酶切,最多2个漏切位点,母离子的质量误差为标准质量的2×10-5倍,碎片离子质量误差0.02 Da,固定修饰为Carbamidomethyl(C),可变修饰为Oxidation(M),Acetyl(N-terminal)。多肽和蛋白假发现率(FDR)<1.0%,每个蛋白至少鉴定到1个特异性多肽。使用数据库为:uniprot_SUS_49792_20220114.fasta。
1.10 波形蛋白(vimentin)和GRP94的互作验证
取ERS条件下WB样本10 μg/孔,IP样品和对照样本8 μL/孔,进行10% SDS-PAGE分析,用湿转法将蛋白条带转印到0.45 μm孔径NC膜上。将膜完全浸没3% BSA-TBST中室温封闭30 min;4 ℃过夜孵育vimentin抗体(1﹕2 000稀释),TBST洗膜5次;再用HRP-羊抗鼠二抗(1﹕5 000稀释)在 37 ℃孵育40 min,TBST洗膜6次;滴加显影剂曝光,分析结果。
2 结果
2.1 猪肝星状细胞中GRP94互作蛋白的富集与质谱鉴定
试验采用免疫沉淀法获得同GRP94具有相互作用的蛋白质。结果显示,正常情况下和ERS条件下,input组和IP样本组在大约94 kDa处都存在明显的条带,说明免疫沉淀GRP94成功(图1)。切取对照组和ERS组IP样品短胶中与GRP94特异性结合的条带,进行质谱鉴定。去除空白对照组中出现的假阳性结合蛋白后,得到互作蛋白。结果发现,正常条件下与GRP94有互作的蛋白146个,ERS条件下与GRP94有互作的蛋白76个,两种情况下都存在互作的蛋白44个(图2)。而与GRP94在ERS条件下特异性结合的互作蛋白有32个,其中包括PRDX1(peroxiredoxin-1)、PRDX2(peroxiredoxin-2)、DIDO1(Death inducer obliterator 1)和CAT(catalase)等重要的功能蛋白。
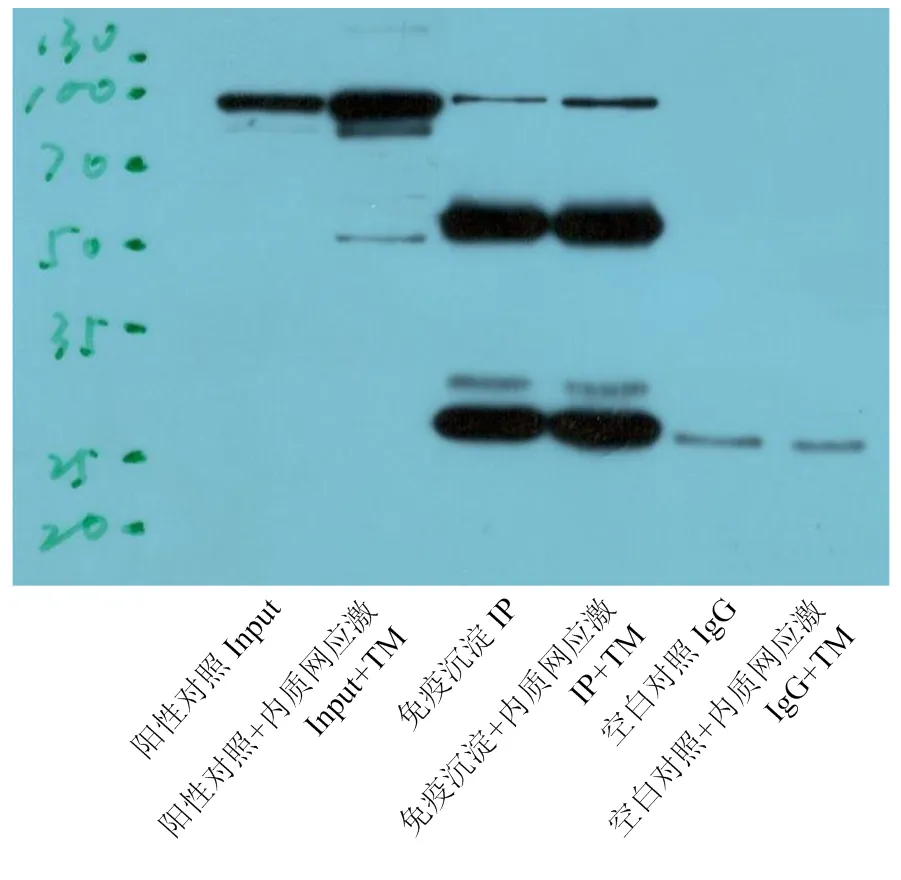
WB验证在正常和ERS条件下免疫沉淀GRP94的互作蛋白是否成功。Input:细胞裂解液;input+TM:经TM处理的细胞裂解液;IP:抽提细胞蛋白后,经定量和GRP94抗体孵化后制备的免疫沉淀样本;IP+TM:抽提TM处理下的细胞蛋白后,经定量和GRP94抗体孵化后制备的免疫沉淀样本;空白IgG:免疫沉淀样本加入对照小鼠抗体;空白IgG+TM:经TM处理后制备的免疫沉淀样本加入对照小鼠抗体
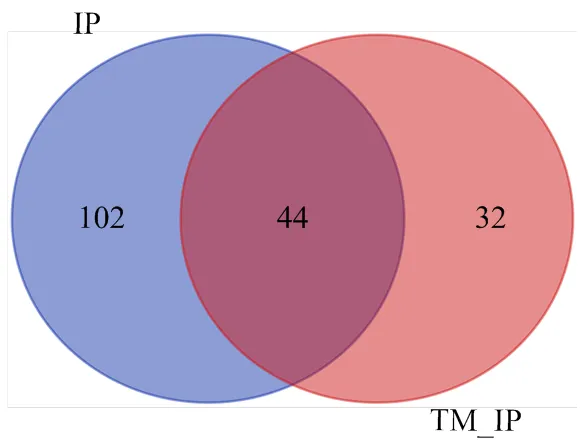
IP对应蓝圈,说明在正常条件下有146个蛋白质与GRP94存在互作关系;TM_IP对应红圈,说明在ERS下有76个蛋白质与GRP94存在互作关系;两圈重叠的区域呈深红色,说明有44个蛋白质在两种条件下都与GRP94存在互作关系
2.2 ERS条件下GRP94互作蛋白组聚类分析
对ERS条件下与GRP94有互作关系的76个蛋白进行GO分析,取差异显著情况下分子功能、细胞组分和生物学过程富集程度TOP10的通路作图(图3)。生物学过程分析显示,GRP94互作蛋白主要参与凋亡过程负调控、肽段交联和泛素依赖型ERAD(endoplasmic reticulum associated degradation)过程等。细胞组分分析显示,互作蛋白主要富集在细胞质、胞外的外泌体和中间丝纤维等组分中。分子功能分析显示,互作蛋白主要参与结构分子激活、未折叠蛋白结合和支架蛋白结合等功能。KEGG分析发现,GRP94互作蛋白主要参与内质网内蛋白加工、沙门氏菌感染、抗体加工和呈递、雌激素信号通路和脂质与动脉粥样硬化等通路(图4)。说明GRP94在ERS下通过加工内质网内蛋白、免疫系统激活、脂质调控和激素合成等途径调控细胞稳态。凋亡过程的负调控指预防或阻止细胞凋亡频率的生物学过程,富集在此通路的蛋白除GRP94外,还有ALB(albumin)、CAT、FLNA(filamin A)、HSPA5(heat shock protein family A member 5)、KRT18(keratin 18)和PHB2(prohibitin 2)6个蛋白质,表明GRP94通过与这些蛋白的相互作用来发挥抗凋亡作用。
进一步对互作蛋白构建蛋白相互作用关系网络(图5),发现其中具有重要调控功能的蛋白分子包括PDIA3、ATP5A1(ATP synthase subunit 2)、ITGB1(intergrin β-1)、vimentin等,且vimentin在GO富集分析中参与了生物学过程、细胞组分和分子功能的多条通路。尤其在细胞组分分析中,细胞质、中间丝纤维和胞液都定位到了vimentin,说明GRP94可能在多个位置都与vimentin发生相互作用,共同发挥生物学功能。
2.3 vimentin和GRP94的互作验证
将ERS条件下的IP样品用免疫共沉淀进行GRP94和vimentin的互作关系验证。共沉淀结果(图6)显示,IP样品在大约54 kDa处出现目的条带,说明GRP94在ERS条件下与vimentin存在互作关系。
3 讨论
在细胞上,应激最早期的反应就是内质网内出现大量未折叠和错误折叠的蛋白,即出现ERS,导致胞内稳态的破坏,畜禽表现为生产性能、繁殖性能的下降和代谢紊乱。猪缺乏汗腺,皮下脂肪厚重,因而更易受到环境应激的影响,饲料霉变、温度变化和病菌感染等都会引发猪肝脏产生内质网应激。当细胞发生ERS时,其会诱发未折叠蛋白反应,内质网膜上的GRP78、GRP94与PERK(protein kinase RNA-like ER kinase)、IRE1(inositol-requiring enzyme-1)和ATF6(activating transcription factor 6)解离,3种跨膜蛋白分别激活其下游通路来恢复细胞稳态及机体功能。此外,除经典的UPR通路外,ERS条件下独立于UPR通路的其他分子,如糖原合成激酶(glycogen synthetase kinase 3β)也有缓解ERS的作用[28]。肝脏作为机体主要代谢器官,存在大量内质网,适合作为ERS研究的试验材料。在分子功能研究中,常以猪肝脏的原代细胞作为细胞来源,但原代细胞对体外培养条件要求苛刻,存在存活时间短、产量有限和传代困难等问题,因此亟需建立永生化的猪肝细胞系。笔者所在实验室克服了猪作为大动物无法进行灌流和养殖环境较差,难以分离出无菌肝脏组织的问题,利用SV40LT过表达慢病毒转染正常的猪肝星状细胞,获得了与原代猪肝星状细胞形态和特性无明显差别的永生化猪肝星状细胞系(专利号:CN201910084613.0)。GRP94是HSP90家族的分子伴侣,主要存在于内质网中,是ERS的重要反应因子。当细胞出现ERS时,诱发UPR反应,启动ERS反应元件,从而使GRP94在应激条件下表达量显著增强。作为UPR通路的上游分子,与细胞凋亡、脂代谢紊乱等ERS相关的表型存在明显的相关。笔者前期研究也证明,ERS条件下GRP94对细胞具有保护作用,但其具体与哪些蛋白共同发挥作用尚不清楚。本研究利用免疫沉淀方法获得GRP94的互作蛋白,随后采用质谱分析鉴定出正常情况和ERS条件下与GRP94结合的蛋白。
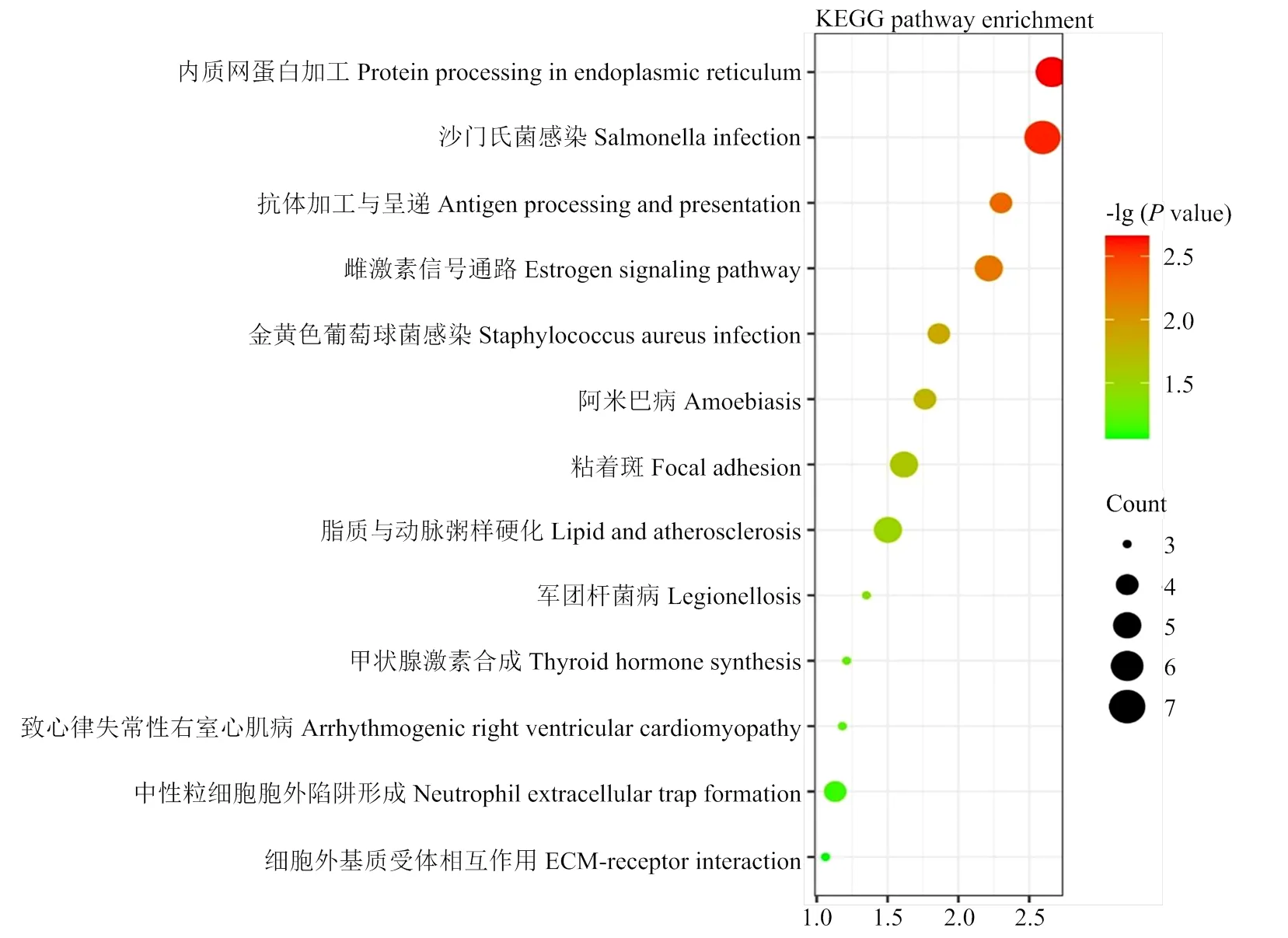
图中每一个圆点表示一个 KEGG 通路,圆点的大小代表富集到该通路的蛋白数目,圆点的颜色代表 P value,P value 越小表示蛋白在该通路中的富集显著性越可靠。纵轴表示 pathway 名称,横轴表示 -lg(P value)
3.1 GRP94互作蛋白的生物信息学分析
对ERS条件下与GRP94相互作用的蛋白质进行数据库搜索和生物信息学分析,GO富集显示这些蛋白质主要参与凋亡过程负调控、肽段交联、泛素依赖型ERAD和过氧化氢分解代谢等过程,说明GRP94在ERS下主要通过ERAD过程和抗氧化作用来发挥抗凋亡作用。参与凋亡过程负调控这一生物学过程的GRP94互作蛋白有ALB、CAT、FLNA、HSPA5、KRT18和PHB2 6个蛋白质。ALB是一种具有清除自由基活性的抗氧化剂,可以缓解细胞的氧化应激和由此引起的细胞凋亡[29]。不过也有研究发现,如果胞内存在过多的ALB也会引发细胞的ERS,进而导致凋亡[30]。这可能是长时间ERS导致细胞凋亡的机制之一。CAT可催化过氧化氢分解成氧和水的酶,存在于细胞的过氧化物酶体内,参与酶抗氧化防御机制。敲除CAT的小鼠在体内表现为氧化还原失衡,细胞代谢由于ERS反应被干扰,非酒精性脂肪肝疾病加重等特点[31-32]。细胞中FLNA通过与肌动蛋白交联和调整细胞骨架与细胞膜的接触,来维持细胞骨架[33]。当细胞内发生钙离子失调引起ERS时,FLNA通过与UPR的重要传感蛋白PERK互作来加强内质网和原生质膜的接触,从而恢复胞内钙稳态[34]。HSPA5基因可以编码内质网网腔内的结合免疫球蛋白,进而协助蛋白质的折叠和ERAD过程,并启动UPR来缓解ERS。角蛋白是中间丝纤维的主要成分,对维持细胞结构起重要作用。如当血管平滑肌受到机械损伤后,伴随着有丝分裂刺激,KRT18会大量表达[35]。KRT18可以作为细胞凋亡的早期标志物[36],这也说明GRP94可能通过调节细胞骨架来发挥抗凋亡作用。PHB2是高度保守的支架蛋白,最近发现它是线粒体自噬的一种重要内膜受体[37],即可以通过选择性地去除受损或不需要的线粒体,参与线粒体的质量控制和维持胞内稳态。当通过阻断PHB2来抑制线粒体自噬时,细胞的生长和产能都会被显著抑制[38],推测GRP94可通过影响线粒体的自噬来调控细胞凋亡。细胞组分分析发现,GRP94互作蛋白主要定位在细胞质、细胞外的外泌体和中间丝纤维上。vimentin,krt 18等都是中间丝纤维的重要组成成分,且vimentin还参与了蛋白质翻译的正向调节这一生物学过程和多个分子功能的实现,可见GRP94与vimentin之间存在重要的互作关系。
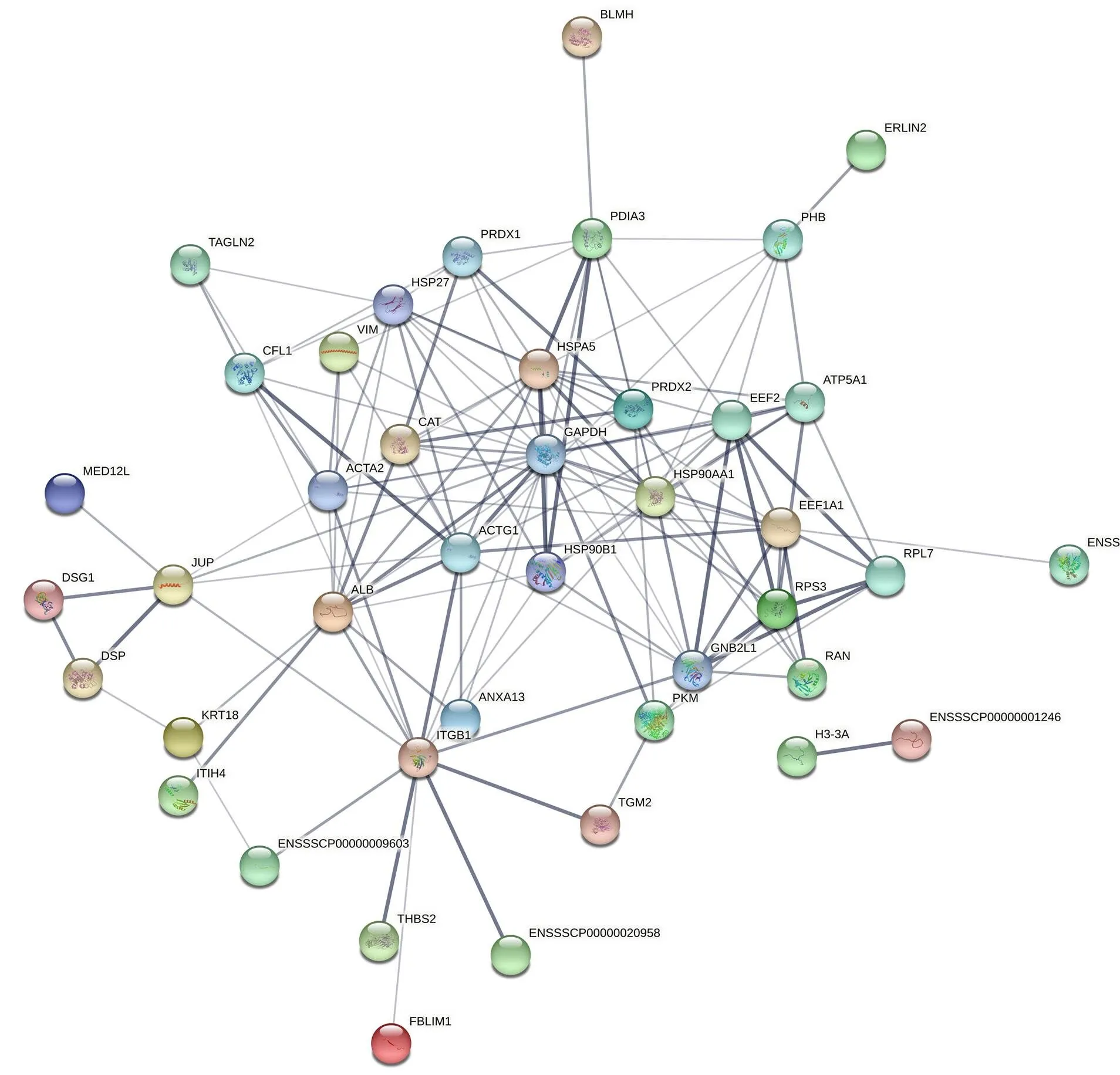
将蛋白ID与string数据库中的蛋白做比对,选择互作 Confidence score 打分大于0.4的蛋白质,获得蛋白相互作用信息。使用 STRING 工具集成了功能交互网络模型,图中节点代表蛋白,两节点之间的连线代表两节点代表的蛋白之间存在互作关系,连线的粗细反映互作的强弱
3.2 免疫共沉淀验证vimentin和GRP94之间存在互作
vimentin 蛋白是 III 型中间丝纤维蛋白家族中表达最广泛的蛋白之一,具有高度保守的α螺旋“杆状”结构域,由头部、杆和尾结构域组成,能稳定细胞结构[39]。vimentin作为中间丝纤维的成分,主要负责细胞骨架的完整性。有研究发现,应用硫酸锌可以缓解由邻苯二甲酸二丁酯引起的ERS和细胞凋亡,同时还可改善波形蛋白的降解,防止精母细胞从输精管上皮脱落[40]。说明vimentin不仅在维持细胞功能结构方面有重要作用,而且受到ERS的调控。本试验的免疫共沉淀结果也证实vimentin与GRP94存在互作关系。
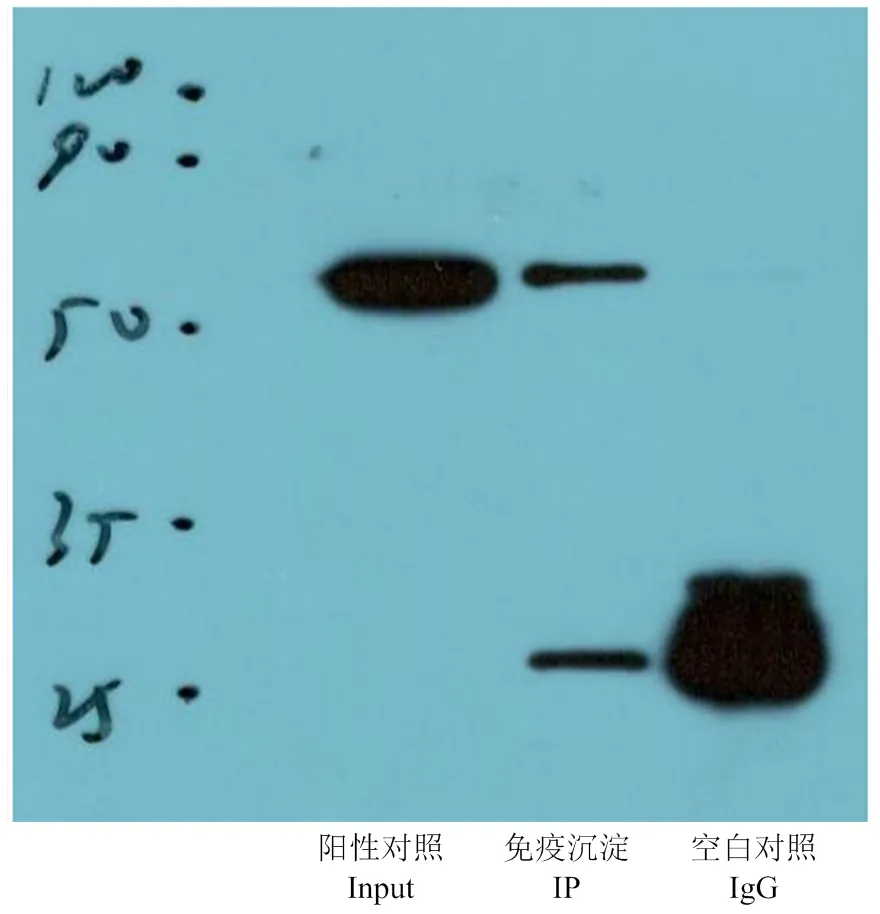
免疫共沉淀验证vimentin和GRP94的互作关系。Input:细胞裂解液;IP:抽提细胞蛋白后,经定量和GRP94抗体孵化后制备的免疫沉淀样本;空白IgG:免疫沉淀样本加入对照小鼠抗体
3.3 ERS条件下与GRP94互作的功能蛋白
通过韦恩图可知,仅在ERS条件下与GRP94存在互作关系的蛋白有32个,其中PRDX1、PRDX2、DIDO1、CAT、Glandular kallikrein和Pyruvate kinase等蛋白与机体缓解ERS的机制密切相关。PRDX1和2都是过氧化物酶,具有抗氧化功能,参与机体的氧化还原反应过程。先前的研究中将敲除PRDX2的小鼠放在低氧环境,发现小鼠体内细胞因子迅速大量增加,内皮血管出现炎症反应,并引发了肝脏的ERS。而在体内融合重组PRDX2后,炎性血管病变和ERS反应减轻,说明该蛋白对低氧环境中的不良反应具有重要的阻断作用[41]。PRDX1具有抗动脉粥样硬化的特性,TDAG51(T-cell death-associated gene 51)可被ERS诱导,其表达上升时会促进细胞凋亡。在载脂蛋白E和TDAG51同时敲除的小鼠中发现,与单纯敲除载脂蛋白E相比,氧化应激和ERS条件下的细胞保护作用增强,PRDX1表达出现上调,动脉粥样硬化得到了缓解[42]。由于动脉粥样硬化本身就可被ERS引起的细胞凋亡所诱导,因此PRDX1很可能与GRP94一起在ERS条件下调节内环境稳态。glandular kallikrein在许多不利环境下(如乙醚麻醉、饥饿和口服盐酸等)会出现释放量的微弱增加,但在热应激诱导的唾液中释放显著增加,说明该分子参与了机体对热应激的调节[43]。热应激可以引起ERS,因此该分子可能在ERS下发挥重要的调节作用。pyruvate kinase在合成丙酮酸过程中有催化作用,参与碳水化合物代谢,已被证明参与多种细胞凋亡过程。在敲除胰腺β细胞的pyruvate kinase后,由ERS诱导的细胞凋亡增加[44]。DIDO1对细胞的早期凋亡有调节作用[45],在敲除该基因后内皮细胞的增殖受到显著抑制[46]。这些蛋白也都与抵抗应激反应关系密切,因此推测在机体处于ERS时,GRP94会特异性地与这些蛋白发生相互作用,以增强自身的防御能力,缓解ERS,防止细胞凋亡。
4 结论
利用猪肝星状细胞,通过免疫沉淀联合LC-MS/ MS技术,共筛选到正常条件下与GRP94存在互作关系的蛋白146个,ERS条件下与GRP94存在互作关系的蛋白76个,两种情况下都存在互作关系的蛋白44个。ERS下与GRP94存在互作的蛋白主要参与抗凋亡、对未折叠蛋白进行折叠和维护细胞内稳态等相关信号通路。该结论为下一步开展GRP94参与肝脏ERS调控机制的研究打下基础。
[1] 甘靖宇, 孙维婧, 卢嘉茵, 王子旭, 陈耀星, 董玉兰. 限位栏对孕猪应激水平及神经内分泌HPA轴的影响. 中国兽医杂志, 2021, 57(7): 1-6.
GAN J Y, SUN W J, LU J Y, WANG Z X, CHEN Y X, DONG Y L. Effect of restraint stress on stress level of pregnant sows and neuroendocrine HPA axis. Chinese Journal of Veterinary Medicine, 2021, 57(7): 1-6. (in Chinese)
[2] YONG Y H, LI J Y, GONG D L, YU T Y, WU L Y, HU C Y, LIU X X, YU Z C, MA X B, GOONERATNE R, EL-ATY A M A, CHEN J J, JU X H. ERK1/2 mitogen-activated protein kinase mediates downregulation of intestinal tight junction proteins in heat stress-induced IBD model in pig. Journal of Thermal Biology, 2021, 101: 103103.
[3] LIAO J Z, HU Z Y, LI Q W, LI H J, CHEN W J, HUO H H, HAN Q Y, ZHANG H, GUO J Y, HU L M, PAN J Q, LI Y, TANG Z X. Endoplasmicstress contributes to copper-induced pyroptosis via regulating the IRE1α-XBP1pathway in pig jejunal epithelial cells. Journal of Agricultural and Food Chemistry, 2022,70(4): 1293-1303.
[4] KAPOOR A, MATTHEWS S G. Prenatal stress modifies behavior and hypothalamic-pituitary-adrenal function in female Guinea pig offspring: Effects of timing of prenatal stress and stage of reproductive cycle. Endocrinology, 2008, 149(12): 6406-6415.
[5] WU J, KAUFMAN R J. From acute ER stress to physiological roles of the Unfolded Protein Response. Cell Death & Differentiation, 2006, 13(3): 374-384.
[6] CORAZZARI M, GAGLIARDI M, FIMIA G M, PIACENTINI M. Endoplasmicstress, unfolded protein response, and cancer cell fate. Frontiers in Oncology, 2017, 7: 78.
[7] ZHU G Y, LEE A S. Role of the unfolded protein response, GRP78 and GRP94 in organ homeostasis. Journal of Cellular Physiology, 2015, 230(7): 1413-1420.
[8] CUI Y, HAO Y, LI J, GAO Y, GU X. Proteomic changes of the porcine skeletal muscle in response to chronic heat stress. Journal of the Science of Food and Agriculture, 2018, 98(9): 3315-3323.
[9] HE Y, FAN X X, LIU N, SONG Q Q, KOU J, SHI Y H, LUO X, DAI Z L, YANG Y, WU Z L, WU G Y. L-glutamine represses the unfolded protein response in the small intestine of weanling piglets. The Journal of Nutrition, 2019, 149(11): 1904-1910.
[10] YOGALAKSHMI B, SATHIYA PRIYA C, ANURADHA C V. Grape seed proanthocyanidins and metformin combination attenuate hepatic endoplasmic reticulum stress in rats subjected to nutrition excess. Archives of Physiology and Biochemistry, 2019, 125(2): 174-183.
[11] LONG M, CHEN X L, WANG N, WANG M Y, PAN J W, TONG J J, LI P, YANG S H, HE J B. Proanthocyanidins protect epithelial cells from Zearalenone-induced apoptosis via inhibition of endoplasmicstress-induced apoptosis pathways in mouse small intestines. Molecules (Basel, Switzerland), 2018, 23(7): 1508.
[12] XU X G, ZHANG H L, ZHANG Q, HUANG Y, DONG J, LIANG Y B, LIU H J, TONG D W. Porcine epidemic diarrhea virus N protein prolongs S-phase cell cycle, induces endoplasmic reticulum stress, and up-regulates interleukin-8 expression. Veterinary Microbiology, 2013, 164(3/4): 212-221.
[13] 文伟, 陈凤鸣, 黄兴国, 李颖慧. 肠上皮细胞中内质网应激与动物肠道炎症机制的研究进展. 动物营养学报, 2020, 32(2): 530-539.
WEN W, CHEN F M, HUANG X G, LI Y H. Research progress of endoplasmicstress and intestinal inflammation mechanism in intestinal epithelial cells. Chinese Journal of Animal Nutrition, 2020, 32(2): 530-539. (in Chinese)
[14] PU J N, TIAN G, LI B, CHEN D W, HE J, ZHENG P, MAO X B, YU J, HUANG Z Q, YU B. Trace mineral overload induced hepatic oxidative damage and apoptosis in pigs with long-term high-level dietary mineral exposure. Journal of Agricultural and Food Chemistry, 2016, 64(8): 1841-1849.
[15] LI S J, DING S T, MERSMANN H J, CHU C H, HSU C D, CHEN C Y. A nutritional nonalcoholic steatohepatitis minipig model. The Journal of Nutritional Biochemistry, 2016, 28: 51-60.
[16] WANG X H, XIN H R, XING M J, GU X H, HAO Y. Acute endoplasmicstress induces inflammation reaction, complement system activation, and lipid metabolism disorder of piglet livers: a proteomic approach. Frontiers in Physiology, 2022, 13: 857853.
[17] WANG X, WANG S X, LIU Y T, DING W C, ZHENG K, XIANG Y F, LIU K S, WANG D M, ZENG Y Y, XIA M, YANG D P, WANG Y F. The Hsp90 inhibitor SNX-2112 induces apoptosis of human hepatocellular carcinoma cells: The role of ER stress. Biochemical and Biophysical Research Communications, 2014, 446(1): 160-166.
[18] LU T, WANG Y, XU K, ZHOU Z J, GONG J, ZHANG Y G, GONG H, DAI Q, YANG J, XIONG B, SONG Z, YANG G. Co-downregulation of GRP78 and GRP94 induces apoptosis and inhibits migration in prostate cancer cells. Open Life Sciences, 2019, 14: 384-391.
[19] MORITO D, NAGATA K. ER stress proteins in autoimmune and inflammatory diseases. Frontiers in Immunology, 2012, 3: 48.
[20] GARDNER B M, PINCUS D, GOTTHARDT K, GALLAGHER C M, WALTER P. Endoplasmic reticulum stress sensing in the unfolded protein response. Cold Spring Harbor Perspectives in Biology, 2013, 5(3): a013169.
[21] BARTON E R, PARK S, JAMES J K, MAKAREWICH C A, PHILIPPOU A, ELETTO D, LEI H, BRISSON B, OSTROVSKY O, LI Z, ARGON Y. Deletion of muscle GRP94 impairs both muscle and body growth by inhibiting local IGF production. FASEB Journal, 2012, 26(9): 3691-3702.
[22] WENDRICH J R, BOEREN S, MÖLLER B K, WEIJERS D, DE RYBEL B.identification of plant protein complexes using IP-MS/MS. Methods in Molecular Biology (Clifton, N J), 2017, 1497: 147-158.
[23] 王加峰, 刘浩, 王慧, 陈志强. 水稻NBS-LRR类抗稻瘟病蛋白Pik-h的互作蛋白筛选. 中国农业科学, 2016, 49(3): 482-490.
WANG J F, LIU H, WANG H, CHEN Z Q. Screening of putative proteins that are interacted with NBS-LRR protein Pik-h by the yeast two-hybrid system. Scientia Agricultura Sinica, 2016, 49(3): 482-490. (in Chinese)
[24] 窦万福, 祁静静, 胡安华, 陈善春, 彭爱红, 许兰珍, 雷天刚, 姚利晓, 何永睿, 李强. GST pull-down联合LC-MS/MS筛选柑橘抗溃疡病转录因子CsBZIP40的互作蛋白. 中国农业科学, 2019, 52(13): 2243-2255.
DOU W F, QI J J, HU A H, CHEN S C, PENG A H, XU L Z, LEI T G, YAO L X, HE Y R, LI Q. Screening of interacting proteins of anti-canker transcription factor CsBZIP40 inby GST pull-down combined with LC-MS/MS. Scientia Agricultura Sinica, 2019, 52(13): 2243-2255. (in Chinese)
[25] 原贵波, 莫双榕, 钱莹, 臧栋楠, 杨帆, 蒋红亮, 武媛, 丁海东. 应用GST pull-down技术筛选番茄SIVQ6互作蛋白. 中国农业科学, 2020, 53(15): 3146-3157.
YUAN G B, MO S R, QIAN Y, ZANG D N, YANG F, JIANG H L, WU Y, DING H D. Screening of interacting protein of tomato SIVQ6 by GST pull-down. Scientia Agricultura Sinica, 2020, 53(15): 3146-3157. (in Chinese)
[26] 辛海瑞, 张闯, 郝月, 顾宪红. 猪肝星状细胞内质网应激模型的建立及对泛素化的影响. 中国畜牧兽医, 2020, 47(2): 399-406.
XIN H R, ZHANG C, HAO Y, GU X H. Establishment of endoplasmicstress model of porcine hepatic stellate cell and its effect on ubiquitination. China Animal Husbandry & Veterinary Medicine, 2020, 47(2): 399-406. (in Chinese)
[27] 辛海瑞. 应激条件下GRP94调节猪肝脏细胞损伤的机理[D]. 北京: 中国农业科学院, 2019.
XIN H R. Regulatory mechanism of GRP94 on liver cell damage of pig under stress condition[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019. (in Chinese)
[28] 边晨晨. 内质网应激对草鱼脂肪细胞脂质蓄积的影响及机制研究[D]. 杨凌: 西北农林科技大学, 2020.
BIAN C C. The effect of endoplasmicreticulum stress on lipogenesis andthe molecular mechanism in grasscarp(idellus)[D]. Yangling: Northwest A & F University, 2020. (in Chinese)
[29] DENG S X, LIU S P, JIN P, FENG S J, TIAN M, WEI P J, ZHU H D, TAN J Y, ZHAO F, GONG Y. Albumin reduces oxidative stress and neuronal apoptosis via the ERK/Nrf2/HO-1 pathway after intracerebral hemorrhage in rats. Oxidative Medicine and Cellular Longevity, 2021, 2021: 8891373.
[30] GONÇALVES G L, COSTA-PESSOA J M, THIEME K, LINS B B, OLIVEIRA-SOUZA M. Intracellular albumin overload elicits endoplasmic reticulum stress and PKC-delta/p38 MAPK pathway activation to induce podocyte apoptosis. Scientific Reports, 2018, 8(1): 18012.
[31] SHIN S K, CHO H W, SONG S E, BAE J H, IM S S, HWANG I, HA H, SONG D K. Ablation of catalase promotes non-alcoholic fatty liver via oxidative stress and mitochondrial dysfunction in diet-induced obese mice. Pflügers Archiv - European Journal of Physiology, 2019, 471(6): 829-843.
[32] HWANG I, UDDIN M J, PAK E S, KANG H, JIN E J, JO S, KANG D M, LEE H, HA H. The impaired redox balance in peroxisomes of catalase knockout mice accelerates nonalcoholic fatty liver disease through endoplasmic reticulum stress. Free Radical Biology and Medicine, 2020, 148: 22-32.
[33] POPOWICZ G M, SCHLEICHER M, NOEGEL A A, HOLAK T A. Filamins: Promiscuous organizers of the cytoskeleton. Trends in Biochemical Sciences, 2006, 31(7): 411-419.
[34] VAN VLIET A R, GIORDANO F, GERLO S, SEGURA I, VAN EYGEN S, MOLENBERGHS G, ROCHA S, HOUCINE A, DERUA R, VERFAILLIE T, VANGINDERTAEL J, DE KEERSMAECKER H, WAELKENS E, TAVERNIER J, HOFKENS J, ANNAERT W, CARMELIET P, SAMALI A, AGOSTINIS P. The ER stress sensor PERK coordinates ER-plasma membrane contact site formation through interaction with filamin-A and F-actin remodeling. Molecular Cell, 2017, 65(5): 885-899.e6.
[35] MOON M C, YAU L, WRIGHT B, ZAHRADKA P. Injury-induced expression of cytokeratins 8 and 18 by vascular smooth muscle cells requires concurrent activation of cytoskeletal and growth factor receptors. Canadian Journal of Physiology and Pharmacology, 2008, 86(5): 223-231.
[36] MANNERY Y O, MCCLAIN C J, VOS M B. Keratin 18, apoptosis, and liver disease in children. Current Pediatric Reviews, 2011, 7(4): 310-315.
[37] WEI Y J, CHIANG W C, SUMPTER R Jr, MISHRA P, LEVINE B. Prohibitin 2 is an inner mitochondrial membrane mitophagy receptor. Cell, 2017, 168(1/2): 224-238.e10.
[38] YAN C J, GONG L L, CHEN L, XU M, ABOU-HAMDAN H, TANG M L, DÉSAUBRY L, SONG Z Y. PHB2(prohibitin 2) promotes PINK1-PRKN/Parkin-dependent mitophagy by the PARL-PGAM5- PINK1axis. Autophagy, 2020, 16(3): 419-434.
[39] SATELLI A, LI S L. Vimentin in cancer and its potential as a molecular target for cancer therapy. Cellular and Molecular Life Sciences, 2011, 68(18): 3033-3046.
[40] ZHANG X, WANG X G, LIU T X, MO M, AO L, LIU J Y, CAO J, CUI Z H. ZnSO4rescued vimentin from collapse in DBP-exposed Sertoli cells by attenuating ER stress and apoptosis. Toxicology in Vitro, 2018, 48: 195-204.
[41] FEDERTI E, MATTÉ A, GHIGO A, ANDOLFO I, JAMES C, SICILIANO A, LEBOEUF C, JANIN A, MANNA F, CHOI S Y, IOLASCON A, BENEDUCE E, MELISI D, KIM D W, LEVI S, DE FRANCESCHI L. Peroxiredoxin-2 plays a pivotal role as multimodal cytoprotector in the early phase of pulmonary hypertension. Free Radical Biology and Medicine, 2017, 112: 376-386.
[42] HOSSAIN G S, LYNN E G, MACLEAN K N, ZHOU J, DICKHOUT J G, LHOTÁK S, TRIGATTI B, CAPONE J, RHO J, TANG D M, MCCULLOCH C A, AL-BONDOKJI I, MALLOY M J, PULLINGER C R, KANE J P, LI Y H, SHIFFMAN D, AUSTIN R C. Deficiency of TDAG51 protects against atherosclerosis by modulating apoptosis, cholesterol efflux, and peroxiredoxin-1 expression. Journal of the American Heart Association, 2013, 2(3): e000134.
[43] DAMAS J, BOURDON V. The release of glandular kallikrein from submaxillary glands of rats exposed to heat. Archives Internationales De Physiologie, De Biochimie et De Biophysique, 1994, 102(3): 183-188.
[44] HORIUCHI Y, NAKATSU D, KANO F, MURATA M. Pyruvate kinase M1 interacts with A-Raf and inhibits endoplasmic reticulum stress-induced apoptosis by activating MEK1/ERK pathway in mouse insulinoma cells. Cellular Signalling, 2017, 38: 212-222.
[45] GARCÍA-DOMINGO D, RAMÍREZ D, GONZÁLEZ DE BUITRAGO G, MARTÍNEZ-A C. Death inducer-obliterator 1 triggers apoptosis after nuclear translocation and caspase upregulation. Molecular and Cellular Biology, 2003, 23(9): 3216-3225.
[46] CAO H H, WANG L L, GENG C K, YANG M, MAO W W, YANG L L, MA Y, HE M, ZHOU Y Y, LIU L Q, HU X J, YU J X, SHEN X F, GU X Z, YIN L F, SHEN Z L. In leukemia, knock-down of the death inducer-obliterator gene would inhibit the proliferation of endothelial cells by inhibiting the expression ofand. PeerJ, 2022, 10: e12832.
Screening of Anti-Apoptotic Protein GRP94 Interaction Proteins in Porcine Hepatic Stellate Cells by Immunoprecipitation Combined with LC-MS/MS
WANG XiaoHong, XING MingJie, GU XianHong, HAO Yue
Institute of Animal Science, Chinese Academy of Agricultural Sciences/State Key Laboratory of Animal Nutrition and Feeding, Beijing 100193
【Background】 Extensive stress reactions often occur in pigs due to poor breeding environment, thick subcutaneous fat and lack of sweat glands in pigs. Endoplasmic reticulum (ER) stress (ERS) may be the earliest stress response, which is closely related to apoptosis and metabolism. Liver is the main metabolic organ of the body. In the process of pig breeding, the artificial operations, such as weaning, feed mildew, and inhalation of harmful gases and temperature changes, will cause ERS in pig liver, which will not only cause liver damage, but also cause liver fat metabolism disorder and extensive inflammatory reaction, affecting animal production performance and reproductive performance. The regulation of ERS in production is helpful to reduce the recessive loss in the pig breeding process. 【Objective】Immunoprecipitation combined with mass spectrometry was used to screen the cellular proteins interacting with glucose-regulated protein 94 (GRP94) in porcine hepatic stellate cells (HSC) under ERS condition, which could lay a foundation for further study on the protective mechanism of GRP94 on biological function of HSC. 【Method】Protein complexes bound to GRP94 bait protein were eluted, collected, and verified by SDS-PAGE gel electrophoresis. The successfully verified sample eluent was detected by liquid chromatography-tandem mass spectrometry (LC-MS/MS), and the interaction proteins of GRP94 under normal condition and ERS condition were identified. The detected proteins were analyzed by GO, KEGG and interaction network. Vimentin, one of the interacting proteins, was verified by co-immunoprecipitation. 【Result】In porcine hepatic stellate cells, 146 proteins were interacting with GRP94 under normal condition, 76 proteins under ERS condition, and 44 proteins under both conditions. The results showed that 76 proteins interacting with GRP94 under ERS were mainly involved in the negative regulation of apoptosis process, peptide cross-linking, ubiquitin-dependent ERAD (endoplasmic reticulum associated degradation) pathway and hydrogen peroxide catabolic process, among them, the specific proteins interacting with GRP94 in the negative regulation of apoptosis process were albumin, catalase, filament A, heat shock protein family A member 5, keratin 18, and prohibin 2, indicating that GRP94 might play an anti-apoptotic role with these proteins. Besides, the vimentin protein that made up the intermediate filament was involved in multiple GO enrichment terms, which might have an important interaction with GRP94, which was further confirmed by co-immunoprecipitation test, further demonstrating that there was indeed an interactive relationship between this two. Further analysis showed that some GRP94 interacting proteins (Such as peroxiredoxin, death inducer obliterator 1, catalase, glandular kallikrein, pyruvate kinase and so on) specifically expressed under ERS were closely related to anti-apoptosis. 【Conclusion】Under ERS, GRP94 interacting proteins were mainly involved in anti-apoptosis, folding of unfolded proteins and maintenance of intracellular homeostasis-related signal pathways. This conclusion laid a foundation for further study on the mechanism of GRP94 involved in liver ERS regulation.
endoplasmic reticulum stress; liver cells; GRP94; protein interactions; pig

10.3864/j.issn.0578-1752.2023.15.015
2022-05-10;
2022-07-14
国家自然科学基金(31872404)、中国农业科学院科技创新工程(ASTIP-IAS07)
王枭鸿,E-mail:caaswangxiaohong@163.com。通信作者郝月,E-mail:haoyueemail@163.com
(责任编辑 林鉴非)
