酱香型白酒高温大曲储存过程中微生物群落演替与理化因子相关性研究
2023-08-15谢丹毕远林胡建锋冯小兵程平言
谢丹,吴 成,毕远林,胡建锋,黄 魏,胡 峰,冯小兵,程平言
(贵州习酒股份有限公司,贵州习水 564622)
“酒乃曲之骨”,酱香型白酒发酵过程中的微生物主要源于高温大曲[1],大曲是一种富含多酶多菌的微生物发酵剂,具有“糖化、发酵、生香”等功能,是白酒发酵过程的重要物质保障,其品质的好坏决定了酱香型白酒的产量和质量[2−5]。
酱香型高温大曲采用生料制曲、添加母曲自然接种、经40 d 发酵逐渐形成了以细菌、霉菌和酵母菌为主的群落结构[6]。酱香型高温大曲制作完成后,需进行拆曲入库储存,使大曲进入“后熟”阶段。合理的储存期对酱香型白酒酿造有至关重要的作用。在大曲储存的理化特性研究方面,张丽等[7]研究结果表明高温大曲储存5~6 个月时,液化力、酯化力等理化特性趋于稳定;刘建文等[8]发现储存3~4 个月的大曲,其功能酶活力均达到最好状态。在微生物多样性研究方面,粱丽文等[9]研究结果表明高温大曲存储过程中主要优势细菌属为Bacillus,真菌属为Pichia;梁晨等[10]研究发现大曲贮存4~6 个月,更有利于白酒的酿造,且Thermoactinomyces、Bacillus等是大曲储存过程中的优势细菌属,未对真菌多样性进行相关研究。陈晓茹等[11]研究表明强化曲在贮存过程中的优势菌属是Bacillus、常规曲的优势菌属为Weissella。目前,对酱香型白酒酿造过程中的微生态结构分析方法主要是传统可培养方法,但该方法耗时长,准确性较低,且具有一定的局限性,远远不能满足对微生物群落结构和多样性的认识,但是传统的可培养方法在微生物检测上的作用是无法替代的。然而随着分子生物学技术的快速发展,能快速精确地揭示微生物种类的多样性,鉴定样本中微生物群落组成的能力,可检测到未发现的微生物,更加全面地了解系统中的微生物,客观地认识微生物的群落结构及其演替变化。对于高温大曲“后熟”质量的评价主要依靠感官和理化指标,且在储存过程其影响因素有待于进一步阐明。在实际生产中,大曲是否成熟主要依靠生产经验判断,存在着盲目性和不确定性。
因此,本文以“后熟”过程的酱香型白酒高温大曲为研究对象,同时采用传统可培养方法和高通量测序技术解析细菌和真菌群落组成,并结合高温大曲中各理化因子动态变化规律,分析微生物群落和理化指标间的相互作用关系,以期为阐明酱香型白酒高温大曲“后熟”过程各因素变化机理提供理论参考。
1 材料与方法
1.1 材料与仪器
高温大曲样品采集自GZXJ 制曲车间不同储存时间成品曲。孟加拉红培养基、营养琼脂 北京奥博星生物技术有限责任公司;WL 培养基 上海博微生物科技有限公司;DNA 提取试剂盒 美国OMEGA BioTek 公司;聚合酶链式反应引物 上海翌圣生物科技股份有限公司。
SW-CJ-2F 无菌操作台 苏州净化设备有限公司;ZQPW-70 全温振荡培养箱 天津市莱玻特瑞仪器设备有限公司;KG-AP32L 自动蒸汽灭菌器 日本ALP 公司;GL-88B 漩涡混合器 海门市其林贝尔仪器制造有限公司;TND03-H-H 混匀型干式恒温器 深圳托能达科技有限公司;ETC811 PCR 仪 北京东胜创新生物科技有限公司;DYCZ-21 电泳仪北京市六一仪器厂;FR-1000 凝胶成像系统 上海复日科技有限公司。
1.2 实验方法
1.2.1 样品采集 选取GZXJ 公司制曲车间某一储存曲库,在储存过程中进行定点跟踪取样,每隔1 月取1 次,共计6 个样品。样品磨碎后置于无菌密封袋中,于−20 ℃下低温保藏,按取样时间依次标记为GX-1(0 d)、GX-2(30 d)、GX-3(60 d)、GX-4(90 d)、GX-5(120 d)、GX-6(150 d)。
1.2.2 理化指标的测定 温度、水分、酸度、糖化力、液化力的测定具体参照QB/T 4257-2011《酿酒大曲通用分析方法》[12]。
1.2.3 可培养微生物的分离保藏、计数及鉴定 a.分离及保藏:称取10 g 样品于90 mL 无菌水中,于25 ℃、180 r/min 条件下振荡30 min,吸取1 mL 悬浮液稀释备用,分别采用营养琼脂、WL 培养基和孟加拉红培养基分离筛选细菌、酵母菌和霉菌,观察菌落在培养基上的形态。细菌和酵母菌采用−80 ℃甘油保藏,丝状真菌采用4 ℃斜面保藏,每株菌株平行保藏3 管。
b.计数:采用稀释涂布的方法,分别采用营养琼脂培养基于37 ℃条件下培养细菌;WL 培养基和孟加拉红培养基于28 ℃条件下培养酵母菌和丝状真菌培养结束后,用计数器对肉眼观察的单菌落计数,记录稀释倍数和相应的菌落数量。
c.鉴定:根据菌落形态特征进行初步分类后,每种类别挑选代表性菌株1~3 株[13]。分别采用Ezup柱式基因组DNA 试剂盒对菌株DNA 进行提取,具体操作流程见试剂盒说明书。参照吴成等[14]方法,细菌采用通用引物27F(AGTTTGATCMTGGCTC AG)和 1492R(GGTTACCTTGTTACGACTT)对16S rRNA 基因扩增测序;酵母菌采用通用引物NL1(GCATATCAATAAGCGGAGGAAAAG)和 NL4(GGTCCGTGTTTCAAGACGG)对26S rRNA 基因D1/D2 片段扩增测序;丝状真菌采用通用引物ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCG CTTATTGATATGC)对内转录间隔区1 和2 片段扩增测序。
PCR 反应体系为:模板DNA 0.5 μL,10×Buffer(with Mg2+)2.5 μL,dNTP2.5 μL,Taq 酶0.2 μL,正向及反向引物各0.5 μL,使用ddH2O 补齐体系至25 μL。PCR 扩增条件为:94 ℃预变性4 min;94 ℃变性45 s;55 ℃退火45 s;72 ℃延伸1 min;30 次循环;72 ℃终延伸10 min 降至4 ℃。扩增完成后,回收PCR 产物并纯化。
1.2.4 大曲总DNA 提取及扩增 总DNA 提取:按照DNA 试剂盒E.Z.N.A™ Mag-Bind Soil DNA Kit 提取试剂盒方法提取DNA。细菌16S V3~V4 区域片段,选择341F(5'-CCTACGGGNGGCWGCAG-3')和805R(5'-GACTACHVGGGTATCTAATCC-3')为扩增引物;真菌采用ITS3(GCATCGATGAAGAAC GCAGC)和ITS4(TCCTCCGCTTATTGATATGC)为扩增引物。
PCR 扩增条件为:95 ℃预变性3 min;94 ℃变性20 s;55 ℃退火20 s;72 ℃延伸30 s;25 次循环;72 ℃终延伸5 min 降至4 ℃。PCR 反应体系为:2×Hieff® Robust PCR Master Mix 15 μL,正向及反向引物各1 μL,DNA 模板20~30 ng,使用ddH2O 补齐体系至30 μL。
1.2.5 高通量测序 采用Illumina Miseq 测序平台,分别对细菌16S rRNA 基因 V3~V4 区、真菌ITS3~ITS4 区进行高通量测序分析(由上海生物工程有限公司完成)。
1.3 数据处理
使用UNITE 为参考数据库进行物种注释,基于Silva 库对97%相似水平的OTU 代表序列进行分类学注释分析,细菌和真菌分别采用RDP 和UNITE数据库进行比对。采用Microsoft Office Excel 2016进行数据统计和处理;理化因子动态图、可培养微生物动态图和物种相对丰度柱状图采用Origin 2017软件进行处理绘制;优势微生物和理化因子之间相关性热图先利用SPSS 22.0 软件计算Spearman 相关性系数,再使用OmicShare Tools 平台绘制组间动态相关性热图;动态丰度Venn 图使用micShare Tools平台绘制;冗余分析(Redundancy analysis,RDA)采用Canoco5.0 软件。
2 结果与分析
2.1 储存过程中理化指标的动态变化
大曲中的水分、酸度、液化力、糖化力等是评价大曲品质好坏常用的理化指标。由图1 可知,随着储存时间的变化,储存仓温度先上升后下降,曲坯的水分、酸度逐渐下降,糖化力呈现先上升后下降的趋势,液化力在(0.02±0.01)~(0.04±0.02)g/g·h 之间波动。微生物可以利用大曲中淀粉、脂肪以及蛋白质降解成小分子进而代谢产酸,随着储存过程中曲坯水分逐渐挥发,微生物的生长繁殖受到影响,导致酸度下降。有研究表明,大曲的酸度主要来源于生酸微生物降解蛋白质、脂肪、淀粉等物质和有机酸代谢产酸,是微生物综合作用的结果[15~17]。大曲的糖化力受工艺控制参数的影响,并且与产品风格密切相关[18]。由图1 可知,随着储存时间的变化,糖化力先升高后下降,在储存120 d(GX-5)时达最高,为248.97±0.02 mg/g·h。大曲的液化力反映大曲中液化型淀粉酶将淀粉水解为糊精的能力,主要是由霉菌和枯草芽孢杆菌产生[19]。

图1 理化指标的变化规律Fig.1 Variation law of physical and chemical indexes
2.2 可培养微生物的动态变化
采用稀释涂布平板法对储存0~150 d 的可培养微生物进行计数、分离,其结果分别表1、图2 所示。
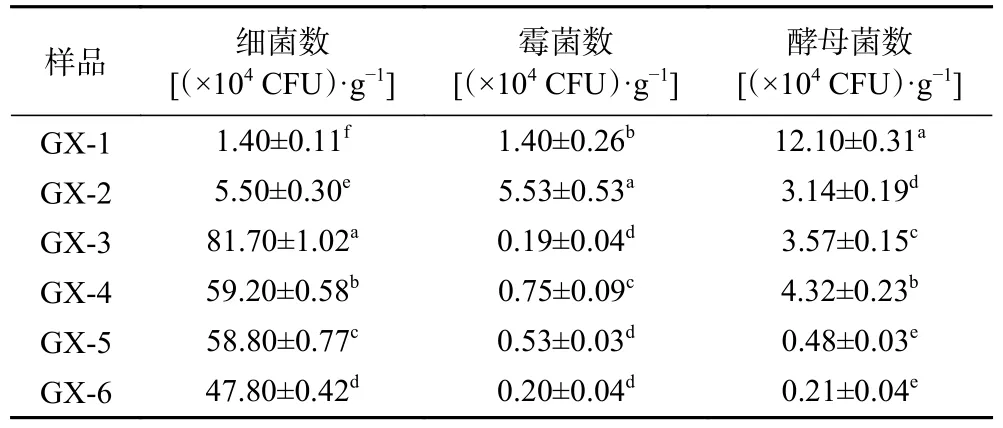
表1 可培养微生物菌落总数变化Table 1 Changes in the total number of culturable microorganisms
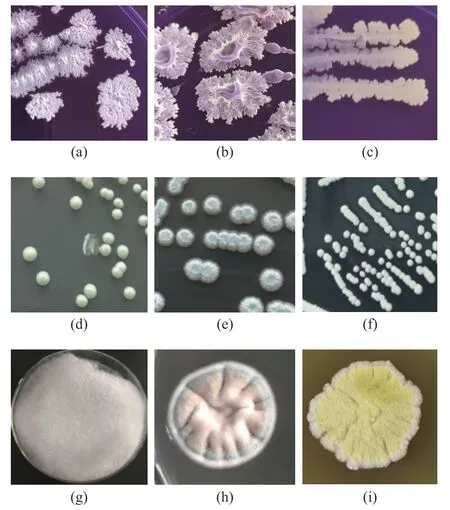
图2 可培养方法分离筛选微生物形态特征Fig.2 Microbial characteristics revealed by culture-dependent approaches
由表1 可知,大曲初入储存仓时,细菌和霉菌均在104CFU/g 数量级,酵母菌在105CFU/g 数量级;大曲储存到60 d(GX-3)时,可培养微生物数量最高,90 d(GX-4)时可培养微生物的数量缓慢下降。分析可能原因是在大曲初入曲房时,储存仓温度较低,随着储存时间增加,曲房温度升高,此阶段大多数的芽孢细菌在此时形成芽孢,有利于微生物生长繁殖。后期随着储存时间的变化,曲坯的水分降低,储存仓温度下降,微生物数量缓慢下降。大曲在储存过程中受成品曲仓、曲坯内部温度、水分、酸度等参数的影响,同时也受曲坯内部微生物生态结构变化的调控,储存过程中存在着一个双向调控机制[20−21]。
本研究采用稀释涂布平板法分离筛选到15 株细菌、6 株酵母菌和12 株霉菌,共保藏菌株99 株。选择代表性菌株进行分子鉴定为B.licheniformis、B.amyloliquifaciens、S.gallinarum三种细菌(a~c);T.ciferrii、M.farinosa、S.cerevisiae三种酵母菌(d~f);L.ramosa、A.sydowii、A.chevalieri(g~i)三种霉菌,其形态特征如图2 所示。相关研究表明,高温大曲中分离出的优势菌种也具有一定的相似性,王晓丹等[22]研究表明茅台地区酱香型高温大曲中的主要优势细菌属为Bacillus;张立强等[23]从泸州老窖大曲中分离出高产纤溶酶的优势菌B.licheniformis:李子键等[24]从中高温大曲中分离出耐高温的微小根毛霉、布氏横梗霉,并且分别具有产糖化酶、蛋白酶活性功能。
2.3 大曲在不同储存时间免培养微生物的变化情况
2.3.1 Alpha 多样性指数分析 样品测序完成后,得到的原始序列经去除嵌合体、过滤等处理后共得到498207 条有效序列,其中细菌202228 条、真菌295979 条。细菌和真菌测序覆盖率都为0.99 以上,表明测序深度足够,样品中几乎所有样本都被检出,测序结果可真实反映出酱香型高温大曲在储存过程中细菌和真菌群落多样性组成情况。对于细菌而言,Shannon 指数呈先升后降,Simpson 指数先降低后趋于平稳,表明大曲群落多样性在储存60 d(GX-3)、90 d(GX-4)、120 d(GX-5)时最高;对于真菌而言,Shannon 指数呈缓慢下降趋势,Simpson 指数呈逐渐升高趋势,表明随着大曲储存时间延长,真菌群落多样性逐渐降低(表2)。

表2 不同储存时间真菌和细菌Alpha 多样性Table 2 Alpha diversity of fungi and bacteria at different storage times
2.3.2 OTU 分布的Venn 图 Venn 图可以用来统计样本中共有和独有的OTU 的数目,直观地展现样品OTU 数目组成的相似性及重叠情况[25]。如图3(a)所示,样品GX-1(0 d)到GX-6(150 d)独有的OTU数目依次为7、8、6、23、8 和14,其中GX-4(90 d)样本中独有的物种数所占比例高,那么样本之间的相似性差,该样本的独特性高;6 个样品共有的 OTU为11 个,其所代表的细菌物种长期存在于储藏期内。图3(b)所示,样品GX-1(0 d)到GX-6(150 d)独有的OTU 数目依次为3、1、2、11、5 和47,共有的OTU 为7 个,其中GX-6 样本独有的物种数所占比例高,独特性高,GX-1~GX-5(0~120 d)与共有样本的数量接近,说明共有物种的占比高,因此样本的相似性就高。
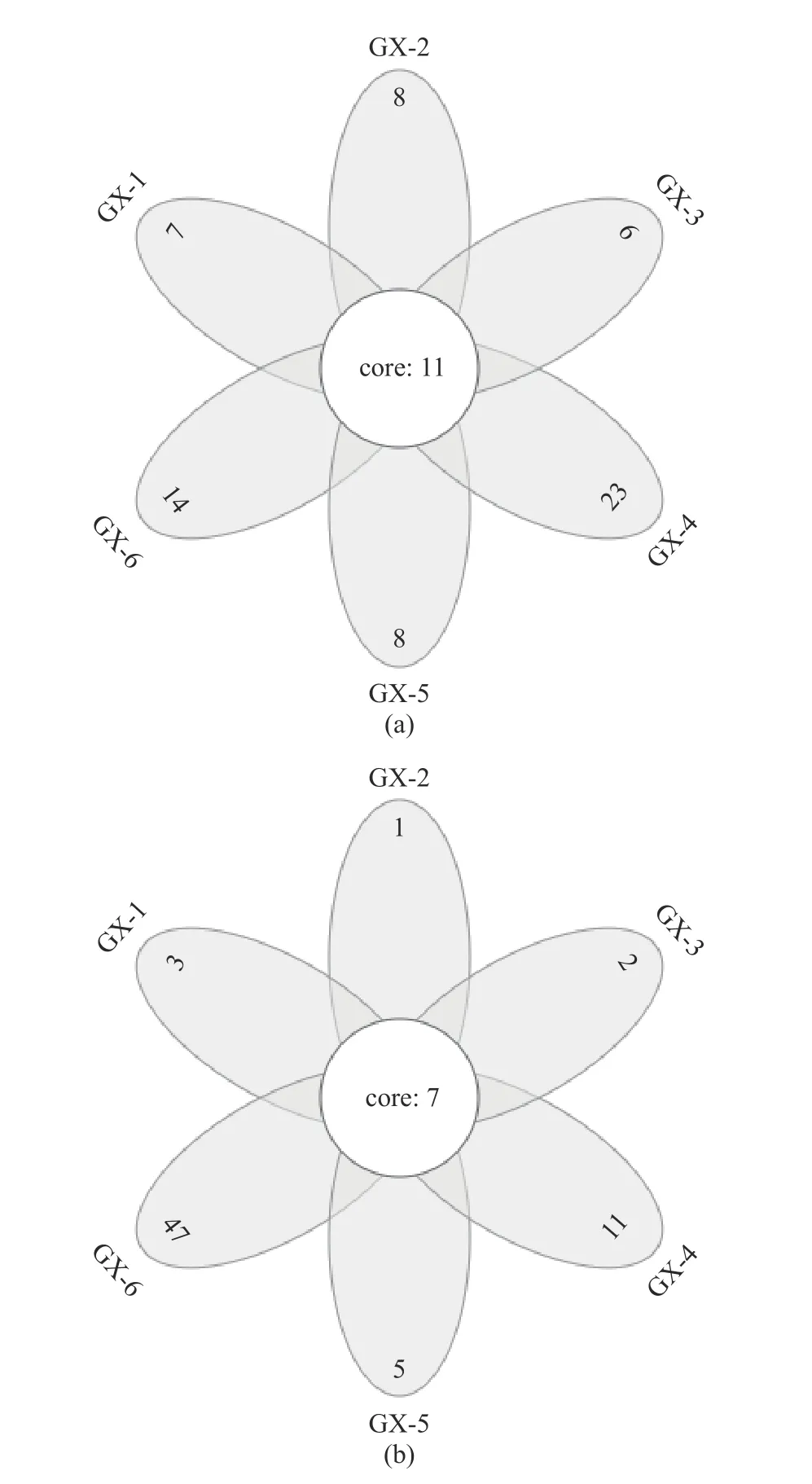
图3 不同样品的细菌(a)、真菌(b)OTU Venn 图Fig.3 Venn profile of OTU of bacteria (a) and fungi (b) in different samples
2.3.3 不同储存时间细菌、真菌群落动态变化 样品经高通量测序后,细菌共检出12 个门、21 个纲、43 个目、80 个科、119 个属和179 个种,其中Firmicutes 为绝对优势细菌门,储存过程中平均占比71.69%;Kroppenstedtia(平均占比30.45%)、Lactobacillus(平均占比11.53%)、Staphylococcus(平均占比10.31%)为主要优势菌属。真菌共检5 个门、17 个纲、37 个目、89 个科、142 个属和203 个种,其中Ascomycota 为绝对优势真菌门,平均占比98.11%,Thermomyces(43.87%)、Trichomonascus(29.77%)为主要优势真菌属。图4、图5 分别为平均相对丰度至少在一个大曲样品中大于1%的菌群结构。
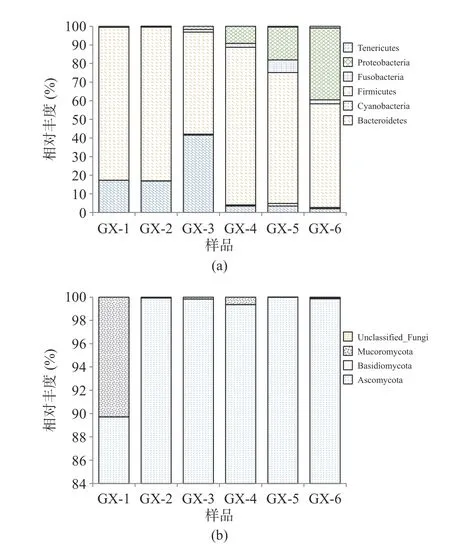
图4 大曲在门水平上细菌(a)、真菌(b)组成情况Fig.4 Composition of bacteria (a) and fungi (b) in hightemperature Daqu at the phylum
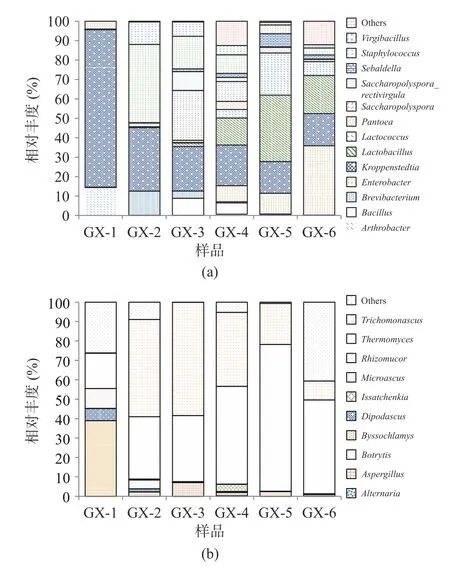
图5 大曲在属水平上细菌(a)、真菌(b)组成情况Fig.5 Composition of bacteria (a) and fungi (b) in hightemperature Daqu at the genus
由图5 可知,Lactobacillus、Lactococcus、Saccharopolyspora、Virgibacillus细菌属和Thermomyces、Trichomonascus、Aspergillus真菌属物种多样性呈现先增后降,在储存到120 d(GX-5)以后,优势菌群的相对丰度含量逐渐下降。分析造成这种现象可能的原因是储存时间过长的曲块,曲虫增多,使大曲中的淀粉等物质流失,破坏大曲的微生物群落结构,因而导致微生物多样性降低[26]。
酱香制曲过程中的细菌主要来源于空气、场地、原辅料及人体,在酱香型白酒酿造过程中的主要作用是产香,在发酵体系中能产生大量酶类,是形成酱香型白酒风味前体物质的主要菌群[27−28]。相关研究表明,Bacillus是酱香型白酒发酵过程中主要的功能细菌种群,具有代谢水解酶、乙偶姻等风味物质功能,对酱香型白酒的风味形成有重要贡献[29−30];Lactobacillus属于乳酸菌菌系,大多是兼性厌氧或厌氧菌,在发酵过程具有重要的生物学调控作用[31]。真菌方面,酿酒酵母是产生酒精的主要功能菌种,曲霉菌和根霉菌具有很强的酶活力,且绝大多数的真菌属于嗜热真菌属,可以在高温下进行生长代谢,产酶丰富,具有分解酒醅中大分子物质、产生白酒中风味化合物及其前提物质的作用[32]。
2.3.4 理化因子与微生物群落相关性分析 理化因子的变化对微生物的生长繁殖及其行为具有较强的影响,进而调控微生物群落的结构及其演替[21]。如图6(a)所示,RDA 分析结果表明大曲在储存0 d(GX-1)时,大曲的后熟过程与温度、水分、液化力和酸度呈正相关关系,与糖化力呈负相关关系,表明该时期温度和水分适宜,比较适合微生物生长;储存30~60 d(GX-2~GX-3)时,大曲中的微生物群落结构不受水分、酸度等因素的影响,表明该时间段理化指标对微生物群落结构影响不大;储存90~150 d(GX-4~GX-6)时,温度、水分、酸度、液化力与储存过程呈负相关,表明了大曲在存储后期,曲仓温度降低,曲坯水分含量低,不适宜微生物代谢活动,因此,微生物多样性降低。

图6 微生物群落结构与大曲理化因子相关性分析Fig.6 Correlation analysis between microble community structure and physical and chemical factors of Daqu
为揭示理化因子对优势微生物群落的影响,选取相对丰度分别排名前10 的优势细菌属、优势真菌属(相对丰度含量至少在一个大曲样品中大于1%的菌群结构)与储存过程中理化因子进行相关性分析。结果如图6(b)所示,对细菌而言,Bacillus与水分、酸度、糖化力、液化力呈负相关关系,与温度呈正相关关系,表明了该细菌属的生长代谢等活动受温度的影响,在大曲储存后期,曲仓温度降低,其相对丰度含量降低,高酸的环境也会抑制其生长。Staphylococcus与温度、水分呈正相关关系、与酸度、糖化力、液化力呈负相关关系;Kroppenstedtia与温度、水分、酸度、液化力呈正相关关系,与糖化力呈负相关关系。
对真菌而言,Aspergillus、Trichomonascus等菌属与水分、酸度、糖化力、液化力呈负相关关系,与温度呈正相关关系;Byssochlamys、Dipodascus与温度、水分、酸度、液化力呈正相关关系,与糖化力呈负相关关系;Thermomyces与温度、水分、酸度呈负相关关系;Rhizomucor与水分、温度、酸度、液化力呈正相关关系。研究表明Thermomyces属于嗜热真菌属,具有促进蛋白质降解的作用,使得微生物能充分利用酿酒原料进行生长代谢[33]。Rhizomucor具有糖化发酵能力,能形成大量乳酸[34]。Aspergillus、Thermomyces、Bacillus、Issatchenkia、Lactococcus等是大曲储存过程中的主导菌群,这些菌群的存在有利于提升大曲的发酵性能[35]。
3 结论
本文同时采用了传统可培养方法和高通量测序技术对酱香型白酒高温大曲在储存(后熟)过程中微生物群落组成情况及理化因子间的相互关系进行了解析。可培养结果表明,随着储存时间的增加,菌落总数呈现先上升后下降趋势;高通量测序结果表明,在储存过程中Kroppenstedtia、Lactobacillus、Staphylococcus、Thermomyces、Trichomonascus等为主要优势菌属;RDA 分析结果表明大曲在储存0 d 时,大曲的后熟过程与温度、水分、液化力和酸度呈正相关关系,与糖化力呈负相关关系,表明该时期温度和水分适宜,比较适合微生物生长;储存30~60 d 时,大曲中的微生物群落结构不受水分、酸度等因素的影响,表明该时间段理化指标对微生物群落结构影响不大;储存90~150 d 时,温度、水分、酸度、液化力与储存过程呈负相关,表明了大曲在存储后期,曲仓温度降低,曲坯水分含量低,不适宜微生物代谢活动,因此,微生物多样性降低。目前,对于酱香型高温大曲微生物多样性相关研究层出不穷,在优势微生物研究方面结论基本一致,说明了酱香型高温大曲的微生物生态系统基本保持一致。储存过程中微生物群落与理化因子存在复杂的作用关系,大曲在储存过程中微生物群落的多样性受温度、水分和酸度等理化因子的影响,表明了储存过程中各微生物、生化指标间相互关联,性质上相互影响,使酱香型大曲在最佳的贮存期进行酿造,从而达到良好的产酒、产香风味。通过相关性计算可知微生物与环境因子之间的关系,目前主要是基于数学模型进行统计分析,但其内在的相互作用机制还有待进一步研究。理化因子在储存过程中对微生物的生长繁殖及其行为具有较强的影响,进而调控微生物群落的结构及其演替,但具体的影响过程还需进一步的实验验证。酱香型白酒高温大曲“后熟”时间的长短关系着大曲的品质及产酒的质量,但是目前没有统一的标准来界定具体的储存时间,因此,该研究为进一步阐明酱香型白酒高温大曲后熟机理提供了理论参考。
