基于TLR4/MyD88/NF-κB信号通路探讨紫菀散对慢性支气管炎气道炎症的干预作用
2023-08-14吴笛,蔺晓源,雷诗卉,姜帆,谭骏岚
吴笛,蔺晓源,雷诗卉,姜帆,谭骏岚





〔摘要〕 目的 觀察紫菀散对慢性支气管炎气道炎症的干预作用,并基于Toll样受体4(Toll-like receptors 4, TLR4)/髓分化因子88(myeloid differentiation factor 88, MyD88)/核转录因子-κB(nuclear factor kappa-B, NF-κB)信号通路探讨其作用机制。方法 60只健康成年雄性SD大鼠随机分为6组,每组10只,除正常组外均采用气管内滴注脂多糖(lipopolysaccharides, LPS)的方法建立慢性支气管炎模型。醋酸地塞米松组给予0.075 mg·kg-1醋酸地塞米松灌胃,每天1次;紫菀散低、中、高剂量组分别给予1.5、3.0、6.0 g·kg-1紫菀散灌胃,每天1次;模型组、正常组给予等量生理盐水灌胃。采用ELISA法检测支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中转化生长因子-β1(transforming growth factor-β1, TGF-β1)、白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-6(interleukin-6, IL-6)水平,采用细胞计数板法计数BALF中白细胞数量,采用HE染色、AB-PAS染色观察肺组织病理改变,采用免疫组化法检测肺组织TLR4、MyD88、NF-κB蛋白表达。结果 与正常组比较,模型组TGF-β1、IL-1β、IL-6水平均升高(P<0.01),白细胞总数和各种白细胞数量均增加(P<0.01),肺组织呈病理改变且气道杯状细胞增生评分升高(P<0.01),TLR4、MyD88、NF-κB蛋白表达均升高(P<0.01);与模型组比较,醋酸地塞米松组及紫菀散各剂量组TGF-β1、IL-1β、IL-6水平均降低(P<0.05或P<0.01),白细胞总数和各种白细胞数量均降低(P<0.01),肺组织病理改变均减轻,气道杯状细胞增生评分均降低(P<0.05或P<0.01),TLR4、MyD88、NF-κB蛋白表达均减少(P<0.05或P<0.01);与醋酸地塞米松组比较,紫菀散中、高剂量组TGF-β1水平均降低(P<0.05或P<0.01),紫菀散低剂量组白细胞总数和各种白细胞数量均增加(P<0.01),紫菀散中剂量组中性粒细胞数量、嗜酸性粒细胞数量均增加(P<0.01),紫菀散高剂量组淋巴细胞数量减少(P<0.01),紫菀散低、中剂量组肺组织病理改变均加重,紫菀散低剂量组气道杯状细胞增生评分升高(P<0.05),紫菀散低剂量组TLR4、MyD88、NF-κB蛋白表达均升高(P<0.05)。结论 紫菀散可能通过抑制TLR4/MyD88/NF-κB信号通路发挥抗慢性支气管炎气道炎症的作用。
〔关键词〕 紫菀散;慢性支气管炎;气道炎症;TLR4/MyD88/NF-κB信号通路;转化生长因子-β1;白细胞介素-1β;白细胞介素-6
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.07.005
Intervention effects of Ziwan Powder on airway inflammation in chronic bronchitis based on TLR4/MyD88/NF-κB signaling pathway
WU Di1,2, LIN Xiaoyuan1,2*, LEI Shihui1,2, JIANG Fan1,2, TAN Junlan3
1. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 2. Key Laboratory of Research on Prevention and Treatment of Major Diseases in Chinese Internal Medicine and Transformation of Achievements of Ministry of Education, Changsha, Hunan 410007, China; 3. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To observe the intervention effects of Ziwan Powder on airway inflammation in chronic bronchitis, and to explore its mechanism based on toll-like receptor 4 (TLR4)/myeloid differentiation factor 88 (MyD88)/nuclear factor-κB (NF-κB) signaling pathway. Methods Sixty healthy adult male SD rats were randomly divided into 6 groups, with 10 in each group. They were induced into chronic bronchitis models by instilling lipopolysaccharides (LPS) into the trachea, except for those of normal group. Dexamethasone Acetate group was given once daily gavage of 0.075 mg·kg-1 Dexamethasone Acetate. Once daily gavage of 1.5, 3.0 and 6.0 g·kg-1 extracts of Ziwan Powder were given to low-, medium-, and high-dose Ziwan Powder groups, respectively. The equal gavage of normal saline was administered to model group and normal group. The levels of transforming growth factor-β1 (TGF-β1), interleukin-1β (IL-1β), and interleukin-6 (IL-6) in bronchoalveolar lavage fluid (BALF) were measured by ELISA. White blood cell count in BALF was checked by hemacytometer. Lung tissue pathological changes were observed by HE and AB-PAS staining. The protein expressions of TLR4, MyD88, and NF-κB in lung tissues were observed by immunohistochemistry staining. Results Compared with normal group, model group showed higher levels of TGF-β1, IL-1β, and IL-6 (P<0.01), elevated count of total white blood cells, macrophages, lymphocytes, neutrophil granulocytes, and eosinophil granulocytes (P<0.01), increased protein expression levels of TLR4, MyD88, and NF-κB (P<0.01), a higher pathological score of airway goblet cell hyperplasia (P<0.01), and obvious pathological changes in lung tissues. Compared with model group, Dexamethasone Acetate group and all Ziwan Powder groups shared lower levels of TGF-β1, IL-1β, and IL-6 (P<0.05 or P<0.01), reduced count of total white blood cells, macrophages, lymphocytes, neutrophil granulocytes and eosinophil granulocytes (P<0.01), decreased protein expression levels of TLR4, MyD88, and NF-κB (P<0.05 or P<0.01), a lower pathological score of airway goblet cell hyperplasia (P<0.05 or P<0.01), and improved pathological changes in lung tissues. Compared with Dexamethasone Acetate group, medium- and high-dose Ziwan Powder groups shared a lower level of TGF-β1 (P<0.05 or P<0.01); low-dose Ziwan Powder group showed elevated count of total white blood cells, macrophages, lymphocytes, neutrophil granulocytes, and eosinophil granulocytes (P<0.01), increased protein expression levels of TLR4, MyD88, and NF-κB (P<0.05), and an increased number of airway goblet cells (P<0.05); medium-dose Ziwan Powder group showed elevated count of neutrophil granulocytes and eosinophil granulocytes (P<0.01); high-dose Ziwan Powder group showed reduced count of lymphocytes (P<0.01); low-dose and medium-dose Ziwan Powder groups shared aggravated pathological changes in lung tissues. Conclusion Ziwan Powder may alleviate airway inflammation in chronic bronchitis by inhibiting the TLR4/MyD88/NF-κB signaling pathway.
〔Keywords〕 Ziwan Powder; chronic bronchitis; airway inflammation; TLR4/MyD88/NF-κB signaling pathway; transforming growth factor-β1; interleukin-1β; interleukin-6
慢性支气管炎是由于感染或非感染性因素导致的气管、支气管黏膜及其周围组织的慢性非特异性炎症,以咳嗽、咳痰或伴有喘息等反复发作为主要症状,可并发阻塞性肺气肿、肺源性心脏病、肺动脉高压等常见并发症,严重影响患者正常的生活和工作[1-2]。慢性支气管炎在我国是一种常见病、多发病,患者多为中老年人,且患病率随年龄增长而增加,我国50岁以上人群患病率超过14%[3]。目前,临床常采用抗感染、抗炎、止咳、化痰等措施治疗慢性支气管炎,但易反复发作。虽然慢性支气管炎的发病机制尚未完全阐明,但有研究[4-6]显示,Toll样受体4(toll-like receptors 4, TLR4)/髓分化因子88(myeloid differentiation factor 88, MyD88)/核转录因子-κB(nuclear factor kappa-B, NF-κB)信号通路是其发病的重要机制之一。
紫菀散为古代经典名方,方出孙思邈《备急千金要方》卷十八“大肠腑方”,由紫菀、款冬花两味中药组成,能止咳化痰,主治咳嗽日久,痰涎不利。此方现多用于治疗慢性支气管炎,可随证加减,疗效确切,但鲜见紫菀散治疗慢性支气管炎的实验研究,故其具体机制尚不明确。李聪等[7]通过小鼠毛细血管通透性实验、氨水致小鼠急性呼吸道炎症模型及脂多糖(lipopolysaccharide, LPS)刺激巨噬细胞释放一氧化氮的变化来观察紫菀、款冬花部位配伍后的抗炎作用,结果显示,紫菀90%醇沉部位、款冬花90%醇溶部位及其配伍均能抑制小鼠毛细血管通透性和氨水致敏引起的急性呼吸道炎症,配伍组作用增强;紫菀90%醇沉部位、款冬花90%醇溶部位均能抑制LPS刺激巨噬细胞后一氧化氮的产生,配伍后作用增强。此研究证实紫菀、款冬花均具有显著的抗炎作用,两者配伍后抗炎效果显著提高,符合相须、相使配伍理论,但未涉及作用机制。
本研究拟观察紫菀散对LPS诱导的大鼠慢性支气管炎气道炎症的干预作用,并基于TLR4/MyD88/NF-κB信号通路探讨其作用机制。
1 材料
1.1 实验动物
60只成年健康雄性SD大鼠,SPF级,体质量(200±20) g,购于湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2019-0004,饲养于湖南中医药大学第一附属医院SPF级实验动物房,饲养环境温度为24~26 ℃,相对湿度为50%~60%,光照周期为各12 h明暗交替,用全价颗粒饲料饲养,自由饮水、进食。实验单位使用许可证编号:SYXK(湘)2020-0010。实验经湖南中医药大学第一附属医院实验动物伦理委员会批准,伦理审查号:ZYFY20220321。
1.2 药品及试剂
紫菀、款冬花均购于湖南邵东廉桥药材市场,经湖南中医药大学中药鉴定教研室刘塔斯教授鉴定,分别为菊科植物Aster tataricus L. f.的干燥根和根茎、菊科植物款冬Tussilago farfara L.的干燥花蕾;醋酸地塞米松片(浙江仙琚制药股份有限公司,国药准字:H33020822,规格:0.75 mg,批号:200124)。95%乙醇(成都市科隆化学品有限公司,批号:2021101902);LPS(美国Sigma-Aldrich公司,批号:L4516);戊巴比妥钠(上海伊卡生物技术有限公司,批号:570471);生理盐水(上海生工生物工程股份有限公司,批号:220316);4%多聚甲醛通用型组织固定液(北京兰杰柯科技有限公司,批号:21313432);瑞氏姬姆萨染色液(武汉赛维尔生物科技有限公司,批号:CR2102001);苏木精染色液、伊红染色液、阿辛兰-过碘酸希夫染色液(北京索莱宝科技有限公司,批号:20220224、20220323、20211216);大鼠转化生长因子-β1(transforming growth factor-β1, TGF-β1)、白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-6(interleukin-6, IL-6) ELISA试剂盒(江苏菲亚生物科技有限公司,批号:2204R11、2204R13、2204R19);一抗兔抗鼠TLR4、MyD88、NF-κB抗体(英国Abcam公司,批号:ab220312、ab220320、ab220405);二抗辣根过氧化物酶标记山羊抗兔免疫球蛋白G(immunoglobulin G, IgG)抗体(英国Abcam公司,批号:GR231489-7)。
1.3 实验仪器
Enspire型多功能酶标仪(美国Perkinelmer公司);H1850型台式高速离心机(湖南湘仪实验室仪器开发有限公司);DSX100型光学显微镜(日本Olympus公司);STP-120型组织脱水机、HM325型轮转式组织切片机、HistoStar型石蜡包埋机、Gemini AS型染色机(美国ThermoFisher公司)。
2 方法
2.1 药液制备
取54 g紫菀、81 g款冬花,混合,依次加10倍量90%乙醇、70%乙醇、50%乙醇和水分别加热回流提取4次,每次1 h,合并4次提取液,濃缩至生药含量为0.15 g·mL-1,得到紫菀散低剂量组用药(相当于临床等效剂量);取108 g紫菀、162 g款冬花,处理方法同紫菀散低剂量组用药,提取液浓缩至生药含量为0.30 g·mL-1,得到紫菀散中剂量组用药(相当于临床等效剂量的2倍);取216 g紫菀、324 g款冬花,处理方法同紫菀散低剂量组用药,提取液浓缩至生药含量为0.60 g·mL-1,得到紫菀散高剂量组用药(相当于临床等效剂量的4倍)。紫菀散药液浓度根据紫菀散给药剂量及大鼠每100 g体质量1 mL的单次给药体积换算确定。为最大程度提取不同极性的化学成分,采用不同浓度的乙醇溶液梯度提取制备紫菀散各剂量组用药。另取醋酸地塞米松片1片,研末,过6号筛(100目),加纯化水100 mL,制成混悬液,得到醋酸地塞米松组用药(相当于临床等效剂量,临用前制备)。醋酸地塞米松药液浓度根据醋酸地塞米松给药剂量及大鼠每100 g体质量1 mL的单次给药体积换算确定。
2.2 动物造模
采用气管内滴注LPS的方法建立慢性支气管炎模型,具体参照文献[8]方法:大鼠腹腔注射戊巴比妥钠30 mg·kg-1麻醉,以耳镜插入喉口,用静脉套管针(拔去针芯)每周注入1 mg·mL-1的LPS溶液200 μL,共3次。模型制备成功的判断依据为以耳镜插入大鼠喉口可观察到大量痰液和气泡。
2.3 动物分组及给药
60只成年健康雄性SD大鼠随机分为正常组、模型组、醋酸地塞米松组、紫菀散低剂量组、紫菀散中剂量组、紫菀散高剂量组,共6组,每组10只。除正常组外,其余5组均造模。醋酸地塞米松组给予0.075 mg·kg-1醋酸地塞米松灌胃,每天1次[给药剂量基于醋酸地塞米松片0.75 mg/片的规格及成人每日0.75 mg(1片)的用量,根据大鼠与人体表面积比值换算确定];紫菀散低、中、高剂量组分别给予1.5、3.0、6.0 g·kg-1紫菀散提取物灌胃,每天1次(给药剂量基于孙思邈《备急千金要方》卷十八“大肠腑方”中紫菀散处方“紫菀二两款冬花三两”及紫菀、款冬花常用剂量5~10 g的用量,根据大鼠与人体表面积比值换算确定);模型组和正常组给予等量生理盐水灌胃。各组均干预3周。
2.4 样本采集及指标检测
2.4.1 ELISA法检测BALF中TGF-β1、IL-1β、IL-6水平 各组大鼠干预3周后,腹腔注射戊巴比妥钠30 mg·kg-1麻醉,打开胸腔,分离并结扎左主支气管,分离暴露大鼠气管并插管,按每100 g/mL生理盐水分两次灌洗,收集BALF,3 000 r·min-1离心10 min(离心半径17.5 cm),ELISA法检测上清液中TGF-β1、IL-1β、IL-6水平。
2.4.2 细胞计数板法计数BALF中白细胞数量 BALF离心后的沉淀用0.5 mL生理盐水混匀,取细胞混悬液100 μL,滴于细胞计数板上,用100 μL白细胞计数液稀释,光镜下计数白细胞总数,稀释液涂片,自然干燥,用瑞氏姬姆萨染色液染色,油镜下每张涂片计数200个细胞,得出白细胞分类计数值。
2.4.3 HE染色、AB-PAS染色观察肺组织病理改变 取未灌洗的左肺组织,经4%多聚甲醛液固定、漂洗、脱水、透明和石蜡包埋、切片,HE染色观察炎性细胞浸润,AB-PAS染色观察气道杯状细胞增生及黏液分泌。光学显微镜下随机选取5个支气管腔大小视野进行观察,采用五级评分法评估AB-PAS染色切片中杯状细胞增生情况:0分表示正常;1分表示轻微,大支气管内杯状细胞增生;2分表示轻度,大中支气管内杯状细胞增生;3分表示中度,大中和一些小支气管内杯状细胞增生;4分表示重度,所有气道内杯状细胞增生[9]。
2.4.4 免疫组化法检测肺组织TLR4、MyD88、NF-κB蛋白表达 免疫组化染色检测肺组织TLR4、MyD88、NF-κB蛋白表达,使用Image-Pro Plus 6.0图像分析软件测量TLR4、MyD88、NF-κB免疫组化图片平均光密度值,对大鼠肺组织TLR4、MyD88、NF-κB蛋白表达进行测定。
2.5 统计学分析
采用SPSS 22.0统计软件对数据进行统计分析。数据以“x±s”表示。两组间比较采用单因素方差分析。以P<0.05表示差异具有统计学意义。
3 结果
3.1 造模及动物一般表现
造模成功的大鼠,表现出咳嗽、气喘、呼吸困难、行动迟缓、精神萎靡、瘦弱、体毛枯槁等表观症状(不一定全部具备),最明显、可靠的标志为以耳镜插入喉口可观察到大量痰液和气泡,故以此作为造模成功的判断依据。模型组、醋酸地塞米松组、紫菀散低剂量组、紫菀散中剂量组、紫菀散高剂量组分别有1、1、2、0、0只大鼠未造模成功,成功率为92%。模型组、紫菀散中剂量组、紫菀散高剂量组分别有1、2、2只造模成功的大鼠死亡,均从本研究中剔除。
3.2 紫菀散对慢性支气管炎模型大鼠BALF中TGF-β1、IL-1β、IL-6水平的影響
与正常组比较,模型组TGF-β1、IL-1β、IL-6水平均升高(P<0.01);与模型组比较,醋酸地塞米松组及紫菀散各剂量组TGF-β1、IL-1β、IL-6水平均降低(P<0.05或P<0.01);与醋酸地塞米松组比较,紫菀散中、高剂量组TGF-β1水平均降低(P<0.05或P<0.01),紫菀散低剂量组TGF-β1水平及紫菀散各剂量组IL-1β、IL-6水平差异无统计学意义(P>0.05)。详见表1。
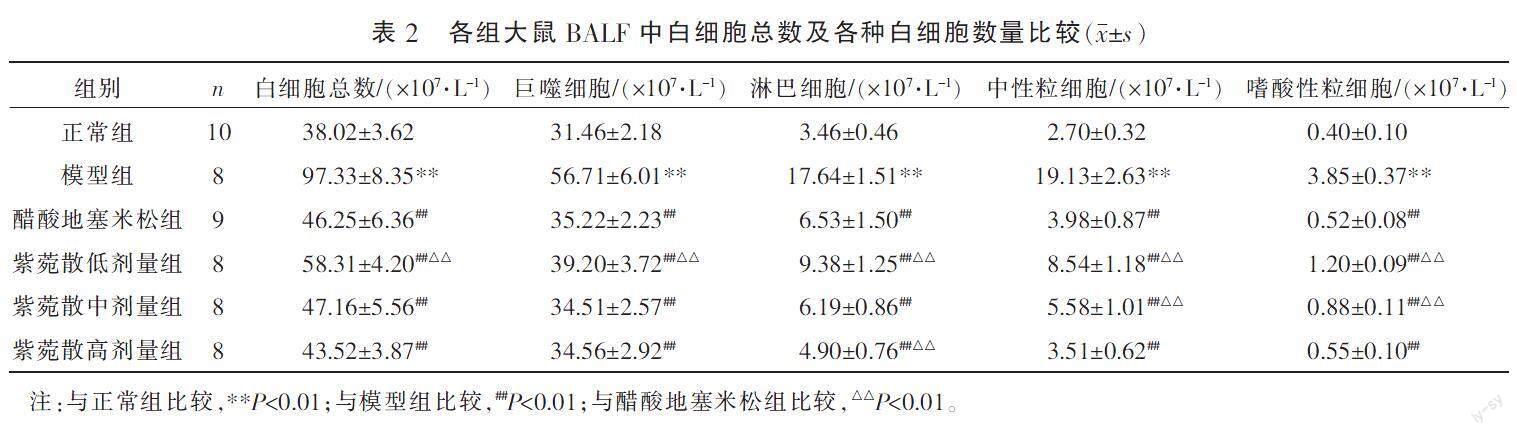
3.3 紫菀散对慢性支气管炎模型大鼠BALF中白细胞总数和各种白细胞数量的影响
与正常组比较,模型组白细胞总数和各种白细胞数量均增加(P<0.01);与模型组比较,醋酸地塞米松组及紫菀散各剂量组白细胞总数和各种白细胞数量均减少(P<0.01);与醋酸地塞米松组比较,紫菀散低剂量组白细胞总数和各种白细胞数量均增加(P<0.01),紫菀散中剂量组的中性粒细胞数量、嗜酸性粒细胞数量均增加(P<0.01),白细胞总数、巨噬细胞数量、淋巴细胞数量差异无统计学意义(P>0.05),紫菀散高剂量组的淋巴细胞数量减少(P<0.01),白细胞总数、巨噬细胞数量、中性粒细胞数量、嗜酸性粒细胞数量差异无统计学意义(P>0.05)。详见表2。
3.4 紫菀散对慢性支气管炎模型大鼠肺组织病理改变的影响
3.4.1 各组HE染色情况比较 正常组肺组织结构完整,气道无明显炎性细胞浸润及炎症物质渗出;与正常组比较,模型组肺组织可见炎性细胞浸润及炎症物质渗出,气道周围可见充血,气道出现明显狭窄伴炎症物质渗出,基底膜增厚,气道平滑肌增厚,气道上皮细胞破坏;与模型组比较,紫菀散各剂量组及醋酸地塞米松组肺组织及气道腔内炎症物质渗出均不同程度减少,炎性细胞浸润改善,气道壁增厚减轻;醋酸地塞米松组与紫菀散高剂量组肺组织病理形态学接近。详见图1。
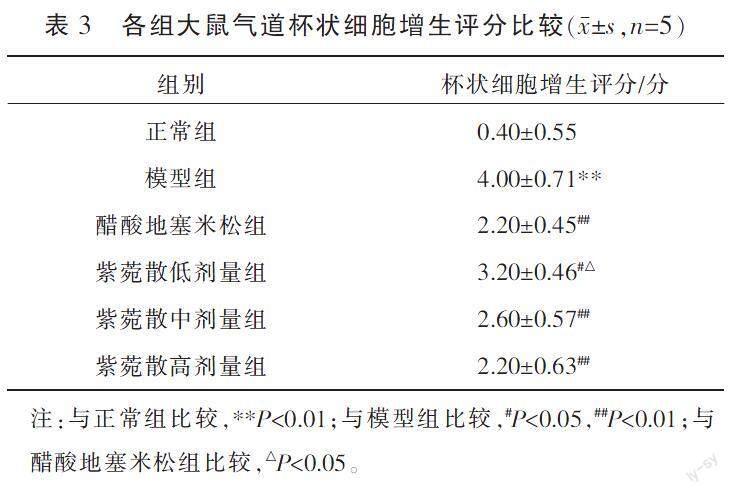
3.4.2 各组AB-PAS染色情况比较 正常组气道上皮结构完整,杯状细胞几乎无增生;与正常组比较,模型组杯状细胞增生评分升高(P<0.01);与模型组比较,醋酸地塞米松组及紫菀散各剂量组杯状细胞增生评分降低(P<0.05或P<0.01);与醋酸地塞米松组比较,紫菀散低剂量组杯状细胞增生评分升高(P<0.05),紫菀散中、高剂量组杯状细胞增生评分差异无统计学意义(P>0.05)。详见图2、表3。
3.5 紫菀散对慢性支气管炎模型大鼠肺组织TLR4、MyD88、NF-κB蛋白表达的影响
与正常组比较,模型组TLR4、MyD88、NF-κB蛋白表达均升高(P<0.01);与模型组比较,醋酸地塞米松组及紫菀散各剂量组TLR4、MyD88、NF-κB蛋白表达均降低(P<0.05或P<0.01);与醋酸地塞米松组比较,紫菀散低剂量组TLR4、MyD88、NF-κB蛋白表达均升高(P<0.05),紫菀散中、高剂量组TLR4、MyD88、NF-κB蛋白表达差异无统计学意义(P>0.05)。详见图3—5、表4。
4 讨论
中医学无慢性支气管炎病名,但根据其咳、痰、喘等主要症状,将慢性支气管炎归属于“咳嗽”“痰饮”“喘证”等范畴[10]。慢性支气管炎,咳、痰、喘是其外在表现,下气道炎症是其本质。紫菀散由紫菀、款冬花两味中药组成,紫菀重在化痰,款冬花偏于止咳,二药合用,原用于治疗咳嗽日久,痰涎不利,现用于治疗慢性支气管炎,效果确切。秦永琪[11]报道紫菀所含紫菀酮、紫菀皂苷等成分可能与紫菀祛痰作用有关。卢艳花等[12]证实紫菀酮、表木栓醇具有祛痰、镇咳作用。刘可越[13]对紫菀散的药效物质进行了研究,确定了其镇咳、祛痰的有效部位,发现祛痰活性成分至少包括紫菀酮、表木栓醇、山柰酚、槲皮素及总皂苷。LI等[14-15]报道绿原酸、异绿原酸A、芦丁可能与款冬花镇咳、祛痰作用密切相关。WU等[16]证实从款冬花中分离得到的绿原酸、异绿原酸A、异绿原酸B、异绿原酸C具有镇咳、祛痰、抗炎活性。另有研究[17-19]显示,从款冬花中分离得到的倍半萜类化合物及从紫菀中分离得到的脂肪酸、萜类、黄酮类化合物均具有抗炎作用。上述研究结果提示紫菀散用于慢性支气管炎不仅能对症治疗,也能对因治疗,标本兼治。
LPS是一种细菌内毒素,是引起慢性支气管炎等炎症性疾病的主要因素之一。LPS可与位于细胞表面的TLR4结合,活化的TLR4可通过MyD88依赖途径激活NF-κB[5-6, 20]。NF-κB是一种调控基因表达的DNA结合蛋白,对巨噬细胞的合成和成熟,以及促炎细胞因子、趋化因子的产生至关重要,也是介导巨噬细胞极化的主要刺激因素[21-22]。NF-κB可诱导巨噬细胞合成、释放多种促炎细胞因子、炎症介质(如TGF-β1、IL-1β、IL-6、TNF-α),诱发机体产生炎症反应[23]。抑制NF-κB的持续激活进而减少促炎细胞因子、炎症介质的产生,是治疗多种炎症性疾病的重要策略和手段[24-26]。TGF-β1广泛存在于呼吸系统组织内,在肺疾病过程中的表达具有双向调节作用,一方面,适量的TGF-β1有利于细胞创伤的修复;另一方面,在急性病变中,TGF-β1的产生是应激性的,呈短时间分泌,而在慢性病中,TGF-β1的产生是持续性的,过多的TGF-β1沉积最终加重局部炎性反应[27]。IL-1β在炎症反应时分泌旺盛,通过抑制慢性支气管炎模型大鼠肺组织IL-1β的水平,可干预模型大鼠机体炎症反应[28]。IL-6是一种重要的促炎细胞因子,在感染、组织损伤等方面起着重要作用,可调节机体免疫应答,介导肺组织、气道炎症反应[29]。有学者将机体IL-6的水平作为评估慢性支气管炎病情轻重的参考指标[30]。另有研究[31]显示,慢性支气管炎模型大鼠肺组织TGF-β1、IL-1β、IL-6蛋白表达明显升高,治疗后模型大鼠肺组织TGF-β1、IL-1β、IL-6蛋白表达显著降低。
本研究结果显示,紫菀散低、中、高剂量组均可显著下调慢性支气管炎模型大鼠肺组织TLR4、MyD88、NF-κB蛋白表达,降低BALF中TGF-β1、IL-1β、IL-6水平,減少白细胞总数及各种白细胞数量,减少肺组织炎性细胞浸润和炎症物质渗出,从而减轻气道炎症反应及肺组织病理改变,其中以紫菀散高剂量组效果最佳。本研究结果提示,紫菀散可能通过抑制TLR4/MyD88/NF-κB信号通路发挥其抗慢性支气管炎气道炎症的作用。
临床常用的抗炎药分为两大类,甾体抗炎药(如可的松、泼尼松、地塞米松)和非甾体抗炎药(如阿司匹林、对乙酰氨基酚、布洛芬),虽然具有确切的抗炎作用,但也具有较多的毒副作用和不良反应,如胃肠道损害、肾损害、肝损害、中枢神经症状、水钠潴留、骨质疏松等。紫菀散作为基础方用于治疗慢性支气管炎,可随证加减,疗效确切。本研究通过动物实验证实紫菀散具有确切的抗慢性支气管炎气道炎症的效果,紫菀散高剂量组抗慢性支气管炎气道炎症的效果与甾体抗炎药醋酸地塞米松基本相当,且部分指标更优。紫菀散临床应用已有千年历史,迄今未见任何关于毒副作用和不良反应的报道,其安全性较常用的甾体和非甾体抗炎药更有优势,值得推广应用。
参考文献
[1] 邓紫娟, 刘玉君, 周胜强, 等. 国医大师刘祖贻防治慢性支气管炎经验[J]. 亚太传统医药, 2023, 19(2): 92-94.
[2] 崔 爽, 张明倩, 梁五林, 等. LPS诱导慢性支气管炎急性发作大鼠模型的建立和评价[J]. 湖南中医药大学学报, 2022, 42(11): 1830-1836.
[3] 牟玉婷, 乔世举. 慢性支气管炎的中医药治疗进展[J]. 实用中医内科杂志, 2022, 36(3): 19-22.
[4] 吴 宁, 黄雨霄, 石 雪, 等. 苗药“杆努尽烟”对慢性支气管炎大鼠TLR4-MyD88-NF-κB信号通路的影响[J]. 贵州医科大学学报, 2020, 45(11): 1283-1288.
[5] 邵国强, 杜 青, 李跃辉, 等. 藏药檀香清咽片对慢性支气管炎模型大鼠支气管肺MyD88/NF-κB/ICAM-1信号通路的影响[J]. 中国药理学通报, 2022, 38(4): 633-638.
[6] 張凯歌, 张燕子, 孙 航, 等. 灵芝水提物对慢性支气管炎大鼠的保护作用及对TLRs通路的影响[J]. 临床和实验医学杂志, 2022, 21(20): 2133-2137.
[7] 李 聪, 黄 芳, 窦昌贵, 等. 紫菀、款冬花配伍对抗炎作用的影响[J]. 中国临床药理学与治疗学, 2009, 14(2): 155-159.
[8] 魏 伟, 吴希美, 李元建. 药理实验方法学[M]. 4版. 北京: 人民卫生出版社, 2010: 1192-1193.
[9] RICKEL E A, SIEGEL L A, YOON B R P, et al. Identification of functional roles for both IL-17RB and IL-17RA in mediating IL-25-induced activities[J]. Journal of Immunology, 2008, 181(6): 4299-4310.
[10] 闫国友, 谌 艳, 王 兴, 等. 慢性支气管炎的中医治疗进展及研究概况[J]. 中国医药导刊, 2011(4): 613-615.
[11] 秦永琪. 紫菀祛痰成分研究[J]. 药学通报, 1984, 19(11): 58-60.
[12] 卢艳花, 戴 岳, 王峥涛, 等. 紫菀祛痰镇咳作用及其有效部位和有效成分[J]. 中草药, 1999, 30(5): 360-362.
[13] 刘可越. 紫菀散药效物质基础的研究及新药研制[D]. 天津: 天津大学, 2006.
[14] LI Z Y, ZHI H J, XUE S Y, et al. Metabolomic profiling of the flower bud and rachis of Tussilago farfara with antitussive and expectorant effects on mice[J]. Journal of Ethnopharmacology, 2012, 140(1): 83-90.
[15] LI Z Y, ZHI H J, ZHANG F S, et al. Metabolomic profiling of the antitussive and expectorant plant Tussilago farfara L. by nuclear magnetic resonance spectroscopy and multivariate data analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 75: 158-164.
[16] WU Q Z, ZHAO D X, XIANG J, et al. Antitussive, expectorant, and anti-inflammatory activities of four caffeoylquinic acids isolated from Tussilago farfara[J]. Pharmaceutical Biology, 2016, 54(7): 1117-1124.
[17] JANG H, LEE J W, LEE C, et al. Sesquiterpenoids from Tussilago farfara inhibit LPS-induced nitric oxide production in macrophage RAW 264.7 cells[J]. Archives of Pharmacal Research, 2016, 39(1): 127-132.
[18] SU X D, JANG H J, LI H X, et al. Identification of potential inflammatory inhibitors from Aster tataricus[J]. Bioorganic Chemistry, 2019, 92: 103208.
[19] LEE J, KANG U, SEO E K, et al. Heme oxygenase-1-mediated anti-inflammatory effects of tussilagonone on macrophages and 12-O-tetradecanoylphorbol-13-acetate-induced skin inflammation in mice[J]. International Immunopharmacology, 2016, 34: 155-164.
[20] XING J, LI R, LI N, et al. Anti-inflammatory effect of procyanidin B1 on LPS-treated THP1 cells via interaction with the TLR4-MD-2 heterodimer and p38 MAPK and NF-κB signaling[J]. Molecular and Cellular Biochemistry, 2015, 407: 89-95.
[21] JUHAS U, RYBA-STANIS AWOWSKA M, SZARGIEJ P, et al. Different pathways of macrophage activation and polarization[J]. Postepy Higieny I Medycyny Doswiadczalnej (Online), 2015, 69: 496-502.
[22] DORRINGTON M G, FRASER I D C. NF-κB signaling in macrophages: Dynamics, crosstalk, and signal integration[J]. Frontiers in Immunology, 2019, 10: 705.
[23] MITCHELL J P, CARMODY R J. NF-κB and the transcriptional control of inflammation[J]. International Review of Cell and Molecular Biology, 2018, 335: 41-84.
[24] GIRIDHARAN S, SRINIVASAN M. Mechanisms of NF-κB p65 and strategies for therapeutic manipulation[J]. Journal of Inflammation Research, 2018, 11: 407-419.
[25] DURAND J K, BALDWIN A S. Targeting IKK and NF-κB for therapy[M]//Chromatin Proteins and Transcription Factors as Therapeutic Targets. Amsterdam, 2017: 77-115.
[26] SINGH S S, RAI S N, BIRLA H, et al. NF-κB-mediated neuroinflammation in Parkinson's disease and potential therapeutic effect of polyphenols[J]. Neurotoxicity Research, 2020, 37(3): 491-507.
[27] 康玉華, 杨 宇, 王宝家, 等. 小承气汤对烟熏法诱导慢性支气管炎模型大鼠TGF-β1/Smad3信号通路的影响[J]. 中华中医药杂志, 2015, 30(10): 3644-3647.
[28] BAINES K J, UPHAM J W, YERKOVICH S T, et al. Mediators of neutrophil function in children with protracted bacterial bronchitis[J]. Chest, 2014, 146(4): 1013-1020.
[29] TANAKA T, NARAZAKI M, KISHIMOTO T. IL-6 in inflammation, immunity, and disease[J]. Cold Spring Harbor Perspectives in Biology, 2014, 6(10): a016295.
[30] BRADFORD E, JACOBSON S, VARASTEH J, et al. The value of blood cytokines and chemokines in assessing COPD[J]. Respiratory Research, 2017, 18(1): 180.
[31] 曹利华, 赵院院, 苗晋鑫, 等. 基于TGF-β信号通路探讨鲜芦根抗慢性支气管炎气道炎症作用机制[J]. 中国中药杂志, 2021, 46(22): 5887-5894.
(本文编辑 周 旦)
