高效液相色谱法测定食品中甜菜红色素
2023-08-13张宏宏林洋许文雅郁蕉竹刘瀛王韵
张宏宏 林洋 许文雅 郁蕉竹 刘瀛 王韵


【摘要】本文选用汽水、果冻、糖果、糕点彩妆四类食品为研究对象,应用高效液相色谱技术建立食品中甜菜红色素的检验方法,并对所建立方法进行标准曲线、检出限、定量限、回收率、精密度等特性参数的方法学验证,以期为甜菜红色素的国家食品安全检测标准的建立提供科学依据。
【关键词】高效液相色谱法;甜菜红;pH值;回收率
【DOI编码】10.3969/j.issn.1674-4977.2023.04.022
Determination of Beet Red Pigment in Food by High Performance Liquid Chromatography
ZHANG Honghong, LIN Yang, XU Wenya, YU Jiaozhu, LIU Ying, WANG Yun
(Shenyang Institute of Food and Drug Inspection, Shenyang 110122, China)
Abstract: This article selects four types of food, namely soda, jelly, candy, and makeup on pastries, as the research objects. High performance liquid chromatography technology is used to establish an inspection method for beet red pigment in food. The established method is validated with specific parameters such as standard curve, detection limit, quantitative limit, recovery rate, and precision, in order to provide scientific basis for the establishment of national food safety detection standards for beet red pigment.
Key words: high performance liquid chromatography; beet red pigment; pH value; recovery rate
甜菜红色素是一种水溶性含氮类色素,主要存在于红甜菜(俗称紫菜头)、商陆、火龙果、紫茉莉、鸡冠花及仙人掌属的某些植物体中,是优良的食用红色色素和黄色色素来源[1]。
甜菜红色素作为一种天然的食用色素,具有着色力强、安全无毒、对人体无害等优点,可广泛应用于食品、医药、保健品等行业[2]。此外,甜菜红还具有抗氧化和清除自由基的生理功能[3-4]。由此可见,甜菜红色素是一种极具开发价值的天然红色素,未来天然甜菜红色素是不可或缺的纯绿色食品添加剂。
目前,我国对甜菜红色素的常用检测方法主要是分光光度法、薄层色谱法(TCL)等。分光光度法操作较简单,缺点是不能排除复杂样品中其他色素成分的干扰,误差较大,灵敏度较低;TCL法测定过程复杂,分析时间长,不易定量,精密度差[5]。高效液相色谱法(HPLC)由于其本身具有自动化程度高、分离效能好、准确性和重现性高等优点,更适合复杂成分的分离、分析。但我国对食品中甜菜红色素含量的HPLC检测方法尚未制定相关标准。因此,我国需建立一个检测限低、易于操作使用并推广、代表国家水平且与国际标准接轨的甜菜红色素分析方法[6]。
采用高效液相色谱法分离测定甜菜红色素已有报道[7-11],但该方法存在梯度洗脱、过程烦琐等缺点。本文应用高效液相色谱仪对食品中甜菜红色素的分析方法进行探索研究,确定食品中甜菜红色素的最佳提取条件及色谱条件,同时对已确立的方法进行校准曲线、检出限、定量限、回收率、精密度等特性参数的方法学验证,以期为建立快速、准确的食品中甜菜红色素的高效液相色谱检测方法提供科学依据。
1仪器、试剂与材料
1.1仪器
Waters e2695高效液相色谱仪(配PDA2998检测器);BSA323S型电子天平:赛多利斯科学仪器(北京)有限公司;涡旋混合器IKA MS3 digital;KQ250DB型数控超声波清洗器:昆山市超声仪器有限公司;H750R高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;FW100不锈钢高速搅拌器:天津市泰斯特仪器有限公司;0.45μm水相滤膜:上海安谱实验科技股份有限公司。
1.2试剂
乙腈(CH3CN)、甲酸(HCOOH)、磷酸(H3PO4):色谱纯,赛默飞世尔科技有限公司。
1.3材料
选用市售汽水、果冻、糖果、糕点彩妆四类食品为研究对象。
2实验方法
2.1标准溶液
2.1.1标准品
甜菜红:上海源叶生物科技有限公司(CAS:7659-95-2,纯度≥96%),或经国家认证并授予标准物质证书的标准物质。
2.1.2标准溶液配制
精密称取甜菜红标准物质10.0 mg,用水溶解并定容至10 mL,充分摇匀,配制成1 mg/mL的标准储备液,贮存于密闭的棕色玻璃瓶中,于4℃条件下保存期为1个月。
2.1.3标准系列工作液
根据实际检测需要配制甜菜红标准系列工作液,现用现配。
2.2样品的制备与提取
2.2.1汽水
设置数控超声波清洗仪温度在25℃以下,在此条件下对汽水样品进行超声处理20 min。称取处理后的样品1.00 g于50 mL离心管中,加入5 mL水,渦旋混匀,超声提取10 min,于8000 r/min条件下离心3 min,取上清液。重复上述提取过程一次,合并上清液并用水定容至10 mL。提取液经0.45μm水相滤膜过滤后待测。
2.2.2果冻(含胶基果冻除外)
使用不锈钢高速搅拌器对果冻样品粉碎处理后进行目标物质提取,提取操作同2.2.1。
2.2.3糖果(含胶基果冻除外)
使用研钵将糖果样品粉碎研磨处理后进行目标物质提取,提取操作同2.2.1。
2.2.4糕点彩妆
准确称取1.00 g试样于50 mL具塞离心管中,加入正己烷5 mL,在≤25℃超声波清洗仪中超声处理5 min,然后加入5 mL体积浓度为1%的氨水溶液,再加入乙醇1 mL,涡旋混匀后于≤25°C超声波清洗仪中超声处理5 min,然后加入亚铁氰化钾溶液1 mL和乙酸锌溶液1 mL,涡旋混匀后在8000 r/min条件下离心5 min,然后弃去有机相,水相转移至10 mL容量瓶中,残渣重复上述操作再提取一次后,合并上清液并定容至10 mL后上机测定(制备好的样品于4℃条件下保存,保存时间不超过3 d。胶基糖果、果冻样品的溶解温度通常需要在50°C以上,而甜菜红在50°C条件下易发生降解且降解程度随着温度的升高而增加,因此本方法不包括胶基糖果、果冻样品的检测)。
2.3色谱条件
1)色谱柱:Syncronis C18色谱柱(250 mm×4.6 mm,5μm);检测波长λ:530 nm;柱温:35℃。
2)进样量:20μL;流动相A为0.1%磷酸水溶液,B为乙腈。
3结果与分析
3.1提取条件的优化选择
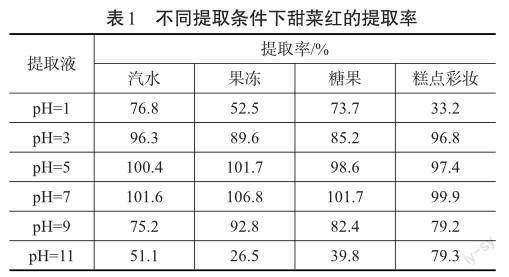
甜菜红色素是水溶性含氮类色素,易溶于水,不溶于无水的有机溶剂,如乙醇、乙醚、丙酮、氯仿、丙二酮、石油醚和乙酸等[12]。本文选用水作为提取溶剂,比较分析汽水、果冻、糖果、糕点彩妆四类食品在不同pH值水溶液下的提取效率。具体检测结果见表1。

試验结果表明,在pH=7的中性条件下甜菜红提取率最高。汽水、果冻、糖果、糕点彩妆四类食品在此条件下的提取率分别为:101.6%、106.8%、101.7%、99.9%。目标物质提取较完全,满足实验要求,因此选择水作为提取溶剂。
3.2色谱条件的优化选择
比较分析梯度洗脱及等度洗脱条件下甜菜红的谱图特征。梯度洗脱条件见表2。此条件下甜菜红(0.5 mg/mL标准溶液)色谱图(λ=530 nm)见图1。等度洗脱条件为流动相A(0.1%磷酸水溶液)+流动相B(乙腈)=92+8,此条件下甜菜红(0.5 mg/mL标准溶液)色谱图(λ=530 nm)见图2。

由图1、图2色谱图可以看出:在梯度洗脱及等度洗脱条件下,甜菜红及其异构体均能达到很好的分离度,均能满足实验条件要求。但梯度洗脱较为烦琐,因此本实验选用等度洗脱的色谱分离条件。
3.3线性关系考察及检出限、定量限测定
3.3.1线性关系
配制甜菜红标准系列溶液:0.05、0.1、0.2、0.5、1.0 mg/mL,按上述色谱条件进行测定,以峰面积(Y)为纵坐标,浓度(X,mg/mL)为横坐标作标准曲线。甜菜红及其异构体分别表示为甜菜红1、甜菜红2。首先采用面积归一化法确定两个峰的百分比,再根据百分比计算两个峰对应的目标物质浓度。经实验测定,在0.05~1.0 mg/mL浓度范围内,甜菜红1的线性回归方程为:Y=1.86e2X+9.92e,线性相关系数r为0.9998;甜菜红2的线性回归方程为:Y=1.92e2X-1.22e2,线性相关系数r为0.9999。甜菜红1、甜菜红2线性相关系数均≥0.99,线性关系良好,满足标准GB/T 27404—2008《实验室质量控制规范食品理化检测》[13]对校准曲线的要求。
3.3.2方法检出限与定量限
1)方法检出限。在空白汽水、果冻、糖果、糕点彩妆四类食品基质中添加不同量的甜菜红标准品,按2.2方法进行样品制备及前处理,并对上述加标样品进行HPLC测定。信噪比(S/N)约为3时测得的四类样品中目标物质浓度分别为:15.006、14.626、14.825、14.887 mg/L,对应到四类样品中甜菜红质量浓度分别为:0.150、0.146、0.148、0.149 g/kg,因此以0.15 g/kg来作为方法检出限。
2)定量限。在空白汽水、果冻、糖果、糕点彩妆四类食品基质中添加不同量的甜菜红标准品,按2.2方法进行样品制备及前处理,并对上述加标样品进行HPLC测定。信噪比(S/N)约为10时测得四类样品中目标物质浓度分别为:49.079、48.632、48.631、49.055 mg/L,对应到四类样品中甜菜红质量浓度分别为:0.491、0.486、0.486、0.491 g/kg,因此以0.50 g/kg来作为定量限。
3.4回收率及精密度试验
3.4.1回收率
分别称取饮料、果冻、糖果、糕点彩妆空白基质1.00 g,添加甜菜红标准溶液,使样品中目标物质含量分别为0.5、1.0、5.0 g/kg,每类食品进行三水平六平行的加标试验。按2.2方法进行样品制备、前处理后进行HPLC测定。
3.4.2精密度
选用3.4.1回收率试验中的加标样品进行精密度试验,每个浓度进行6次重复测定。三水平加标样品测得的回收率平均值及精密度结果见表3。
由表3实验数据可以得出:三个加标水平下,四类样品所得回收率均在95%~105%之间;添加浓度为0.5 g/kg时测得精密度均<5.3%;添加浓度为1.0 g/kg及5.0 g/kg时测得精密度均<3.8%。综上,四类样品的三水平加标试验所得回收率及精密度均满足GB/T 27404—2008对回收率及精密度的要求。

4讨论
4.1检测波长的选择
在紫外-可见光波长范围内,每种物质对不同波长的光线具有不同的吸收能力。本实验根据主成分在流动相中的紫外吸收谱图来确定检测波长。甜菜红及其异构体在530 nm处有最大吸收峰,且无溶剂干扰(甲醇的紫外吸收波长在205 nm以下),故选择530 nm作为甜菜红的检测波长。
4.2提取试剂及色谱条件的选择
本研究比较分析了不同pH(1、3、5、7、9、11)条件下目标物质的提取率。测试结果表明:采用中性水溶液提取时,目标物质提取率最高,提取较完全,故选水作为最终的提取溶剂。同时,比较分析了梯度洗脱及等度洗脱条件下目标物质的色谱特征。测试结果表明:两种色谱条件均可达到试验要求,但考虑试验的简便性,故采用等度洗脱方法。
4.3方法学验证
本研究的方法学验证参照GB/T 27404—2008附录F检测方法确认的技术要求进行,内容包括标准曲线的线性、方法检测限、定量限、精密度、准确度(回收率)。结果表明:所建立的高效液相色谱分析方法准确性高,适合于食品中甜菜红的定性及定量检测。
5结论
本方法在进行甜菜红色素检测时在曲线的线性、方法检出限、定量限、精密度,准确度等方面均能满足日常检测工作的需要。该方法前处理简单、试剂易得,且采用了等度洗脱方法,分析时间短、灵敏度高,可用于食品中甜菜红含量的测定。同时,高效液相色谱法还具有自动化程度高、样品用量小、分离效能高、无热分解的危险等优点,能较好地分离检测热不稳定的甜菜红色素。该方法适合在日常检测工作中推广应用。
【参考文献】
[1]蔺定运.食用色素的识别与应用[M].北京:中国食品出版社,1987.
[2]熊勇.甜菜红色素的制备及其稳定性的研究[D].南昌:南昌大学,2011.
[3]PEDRENO M A,ESCRIBANO J.Studying the oxidation and the antiradical activity of betalain from beetroot[J]. Journal of Biological Education,2000,35(1):49-51.
[4]KANNER J,HAREL S,GRANIT R. Betalains-A New Class of Dietary Cationized Antioxidants[J]. Agricultural and Food Chemistry,2001,49(11):5178-5185.
[5]孙世萍,代斌,洪成林.高效液相色谱法测定甜菜红色素[J].食品科学,2006(2):215-217.
[6]孙世萍.高效液相色谱法检测甜菜红色素的方法研究[D].石河子:石河子大学,2006.
[7]JOSE A. FERNANDEZ L A,LUIS A B. Application of high-performanceliquidchromatographytothe characterization of the betalain pigments in prickly pear fruits-ScienceDirect[J]. Journal of Chromatography A,2001,913(1/2):415-420.
[8]SCHLIEMANN W,CAI Y,DEGENKOLB T,et al. Betalains of Celosia argentea[J].Phytochemistry,2001,58(1):159-165.
[9]CAI Y,SUN M,SCHLIEMANNET W,et al. Chemical stability and colorant properties of betaxanthin pigments from Celosia argentea[J].Journal of Agricultural & Food Chemistry,2001(9):49.
[10] SCHOEFS B.Determination of pigments in vegetables[J]. Journal of chromatographyA,2004,1054(1/2):217-226.
[11] STRACK D,VOGT T,SCHLIEMANN W. Recent Advances in Betalain Research[J].Phytochemistry,2003,62(3):247-269.
[12]郝秀梅.甜菜紅色素的分离纯化及抗氧化与抗疲劳活性的研究[D].哈尔滨:东北林业大学,2011.
[13]实验室质量控制规范食品理化检测:GB/T27404—2008[S].
【作者简介】
张宏宏,女,1987年出生,高级工程师,硕士,研究方向为食品检测。
(编辑:李加鹏)
