亚硝基胍-紫外复合诱变选育高产衣康酸菌株
2023-08-12杜敬彩赵刚李自云许国峰张成虎
杜敬彩,赵刚,李自云,许国峰,张成虎*
(1.山东泓达生物科技有限公司,山东临沂 276400;2.山东沂蒙山酒业有限公司,山东临沂 276400)
衣康酸学名为甲叉琥珀酸、亚甲基丁二酸,是不饱和二元有机酸。因为衣康酸分子内含一个不饱和双键,化学性质活泼,可进行自聚合,也能与其他有机物共聚。衣康酸具有两个羧基,还可以与醇发生酯化反应。平台化合物是指可进一步转化为价值更高的目标化工产品的基础化学物,2004 年,衣康酸被美国能源部评选为12 种最具发展潜力的生物基平台化合物之一[1]。衣康酸酯类是生产腈纶、树脂、塑料、橡胶、药物、表面活性剂、无毒食品包装材料、除草剂、除垢剂、粘着剂、除臭剂、纸张等的工业原料,广泛用于化工行业[2-3]。因此,衣康酸是化学合成工业的重要原料,也是化工生产的重要原料。
衣康酸的生产方法主要有化学法和生物法,相比化学法生产衣康酸,生物发酵法具有原料来源丰富、成本较低、反应条件温和、环境友好、工艺技术成熟等优点,因此生物发酵法是目前衣康酸生产的主流方向。近年来报道的微生物发酵法生产衣康酸的主要菌种包括土曲霉[4](Aspergillus terreus)、玉米黑粉菌[5](Ustilago maydis)、黑曲霉[6](Aspergillus niger),这些菌株产生的衣康酸可自主分泌到胞外。目前,土曲霉(Aspergillus terreus)仍然是应用最广泛的衣康酸工业生产菌株,但菌种产量较低、产酸不稳定成为制约衣康酸生物发酵产业快速发展的重要因素。因此,利用传统诱变育种或基因重组对菌种进行改良已成为衣康酸生产领域的重要研究方向。
传统的物理、化学诱变方法可以促进诱发突变,提高突变率,并且因其便捷、快速、有效等优点,迄今为止仍是国内外提高菌种产量、性能的主要手段。诱变方法不同对菌株产生的诱变效应也不同。如紫外诱变是一种常用的物理诱变因素,可使DNA 形成嘧啶二聚体[7],而亚硝基胍(NTG)是烷化剂的一种,被喻为“超诱变剂”[8],它主要在DNA 链的复制区引起GC →AT 的转换,即使在致死率很低的条件下也能使微生物产生高频率的突变。单一诱变方法虽可得到高产菌株,但突变概率偏低;复合诱变具有协同效应,比单一诱变效果好[9]。
本研究采用亚硝基胍-紫外复合诱变对本实验室一株产衣康酸菌株进行菌种选育,加大菌株突变率,有效提高高产菌株的选育效率,并对高产菌株的遗传稳定性进行了研究。
1 材料与方法
1.1 材料
1.1.1 菌株
土曲霉KYK-031,本实验室筛选保藏。
1.1.2 培养基
(1)传代斜面培养基:葡萄糖20.0 g/L,胰蛋白胨1.0 g/L,玉米浆3.0 g/L,硫酸镁1.0 g/L,磷酸二氢钾0.5 g/L,琼脂20.0 g/L,pH 自然。
(2)种瓶培养基:葡萄糖40.0 g/L,硫酸铵5.0 g/L,玉米浆2.5 g/L,硫酸镁1.0 g/L,磷酸二氢钾0.5 g/L,硝酸调pH 值至3.0。
(3)摇瓶培养基:葡萄糖130.00 g/L,硫酸铵5.00 g/L,玉米浆2.50 g/L,硫酸镁1.00 g/L,磷酸二氢钾0.50 g/L,硫酸亚铁0.01 g/L,硫酸锌0.01 g/L,氯化钙0.50 g/L,硝酸调pH 值至3.0。
(4)初筛显色平板培养基:葡萄糖100.00 g/L,硫酸铵5.00 g/L,玉米浆2.50 g/L,硫酸镁1.00 g/L,磷酸二氢钾0.50 g/L,硫酸亚铁0.01 g/L,硫酸锌0.01 g/L,溴甲酚绿0.10 g/L,琼脂20.00 g/L。
1.1.3 试剂
亚硝基胍,分析纯,上海源叶生物科技有限公司;溴甲酚绿,分析纯,天津市科密欧化学试剂有限公司;胰蛋白胨,生化试剂,国药集团化学试剂有限公司;玉米浆,生化试剂,鲁洲生物科技(山东)有限公司;琼脂,生化试剂,上海沃凯药业有限公司;酚酞,分析纯,天津市北辰区方正试剂厂;其余试剂均为国药集团化学试剂有限公司生产的分析纯试剂。
1.1.4 仪器与设备
ZWY-2112B 型恒温摇床、ZXDP-B2270 型电热恒温培养箱和ZHJH-C1112C 型超净工作台,上海智城分析仪器制造有限公司;LDZM-80L-Ⅱ型立式高压蒸汽灭菌锅,上海申安医疗器械厂;SBA-40E 型生物传感分析仪,山东省科学院生物研究所。
1.2 实验方法
1.2.1 单孢子悬液制备
甘油管菌种接种新鲜斜面培养基,37 ℃培养6 ~7 d,待长出孢子,取出斜面加入6 mL 磷酸缓冲液(0.1 mol/L,pH 6.0),用接种环刮下孢子,振荡试管立即通过带滤纸漏斗过滤,调整孢子悬液的浓度为106个/mL,得到单孢子悬液[10]。
1.2.2 亚硝基胍(NTG)溶液的制备
使用磷酸缓冲液(0.1 mol/L,pH 6.0)配制1 mg/mL亚硝基胍溶液,于暗处振荡溶解后备用。
1.2.3 亚硝基胍诱变
亚硝基胍溶液与单孢子悬液以1 ∶1 的体积比例混合,30 ℃振荡20 ~60 min,20 min 时取样1 次,之后每10 min 取样1 次,取样后立即稀释1 000 倍终止反应;梯度稀释后,于初筛显色平板进行分离培养,37 ℃培养3 d 后计数。未处理的单孢子悬液与pH 6.0的磷酸缓冲液以1 ∶1 的体积比例混合,梯度稀释后于初筛显色平板进行分离培养,37 ℃培养3 d 后计数。
根据处理前后的孢子数按公式(1)计算致死率。根据Hc 值(变色圈直径与菌落直径的比值),处理后的单菌落比处理前的单菌落Hc值高的为正突变菌株,按公式(2)计算正突变率。
式中:B0和By分别为每1 mL 未处理和诱变处理孢子液中孢子数;J为每1 mL 对照组菌液中菌株数。
1.2.4 紫外诱变
取单孢子悬液8 mL 至直径为9 cm 的无菌培养皿中,置于磁力搅拌器上,15 W 紫外线下30 cm 处。在正式照射前,应先开启紫外灯预热10 ~20 min,待光波稳定后,开启皿盖和磁力搅拌,分别照射1 min、2 min、3 min、4 min 和5 min。操作全过程在红灯下进行,避免白炽光。诱变单孢子悬液放入黑暗冰箱中保存1 h,抑制突变体中的修复酶活,提高诱变突变率。取未照射的制备孢子液和照射后冰箱保存的孢子液各1 mL,梯度稀释至合适浓度,取0.1 mL 单孢子悬液均匀涂布于初筛显色平板,于37 ℃避光培养3 d。计算致死率和正突变率。
1.2.5 亚硝基胍-紫外复合诱变
以亚硝基胍和紫外线诱变的最佳参数进行复合诱变。取经亚硝基胍诱变的单孢子悬液8 mL 至直径为9 cm 的无菌培养皿中,进行紫外诱变,稀释分离后涂布于初筛显色平板,于37 ℃避光培养3 d。根据孢子液中活孢子数和Hc 值,以未经处理的单孢子悬液为对照,计算致死率和正突变率。
1.2.6 筛选方法
(1)平板初筛
衣康酸单菌落生长过程中产生衣康酸,渗透进周围培养基中,导致pH 降低,初筛显色平板在溴甲酚绿酸碱指示剂的作用下,蓝绿色的平板上产生黄色变色圈,根据初筛显色平板上的Hc 值,选取10%的高产菌株传代于试管斜面培养基,37 ℃下恒温培养箱培养3 d 进入复筛。
(2)摇瓶复筛
将平板初筛获得菌株斜面孢子接种瓶培养基,37 ℃下200 r/min 回旋式摇床培养36 h,按10%接种量转接摇瓶培养基,500 mL 三角瓶装液量为60 mL,每株菌株做3 个平行,在37 ℃下200 r/min 回旋式摇床培养3 d。
(3)诱变筛选路线
根据选定诱变条件,确定如下诱变路线[11]。第一轮:以土曲霉HYK-031 为出发菌株,经亚硝基胍-紫外复合诱变后,初筛显色平板上根据Hc 值从500 株显色菌株进行初筛,选取50 株Hc 值较大菌株进行摇瓶复筛,筛选出5 株高产菌株。第二轮:分别以5 株高产菌株为出发菌株,每株出发菌株经亚硝基胍-紫外复合诱变后,分别从初筛显色平板上长出的100 株显色菌株(共500 株)中进行初筛,选取50 株Hc 值较大菌株进行摇瓶复筛,筛选出5 株高产菌株。第三轮:与第二轮步骤相同。第四轮:与第三轮步骤相同。
1.2.7 高产突变株遗传稳定性考察
将亚硝基胍-紫外复合诱变后复筛选育的衣康酸高产菌株,连续传5 代,并将5 代全部进行摇瓶发酵验证,根据发酵结果确定高产菌株的遗传稳定性。
1.2.8 分析方法
(1)衣康酸含量检测
发酵完毕,取出摇瓶加水恢复至原体积60 mL,取发酵液用滤纸进行过滤后,称取滤液0.2 g,精确到0.2 mg,用约50 mL 水溶解并全部移入250 mL 锥形瓶中,加酚酞指示液2 ~3 滴,以0.1 mol/L 氢氧化钠标准滴定溶液滴定至淡粉色,并保持30 s不褪色为终点,记录消耗氢氧化钠标准滴定溶液的体积V1,同时做空白试验,记录消耗氢氧化钠标准滴定溶液的体积V2。衣康酸质量分数W按公式(3)计算。
式中,c为氢氧化钠标准滴定溶液的准确浓度,mol/L;65.05 为衣康酸的摩尔质量,g/mol;m为试样的质量,g。
(2)糖酸转化率
生物传感分析仪检测初始糖浓度和残糖浓度,糖酸转化率按公式(4)计算。
1.3 统计与分析
利用Excel 2007 软件对数据进行平均数和方差的统计分析。
2 结果与分析
2.1 亚硝基胍诱变时间的确定
对出发菌株土曲霉KYK-031 进行亚硝基胍诱变后,计算致死率和正突变率,结果如图1 所示。亚硝基胍在500 μg/mL 浓度下,随着亚硝基胍诱变时间的延长,致死率逐渐升高,正突变率则先上升后下降。当亚硝基胍诱变时间为40 min 时,正突变率达到最高(15%),此时的致死率为81.6%。因此,选择亚硝基胍诱变时间为40 min。
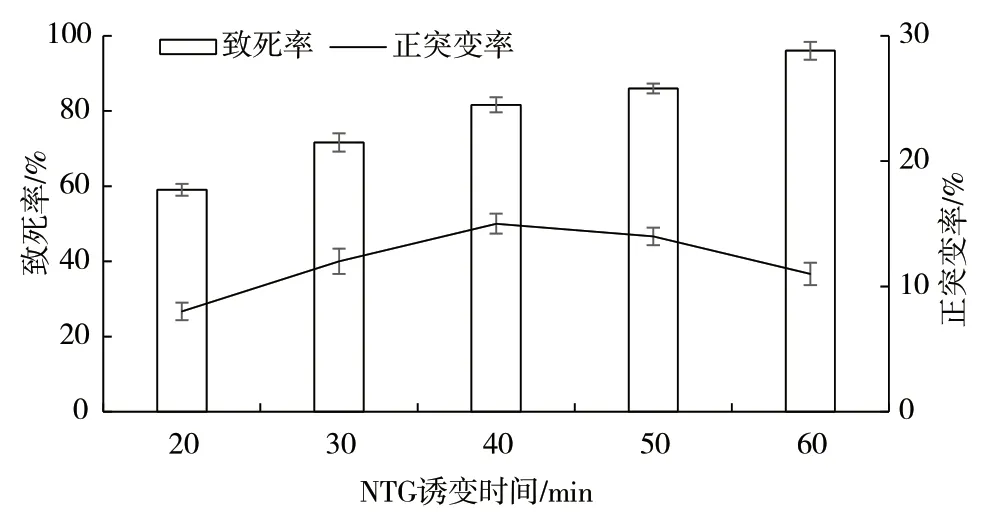
图1 NTG 诱变的影响
2.2 紫外诱变时间的确定
对出发菌株土曲霉KYK-031 进行了紫外诱变后,计算致死率和正突变率,结果如图2 所示。在相同紫外照射强度下,随着诱变时间的延长致死率逐渐升高,正突变率则呈现先上升后下降的趋势。当紫外诱变时间为2 min 时,正突变率达到最高(17.3%),此时的致死率为75.2%。因此,选择紫外诱变时间为2 min。
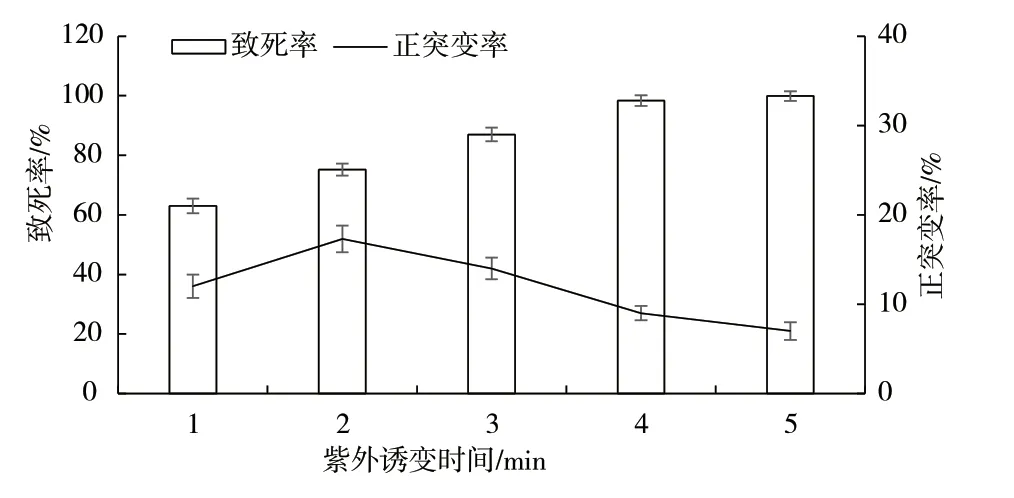
图2 紫外诱变的影响
2.3 亚硝基胍-紫外复合诱变
对出发菌株土曲霉KYK-031 进行亚硝基胍-紫外复合诱变,选择亚硝基胍诱变浓度为500 μg/mL,亚硝基胍诱变时间为40 min,15 W 紫外线照射时间为2 min,亚硝基胍-紫外复合诱变后,进行致死率和正突变率的计算。三次重复实验结果见表1,致死率达到93.5%,正突变率也达到了26.1%,比单一诱变正突变率高。
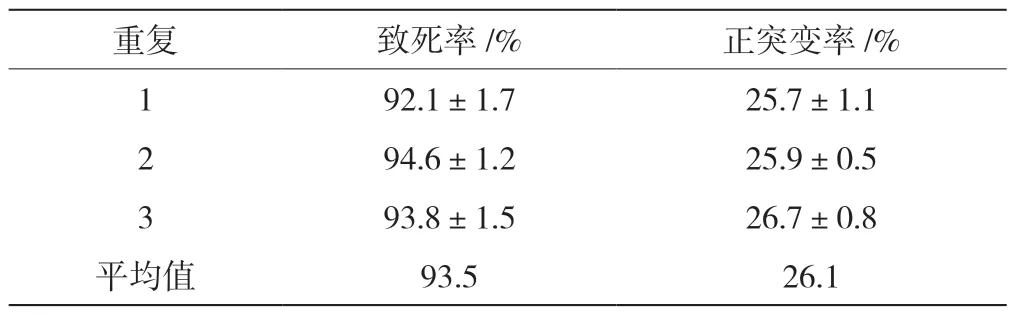
表1 亚硝基胍-紫外复合诱变对土曲霉的影响
2.4 高产菌株的筛选
以土曲霉KYK-031 为出发菌株,进行三轮亚硝基胍-紫外复合诱变后,根据平板初筛和摇瓶复筛结果,筛选出5 株衣康酸高产菌株KYK-1035、KYK-1165、KYK-1352、KYK-1483 和KYK-1494,摇瓶发酵产量结果如图3 所示。KYK-1035 菌株摇瓶发酵衣康酸产量最高,为73.7 g/L,比出发菌株(41.8 g/L)提高了76.3%,糖酸转化率为63.4%。
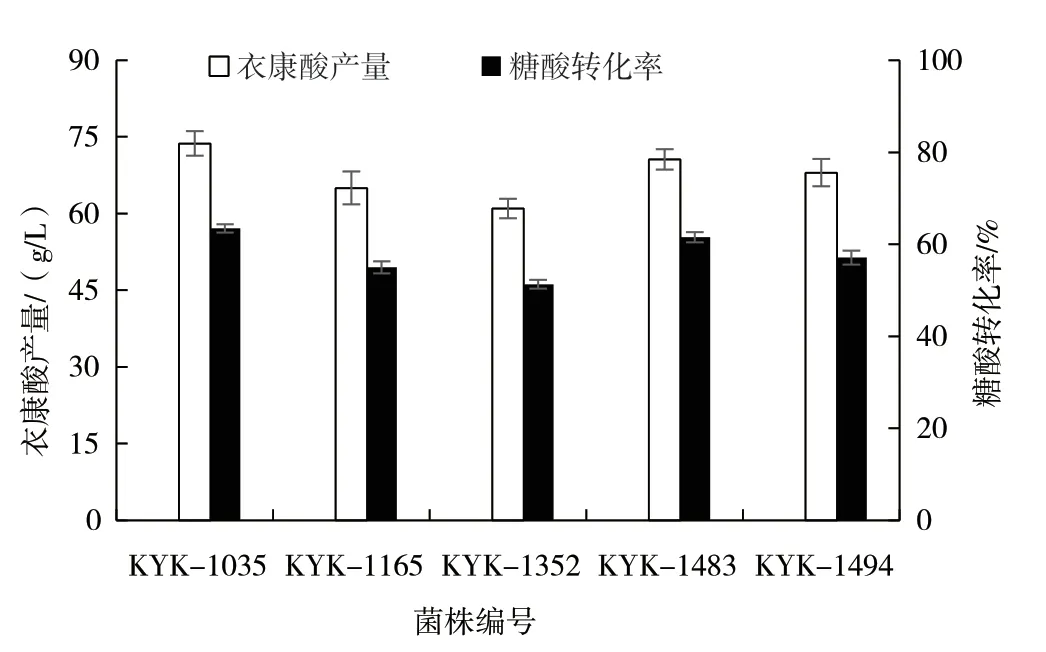
图3 土曲霉突变株产量和糖酸转化率
2.5 高产菌株的遗传稳定性
筛选出的衣康酸高产菌株要符合生产菌株稳定性的要求。对筛选出的衣康酸高产菌株KYK-1035传代5 次,对5 代菌株的遗传稳定性进行考察,结果见表2。由结果可知,KYK-1035 菌株摇瓶发酵衣康酸的产量维持在72.4 ~73.9 g/L,糖酸转化率维持在62.6%~63.6%,衣康酸产量和糖酸转化率都较稳定,遗传稳定性良好。
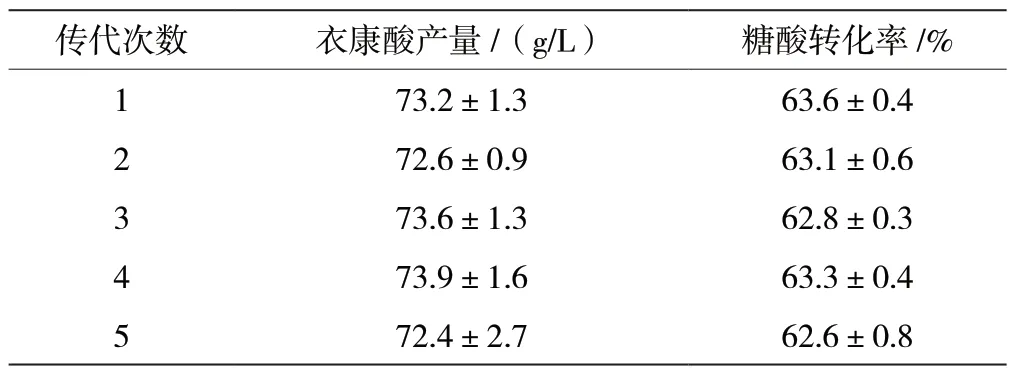
表2 土曲霉突变株KYK-1035 的遗传稳定性
3 结论
通过对衣康酸出发菌株土曲霉KYK-031 进行传统的化学、物理诱变,获得高产衣康酸菌株。分别对亚硝基胍诱变和紫外诱变的致死率和正突变率进行研究,确定了亚硝基胍在500 μg/mL 浓度下的最佳诱变时间为40 min,15 W 紫外诱变的最佳诱变时间为2 min。最佳诱变条件下对土曲霉KYK-031 进行亚硝基胍-紫外复合诱变,比单一诱变的正突变率更高。进行三轮亚硝基胍-紫外复合诱变后,筛选出一株衣康酸高产菌株KYK-1035,摇瓶发酵衣康酸产量水平为73.7 g/L,比出发菌株(41.8 g/L)提高了76.3%,糖酸转化率为63.4%。对KYK-1035 菌株进行遗传稳定性验证,该菌株稳定性良好,为今后的工业化生产奠定了基础。后期将继续对该菌株进行逐步放大优化,使其作为生产菌株更适应工业化生产。
