基于网络药理学结合LC-MS与分子对接探讨黄芪-莪术药对治疗卵巢癌的有效成分及作用机制
2023-08-12祖玥梁研孙若岚赵凡卞勇唐德才尹刚
祖玥,梁研,孙若岚,赵凡,卞勇,唐德才,尹刚
(南京中医药大学中医学院·中西医结合学院,江苏 南京 210023)
卵巢癌(Ovarian cancer,OC)是妇科常见的恶性肿瘤之一,死亡率高居妇科恶性肿瘤首位[1]。OC发病具有隐匿性和进展迅速性特点,大多数患者确诊时已是晚期,严重影响临床治疗效果,对妇女生命健康造成极大危害。中医药在卵巢癌防治方面优势明显[2-3],卵巢癌在中医属“癥瘕”“积聚”“肠蕈”等范畴,多为阴阳失调,脏腑虚弱,外邪入侵人体搏结气血,气血瘀滞,久成积聚而发病,治疗以补气活血为主[4-5]。黄芪、莪术配伍在临床上治疗消化道肿瘤效果良好[6],且课题组前期研究证实黄芪、莪术配伍能够有效抑制卵巢癌的生长,与调控肿瘤血管生成、肿瘤细胞凋亡相关基因的表达密切相关[7-8],但作用机制尚未明确。本文拟基于网络药理学、LC-MS及分子对接技术,构建“成分-靶点”、靶点互作(PPI)、靶点功能通路等多层次生物信息网络,分析黄芪-莪术药对治疗卵巢癌的有效成分和作用机制,为临床应用提供依据。
1 材料与方法
1.1 LC-MS技术定量分析黄芪-莪术药对代表性成分
1.1.1 材料 黄芪为蒙古黄芪Astragalusmembranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao的干燥根,莪术为温郁金CurcumawenyujinY.H.Chen et C.Ling的干燥根茎,均购自江苏省中医院中药房,并由南京中医药大学药学院吴啟南教授鉴定。
芒柄花素(Formononetin,F27J7S18516)、毛蕊异黄酮(Calycosin,Y24N9Y75652)、黄芪皂苷Ⅱ(Astragaloside Ⅱ,YM0306HD14)、黄芪甲苷(Astragaloside Ⅳ,J04M8T30363)、芒柄花苷(Ononin,R28O8F46957)及毛蕊异黄酮葡萄糖苷(Calycosin-7-glucoside,Y27F9H54731)购自上海源叶生物科技有限公司;大豆皂苷Bb(Soyasaponin Ⅰ,LW18020501)及姜黄素(Curcumin,LW17091410)购自南京良纬生物科技有限公司;吉马酮(Germacron,PS010352);去甲氧基姜黄素(Demethoxycurcumin,PS000767);双去甲氧基姜黄素(Bisdemethoxycurcumin,PS010211)购自成都普思生物科技有限公司。所有标准品纯度均≥98%。
1.1.2 仪器 Vanquish UHPLC超高效液相色谱系统(Thermo,USA);TSQ Quantis三重四极杆液质联用仪,配有HESI、APCI离子源(Thermo ScientificTMTSQ QuantisTM,USA);Milli-Q Gradient A10超纯水器(Millipore,USA); Labconco CentriVap冷冻离心浓缩仪(Labconco,USA);Centrifuge 5804R大型高速冷冻离心机(Eppendorf,Germany)。
1.1.3 样本制备 黄芪-莪术水煎液的制备:称取黄芪10 g和莪术5 g,加10倍量纯水回流提取2次,每次1 h,装载挥发油测定器收集挥发油,合并2次上清液,旋蒸浓缩后加入挥发油定容至15 mL,过0.22 μm微孔滤膜并稀释成50 mg·mL-1的供试品溶液。
对照标准品溶液的配制:分别取上述标准品配制1.0 mg·mL-1的单个标准品母液(单标),稀释成500 ng·mL-1,进样确定方法学;后单标配成混合标准品溶液(混标),并梯度稀释:1、5、10、25、50、100、250、500、1000 ng·mL-1。
1.1.4 检测条件 色谱条件:色谱柱为ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm,江苏汉邦),以0.1%甲酸水(A)-乙腈(B)为流动相,流速为0.25 mL·min-1,柱温40 ℃,梯度洗脱(0~0.5 min,10% B;0.5~3 min,10%~25% B;3~9 min,25%~75% B;9~10 min,75%~100% B;10~12 min,100% B;12~12.1 min,100%~10% B;12.1~15 min,10%B)。
质谱条件:电喷雾电离源(H-ESI),正离子模式(ESI+)和负离子模式(ESI-)扫描,电压均为3 kV,离子传输管温度325 ℃,气化温度350 ℃,鞘气压50 arb,辅助气压10 arb。
1.1.5 数据分析 供试品及标准品溶液进样测定,通过一级质谱图确定相对分子质量、各化学成分的保留时间等相关质谱信息,结合提取离子流图,获得裂解的二级质谱信息,与标准品、文献数据比对进行半定性与定量分析黄芪-莪术药对中的代表性成分。
1.2 网络药理学分析黄芪-莪术药对抗OC有效成分及作用机制
1.2.1 黄芪-莪术药对成分靶点收集 在上述LC-MS定量分析结果的基础上,应用TCMSP数据库(http://tcmspw.com/tcmsp.php)并结合文献报道,收集筛选黄芪-莪术药对活性成分及作用靶点,在PubChem数据库中(https://pubchem.ncbi.nlm.nih.gov/)获取药对活性成分PubChem CID编号及分子SDF结构式,将其导入Swiss Target Prediction数据库(http://www.swiss target prediction.ch)进行靶点预测,以此作为TCMSP数据库靶点信息的补充,最后利用Uniprot数据库(https://www.uniprot.org)进行靶点名称标准化。
1.2.2 黄芪-莪术药对抗OC的作用靶点获取 以“Ovarian cancer”和“Ovarian carcinoma”为关键词,通过Drugbank数据库(https://www.drugbank.ca/)、DisGeNET数据库(https://www.disgenet.org/)、GeneCards数据库(https://www.genecards.org/)检索、收集、合并OC的疾病靶点并标准化,将其与“1.2.1”中黄芪-莪术药对成分靶点取交集,交集靶点即为黄芪-莪术药对抗OC的潜在作用靶点。
1.2.3 黄芪-莪术药对抗OC关键靶点及生物信息学分析 将“1.2.2”中黄芪-莪术药对抗OC潜在作用靶点导入STRING数据库(https://www.string-db.org/)获得蛋白互作关系(protein-protein interaction,PPI),并在CytoScape中构建PPI网络,分析获得相互作用网络的潜在关键靶点。并通过Metascape数据库(http://metascape.org/gp/index.htmL)对黄芪-莪术药对抗OC潜在作用靶点进行基因功能注释(GO)和京都基因组百科全书(KEGG)通路富集分析。
1.2.4 黄芪-莪术药对核心活性成分与关键靶点的确定 将黄芪-莪术药对的所有活性成分、抗OC潜在的关键靶点及富集的前10条信号通路导入CytoScape构建“药材-成分-靶点-通路-疾病”网络,并根据网络拓扑学参数确定黄芪-莪术药对发挥抗OC的核心成分、关键靶点及主要通路。
1.3 黄芪-莪术药对抗OC关键靶点分子对接验证
通过RSCB PDB数据库(http://www.rcsb.org)获取关键靶点蛋白3D结构,用PyMOL软件(www.pymol.org)对蛋白质进行去水,利用AutoDockTools 1.5.6软件对靶点蛋白受体和配体小分子进行加氢等常规处理,以原配体为中心设置Grid Box,应用AutoDock Vina进行分子对接验证,以结合自由能的高低作为与化合物结合程度的评价标准。
2 结果
2.1 LC-MS技术分析黄芪-莪术药对代表性成分
比较相同色谱、质谱条件下黄芪-莪术混合标准品及水煎液图谱,根据质谱所提供的保留时间、精确相对分子质量及二级质谱裂解碎片来定量分析其所含成分。总离子流图见图1,在正、负离子同时扫描的模式下从黄芪-莪术水煎液中共定量出11种成分,见表1。其中芒柄花素(Formononetin)、毛蕊异黄酮(Calycosin)、黄芪皂苷Ⅱ(Astragaloside Ⅱ)、黄芪甲苷(Astragaloside Ⅳ)、芒柄花苷(Ononin)、毛蕊异黄酮葡萄糖苷(Calycosin-7-glucoside)、大豆皂苷Bb(Soyasaponin Ⅰ)来源于黄芪;吉马酮(Germacron)、姜黄素(Curcumin)、去甲氧基姜黄素(Demethoxycurcumin)及双去甲氧基姜黄素(Bisdemethoxycurcumin)来源于莪术。

表1 正负离子模式下,黄芪-莪术水煎液中成分特征信息及含量

注:A.混合标准品;B.黄芪-莪术水煎液;C.定量的11种成分
2.2 黄芪-莪术药对抗OC成分及作用机制
2.2.1 活性成分筛选及其靶点预测 在前期研究[9]及上述LC-MS定量分析结果的基础上,以ADME属性值“口服利用度(Oral bioavailability, OB)≥30%”“药物相似性(Drug likeness, DL)≥0.18”在TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)筛选黄芪-莪术药对活性成分,未出现在该数据库或不满足上述参数设定条件但通过查阅文献(https://www.cnki.net)报道有明确抗肿瘤活性的化学成分也纳入研究[10-17]。共确定67个化合物为黄芪-莪术药对潜在活性成分,见表2。TCMSP数据库获取药对成分靶点682个,SWISS数据库补充成分靶点2 673个,经Uniprot数据库标准化及合并、去重后共获得黄芪-莪术药对潜在成分靶点684个,为后续相关通路的预测及核心成分的确定做准备。

表2 黄芪-莪术药对活性成分信息
2.2.2 黄芪-莪术药对抗OC的作用靶点获取 Drugbank、DisGeNET、GeneCards数据库检索、收集、合并OC的疾病靶点并标准化后获得OC疾病靶点1 518个。将其与“2.2.1”中684个黄芪-莪术药对成分靶点在Venny 2.1.0中取交集绘制韦恩图,252个交集靶点即为黄芪-莪术药对抗OC的潜在作用靶点,将“2.2.1”中67个黄芪-莪术药对潜在活性成分与252个潜在作用靶点进行网络分析,结果见图2。黄芪-莪术药对抗OC的潜在核心成分可能为黄芪中黄酮类化合物及莪术中姜黄素类化合物。

注:A.交集靶点韦恩图;B.黄芪-莪术药对“药材-成分-靶点”网络图;黄色菱形为药物成分;红色圆形为蛋白靶点;节点大小与Degree值成正比
2.2.3 黄芪-莪术药对抗OC潜在关键靶点分析 将“2.2.2”中黄芪-莪术药对抗OC的潜在作用靶点导入STRING数据库获得蛋白互作关系(Protein-protein interaction,PPI),并导入CytoScape构建PPI网络进行拓扑分析,经“度中心性”(Degree),“中介中心性”(Betweenness),“接近中心性”(Closeness)3个参数均比中位数大为依据筛选得到前21个靶点作为黄芪-莪术药对抗OC的潜在关键靶点,并通过degree值排序,使用CytoScape构建PPI网络,如图3所示,图中节点大小与degree值成正比关系。其中度值最高的TP53(Tumor suppressor p53)可与182个蛋白靶点进行互作。

图3 黄芪-莪术药对抗OC相关靶点的PPI网络
2.2.4 生物信息学分析 基于Metascape数据库结合R软件对252个黄芪-莪术药对抗OC潜在作用靶点进行GO和KEGG富集分析。GO分析得到的生物过程(Biological process,BP)、分子功能(Molecular function,MF)、细胞组分(Cellular component,CC)富集结果如图4A~C所示,主要涉及细胞运动、迁移、化学应激调控等生物过程,其影响的分子功能主要为蛋白激酶活性及其结合等方面。KEGG分析共得到40条与肿瘤进展相关的信号通路,前10条与黄芪-莪术药对抗OC相关度最高,如图4D所示,主要包括MAPK、HIF-1信号通路等,推测黄芪-莪术药对可能是通过关键靶点作用于这些信号通路从而发挥抗OC作用,接下来将进行关键靶点-主要通路的网络分析进一步验证。
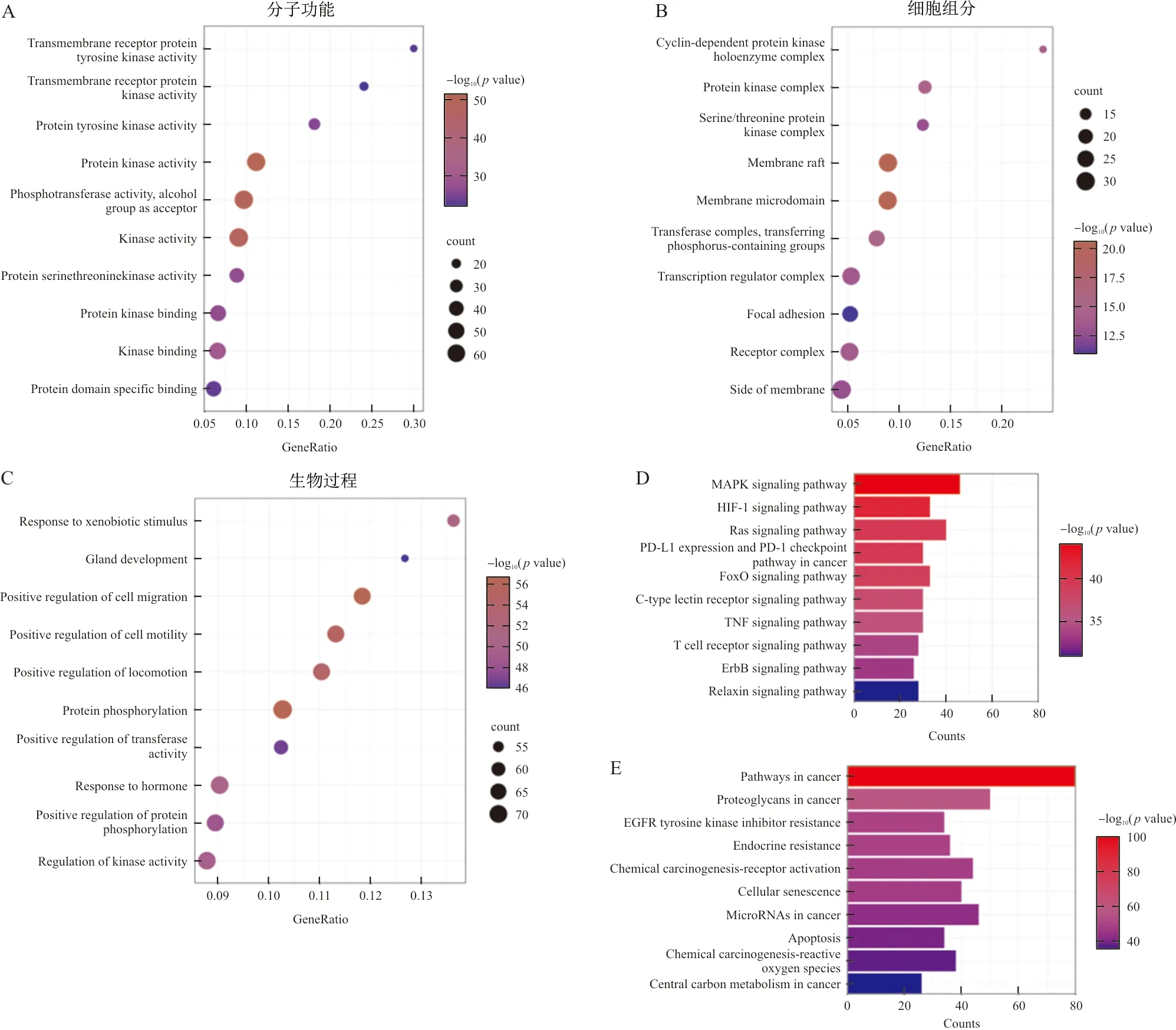
注:A~C.GO富集结果;D~E.KEGG富集结果
2.2.5 黄芪-莪术药对核心成分、关键靶点、主要通路的确定 将筛选到的黄芪-莪术药对前10个潜在核心成分、21个潜在关键靶点、10条信号通路运用Cytoscape构建“药材-成分-靶点-通路-疾病”网络。如图5所示,黄芪中的黄酮类化合物槲皮素(AR2,Quercetin)、山柰酚(AR15,Kaempferol)、异鼠李素(AR6, Isorhamnetin)等和莪术中姜黄素类化合物去甲氧基姜黄素(CR8,Demethoxycurcumin)、双去氧基姜黄素(CR23,Bisdemethoxycurcumin)连接度相对较高(前10,Degree>60),推测其可能为黄芪-莪术药对发挥抗OC作用的核心活性成分。结合“2.2.3”中PPI网络分析结果,HSP90AA1、EGFR、ESR1、AKT1、SRC、VEGFA等靶点连接度较高(PPI前21,Degree>110),可能为黄芪-莪术药对发挥抗OC的关键作用靶点。如图所示,21个关键靶点无孤立靶点,均能与主要通路产生连接,进一步说明黄芪-莪术药对可能是通过关键靶点作用于这些通路发挥抗OC作用,但相互作用网络复杂,多个潜在靶点与多种化合物相互作用、与多条信号通路产生联系,提示黄芪-莪术药对是通过多成分、多靶点、多通路调节方式发挥抗OC作用。

注:黄色菱形为药物成分;红色圆形为蛋白靶点;绿色菱形为信号通路;节点大小与Degree值成正比
2.3 分子对接技术验证黄芪-莪术药对潜在核心成分与靶点结合能
据网络药理学分析结果,利用AutoDock Vina[18]对“2.2.5”结果中的21个潜在关键靶点(PPI前21,Degree值>110)与“2.2.2”结果黄芪、莪术中10个核心活性成分(成分-靶点网络前10,degree值>60)进行分子对接以验证分析黄芪-莪术药对能否通过上述潜在关键靶点发挥抗OC的作用。如果活性成分能够与靶点蛋白发生相互作用,这必然在蛋白靶点的活性位点附近发生,如此能够引起蛋白结构功能的改变,进而影响相关信号通路发生变化。以大分子原配体位置为活性口袋,即Grid Box模块以原配体位置为中心(原配体见表3);其他参数设置“x: 40, y: 40, z: 40”“Spacing: 0.375”进行分子对接,通常配体与受体结合能越低,结合的构象越稳定。结合能小于-4.25 kcal·mol-1(1 kcal≈4.185 85 kJ)提示配体与受体有一定的结合活性,小于-5.0 kcal·mol-1有较好的结合活性,小于-7.0 kcal·mol-1有强烈的结合活性[19]。结果发现,10种活性成分与21个蛋白靶点均有较强烈的结合能力,见表3。用PyMOL软件对黄芪、莪术单个药味中结合能最强的成分与靶点对接结果进行可视化(Quercetin-ERBB2、Demethoxycurcumin-MAPK3),可见分子对接预测槲皮素会通过MET-125以及LYS-71在ERBB2的活性口袋与两个氢键结合。去甲氧基姜黄素被预测通过氢键连接LYS-753结合至MAPK3的活性口袋,见图6。
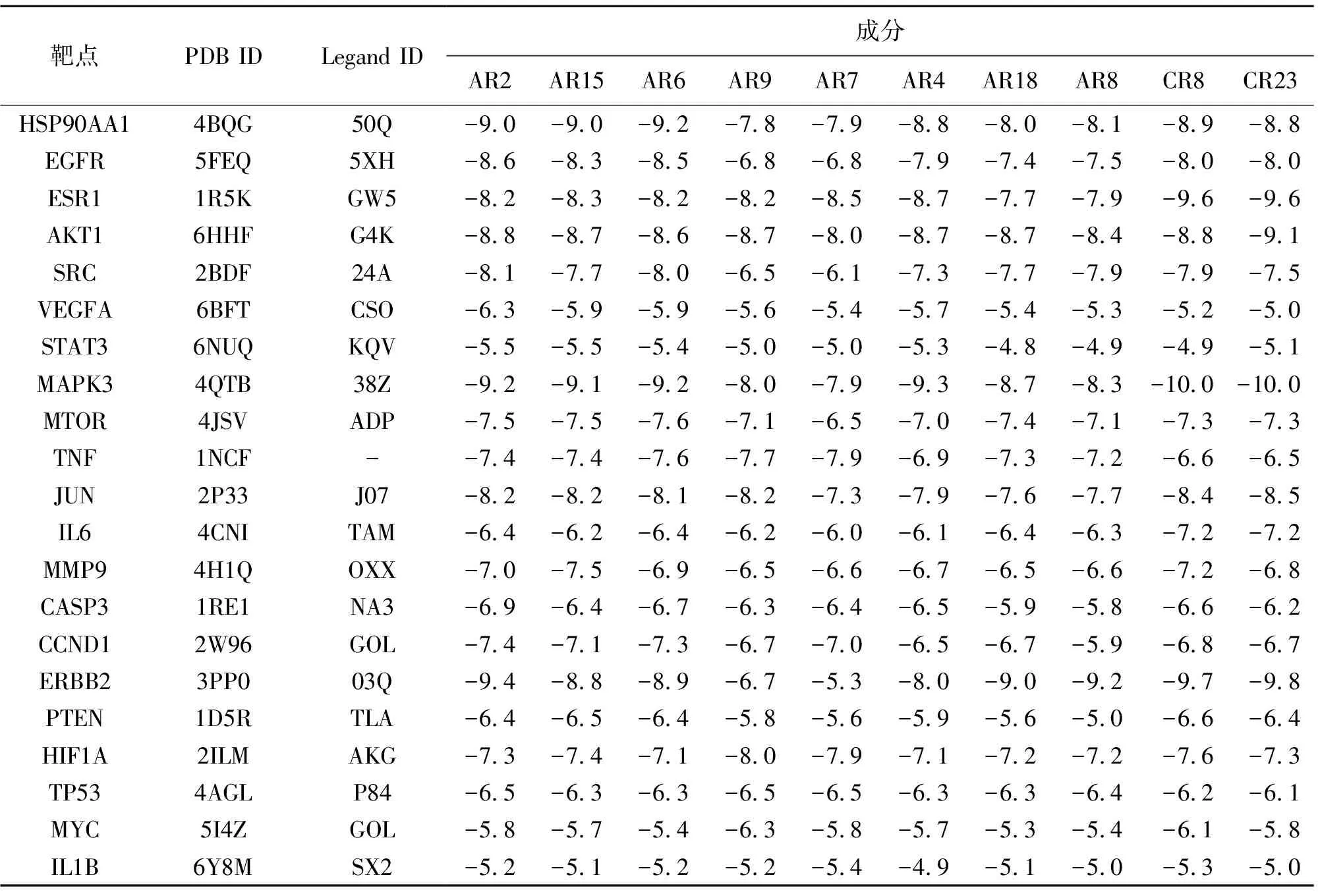
表3 黄芪-莪术药对核心活性成分与关键靶点分子对接结果(kcal·mol-1)
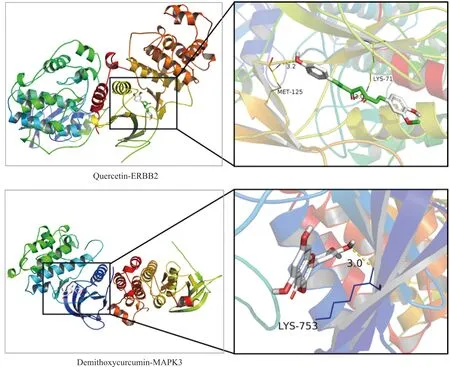
图6 黄芪-莪术药对抗OC的活性成分与关键靶点分子对接模式图
3 讨论
卵巢癌作为死亡率较高的妇科肿瘤疾病,其病理机制复杂,涉及多种信号转导通路。研究表明,中药可通过多靶点、多环节发挥抗肿瘤作用,且毒副作用低、不易产生耐药性,是近年来研究的热点[3]。针对气虚血瘀的肿瘤基本病机,在临床上运用补气活血化瘀法截断肿瘤发展之势是当代临床抗肿瘤治法中核心法则之一,张锡纯在《医学衷中参西录》中以黄芪配伍莪术为主药治疗“一切脏腑癥瘕、积聚”。黄芪、莪术相使为用,黄芪味甘性温,有温中益气、补阳利水之功,是补气要药;莪术辛散苦泄,温通行滞,既能破血行气,又能消积止痛。黄芪得莪术流通之性,补气而不壅中,攻破并不伤正,补而不滞,增强扶正之效,脾气旺盛则血循通畅,继而激发莪术破血消癥,抑瘤削结。两药相伍,养祛并存,散中寓收,共奏扶正祛邪,修荣新脉之功,达遏制肿瘤生长及转移的目的。
本研究通过液质联用技术定量分析了黄芪-莪术药对中代表性成分,如药典中规定的黄芪质量控制指标黄芪甲苷、毛蕊异黄酮葡萄糖苷,及其他经过前期研究发现含量较高、活性较好的成分,如芒柄花素、毛蕊异黄酮、芒柄花苷等;莪术主要含挥发油和姜黄素类成分,前期我们对莪术中挥发油成分Curcumenol、Curdione、Isocurcumenol、Furanodienone、Curcumol和Germacrone进行了定量分析[9],本实验补充分析了姜黄素类成分中的姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素和挥发油中的吉马酮。网络药理学研究基于LC-MS分析结果,分析得到黄芪-莪术药对抗OC的核心成分(有效成分),包括黄芪中的黄酮类成分槲皮素、山柰酚、异鼠李素等及莪术中的姜黄素类化合物去甲氧基姜黄素、双去甲氧基姜黄素。本研究的数据收集不仅结合数据库平台,同时根据文献报道补充了化学成分,可以较全面地将黄芪-莪术药对抗OC活性成分考察在内。
现代研究表明,黄芪、莪术具有明显的抗肿瘤效应,槲皮素可通过多种机制对多种肿瘤发挥作用,在防癌抗癌方面抑制多种酶参与的细胞增殖、信号传导途径[20-21];山柰酚可显著抑制小鼠肿瘤模型中的肿瘤生长与肺转移[22];异鼠李素可通过抑制缺氧环境中PI3K介导的适应性自噬促进MKN-45胃癌细胞的凋亡[23];姜黄素及其衍生物能够通过阻滞细胞周期和诱导细胞凋亡来诱导人多形性胶质母细胞瘤GBM 8401细胞凋亡[24],还能显著抑制膀胱癌细胞增殖和诱导凋亡[25],虽然去甲氧基姜黄素相对上述成分生物利用度较低,但研究表明,与姜黄素相比,其缺少与苯环直接相连的甲氧基,这种细微的差异导致去甲氧基姜黄素的化学结构更加稳定,并具有显著的抗癌活性[26],后续可通过开发脂质分散体、纳米颗粒系统等来提高其生物利用度。在配伍抗肿瘤方面,黄芪甲苷与姜黄素联用可降低肝癌细胞微血管计数以及血管生成相关因子的表达,促进血管正常化[27]。黄芪与莪术配伍的水煎剂抗肿瘤作用亦显著[28-31],且两者配伍抑制肿瘤生长、转移的效果优于单用黄芪、莪术[32]。由此可见,以黄酮类、姜黄素类为代表的活性成分可能为黄芪-莪术药对抗OC的物质基础。但网络药理学亦存在局限性,如对活性成分的研究未把“量效”等关系考虑在内,从药物作用特点来看,有些药物的作用在宏量级,有些药物的作用在微量级,需后续运用现代仪器结合化学分析、组学分析手段加以优化。
GO和KEGG富集分析结果显示,大量癌症相关功能和信号通路出现显著富集,如MAPK、HIF-1信号通路等,反映了OC发生发展过程中分子功能、生物过程和信号通路的紊乱。通过“成分-靶点-通路”网络的构建,得到黄芪-莪术药对抗OC的关键靶蛋白HSP90AA1、EGFR、ESR1、AKT1、SRC、VEGFA等,其同一活性成分对应多种靶点与多条疾病途径或信号通路,同一靶点对应多种活性成分与多条疾病途径或信号通路,显示出成分、靶点与信号通路间的多协同作用。为了验证黄芪-莪术药对中的核心活性成分与关键靶点的结合能力,利用AutoDock Vina工具[33-34]验证黄芪-莪术药对中的10种潜在核心成分与相关度较高的21个潜在关键靶蛋白的结合能力,结果显示10种核心活性成分与靶蛋白均具有强烈的结合活性。氢键的能量贡献是由受体和供体之间的夹角和氢键的长度决定的,氢键长度不大于3.5 Å,结构稳定[35]。本次分子对接结果中,黄芪中的槲皮素与ERBB2的结合活性最强(-9.4 kcal·mol-1),其与MET-125以及LYS-71在ERBB2的活性口袋以两个氢键相连。氢键距离分别为3.0 Å、3.2 Å。莪术中的去甲氧基姜黄素与MAPK3的结合活性最强(-10.0 kcal·mol-1),其与LYS-753结合通过氢键连接,氢键距离分别为3.0 Å。提示黄芪、莪术中活性成分能够与潜在核心靶点存在稳定的氢键相互作用,黄芪-莪术药对能够通过作用于相应靶蛋白发挥抗OC作用。
综上所述,尽管中医药在防癌抗癌方面疗效确切,但中药成分复杂,明确其有效成分及作用机制是目前亟待解决的问题。本研究通过网络药理学结合液质联用、分子对接技术对黄芪、莪术抗OC的有效成分及作用机制进行探究,以验证临床运用黄芪、莪术组方治疗OC的合理性,为其后续疗效评价指标的筛选及深入机制研究提供思路和理论依据。
