肝细胞癌患者临床特征及肝切除术后其生存情况的模型评价
2023-08-10杨培伟赵文霞
杨培伟 赵文霞
据2020年全球癌症统计数据(GLOBOCAN)估计,肝癌现已成为全球第六大常见癌症,第三大癌症死亡原因[1]。而肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的常见病理学类型(75%~85%),发病率和死亡率高[2]。目前肝癌的治疗是多学科参与、多种治疗方法(例如肝切除术、肝移植术、消融治疗、TACE、放射治疗、系统抗肿瘤治疗等)共存。但在目前的临床实践中,根治性肝切除术等手术治疗仍然是肝细胞癌患者的首选,在改善患者预后和降低复发等方面具有重要的优势[3]。因此,分析HCC患者的临床特征,为肝切除术后HCC患者建立独立的预后模型分析,针对不同风险实施有效精准的个体化干预措施,对于临床医师决策具有重要的指导意义。
本研究旨在通过使用监测、流行病学和最终结果(surveillance,epidemiology,and end results,SEER)数据库,回顾性分析2004年至2018年SEER数据库中肝切除术后的HCC患者临床病理资料,探讨肝切除术后的HCC患者的临床特征、预后危险因素、构建并评价列线图模型,旨在为个体化临床诊疗提供参考依据。
1 资料与方法
1.1 资料来源
本研究应用SEER*Stat 8.3.9软件,回顾性分析2004至2018年美国国立癌症研究所SEER数据库5049例肝切除术后的HCC患者的临床资料。纳入标准:①组织病理学诊断为HCC,肿瘤疾病分类编码(ICD-O-3)中组织学编码为8180/3;②进行肝切除术的患者;③原发肿瘤可评估;④一般临床病理信息完整,并且有完整的随访信息。排除标准:①组织病理学诊断非HCC者;②治疗方式非肝切除术或不明确者;③存在肝外转移者或多种肿瘤者。由于SEER是公开数据库,本研究免于伦理审查,不需要患者签署知情同意书。本研究符合《赫尔辛基宣言》的要求。
1.2 观察指标
(1)主要结局为总生存时间(overall survival,OS),即患者从诊断为HCC行肝切除术到死亡或最后一次随访时间。(2)肝切除术后的HCC患者的临床特征和预后影响因素,包括年龄、性别、种族(黑人、白人,其他种族,包括美洲印第安人/AK土著、亚洲人群等)、HCC病理分化程度(分化良好,Grade Ⅰ;中度分化,Grade Ⅱ;分化差,Grade Ⅲ;未分化,Grade Ⅳ)、肝癌T分期(参照美国癌症联合委员会ACJJ肝癌TNM第7版分期标准[4],根据单/多发、肿瘤直径、有无血管侵犯、有无穿透脏层腹膜、有无肝外结构侵犯分T1、T2、T3a、T3b、T3NOS、T4、TX期)、肝癌N分期(有无局部淋巴结转移)、肝癌M分期(有无远处转移)。(3)HCC患者的随访和生存情况。(4)列线图。
1.3 统计学分析
应用SPSS 26.0统计分析软件和R 3.6.3软件进行数据的整理和分析。计数资料以率和频数表示;生存分析曲线采用Kaplan-Meier法,以对数秩检验(log-rank检验)比较;Cox多因素等比例风险回归模型的结果用风险比(hazardratio,HR)和95% CI表示。P<0.05为差异有统计学意义。
2 结果
2.1 HCC患者的临床特征和预后影响因素
本研究共纳入5049例肝切除术后的HCC患者,患者年龄、性别、种族、病理分化程度、肿瘤TNM分期等具体临床病理特征见表1。
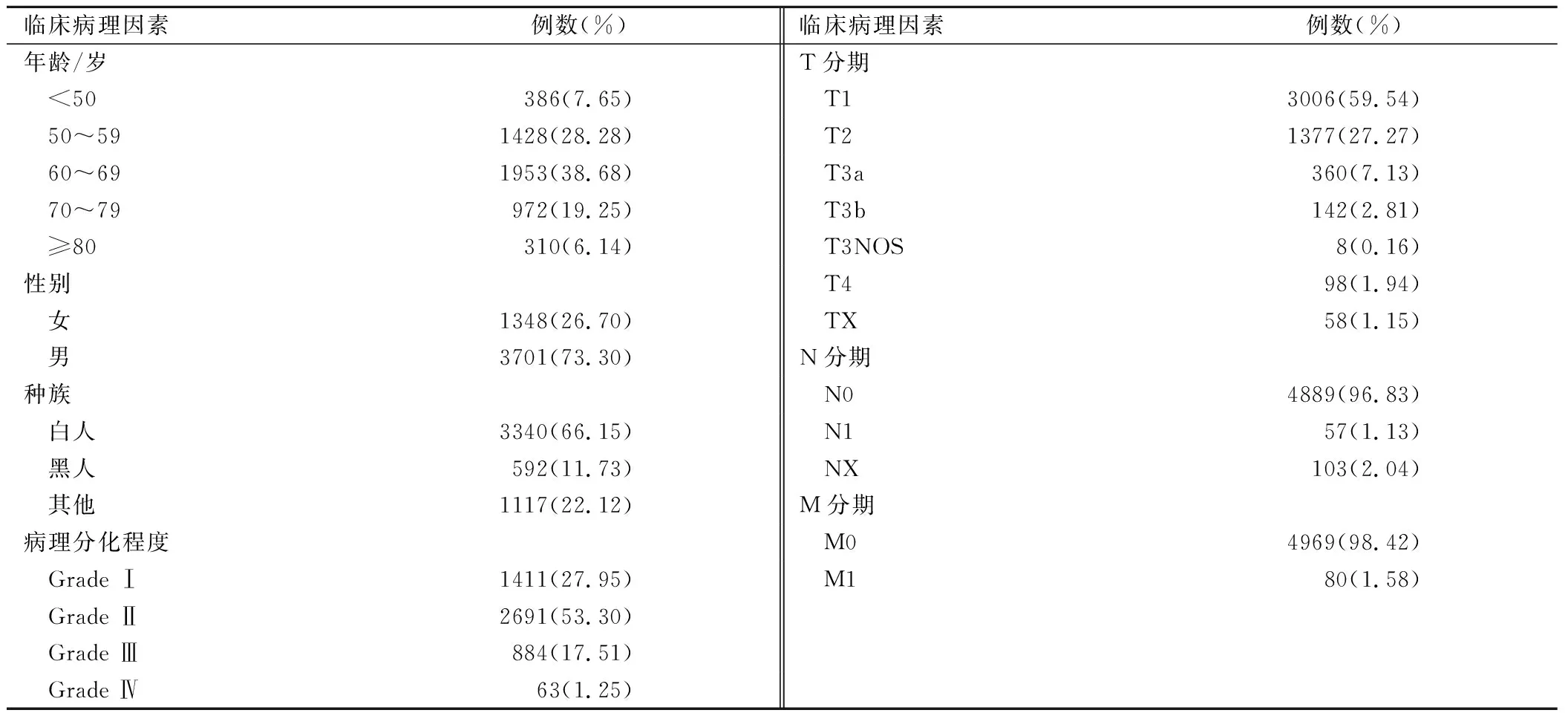
表1 HCC患者的临床特征
2.2 HCC患者的预后影响因素分析
单因素分析显示:年龄、性别、种族、病理分化程度和肿瘤TNM分期是影响肝切除术HCC患者预后的相关因素。进一步的多因素分析显示:年龄(70岁以上)、性别(男性)、种族(其他种族)、病理分化程度(Grade Ⅲ~Ⅳ期)和肿瘤TNM分期(T2~T3b、T4和M1)者,预后较差,是影响肝切除术后HCC患者预后的独立危险因素(P<0.05),具体结果见表2。通过R软件,计算相关的C-index指数为0.65。影响肝切除术后HCC患者危险因素的Kaplan-Meier生存曲线如图1所示。
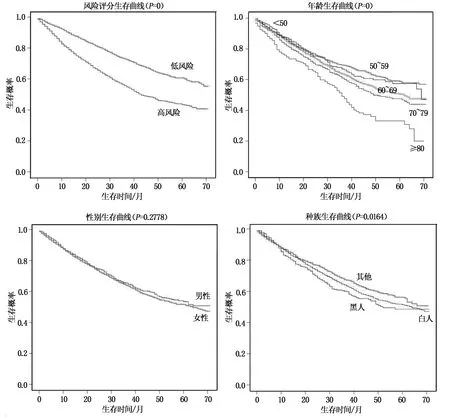
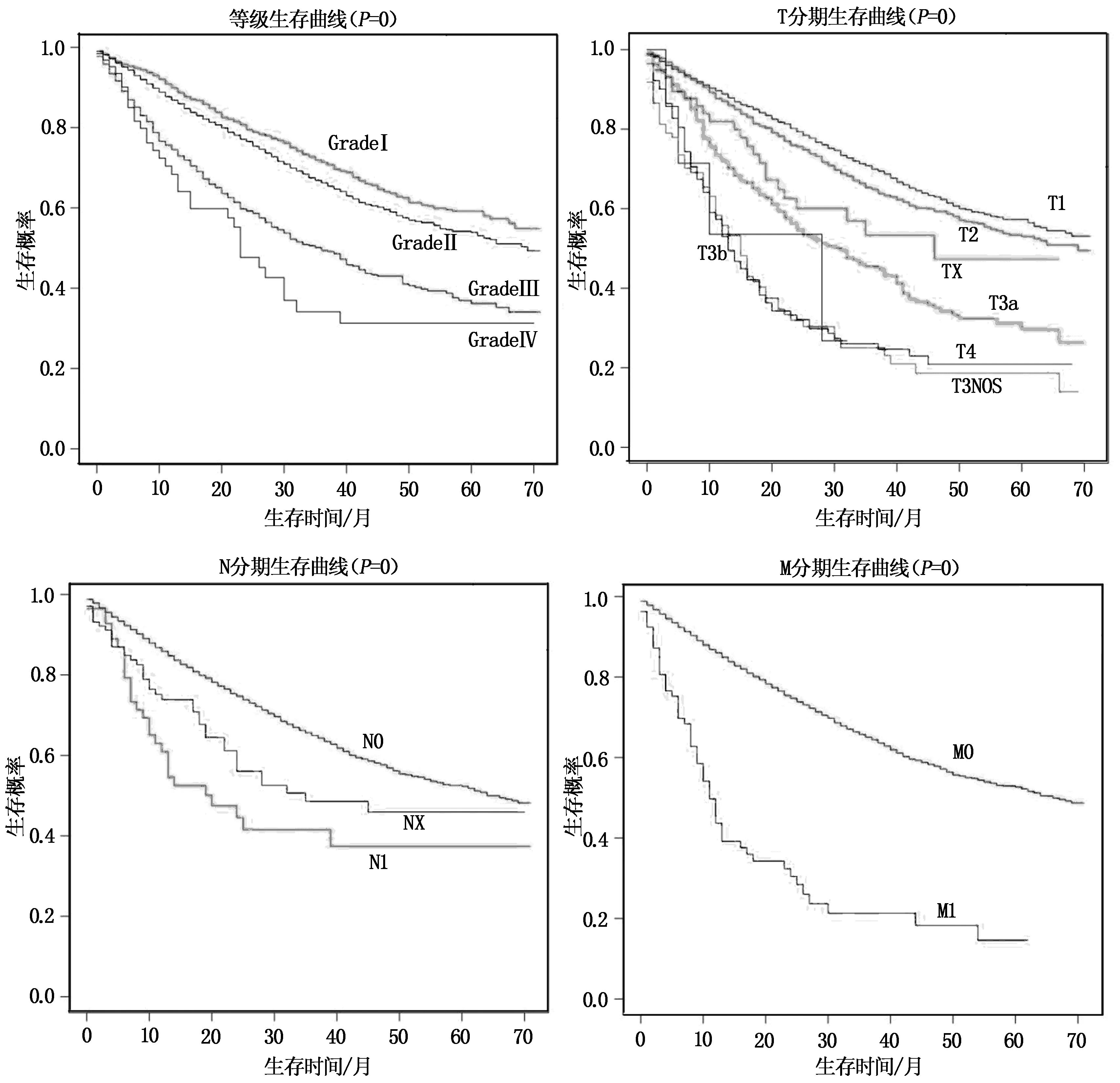
图1 Kaplan-Meier生存曲线
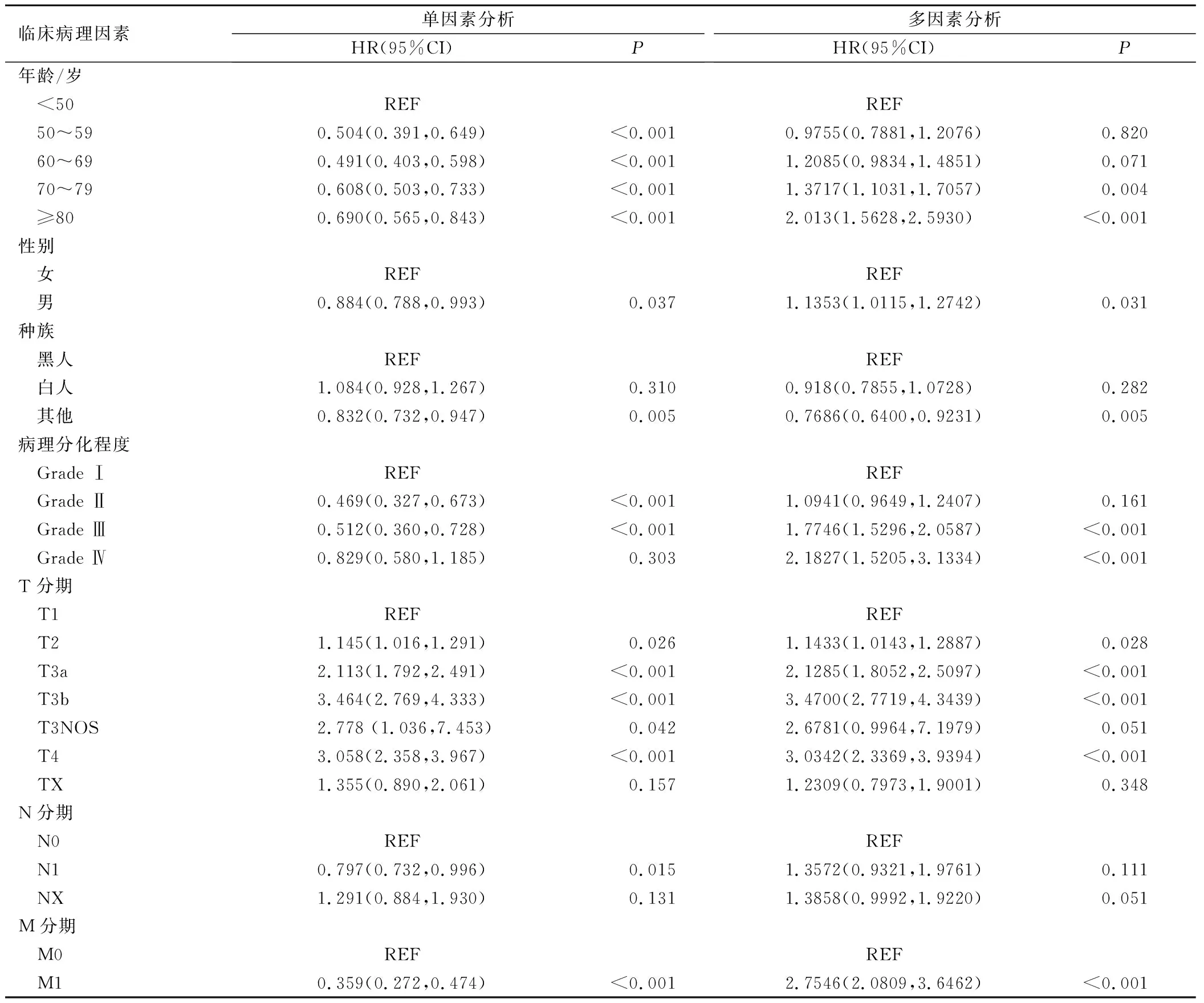
表2 单因素和多因素分析结果
2.3 列线图构建及评价
基于影响肝切除术后HCC患者预后的独立危险因素构建列线图(图2)。列线图可将各个变量Cox比例风险模型相关系数转化为0~100分,将各变量分值相加即为总分值,从总分值标尺向下投射可得出特定患者的1年、3年和5年的总生存率。采用Bootstrap法自抽样次数B=1400,绘制列线图校准曲线(图3),1年、3年和5年的总生存率校准曲线与理想的斜率为1的直线拟合度良好,提示列线图预测值和实际值之间具有较好的一致性。
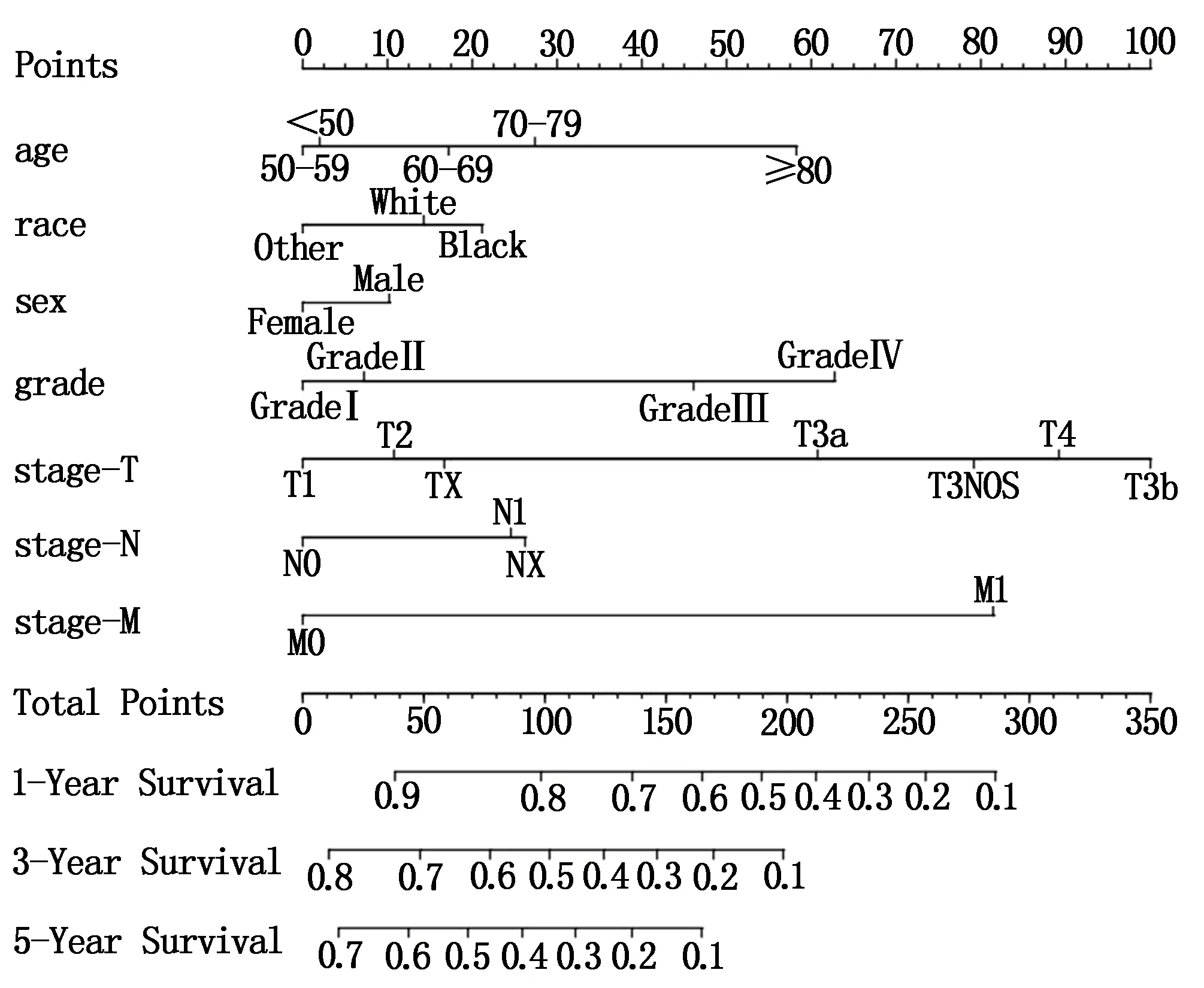
图2 预测肝切除术后HCC患者预后的列线图
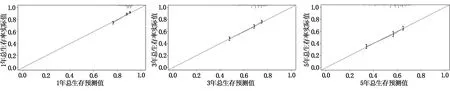
图3 列线图校准曲线
3 讨论
HCC是原发性肝癌中的1种常见病理类型,占所有原发性肝癌75%~85%,是1种常见的恶性肿瘤,在我国甚至世界范围内具有较高的发病率和死亡率[1-2]。HCC的高发病率是晚期肝病患者死亡的主要原因,尽管目前多种治愈性和姑息性治疗方法,但仍缺乏对HCC患者报告结局的系统性评估[5]。我国肝癌治疗现状调查结果显示,由于大部分患者首次确诊时即为中晚期,已经失去手术机会,或者即使考虑为肝癌有手术适应症建议患者手术治疗,但因各种因素等未能进行手术,进而影响患者的长期生存和预后。本研究中,我们利用大样本的SEER数据库,纳入了5049例肝切除术后HCC患者,探究了HCC患者的临床特征和影响其预后的独立危险因素,并构建了列线图用于肝切除术后HCC患者的个体评估。
原发性肝癌的诊疗指南中也指出肝癌的外科治疗(主要包括肝切除术和肝移植术)是肝癌患者获得长期生存最重要的手段,在改善患者预后和降低复发等方面具有明显的优势[3,6-7]。有研究表明[8],肝切除术是早期HCC患者的基础治疗,也是HCC唯一潜在的根治性治疗的选择,手术治疗的患者应彻底评估肿瘤特征和生物学特性,以及基于证据的各种可实施的治疗方案,以实现HCC患者的最佳长期预后。Seong等[9]的荟萃分析研究显示,和局部消融治疗HCC相比,肝切除术可延长HCC患者的无复发生存期(RFS),降低局部复发发生率,并且显示出更好的肿瘤学结局。Peng等[10]研究也发现,根治性肝切除术联合术后肝动脉化疗栓塞术(TACE)可改善中度HCC患者的1年、3年和5年生存率和疾病无进展生存率,明显改善HCC患者的生存和预后。整体而言,肝切除患者的预后较好,因此,对肝切除术HCC患者进行预后模型评估是有指导意义的。
结合Cox单因素、多因素分析和Kaplan-Meier生存曲线显示年龄、病理分化程度和肿瘤TNM分期者是影响肝切除术后HCC患者预后的独立危险因素(P<0.05)。而性别和种族无明显统计学差异。本研究中70岁以上HCC患者,肝切除术后预后不良,这与老年人的体质、术后恢复、机体代谢和营养状况等因素均有关[11]。从本研究结果中发现,虽然男性、其他种族的HCC患者发病率较高,但二者总体生存率无明显差异,这与之前的研究报道一致[12]。肿瘤病理分化程度是影响肝切除术后HCC患者预后的决定因素之一,分化良好的患者整体预后较好,分化差或未分化者预后较差。Shen等[13]和Longerich等[14]研究发现分化不良的HCC患者在接受肝切除术后的无复发生存期和总生存期较差,提示分化不良的HCC患者对肝切除术后复发及其长期生存有负面影响,是HCC早期复发的独立危险因素。因此,HCC的病理分化程度可能是通过HCC的复发进而影响肝切除术后HCC患者的生存和预后。中晚期的TNM分期是HCC肝切除术后患者预后的独立危险因素,本研究发现T2、T3a/3b、T4和M1是影响HCC肝切除术后患者的独立因素。单/多发、肿瘤直径、有无血管侵犯、有无门静脉血栓形成、有无穿透脏层腹膜、有无肝外结构侵犯等等危险因素,可能需要进一步的亚组分析以明确哪些因素是影响肝切除术后HCC患者的生存和预后的不良因素[15]。
列线图是一种直观简单的统计工具,能够纳入各种危险因素并为患者提供个体化的评估。本研究纳入了5项客观临床和病理因素(性别、年龄、种族、肿瘤病理分化程度和肿瘤的TNM分期)来构建列线图并预测肝切除术后HCC患者的生存和预后。列线图的C-index为0.65,校准曲线与理想的斜率为1的直线拟合度良好,提示列线图对肝切除术后HCC患者总生存率的预测具有很好的临床价值。
尽管本研究中的样本来源广泛、病例资料多、病理诊断明确、随访完整等优势,但仍然存在以下局限性:首先,由于SEER数据库中缺少肿瘤相关标志物CA125、CA199、新的治疗靶点、Child-Pugh分级、生化指标、并发症、手术切缘和手术类型等等相关信息,因此无法分析这些指标对其生存和预后的影响;另外,由于国内临床样本量的限制,本研究未能进一步临床验证,后期希望能在本研究的基础上开展多中心大样本的临床研究进一步验证和细化目前的结论。
