MYBL1在肾透明细胞癌组织中表达及与其预后相关性分析
2023-08-10周成炜孔嘉欣
周成炜 王 桦 程 玲 孔嘉欣
肾细胞癌(RCC)是最常见的泌尿系恶性肿瘤之一,据最新调查显示,肾细胞癌是男性第9位常见恶性肿瘤和女性第14位常见恶性肿瘤[1]。肾细胞癌的发病率在世界范围内呈上升趋势,每十年以2%~4%速度上升,2018年肾细胞癌新发病例超过400000例,死亡病例超过170000例[2]。透明细胞肾细胞癌(KIRC)是肾细胞癌最常见类型,临床上透明细胞肾细胞癌占70%~80%[3]。由于缺乏早期诊断及判断预后的生物标志物,30%以上KIRC患者发生转移,转移性患者预后较差,5年生存率不超过10%[4]。因此本研究将探讨透明细胞肾细胞癌相关分子机制,以挖掘新型临床诊断方法及提供新的治疗靶点。MYBL1属于MYB转录因子家族中一种亚型,位于染色体8q22上,编码两种核蛋白,主要表达于生殖细胞、乳腺、中枢神经系统、T细胞、B细胞中等[5]。MYBL1表达可调节细胞增殖、分化、凋亡,同时可与C-MYB协同调控细胞周期,从而参与多种肿瘤发生、发展[6]。MYBL1可通过靶向TWIST1基因表达影响肝细胞癌生长及转移[7]。MYBL1上调可导致胶质瘤发生,尤其是弥漫性胶质瘤及低级别胶质瘤[8]。MYBL1通过调节B细胞存活参与淋巴瘤形成[9]。约60%头颈部腺样囊性癌患者中可检测出MYB/MYBL1-NFIB融合[10],同时MYBL1基因重排可作为乳腺腺样囊性癌驱动因素[11]。除了上述肿瘤,结直肠癌[12]、胰腺癌[13]、子宫内膜癌[14]均证实MYBL1表达量升高。目前暂无报道MYBL1在肾透明细胞癌中表达及相关影响,本研究将通过对肾透明细胞癌患者分析,研究MYBL1对其影响,探讨MYBL1对于肾透明细胞癌作为预后的生物标志物可能性,尽可能为临床提供新的治疗靶点。
1 资料与方法
1.1 MYBL1表达与肾透明细胞癌临床特征的相关性
通过癌症基因图谱(TCGA数据库:收录人类36种癌症基因序列)下载数据库中肾透明细胞癌的RNA-seq相关临床资料,包含539例样本组织和72例癌旁正常组织,获取肾透明细胞癌临床资料包含年龄、种族、性别、肿瘤分级、TNM分期。以MYBL1-mRNA表达水平的中位数将肾透明细胞癌病例分为高、低表达两组。
1.2 MYBL1表达与肾透明细胞中表达差异及预后分析
应用非参数秩和检验和R软件Survival包分析TCGA数据库中MYBL1在肾透明细胞癌中表达差异。利用Kaplan-Meier曲线进行生存分析MYBL1表达在肾透明细胞癌患者总生存期(OS)及无进展间隔期(DFI)之间关系,P<0.05为差异有统计学意义。采用受试者工作特征(ROC曲线)说明MYBL1在肾透明细胞癌中诊断价值。
1.3 MYBL1相关基因筛选、蛋白质相互作用网络构建和功能富集分析
通过LimkedOmic数据库,数据集选择“TCGA-KIRC”,基因为“MYBL1”,分析正、负相关显著基因。通过对相关基因进行GO/KEEG分析基因相关通路。
1.4 免疫浸润相关性分析
使用肿瘤免疫评估资源(TIMER)进行免疫浸润分析,进入Gene版块,Gene Symbol为“MYBL1”,Cancer Typers为“KIRC”,获取MYBL在肾透明细胞癌中表达与B细胞、CD4+、CD8+、巨噬细胞、中性粒细胞、树突状细胞的浸润程度。
1.5 统计学分析
应用统计软件R 4.0.4及绘图软件Graphpad8;MYBL1表达量在肾透明细胞癌临床特征中,两两比较采用卡方检验;肾透明细胞癌生存预后使用Kaplan-Meier和Log-Rank检验分析,P<0.05为差异有统计学意义;pROC包绘制ROC曲线,通过AUC值评估诊断准确性,AUC值越接近1,其诊断效能越高,AUC值介于0.5~0.7之间提示具有较低准确性;AUC值介于0.7~0.9之间提示具有一定诊断效能;AUC大于0.9提示具有较高准确效能。
2 结果
2.1 MYBL1表达与肾透明细胞癌临床特征的相关性
通过TCGA数据库获取539例具有完整临床特征的肾透明细胞患者,以MYBL1表达中位数分界,269例为低表达组,270例为高表达组。MYBL1表达与性别(P=0.008)、肿瘤分级(P=0.001)、T分期(P=0.02)、M分期(P=0.003)具有相关性,与种族、年龄、N分期无显著相关,见表1。
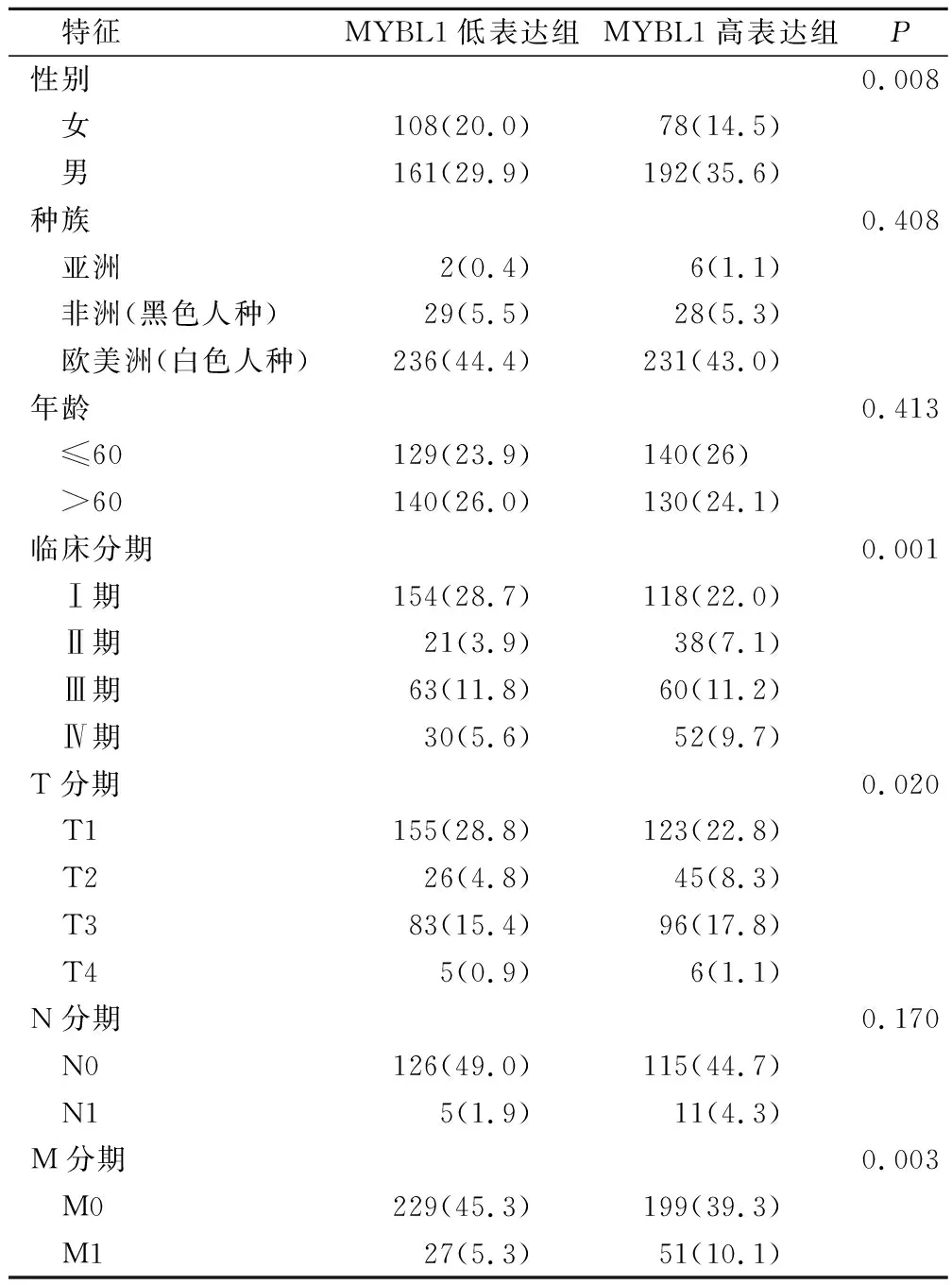
表1 MYBL1表达与肾透明细胞癌临床特征相关性(例,%)
2.2 MYBL1在两组中表达差异及预后分析
对肾透明细胞癌及癌旁正常组织中MYBL1表达量进行正态性分析,P均<0.05,符合正态分布。对两组表达量进行非配对t检验,结果显示MYBL1在肾透明细胞癌中表达水平(1.001±0.519)显著高于癌旁正常组织(0.414±0.167),差异具有统计学意义(P<0.01)。见图1A。对肿瘤组织及癌旁正常组织MY-BL1表达量采用配对t检验,肿瘤组织(0.997±0.589)同样高于正常组织(0.414±0.167),P<0.01,差异具有统计学意义,见图1B。
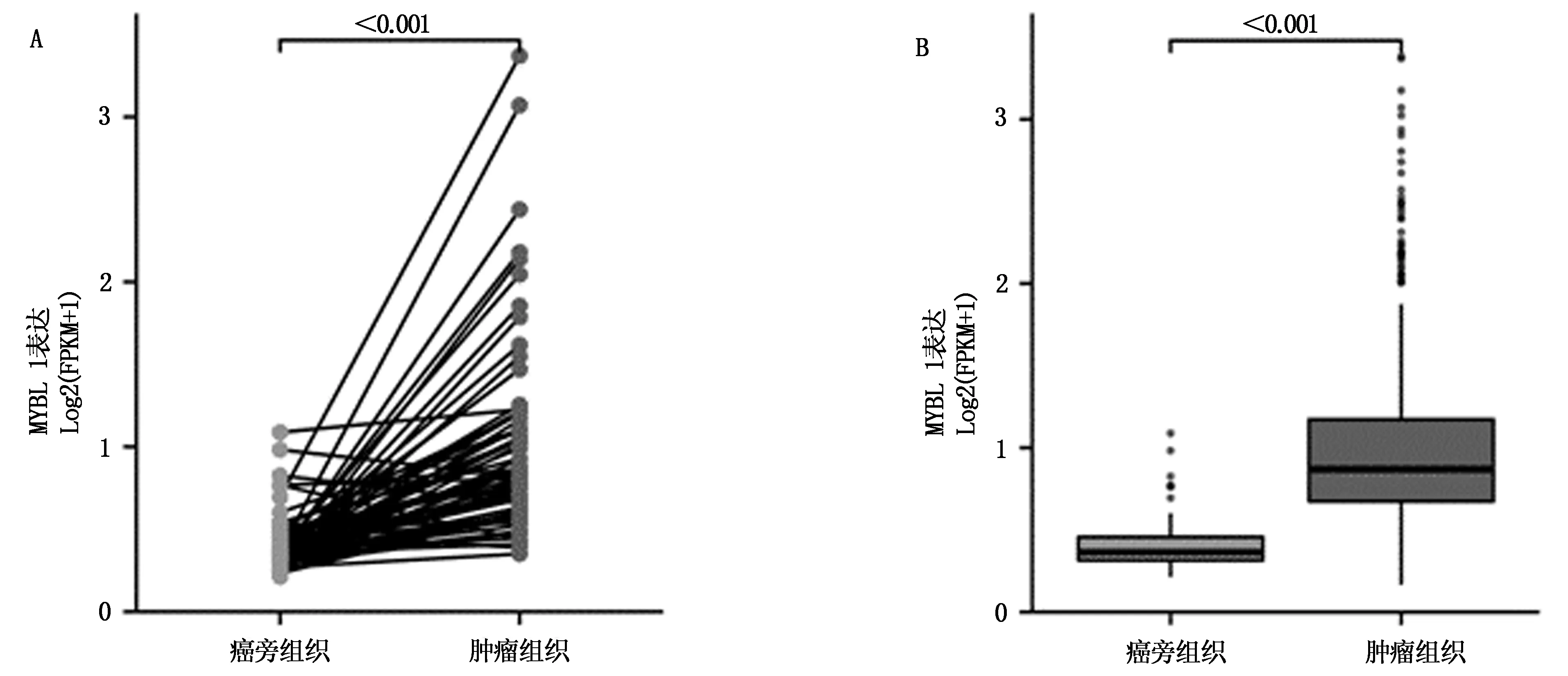
图1 MYBL1在肾透明细胞癌和癌旁组织中表达差异
通过KM曲线获取MYBL1表达对患者总生存期及无进展生存期(PFI)的影响,如图2A,MYBL1低表达组总生存(OS)明显优于高表达组,HR=1.51,95%CI(1.12~2.04),P<0.01,差异具有统计学意义。图2B显示MYBL1低表达组无进展期更长,HR=1.38,95%CI(1.01~1.89),P<0.01,差异具有统计学意义。
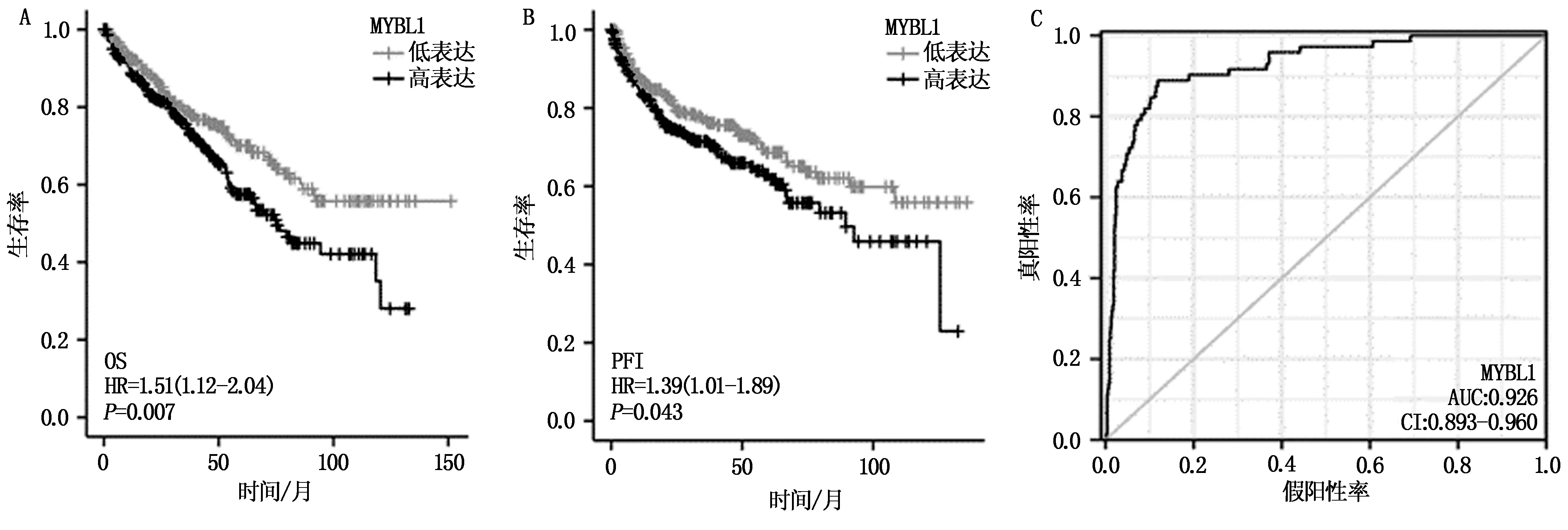
图2 MYBL1表达对肾透明细胞癌的诊断及预后判断价值
如图2C,ROC曲线下面积为0.926,可信区间为(0.89~0.926),提示标量MYBL1在肾透明细胞癌中具有较高准确性,因此,MYBL1具有作为肾透明细胞癌的诊断分子标志物的可能。
2.3 MYBL1相关基因及GO/KEEG通路分析
正相关前50依次为E2F7(相关系数R:0.628)、CENPE(0.626)、POLQ(0.625)等等。前50负相关显著基因,前3位分别为PINK1(-0.511)、PCCA(-0.465)、BAG1(-0.463)。对MYBL1正、负相关显著基因进行GO/KEEG通路分析,包含生物过程(BP)、细胞成分(CC)、分子功能(MF)三方面,参与细胞器分裂、细胞核分裂、染色体分离以及ATP酶活性和偶联、微管运动等多种细胞周期活动,见表2。
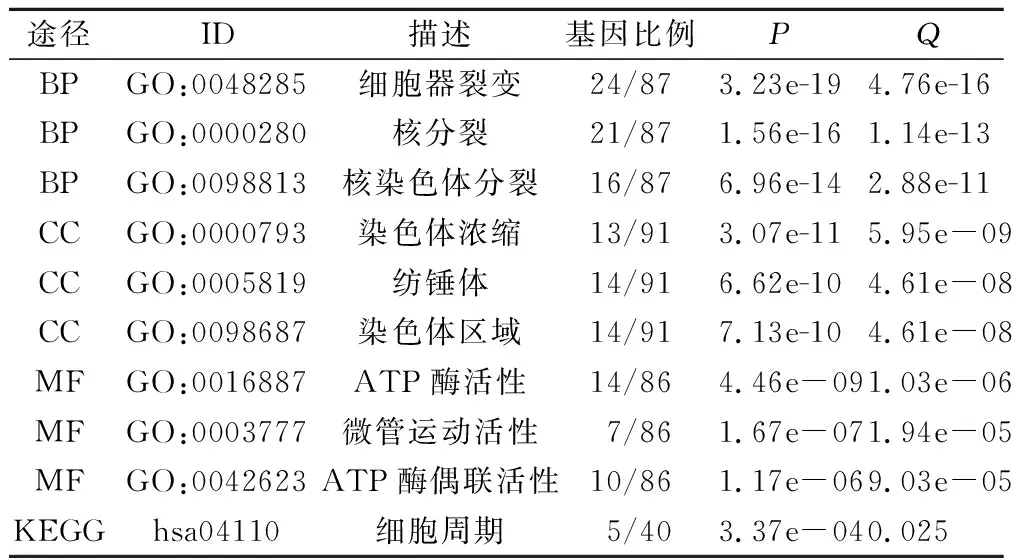
表2 MYBL1相关基因GO/KEEG
2.4 免疫浸润相关性分析
如图3,MYBL1表达与B细胞(cor=0.209)、CD4+T细胞(cor=0.178)、CD8+T细胞(cor=0.388)、巨噬细胞(cor=0.331)、中性粒细胞(cor=0.484)、树突状细胞(cor=0.331)等呈正相关,且各P均<0.01,差异具有统计学意义。
3 讨论
尽管癌症治疗发展迅速,但肾透明细胞癌死亡率仍居高不下,最主要原因是肾透明细胞癌早期缺乏典型症状,以致诊断时往往为肿瘤晚期,失去手术机会,且肾透明细胞癌对放疗和化疗敏感性较差[15]。为早期诊断及预后判断寻找敏感基因是本研究中重点。
MYBL1参与细胞周期调控,染色体易位、基因重排等方式使得MYBL1负性调节结构域缺失,进一步引起细胞增殖失控,从而对肿瘤的发生发展起重要作用[6],通过影响细胞周期调控参与肿瘤产生与本文KEEG富集通路分析结果相一致。MYBL1参与肝癌、结直肠癌、乳腺癌、腺样癌以及多种血液肿瘤的发生发展。
本研究通过TCGA数据库纳入539例KIRC临床资料,以MYBL1中位数为界分低表达组、高表达组,MYBL1表达与性别、肿瘤分期、T分期、M分期有关。同时本研究观察到MYBL1在肾透明细胞癌中表达量高于癌旁正常组织,因此对于临床实践中,可通过检测MYBL1表达量作为肾透明细胞癌的诊断标准物。同时对于MYBL1在肾透明细胞癌患者中不同表达量进行生存分析,MYBL1表达与OS、PFI等生存指标成反比,因此MYBL1可作为肾透明细胞癌的预后标志物。通过对MYBL1及其相关基因进行分析,进一步研究其对肿瘤的发生发展机制,通过GO/KEEG通路分析,MYBL1参与细胞周期调控,以及细胞器裂解、核裂变、ATP酶活性和偶联、微管运动等多种细胞周期活动。MYBL1与多种免疫细胞相关,其表达与B细胞、CD4+T细胞、CD8+T细胞、巨噬细胞、树突状细胞成正相关,为将来免疫治疗提供更广阔思路。
通过本研究阐述,MYBL1表达在肾透明细胞癌的早期诊断及预后标准物具有一定意义,且其表达与免疫细胞浸润为将来新的免疫治疗提供理论依据。
