淫羊藿苷通过IL-6/STAT3通路逆转肺癌A549/DDP细胞顺铂耐药的作用机制研究
2023-08-10宁丞君胡邵霖
宁丞君 王 瑜 胡邵霖
肺癌是威胁人类生命健康的全球性问题,化疗是临床上治疗肺癌的重要手段,顺铂(cisplatin,DDP)是常用的化疗药物,但是长期应用,肿瘤细胞则会对其产生耐药性,导致患者化疗效果不佳[1],因此寻找能有效增强肿瘤细胞对顺铂的敏感性,降低其耐药性的药物,对肺癌的治疗将是一个重大的突破。淫羊藿苷(icariin,ICA)是从淫羊藿属植物中提取的一种活性成分,研究表明,ICA通过抑制自噬,可增强顺铂耐药卵巢癌细胞的化疗敏感性[2]。此外,ICA通过降低乳腺癌细胞对它莫昔芬的耐药性,从而促进细胞凋亡,降低细胞增殖迁移能力[3]。白细胞介素-6(interleukin-6,IL-6)/信号传导子及转录激活子3(signal transducer and activator of transcrip-tion3,STAT3)信号通路在细胞增殖、分化过程中具有重要作用。研究发现,在肝癌的发生发展中IL-6/STAT3信号通路被激活,隐甲肾上腺素通过抑制该信号通路诱导癌细胞凋亡[4]。二肽基肽酶 Ⅳ激活IL-6/STAT3信号通路促进子宫内膜癌细胞增殖,增强癌细胞体内致瘤性[5]。本研究以肺癌A549/DDP顺铂耐药细胞为研究对象,探讨ICA逆转A549/DPP细胞耐药性的影响,及对IL-6/STAT3信号通路的调节作用。
1 材料与方法
1.1 细胞系
人肺癌A549/DDP耐药细胞株购自中科院上海细胞库,培养于含10%胎牛血清、1%青霉素和链霉素的DMEM培养基中,置于37℃、5%CO2的培养箱中培养,每天更换一次培养基,当细胞融合率达到80%时,胰蛋白酶消化传代,传至第4代后,取对数生长期的细胞用于实验。
1.2 试剂和仪器
ICA(纯度≥98%)购自上海纯优生物科技有限公司;Transwell小室购自北京优尼康生物技术有限公司;Matrix基质胶购自上海BD公司;DDP购自美国Sigma-Aldrich公司;MTT试剂盒购自北京索莱宝科技有限公司;肺耐药蛋白(lung resistance-related protein,LRP)和多药耐药相关蛋白(multidrug resistance-associated protein,MRP)PCR引物购自上海生工生物工程股份有限公司;兔抗人IL-6、STAT3、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associad X,Bax)购自美国Invitrogen公司;多功能酶标仪购自美国Bio-Rad公司;电泳仪购自美国伯乐公司。
1.3 MTT法检测不同浓度ICA对A549/DDP细胞增殖率的影响
取对数生长期的A549/DDP细胞,DMEM培养基将细胞制成单细胞悬液,以1×105个/孔接种于96孔板,置于培养箱中培养24 h,将细胞随机分为A549/DDP组、ICA组(ICA浓度为10、20、50、100、200 μmol/L),每组设置5个复孔,培养箱中培养48 h后,加入MTT溶液(5 mg/mL)20 μL,培养4 h后弃掉上清,加入DMSO 150 μL,充分混匀后,置于酶标仪上,490 nm波长处检测吸光度(A)值,细胞增殖率(%)=(AICA-A)/(AA549-A)×100%。
1.4 MTT法检测不同浓度ICA对A549/DDP细胞耐药性的影响
收集对数生长期的A549/DDP细胞,制成单细胞悬液,以1×105个/孔接种于96孔板,置于培养箱中培养24 h,将细胞随机分为DDP组、DDP+ICA-50 μmol/L组、DDP+ICA-100 μmol/L组。DDP组细胞加入DDP(DDP浓度为0、4、8、16、32 μg/mL),DD-P+ICA-50 μmol/L组和DDP+ICA-100 μmol/L组细胞加入上述浓度DDP后,再加入浓度分别为50 μmol/L和100 μmol/L的ICA,每组设置5个复孔,培养48 h后,再加入MTT溶液孵育4 h,弃掉上清,再加入DMSO 150 μL振荡混匀,490 nm波长处检测吸光度(A)值,计算细胞增殖率和半数抑制浓度(50% inhibiting concentration,IC50)。
1.5 ICA对A549/DDP细胞凋亡率的影响
收集对数生长期的A549/DDP细胞,制成单细胞悬液,以1×105个/孔接种于96孔板,置于培养箱中培养24 h,将细胞随机分为A549/DPP组、DDP组、DDP+ICA-1组,DDP+ICA-2组,DDP组细胞加入4 μg/mL DPP,DDP+ICA-1组和DDP+ICA-2组细胞加入4 μg/mL DPP后,再分别加入ICA 50 μmol/L和100 μmol/L,继续培养48 h,收集细胞,PBS清洗细胞,500 μL Binding buffer将细胞重悬,细胞悬液中加入5 μL Annexin V-FITC,振荡混匀,再加入PI 5 μL,避光孵育10 min,上机检测。
1.6 ICA对A549/DDP细胞侵袭能力的影响
细胞处理及分组同1.5,培养48 h后,收集细胞,制成细胞悬液,以密度为2×104个/孔接种于Transwell上室(已铺基质胶),每孔接种200 μL,下室中加入600 μL DMEM培养基,置于培养箱中继续培养12 h,取出上室,甲醛固定20 min,用棉签轻轻擦掉上室多余细胞,1%结晶紫染色15 min,PBS清洗2次,显微镜下观察,并计数。
1.7 ICA对LRP和MRP mRNA相对表达量的影响
细胞处理及分组同1.5,培养48 h后,收集细胞,加入Trizol提取细胞总RNA,根据逆转录试剂盒将RNA逆转录成cDNA,以cDNA为模板,进行PCR扩增,反应体系为:dNTPs 0.5 μL+5×Buffer 5 μL+Taq酶0.3 μL+MgCl2 1.5 μL+cDNA模板2 μL+上下游引物各1 μL,加ddH2O至总体积25 μL。反应条件为:95 ℃预变性5 min,95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s,共40个循环,72 ℃延伸10 min,以GAPDH为内参,采用2-△△CT方法计算LRP和MRP mRNA相对表达量,引物序列见表1。
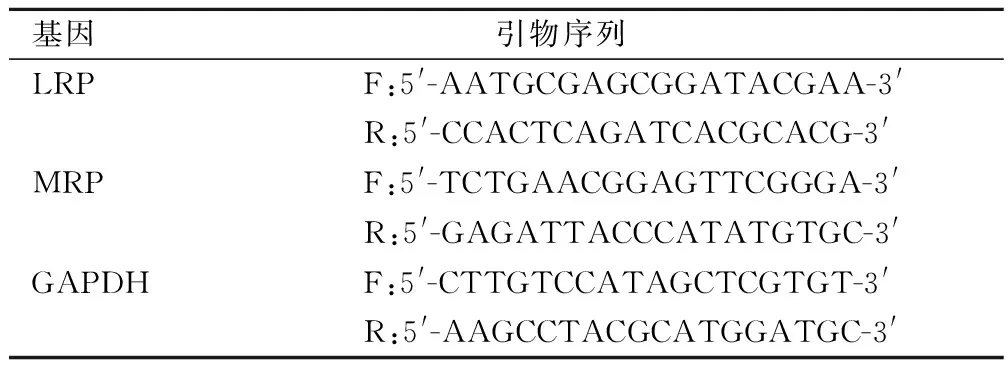
表1 引物序列
1.8 ICA对IL-6、p-STAT3、Bax和Bcl-2蛋白相对表达量的影响
细胞处理及分组同1.5,培养48 h后,收集细胞,加入RIPA裂解液裂解30 min,4 ℃ 12000 r/min离心10 min(离心半径为10 cm),收集上清液,BCA法测定蛋白浓度,裂解液调整蛋白浓度,100 ℃煮沸,使蛋白变性稳定,120 v电泳2 h,0.3 A湿转2 h,TBST洗膜,封闭1 h,4 ℃条件下IL-6、p-STAT3、STAT3、Bax、Bcl-2和GAPDH一抗(1∶1000)孵育过夜,TBST洗膜,二抗(1∶5000)室温孵育1 h,ECL法显色,Image J分析蛋白条带灰度值,目的蛋白条带灰度值/内参蛋白条带灰度值=目的蛋白相对表达量。
1.9 统计学分析
2 结果
2.1 各组细胞增殖能力比较
与A549/DPP组比较,10和20 μmol/L ICA处理后细胞增殖率差异无统计学意义(P>0.05),50、100和200 μmol/L ICA处理后细胞增殖率降低,且具有剂量依赖性(P<0.05),见表2。
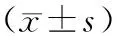
表2 各组细胞增殖率比较
2.2 各组细胞化疗耐药性比较
DDP组、DDP+ICA-50 μmol/L组和DDP+ICA-100 μmol/L组细胞的IC50分别为(18.36±2.05)μg/mL、(9.47±2.32)μg/mL和(5.61±1.78)μg/mL。与DDP组比较,DDP+ICA-50 μmol/L组和DDP+ICA-100 μmol/L组细胞IC50均降低(P<0.05);与DDP+ICA-50 μmol/L组比较,DDP+ICA-100 μmol/L组细胞IC50降低(P<0.05)。
相同浓度DDP时,与DDP组比较,DDP+ICA-50 μmol/L组和DDP+ICA-100 μmol/L组细胞增殖率降低(P<0.05);与DDP+ICA-50 μmol/L组比较,DDP+ICA-100 μmol/L组细胞增殖率降低(P<0.05);随DDP浓度的增加,各组细胞增殖率降低,差异有统计学意义,且具有浓度依赖性(P<0.05),见表3。
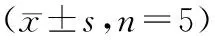
表3 各组细胞增殖率比较
2.3 各组细胞凋亡率比较
细胞凋亡率组间比较,差异有统计学意义(P<0.05)。与A549/DPP组比较,DDP组、DDP+ICA-1组和DDP+ICA-2组细胞凋亡率升高(P<0.05);与DDP组比较,DDP+ICA-1组和DDP+ICA-2组细胞凋亡率升高(P<0.05);与DDP+ICA-1组比较,DDP+ICA-2组细胞凋亡率升高(P<0.05),见表4。
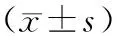
表4 各组细胞凋亡率比较
2.4 各组细胞侵袭能力比较
侵袭细胞数组间比较,差异有统计学意义(P<0.05)。与A549/DPP组比较,DDP组、DDP+ICA-1组和DDP+ICA-2组侵袭细胞数减少(P<0.05);与DDP组比较,DDP+ICA-1组和DDP+ICA-2组侵袭细胞数减少(P<0.05);与DDP+ICA-1组比较,DDP+ICA-2组侵袭细胞数减少(P<0.05),见表5。
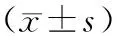
表5 各组侵袭细胞数比较
2.5 各组细胞LRP和MRP mRNA相对表达量比较
LRP和MRP mRNA相对表达量组间比较,差异有统计学意义(P<0.05)。与A549/DPP组比较,DDP组、DDP+ICA-1组和DDP+ICA-2组LRP和MRP mRNA相对表达量降低(P<0.05);与DDP组比较,DDP+ICA-1组和DDP+ICA-2组LRP和MRP mRNA相对表达量降低(P<0.05);与DDP+ICA-1组比较,DDP+ICA-2组LRP和MRP mRNA相对表达量降低(P<0.05),见表6。
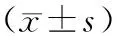
表6 各组细胞LRP和MRP mRNA相对表达量比较
2.6 各组细胞IL-6、p-STAT3、Bax和Bcl-2蛋白相对表达量比较
IL-6、p-STAT3、Bax和Bcl-2蛋白相对表达量组间比较,差异有统计学意义(P<0.05)。与A549/DPP组比较,DDP组、DDP+ICA-1组和DDP+ICA-2组IL-6、p-STAT3和Bcl-2蛋白相对表达量降低,Bax蛋白相对表达量升高(P<0.05);与DDP组比较,DDP+ICA-1组和DDP+ICA-2组IL-6、p-STAT3和Bcl-2蛋白相对表达量降低,Bax蛋白相对表达量升高(P<0.05);与DDP+ICA-1组比较,DDP+ICA-2组IL-6、p-STAT3和Bcl-2蛋白相对表达量降低,Bax蛋白相对表达量升高(P<0.05),见表7。
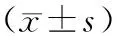
表7 各组细胞中IL-6、p-STAT3、Bax和Bcl-2蛋白相对表达量比较
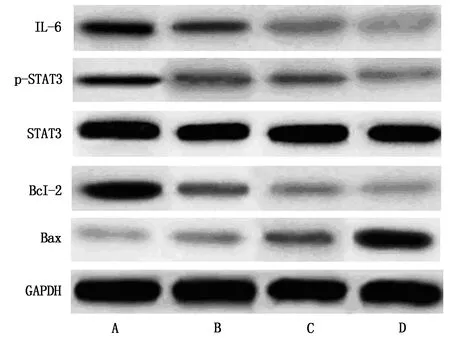
A为A549/DPP组;B为DDP组;C为DDP+ICA-1组;D为DDP+ICA-2组。图1 A549/DDP细胞中蛋白表达情况
3 讨论
根据病理组织学特征,临床上将肺癌分为小细胞肺癌和非小细胞肺癌,由于病理亚型存在多样性,亚型之间的异质性以及治疗中出现的耐药性,造成肺癌治疗效果差,多数肺癌患者就诊时已是晚期,且肿瘤发生转移,所以无法进行手术治疗,因此化疗是治疗肺癌的首选手段。而DDP是治疗晚期非手术肺癌的常用药物,但化疗药物耐药性的问题仍不可避免,但目前细胞耐药机制仍不明确,因此肺癌细胞顺铂耐药机制的研究具有一定临床意义。
ICA是我国的传统中药,是一种黄酮类化合物,具有抗炎,抗氧化及抗肿瘤等多种药理学活性。研究发现,ICA通过激活自噬相关蛋白,具有延缓D-半乳糖引起的脑衰老作用[6]。ICA通过促进凋亡蛋白的表达,降低抗凋亡蛋白的表达,从而抑制结肠癌肝转移瘤的生长[7]。此外,ICA在逆转肿瘤耐药性中的作用已见报道,Jiang等[8]研究发现,ICA可诱导多药耐药卵巢癌细胞凋亡,降低癌细胞增殖、迁移和侵袭能力。Wang等[9]研究表明ICA可逆转阿霉素耐药人骨肉瘤细胞的多药耐药。本研究采用不同浓度ICA处理A549/DDP后,MTT法检测结果显示:随着ICA浓度的升高,细胞增殖率逐渐降低。采用50 μmol/L和100 μmol/L ICA处理经不同浓度DDP培养的A549/DDP细胞,结果显示:ICA可提高A549/DDP细胞对DDP的敏感性,降低DDP对细胞的IC50。采用4 μg/mL DDP和50、100 μmol/L ICA处理A549/DDP细胞,结果显示:ICA提高A549/DDP细胞的凋亡率,降低细胞侵袭能力,并存在剂量依赖性。多药耐药(MDR)是造成肿瘤细胞化疗效果不佳的重要原因之一,MDR发生机制复杂,MRP和LRP是引起MDR的重要原因,MRP通过参与转运GS-X复合物和运输胞质囊泡产生耐药,LRP通过阻滞药物在核内聚集或将细胞质中的药物运输到囊泡,通过胞吐作用将其排除细胞外,从而产生耐药性。Shen等[10]研究表明A549/DDP细胞中MRP和LRP表达升高。本研究采用PCR法检测MRP和LRP mRNA相对表达量,结果显示:50和100 μmol/L ICA降低MRP和LRP mRNA相对表达量,且具有剂量依赖性。结果提示:ICA可增强A549/DPP细胞对顺铂的敏感性,降低其耐药性。
IL-6/STAT3信号通路激活在多种癌细胞的增殖、迁移和侵袭过程中具有重要作用,IL-6是衔接炎症和肿瘤最核心的炎症因子,在调节免疫功能、炎症反应和促进肿瘤生长等生物学过程中发挥作用,STAT3通过将炎症因子介导的细胞外信号传递至细胞内,重新编码细胞内基因,参与调控肿瘤细胞的恶性行为学[11]。三苯氧胺通过抑制IL-6/STAT3信号通路降低星形胶质细胞脑转移,并逆转癌细胞耐药性[12]。靶向抑制IL-6/STAT3信号级联可逆转雌激素受体阳性乳腺癌三苯氧胺耐药[13]。细胞凋亡手机提的严密调控,设计多个基因的激活,Bcl-2家族中促凋亡分子和抗凋亡分子间的平衡对细胞线粒体膜电位的稳定性至关重要,Bcl-2和Bax对细胞凋亡有着“分子开关”的作用,Bax主要位于细胞质中,一旦细胞接收到凋亡信号,其由细胞质转位至线粒体膜上,导致线粒体膜上分子通道开放,使促凋亡因子大量释放。Bcl-2是线粒体上重要的跨膜蛋白,与Bax结合可形成二聚体,从而稳定线粒体膜电位,降低促凋亡因子释放,发挥抗细胞凋亡作用[14]。本研究中蛋白印迹法检测结果显示:50和100 μmol/L ICA可降低IL-6、p-STAT3和Bcl-2蛋白相对表达量降低,Bax蛋白相对表达量升高。结果提示:ICA抑制IL-6/STAT3信号通路,发挥促凋亡作用。
综上所述,ICA可降低A549/DDP细胞顺铂耐药性,其可能是通过抑制IL-6/STAT3信号通路发挥作用,为临床治疗肺癌提供新的理论依据。
