鹰嘴豆芽素A通过抑制Wnt/β-catenin信号通路抑制结肠癌细胞增殖迁移的可能机制
2023-08-10陈晓燕王莹莹罗金键
陈晓燕 王莹莹 罗金键
结肠癌是临床常见消化道恶性肿瘤,多发于40岁以上中年人群,男性居多,其病死率较高,现已成为我国第四大癌症死因,且随着国内饮食习惯的改变,其发病率亦成上升趋势,严重威胁人民生命安全[1]。目前,临床治疗结肠癌多采用外科手术配合放化疗,效果并不理想,且存在术后创伤、化疗耐药及毒副作用等诸多不足[2]。鹰嘴豆芽素A(biochanin A,BCA)是传统中草药红车轴草的主要有效成分,可抗炎、抗菌、抗氧化、调节血糖、抑制组织增生[3]。有学者认为[4],BCA可抑制胶质母细胞瘤细胞活性,诱导细胞周期G1期停滞,增强替莫唑胺抗癌作用,提示其具有抗肿瘤活性。然而,目前关于BCA对于结肠癌的治疗作用鲜有报道,且缺乏对应的机制研究。本研究采用BCA干预结肠癌细胞,观察其对该细胞增殖、迁移的影响,并探讨可能机制。
1 材料与方法
1.1 材料
1.1.1 细胞系 人结肠癌HCT-116细胞系,购自中国科学院上海细胞库。
1.1.2 药物、主要试剂、仪器 BCA(纯度:98%,上海信裕生物科技有限公司);MTT试剂盒(上海恒斐生物科技有限公司);Wnt/β-连环蛋白(β-catenin)通路激活剂SB216763[爱必信(上海)生物科技有限公司];兔抗人糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)、β-catenin一抗(日本MBL公司)。GENios酶标仪(瑞士Tecan公司);E100显微镜(日本Nikon株式会社)。
1.2 方法
1.2.1 细胞培养 取冷冻保存的人结肠癌HCT-116细胞,复苏后置于RPMI-1640培养基(含有10%胎牛血清、1%青链霉素双抗),37 ℃,5% CO2条件下培养箱中传代培养,取对数期细胞进行后续实验。
1.2.2 MTT法测定HCT-116细胞增殖活性(半数抑制浓度) 取对数期HCT-116细胞,胰酶消化、重悬,调整细胞密度为1×105个/mL接种至6孔板,待细胞融合至80%,加入不同终浓度(5,10,20,40,80,160 μmol/L)BCA溶液,培养48 h后每孔加入新制备MTT溶液20 μL,培养2 h后弃上清,每孔加入DMSO 150 μL,振荡20 min后静置2 h,酶标仪测定490 nm处各孔吸光度(A)值,计算细胞抑制率(%)=(1-各浓度A值/对照细胞A值)×100%,画出折线图得出半数抑制浓度(IC50)。
1.2.3 细胞干预、分组[5]取对数期HCT-116细胞,胰酶消化、重悬,待其生长至贴壁,随机分为对照组、BCA组、SB216763组、联合组,对照组置于RPMI-1640培养基常规培养,BCA组培养基中加入BCA DMSO溶液(终浓度40 μmol/L),SB216763组培养基中加入SB216763 DMSO溶液(终浓度20 μmol/L),联合组加入BCA DMSO溶液(终浓度40 μmol/L)、SB216763 DMSO溶液(终浓度20 μmol/L)。各组设置5个复孔,培养48 h后进行后续实验。
1.2.4 MTT法检测各组增殖能力 取培养48 h后的各组细胞,胰酶消化、重悬,调整细胞密度为1×106个/mL接种至96孔板,分别于培养24、48、72 h时,加入新制备MTT溶液20 μL,培养2 h后弃上清,每孔加入DMSO 150 μL,振荡20 min后静置2 h,酶标仪测定490 nm处各孔吸光度值。
1.2.5 划痕实验检测各组迁移能力 取培养48 h后的各组细胞,胰酶消化、重悬,调整细胞密度为1×106个/mL接种至6孔板,培养至贴壁后弃去培养基,无菌移液枪头沿孔中心位置竖直画一条直线划痕,PBS冲去边缘碎片,加入完全培养基培育,光镜下拍照记录培养0 h划痕宽度与培养24 h划痕宽度,计算各组迁移率=(培养0 h划痕宽度-培养24 h划痕宽度)/培养0 h划痕宽度×100%。
1.2.6 血管拟态形成实验检测血管新生能力 Matrigel胶融化后与RPMI-1640培养基等比例混匀,注入96孔板,室温凝固,取培养48 h后的各组细胞,胰酶消化、重悬,调整细胞密度为1×104个/mL接种于该孔板,置于37℃恒温箱中孵育(气体构成:94%氮气,5% CO2,1%氧气),12 h后光镜取5个不重复视野拍照记录,经图像处理软件Image Pro分析血管数量,取其均值。
1.2.7 免疫印迹法检测细胞GSK-3β、β-catenin蛋白表达量 取培养48 h后的各组细胞,加入RIPA裂解细胞,移至离心管内,低温离心机8 000 r/min离心15 min(离心半径10 cm),BCA试剂盒定量蛋白。将微量样本蛋白与4倍体积上样缓冲液混匀,水浴煮沸5 min变性蛋白,离心取上清,电泳分离后转至PVDF膜,5%脱脂牛奶封闭2 h,洗膜后加入兔抗人GSK-3β、β-catenin一抗(1∶500),4 ℃摇床孵育过夜,再次洗膜加入二抗(1∶2 000),孵育2 h后洗膜,经ECL发光、暗室显影,采用凝胶成像分析仪分析条带灰度值,以GSK-3β、β-catenin蛋白灰度值与内参GAPDH灰度值之比代表GSK-3β、β-catenin蛋白相对表达量。
1.3 统计学处理
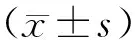
2 结果
2.1 不同浓度BCA对HCT-116细胞的增殖抑制率、IC50
经5,10,20,40,80,160 μmol/L BCA溶液干预后,HCT-116细胞增殖抑制率逐渐升高,IC50位于40~80 mol/L之间,后续时实验均采用40 mol/L作为BCA干预剂量。见图1。
图1 不同浓度BCA对HCT-116细胞的增殖抑制率
2.2 各组细胞增殖能力比较
与对照组比较,BCA组24、48、72 h MTT实验吸光度值降低(P<0.05),SB216763组24、48、72 h MTT吸光度值升高(P<0.05);与BCA组比较,联合组24、48、72 h MTT吸光度值升高(P<0.05);与SB216763组比较,联合组24、48、72 h MTT吸光度值降低(P<0.05)。见表1。
表1 各组细胞MTT吸光度值比较
2.3 各组细胞迁移能力比较
与对照组比较,BCA组细胞迁移率降低(P<0.05),SB216763组细胞迁移率升高(P<0.05);与BCA组比较,联合组细胞迁移率升高(P<0.05);与SB216763组比较,联合组细胞迁移率降低(P<0.05)。见表2,图2。
表2 各组细胞迁移率比较

图2 划痕实验观察各组迁移能力(×100)
2.4 各组细胞血管新生能力比较
与对照组比较,BCA组血管数量/视野减少(P<0.05),SB216763组血管数量/视野增加(P<0.05);与BCA组比较,联合组血管数量/视野增加(P<0.05);与SB216763组比较,联合组血管数量/视野减少(P<0.05)。见表3,图3。
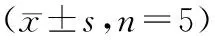
表3 各组细胞血管新生能力比较
图3 血管拟态形成实验检测管状结构数量(×200,标尺20 μm)
2.5 各组细胞GSK-3β、β-catenin蛋白表达量比较
与对照组比较,BCA组GSK-3β蛋白表达量升高、β-catenin蛋白表达量降低(P<0.05),SB216763组GSK-3β蛋白表达量降低、β-catenin蛋白表达量升高(P<0.05);与BCA组比较,联合组GSK-3β蛋白表达量降低、β-catenin蛋白表达量升高(P<0.05);与SB216763组比较,联合组GSK-3β蛋白表达量升高,β-catenin蛋白表达量降低(P<0.05)。见表4,图4。
表4 各组细胞GSK-3β、β-catenin蛋白表达量比较
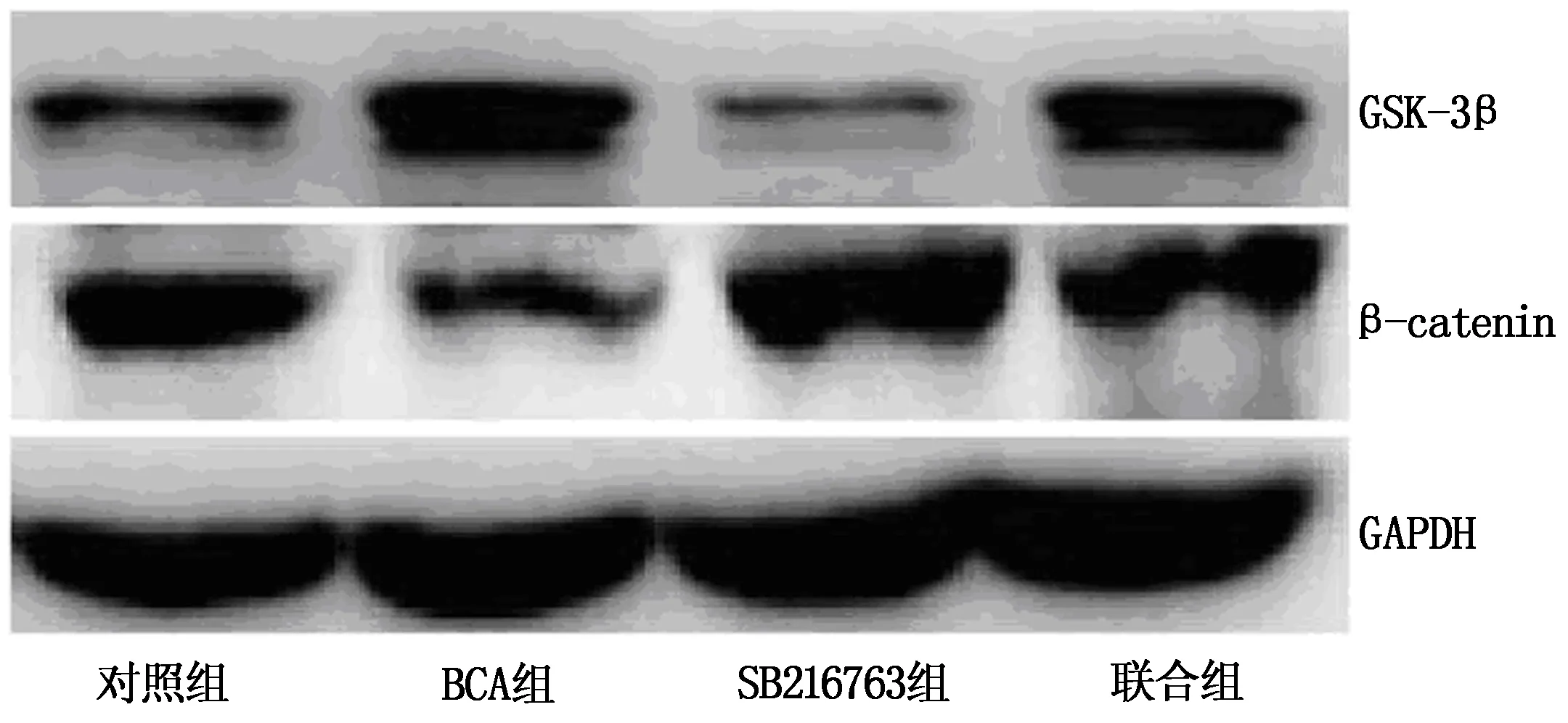
图4 各组细胞GSK-3β、β-catenin蛋白表达量
3 讨论
结肠癌好发于直肠或直肠与乙状结肠交界位置,起始为黏膜层或黏膜下层癌肿,后逐渐侵犯至黏膜下方,直至浆膜层,腔内生长或沿肠壁浸润,部分蔓延至淋巴结,发生淋巴转移,病灶随之增大、增多,影响机体全身[6]。结肠癌早期症状较轻,中期则表现为腹部肿块、血便、乏力,后进展为黄疸、腹水,甚至全身衰竭[7]。纤维素食用过少、红肉食用过多是结肠癌的主要危险因素,此外家族遗传也是其发病影响因素之一[8]。发病隐匿、复发性强、转移率高是结肠癌的基本特征,多数患者确诊时已处于晚期,此时已出现淋巴转移或肝脏转移,治疗难度显著增加[9]。癌细胞高增殖性及高迁移能力是肿瘤转移的主要原因,也是导致患者预后不佳的重要因素[10]。因此,探寻有效抑制结肠癌细胞增殖、迁移的药物,对于结肠癌治疗意义重大。
中医治疗结肠癌的历史久远,具有其独特优势。中医将结肠癌归于“肠澼”、“积聚”、“下痢”等范畴,其病因为素体不足、饮食不结、阳气缺损、气化不调,以致脾胃损伤、运化失司、湿浊生热、毒邪始聚、滞存肠府,进而发病,热毒郁结是其主因,故应以清热解毒、补气凉血为主[11]。中药红车轴草取自豆科植物红车轴草干燥花序及带花枝叶,性微寒,味甘、苦,可清热、凉血、止咳、消肿,BCA是其含有的一种植物异黄酮,作为天然类雌激素,可诱导癌细胞凋亡,抑制肿瘤血管生成,从而发挥其抗癌作用[12]。Zhao等[13]研究认为,BCA可降低体外骨肉瘤细胞MG63、U2OS增殖率、抑制其侵袭、迁移能力,提示BCA可作为恶性肿瘤潜在治疗药物。本研究结果显示,与对照组比较,BCA组24、48、72 h MTT实验A值、迁移率降低,血管数量/视野减少,提示BCA可抑制结肠癌细胞增殖、迁移及血管新生。
Wnt/β-catenin信号通路是机体内一条复杂的蛋白质作用通路,在胚胎发育及恶性肿瘤发生发展过程中扮演重要角色,其中Wnt、GSK-3β、β-catenin是该通路重要组成蛋白[14]。β-catenin是细胞骨架结构蛋白,正常状态下与E钙粘蛋白结合,发挥其细胞黏附作用[15]。Wnt是分泌糖蛋白的一种,可在细胞膜上与受体结合,间接抑制β-catenin拮抗蛋白GSK-3β表达,并促进其失活,大量β-catenin降解受阻而游离在胞质中,部分β-catenin进入胞核,与其他转录因子共同作用,发挥其诱导细胞癌变、促进血管新生等作用[16]。Tang等[17]研究认为,激活Wnt/β-catenin信号通路可增强结直肠癌细胞迁移、侵袭,维持其复发、转移过程中上皮间质转化能力及癌细胞干性。本研究结果显示,与对照组比较,BCA组GSK-3β蛋白表达量升高,β-catenin蛋白表达量降低,增用Wnt/β-catenin通路激活剂SB216763可降低BCA对结肠癌的治疗作用,提示BCA对结肠癌的治疗作用可能与调控Wnt/β-catenin信号通路有关。
综上所述,BCA可抑制结肠癌细胞增殖、迁移及血管新生,抑制Wnt/β-catenin信号通路可能是其作用机制之一。
