基于问题解决的单元整体教学设计
2023-08-09沈金龙李娜
沈金龙 李娜


摘要:核心素养的内涵反映出知识与能力的一体化,而单元整体教学是核心素养落地的重要教学方式之一。本文基于食盐水蒸发的现象,构建可溶电解质沉淀溶解平衡模型;通过优化教材中PbI2的实验,引导学生设计实验,帮助学生构建难溶电解质的沉淀溶解平衡的基本模型,厘清溶解度与溶度积的关系;基于水垢形成和水垢如何处理的真实情境的问题解决,从定性和定量双角度帮助学生理解沉淀的溶解和沉淀的转化。
关键词:单元整体教学;沉淀溶解平衡;溶度积;转化;核心素养
文章编号:1008-0546(2023)12-0050-05 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2023.12.011
一、背景分析
《普通高中化学课程标准(2017年版2020年修订)》中指出,核心素养为导向的教学理念立德树人,既要重視“素养为本”的教学,又要培养学生的创新精神,基于真实问题情境下教学,开展以学生实验为主的多种探究活动,激发学生学习化学的兴趣,发展学生宏观辨识与微观探析、变化观念与平衡思想、证据推理与模型认知、科学探究与创新意识、科学态度与社会责任的化学核心素养。[1]核心素养的内涵反映出知识和能力的一体化,单元整体教学是核心素养落地的重要教学方式之一。基于真实情境下的单元教学设计,能激发学生学习的兴趣,从整体上把握教学,发展学生的化学核心素养。
沉淀溶解平衡是化学平衡、电离平衡、水解平衡之后的重要的平衡理论,学生在已有的平衡体系认识基础之上再认识沉淀溶解平衡,能帮助学生更全面了解水溶液中离子平衡的相关理论。沉淀溶解平衡也是对认识离子反应本质的补充,能够使学生更加透彻地理解离子反应的实质。溶液是一个需要系统分析的研究对象,沉淀溶解平衡是多平衡体系的重要应用,同时也为认识离子反应复杂平衡体系作铺垫,发展溶液中的平衡观,关注和利用平衡间的互相影响。笔者始终坚持以学生核心素养为本的整体教学,教学以课标为重要的理论依据,基于真实问题的解决,帮助学生构建利用角度和思路解决复杂问题思维模型,发展学生的思维有序性,从而提升学生的核心素养。
二、教学内容分析
“沉淀溶解平衡”是鲁科版《化学反应原理》第三章第三节的内容,是高中阶段关于水溶液知识的重要组成部分,从教材的编排上,知识是有层次的螺旋式上升,整章的编排从单一平衡体系溶剂和溶剂的电离分析,过渡到多平衡体系盐类的水解和沉淀溶解的探究,最后落脚到复杂平衡体系离子反应实质的应用。沉淀溶解平衡在整章的教学中起到重要衔接的作用,学生通过构建水溶液中多平衡体系的思维模型,从而补充解决复杂平衡体系中离子反应的实质,通过构建可溶电解质沉淀溶解平衡模型,为探究微项目侯氏制碱法的原理提供理论支持。沉淀溶解平衡的教学内容包括可溶电解质的沉淀溶解平衡的建立、难溶电解质的沉淀溶解平衡的建立、溶度积常数、沉淀溶解和沉淀的转化。
三、教学设计思路
如表1所示。
四、教学过程
第1课时沉淀溶解平衡与溶解度
任务一:构建可溶电解质沉淀溶解平衡
【问题1】食盐水蒸发结晶时,有什么实验现象?分析产生现象的原因。
【问题2】有大量晶体析出后,停止加热,冷却后,再向其中加蒸馏水,会有什么实验现象?从平衡移动的角度分析产生现象的原因。
【问题3】向饱和的NaCl溶液中通入氯化氢气体,预测会有什么实验现象?
【学生活动1】学生根据建立的沉淀溶解平衡,利用沉淀溶解平衡移动的原理,分析有大量的白色沉淀析出。
【教师归纳】可溶电解质存在沉淀溶解平衡,此类平衡是化学平衡中的一类,符合平衡移动的规律,可溶电解质的沉淀溶解平衡在工业生产中有广泛应用,
国人引以为自豪的侯氏制碱法就应用了这一原理。
设计意图:创设了食盐水蒸发结晶的情境,利用熟悉的饱和食盐水以及蒸发过程中的现象、向过饱和食盐水中加蒸馏水的现象,能够让学生关注到NaCl在水中溶解是有限度的。通过宏观实验现象,促使学生从微粒角度分析,调用平衡理论,构建可溶电解质的沉淀溶解平衡,同时也为微项目侯氏制碱法学习作了铺垫,帮助学生建立微粒观、变化观、平衡观等学科观念。认识宏观现象的微观本质,形成证据意识,发展证据推理、科学探究与创新意识、科学态度和社会责任的核心素养。
【过渡】可溶电解质在水中存在沉淀溶解平衡,那么难溶电解质是不是也存在沉淀溶液平衡呢?
任务二:构建难溶电解质沉淀溶解平衡【思考】难溶电解质在水中是否完全不溶?
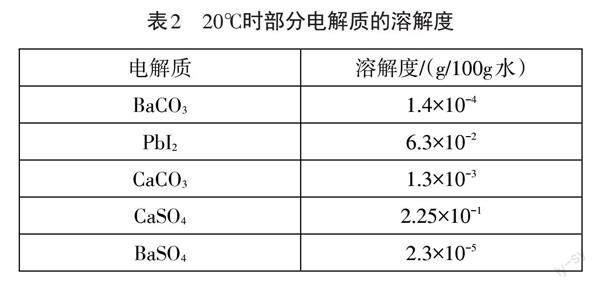
【数据展示】部分电解质的溶解度如表2所示。
【数据展示】20℃时100 g水中物质溶解性的分类如图1所示。
【教师总结】溶解是绝对的,不溶是相对的,没有绝对不溶的物质,所有物质都能溶解,只是溶解的相对大小不同,[2]因此所有电解质都会有沉淀溶解平衡。
【思考】从哪些视角可以验证 PbI2悬浊液存在沉淀溶解平衡呢?
【追问】思考如何通过平衡移动的视角设计实验方案。
【学生活动2】根据教师的提示,独立思考,小组讨论,设计实验方案,学生展示实验设计方案(见表3)。
【实验探究1】按表3所示的实验设计方案进行实验。
资料:碘化铅(PbI2),黄色固体,难溶于水,强电解质。
实验目的:PbI2在水中存在沉淀溶解平衡
实验用品:PbI2悬浊液、蒸馏水、0.1 mol · L-1 KI溶液、0.1 mol ·L-1 Pb(NO3)2溶液、试管。
设计意图:将课本实验设计成开放性实验活动,学生可以基于共存和平衡移动两个视角设计实验,借此检验学生实验设计方案的能力及思维严谨性,通过追问问题,引导学生设计出教参中提供的平衡移动的角度证明沉淀溶解平衡的实验方案,学生设计并动手实验,体验实验的乐趣,通过学生对实验方案的书写,探查学生对平衡理论的认识以及文字表达能力,发展学生的科学态度的核心素养。
任务三:再认识沉淀溶解平衡
【过渡】沉淀溶解平衡是继化学平衡、电离平衡、水解平衡之后,又一个重要的平衡过程,也遵循平衡的规律和特点。如何定量描述沉淀溶解平衡的限度呢?
【学生活动3】学生能联想到溶解度和平衡常数,学生阅读课本,正确地认识溶度积常数,并能正确地书写溶度积常数的表达式。
【问题3】为什么同类型的难溶电解质可以比较Ksp,不同类型的却不能比较?
【问题4】Ksp与溶解度是什么关系?为何引入Ksp?
【归纳总结】对于电解质在水中的溶解度,既可以用100 g水中溶解的溶质质量表示,也可以使用1 L溶液中溶解溶质的物质的量来表示。利用饱和溶液中溶质的物质的量浓度,不仅可以表示纯水中溶解度,还可以适用于混合溶液中。
【深度思考】从定量的角度分析,实验方案(3)中 PbI2悬浊液产生黄色沉淀更明显的原因。
【追问】加入KI溶液后,PbI2上清液、PbI2悬浊液中的平衡如何移动?PbI2悬浊液中的沉淀有什么作用?
【学生活动4】学生思考,利用Ksp与 Q 的关系解释产生现象的原因。
设计意图:帮助学生厘清溶解度与Ksp的关系,体现引入Ksp的必要性,借助特殊现象,引发学生思考,促使学生基于宏观现象,多角度、动态分析水溶液中的微粒变化,使学生认识到悬浊液中上下层溶液平衡的移动相关联的,从而帮助学生构建动态平衡思想,培养学生变化观念与平衡观念、证据推理与模型认知的核心素养。
任务四:利用认知模型,解决真实问题
如果误食钡盐,会造成钡中毒,在医学生常用5%Na2SO4溶液洗胃。5%Na2SO4溶液中 SO4(2)-的物质的量浓度近似为0.35 mol · L-1,请通过计算说明,5%Na2SO4溶液能否有效解毒?
已知:Ksp(BaSO4)=1.1×10-10,胃中Ba2+浓度小于1×10-4 mol ·L-1,不会对身体有伤害。
【学生活动5】学生从定量的角度分析解决问题。
设计意图:通过解决钡中毒这一真实情境,深化学生对沉淀溶解平衡的再认识,使学生从定性的分析延伸到定量的计算,发展学生的高阶思维能力,同时让学生体会到学习化学的乐趣和价值,发展科学精神与社会责任核心素养。
第2课时沉淀溶解平衡的应用
任务一:去除水垢原理的分析
【问题1】请从下列试剂中选择去除水垢中碳酸钙的试剂,并从微观和平衡移动的角度分析除去碳酸钙的原理。
试剂:0.1 mol · L-1 HCl 溶液、0.1 mol · L-1 NaOH 溶液、0.1 mol · L-1 CH3COOH 溶液、0.1 mol · L-1 NH4Cl、0.1 mol · L-1 CH3COONa溶液。
【学生活动】学生借助 Q 与Ksp的关系,从微观上、动态上分析碳酸钙沉淀溶解的原理,构建沉淀溶解的思维模型。
知识支持:化工厂设备中的水垢种类很多,如碳酸盐型、硅酸盐型,直接用酸洗法处理水垢,有些水垢如硫酸钙水垢,其外表致密,质地坚硬,与酸反应速度十分缓慢,在常温、常压下,盐酸对硫酸钙的溶解率小于15%,[3]所以工业上用饱和碳酸钠溶液和盐酸处理硫酸盐,即先加入饱和碳酸钠溶液浸泡,然后再向处理后的水垢中加入盐酸。
已知:Ksp(CaSO4)=9.1×10-6
Ksp(CaCO3)=2.8×10-9
【问题2】从微观和平衡移动的角度分析工业上先加入饱和碳酸钠溶液浸泡,过滤后再向处理后的水垢中加入盐酸的原理是什么?
【学生活动】学生从微观的角度分析硫酸钙的溶解和碳酸钙沉淀的形成,再结合平衡移动的原理,从定性和定量的角度分析,沉淀由 CaSO4转化成 CaCO3,过滤沉淀之后,再用盐酸除去沉淀。
【学生总结教师补充】为何硫酸钙沉淀能转化成碳酸钙沉淀呢?
从化学反应限度角度分析反应的难易程度:
这一个反应的化学平衡常数K= c(c) O(O)-(-)= K(K)s(s)p(p) CaCO(CaSO)3(4)=3.25×103,由于反应的K 比较大,说明 CaSO4容易转化成CaCO3。对于沉淀之间的转化是有条件的,沉淀的转化向着从难溶的沉淀转化成更难溶的沉淀方向进行。从沉淀溶解平衡的角度分析反应的难易程度:硫酸钙存在沉淀溶解平衡,从定量的角度利用Ksp计算钙离子的浓度,溶液中存在钙离子浓度钙,则溶液中只需要碳酸根离子的浓度满足反应Ca2+(aq)+ CO3(2)-(aq)一---(---一) CaCO3(s)发生的要求,即 Q大于Ksp(CaCO3)。由于此浓度比较小,因而很容易实现CaSO4沉淀转化成CaCO3沉淀。沉淀之间的转化是有条件的,沉淀的转化向着从难溶的沉淀转化成更难溶的沉淀方向进行。
设计意图:从微观上分析碳酸钙溶解和硫酸钙转化的原理,运用平衡移动原理中Q 与Ksp的关系解释生活中碳酸钙、硫酸钙水垢去除的问题,发展学生基于Q 与Ksp的关系调控沉淀溶解平衡向沉淀生成或溶解的方向移动,帮助学生构建分析多平衡体系的思维模型,建立水溶液中离子反应与平衡的认识角度和基本思路。
任务二:实验探究模拟水垢去除
【问题3】结合工业去除水垢中 CaSO4的方式,请同学们模拟去除水垢中的CaSO4实验探究。
【学生活动】向试管中加入少量的 CaSO4固体,再向其中滴加2 mL 饱和碳酸钠溶液浸泡,过滤,洗涤沉淀2至3次,向沉淀中滴加2 mL 2 mol · L-1的盐酸,观察到产生大量气泡,沉淀溶解。
设计意图:通过学生设计去除CaSO4的实验,帮助学生从宏微结合角度分析沉淀的转化,使学生建立证据意识,发展科学探究的素养,提升学生基于证据來分析解决问题的能力。
任務三:微观探析水垢的形成
【问题4】水垢又称为水碱,其主要成分是 CaCO3、 CaSO4、Mg(OH)2,请同学们根据自然水的成分,从微观上分析在长时间烧水后水垢是如何形成的?
知识支持:自然水中含有的离子成分:Ca2+、Mg2+、Na+、K+、HCO3(-)、SO4(2)-、Cl-。
【学生活动】学生从微观的角度分析水垢的形成:
【教师总结】水长期加热煮沸,由于氢氧化镁的溶度积小于碳酸镁的溶度积,从而实现碳酸镁沉淀转化成氢氧化镁沉淀。
设计意图:从生活案例出发,激发学生学习化学的兴趣,使学生学会用所学理论解决实际问题,帮助学生从微观的角度深刻理解在溶液中发生的离子反应与平衡问题,进一步完善学生对于沉淀生成、溶解、转化的认识。
五、教学创新与反思
1.把握好教材,创造性地用好教材
把握教材的编写意图和编写特点是化学教师应具备的能力。现行的新教材栏目设计和编排非常合理,符合学生的认知规律,根据学情可以创造性地使用教材。笔者在这一部分教学中的处理,充分挖掘教材,活用教材,把教材中各栏目的情景融入到课堂,例如:实验探究难溶电解质的沉淀溶解平衡,笔者结合教参提示,对教材实验进行改编,设计成开放性的实验,充分调动学生学习的积极性,让学生构建动态的平衡思想。教材中提到的钡离子中毒、水垢中氢氧化镁形成过程等栏目,笔者基于教材进行改编,帮助学生从定性和定量的角度分析沉淀的形成、溶解和转化。对于沉淀溶解和沉淀转化的教学中,笔者基于学生熟悉的处理水垢的真实情境展开,对教材进行改编,从学生生活案例出发,激发学生学习化学的兴趣,使其学会用所学理论解决实际问题。教材中每一个环节都是一个很好的教学设计和教学案例,我们要深度挖掘教材,创造性地使用教材,让我们的教学更有效。
2.基于化学核心素养的情境化、问题化教学
问题情境教学能在教学过程中引起学生的直接注意和积极的情感体验,使其形象思维向抽象思维转移的速度和宽度得以提高。生活的情境与问题化教学相互作用,与学生的思考反应共生一体。笔者在教学中,从生活情境出发,将情境问题化,从熟悉的蒸发结晶食盐水情境出发,构建易溶电解质沉淀溶解平衡,钡离子中毒如何处理,水垢如何形成,以及水垢如何处理的真实问题情境贯穿于整个课堂,让学生感受到学习化学就是为了解决实际问题的,感受到化学是非常有价值的,激发学生学习化学的积极性,提升学生化学核心素养。
3.聚焦实验教学,提升核心素养
新课程标准要求开展核心素养导向下的化学实验教学,强化实验为主的探究活动,对 PbI2验证难溶电解质的沉淀溶解平衡实验,设计成开放性实验,有助于学生从反应物和生成物共存以及平衡移动的角度构建沉淀溶解平衡;模拟水垢处理实验,学生能从宏观角度认识物质之间的转化,帮助学生建立水溶液中离子反应和平衡的基本架构,培养学生的创新思维能力。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订).北京:人民教育出版社,2020.
[2]曾阔,蒋小钢.以化学观念建构为顶层设计的教学实践与思考——以“沉淀溶解平衡”的教学为例[J].化学教与学,2017(4):48-51.
[3]陈魁,向兰.硫酸钙溶解行为初探[J].盐业与化工,2007,36(2):1-3.
[4]王磊.普通高中教科书(化学选择性必修1)[M].济南:山东科学技术出版社,2017.
[5]王磊.普通高中教科书(化学选择性必修1)教师用书[M].济南:山东科学技术出版社,2019.
