鼻用糖皮质激素对大鼠鼻纤毛运动的影响评估
2023-08-08易文琪徐铭鸿董思淇雷解放军医学院北京008解放军总医院耳鼻咽喉头颈外科医学部北京008首都医科大学附属北京儿童医院耳鼻咽喉头颈外科北京000解放军总医院第五医学中心介入超声科北京008中山大学附属第八医院耳鼻咽喉头颈外科广东深圳8000
易文琪,刘 晨,徐铭鸿,逄 川,王 瑾,董思淇,陈 雷解放军医学院,北京 008;解放军总医院耳鼻咽喉头颈外科医学部,北京 008;首都医科大学附属北京儿童医院耳鼻咽喉头颈外科,北京 000;解放军总医院第五医学中心介入超声科,北京 008;中山大学附属第八医院耳鼻咽喉头颈外科,广东 深圳 8000
鼻用糖皮质激素是治疗过敏性鼻炎和慢性鼻窦炎等常见鼻部疾病的一线药物[1-2]。它可以有效降低炎症反应,改善临床症状,但长期使用可能造成局部过度刺激,引起干燥和鼻出血等不良反应[3-5]。鼻用糖皮质激素对纤毛运动的作用结果一直备受关注[6-7]。黏液纤毛清除系统(mucociliary clearance,MCC)是呼吸道防御各种吸入颗粒和外来病原体的第一道防线,其主要的动力来源是协调的纤毛运动[8]。决定黏液纤毛清除能力的一个关键参数是纤毛的摆动频率(ciliary beat frequency,CBF)。鼻用药物的生物安全性通常以CBF 作为重要的衡量指标[9]。部分药物的纤毛毒性会抑制CBF,造成MCC 功能减退,从而使鼻腔黏膜与病原体、污染物或致癌物的接触时间延长,最终导致鼻黏膜的感染或损伤[7]。因此,评价鼻用糖皮质激素对纤毛运动的影响具有重要意义。临床上常见的鼻用糖皮质激素包括布地奈德、糠酸莫米松和丙酸氟替卡松等。既往离体研究发现,未稀释的布地奈德会导致纤毛可逆的停滞,50% 稀释浓度的糠酸莫米松和丙酸氟替卡松则可造成纤毛完全不可逆的停滞[6-7]。然而,离体实验的结果不能完全反映在体鼻黏膜的生理状态,因为离体组织或细胞失去了在体时的生理环境[10],以及神经、免疫等固有调控机制的保护[11-12],使得离体纤毛更容易受药物作用的影响。因此,离体实验的结果可能会放大药物作用于纤毛的毒性作用,从而干扰局部用药的精准性。但由于观察技术和设备的限制,在体观测CBF 很难实现。本课题组前期通过应用新型数码显微系统,在体观察并记录啮齿类动物模型鼻黏膜表面的纤毛运动,计算CBF、纤毛摆动幅度等数据,并探究了温度[13]、卵清蛋白和组胺对纤毛运动的影响[14],成功建立了在体评估纤毛运动的方法。基于该方法,我们拟观察和分析鼻用糖皮质激素对在体和离体鼻黏膜CBF 的影响,为进一步探究鼻用糖皮质激素潜在的纤毛毒性提供新的数据支持。
材料与方法
1 实验动物 60 只清洁级3 月龄成年SD 大鼠,体质量200 ~ 300 g,购自斯贝福(北京)生物技术有限公司。大鼠饲养于系统自动控制光照与温度的动物饲养房内,每日模拟光照与黑夜各12 h,温度25℃,自由进食水。大鼠在适应性喂养1 周后用于实验。本研究经解放军总医院实验动物伦理委员会批准。
2 主要试剂和仪器 0.64%布地奈德(瑞典Astra Zeneca AB 公司)、0.05%糠酸莫米松(比利时MSD Belgium BVBA/SPRL 公司)、0.05%丙酸氟替卡松(西班牙Galxo Wellcome,S.A 公司)、DMEM 培养基和胎牛血清(美国Invitrogen 公司)、青霉素-链霉素双抗(武汉赛维尔生物科技有限公司)、戊巴比妥钠(美国Merck 公司)。数码显微系统(VHX6000,日本Keyence 公司);镜头(Z100R,日本Keyence公司);环形照明器(VH-Z100R,日本Keyence 公司);高速数码显微摄影系统(VW-9000,日本Keyence 公司)。
3 动物分组 大鼠随机分为在体观察组和离体观察组,每组30 只。每组又随机分为布地奈德、糠酸莫米松和丙酸氟替卡松3 个亚组,各亚组均以磷酸盐缓冲液(phosphate buffered saline,PBS)作为对照,每个试验组和对照组各5 只大鼠。
4 在体观察鼻黏膜纤毛运动 参照本课题组已发表的研究方法[13-14],在体观察组大鼠按60 mg/kg的剂量腹腔注射戊巴比妥钠麻醉大鼠,确认麻醉深度后,全程密切观察动物呼吸和心跳。切除大鼠单侧鼻腔外侧壁,暴露鼻中隔黏膜,将大鼠放置于带有加热垫的定制平台以维持体温和保持固定。将平台放置于数码显微系统载物台上,调整显微镜光源,使用高速数码显微系统对纤毛运动影像进行动态观察,频率设定为150 帧/s。即刻记录未添加药物前的纤毛摆动影像,每只大鼠随机在鼻中隔黏膜上选取5 处感兴趣区域(region of interest,ROI) 测量CBF,取平均值,代表这只大鼠CBF 基础值。然后在试验组大鼠的鼻黏膜表面分别滴加0.1 µL 的布地奈德、糠酸莫米松和丙酸氟替卡松溶液,在对照组大鼠的鼻黏膜表面滴加0.1 µL 的PBS。每间隔5 min 记录1 次纤毛运动的影像,持续观察并记录纤毛运动的情况60 min。
5 离体观察鼻黏膜纤毛运动 将离体观察组大鼠过量麻醉后断头处死,立即解剖鼻中隔黏膜并放置于DMEM 培养液(补充有10%胎牛血清、100 U/mL青霉素钠和100 µg/mL 硫酸链霉素)中。培养基液体刚好不浸没鼻黏膜表面,以避免影响表面黏液,然后放置于上述数码显微系统下观察黏膜表面非边缘区域的纤毛运动,以减少取材切割过程中机械性刺激对纤毛的影响。维持环境恒温恒湿。即刻记录未添加药物前的纤毛摆动影像,随机在鼻中隔黏膜上选取5 处ROI 测量CBF,取平均值,代表这只大鼠离体观察的CBF 基础值。然后在试验组大鼠的鼻黏膜表面分别滴加0.1 µL 鼻用糖皮质激素,在对照组大鼠的鼻黏膜表面滴加0.1 µL PBS。每5 min 记录1 次纤毛运动的影像,持续观察60 min。
6 CBF 的测量和评估 按照Francis 和Lo[15]描述的方法,使用Fiji/ImageJ 软件包处理纤毛运动影像。沿纤毛运动方向,在感兴趣的纤毛波上画一条直线,然后使用 “Reslice”功能生成具有波浪图案的图像。测量每个波峰之间的像素数,计算纤毛每秒摆动次数,即CBF (Hz) = 每秒像素/每个波的像素,因为每个像素代表1 帧图像。对于在体和离体观察,每只大鼠的CBF 为该时间点记录的纤毛运动影像中随机5 处ROI 的CBF 平均值。根据Merkus 等[16]的描述将药物对纤毛的抑制程度分为3 类:60 min 后,CBF 恢复到基础值的75%或以上,为纤毛友好;恢复到基础值的25% ~75%,为纤毛抑制;恢复到基础值的25% 或更低,为纤毛停滞。
7 统计学分析 使用GraphPad Prism 9.0 统计软件进行数据分析。符合正态分布的计量数据以x¯±s表示,在体和离体CBF 数据的比较采用t检验。CBF 随时间变化的数据采用重复测量方差分析,组间比较采用Sidak 多重比较检验。P<0.05 为差异有统计学意义。
结 果
1 在 体 和 离 体 观 察鼻 黏膜 的CBF 比 较 在体大鼠鼻黏膜的CBF 显著高于离体鼻黏膜[(9.83 ±0.94) Hzvs(6.10 ± 0.91) Hz,P<0.001)]。见图1。

图1 在体与离体观察鼻黏膜的CBF 比较(n=30)Fig.1 Comparison of CBF of nasal mucosa observed in vivo and in vitro (n=30)
2 布地奈德对在体和离体鼻黏膜CBF 的影响在体条件下,鼻黏膜滴加布地奈德后CBF 在60 min内无显著变化。离体条件下,布地奈德加药后造成CBF 即刻下降,于15 min 时下降至最低,为加药前的26.24%,60 min 恢复至基础值的55.38%,且加药后组间各时间点的CBF 与对照组相比差异均有统计学意义(P<0.05)。见图2。
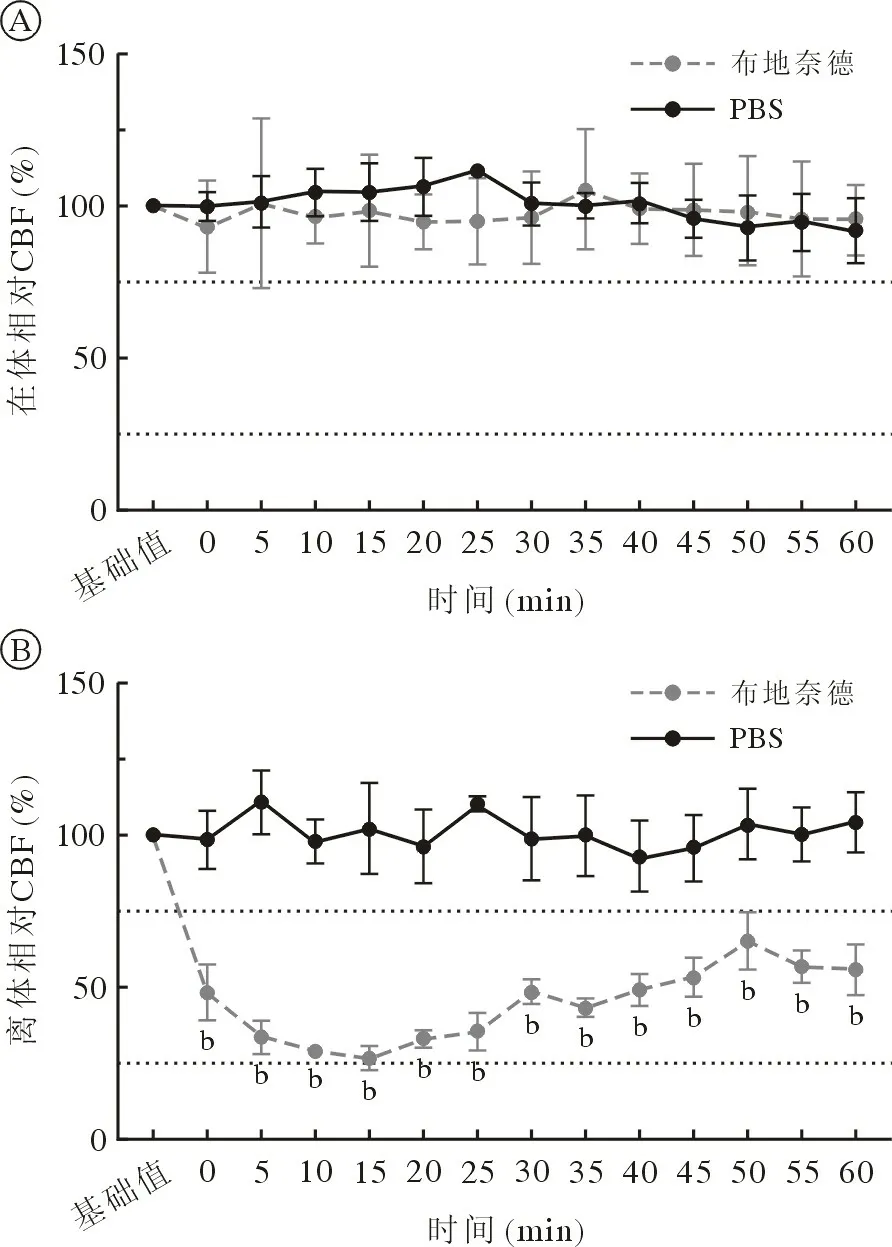
图2 布地奈德和PBS 对在体和离体鼻黏膜CBF 的影响A:布地奈德对在体CBF 的影响;B:布地奈德对离体CBF的影响(n=5;bP<0.01,vsPBS)Fig.2 Effect of budesonide and PBS on CBF of nasal mucosa in vivo and in vitro A: Effect of budesonide on CBF in vivo; B: Effect of budesonide on CBF in vitro (n=5; bP<0.01, vsPBS)
3 糠酸莫米松对在体和离体鼻黏膜CBF 的影响在体条件下,鼻黏膜滴加糠酸莫米松后CBF 在60 min 内无显著变化。而离体条件下,糠酸莫米松在60 min 内造成CBF 缓慢而持续的下降,于60 min 时降至最低,为加药前的44.11%,且加药5 min 后组间各时间点的CBF 与对照组相比差异均有统计学意义(P<0.05)。见图3。
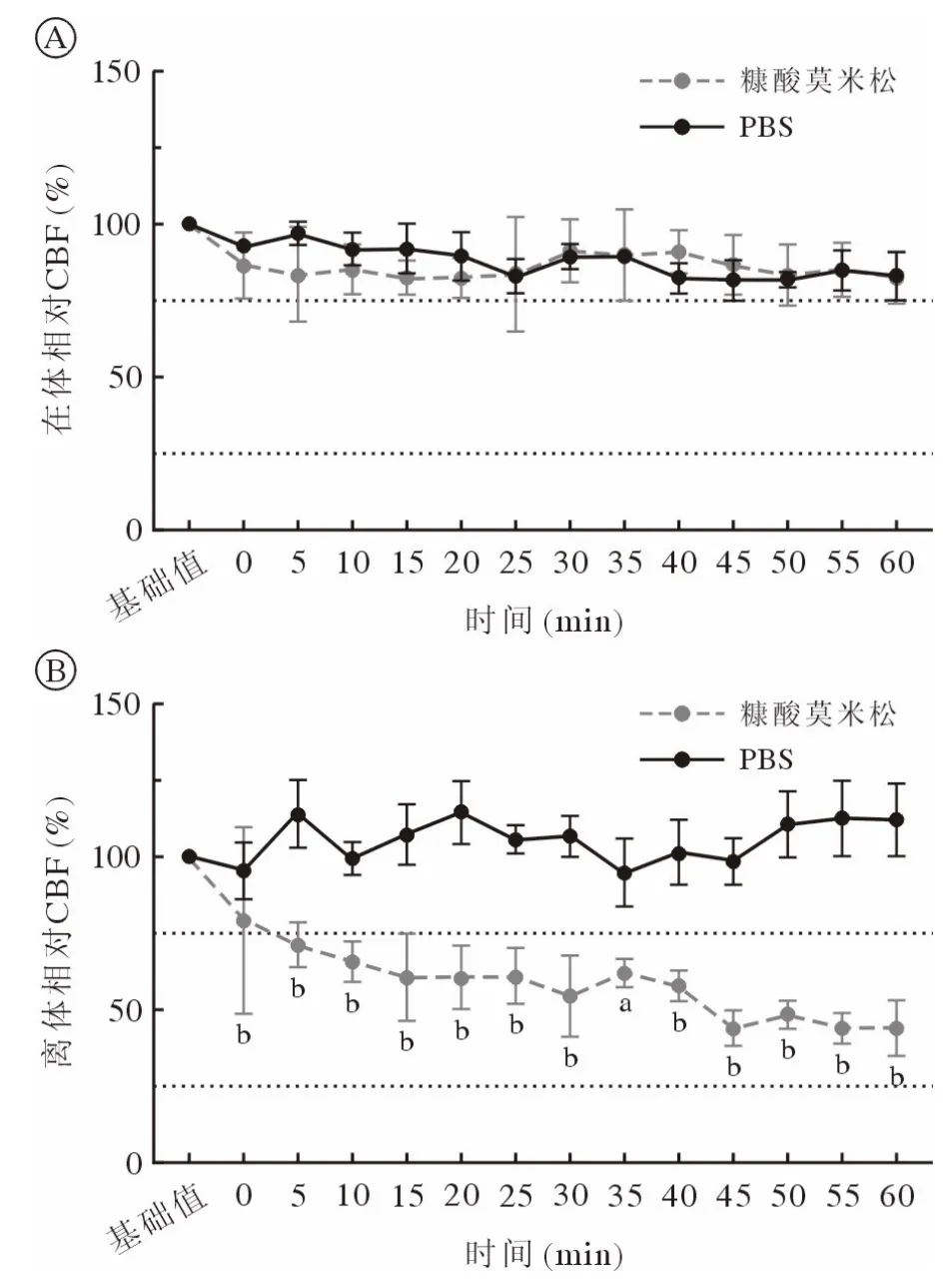
图3 糠酸莫米松和PBS 对在体和离体鼻黏膜CBF 的影响A:糠酸莫米松对在体CBF 的影响;B:糠酸莫米松对离体CBF 的影响(n=5;aP<0.05,bP<0.01,vsPBS)Fig.3 Effect of mometasone furoate and PBS on CBF of nasal mucosa in vivo and in vitro A: Effect of mometasone furoate on CBF in vivo; B: Effect of mometasone furoate on CBF in vitro (n=5; aP<0.05, bP<0.01, vsPBS)
4 丙酸氟替卡松对在体和离体鼻黏膜CBF 的影响 在体条件下,鼻黏膜滴加丙酸氟替卡松后CBF在60 min 内无显著变化。离体条件下,丙酸氟替卡松在60 min 内使CBF 呈波动式下降,在60 min时抑制程度为加药前的67.81%,且在加药0 ~ 5 min和20 ~ 60 min 时,组间各时间点的CBF 与对照组相比差异均有统计学意义(P<0.05)。见图4。
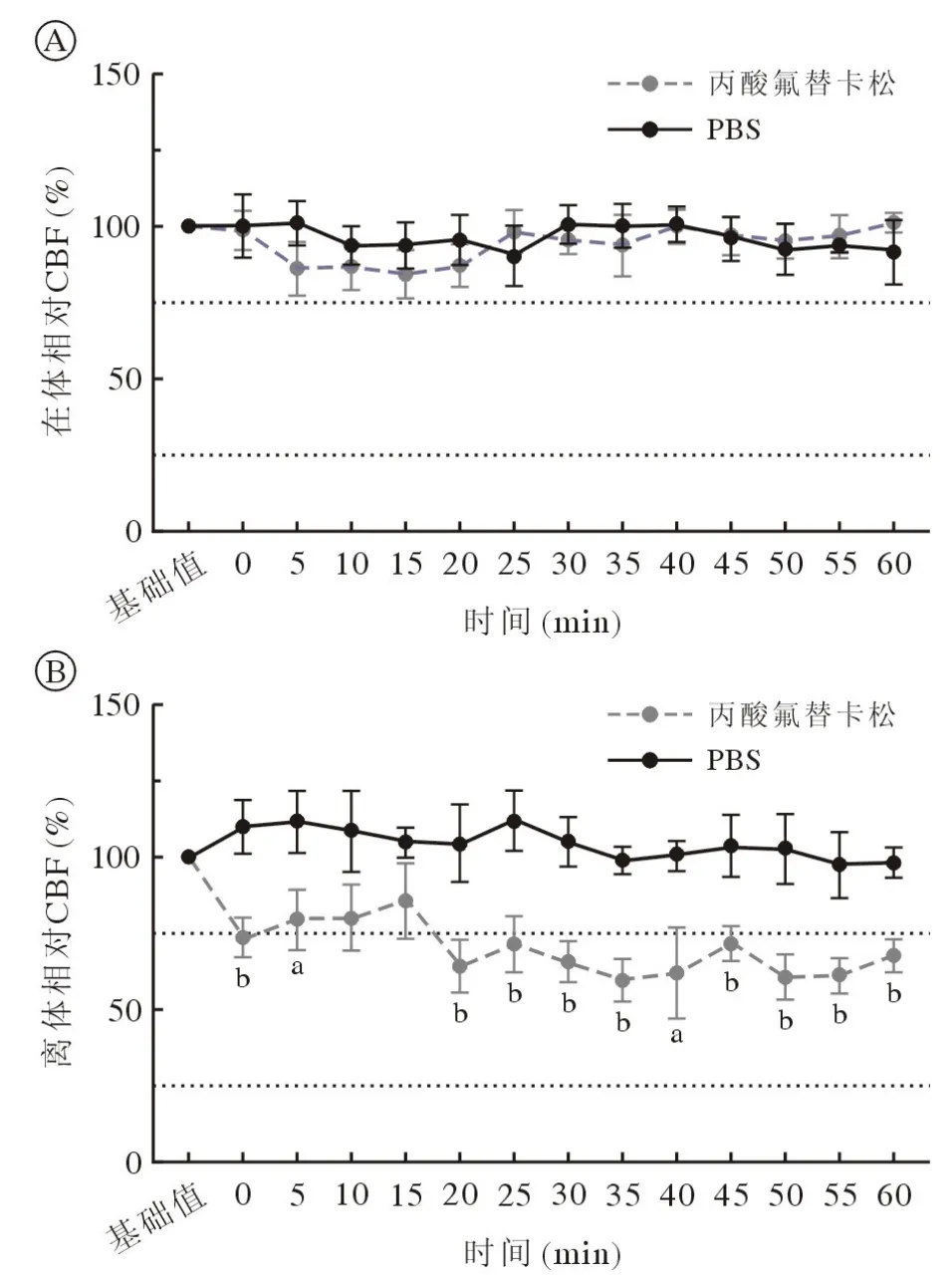
图4 丙酸氟替卡松和PBS 对在体和离体鼻黏膜CBF 的影响A:丙酸氟替卡松对在体CBF 的影响;B:丙酸氟替卡松对离体CBF 的影响(n=5;aP<0.05,bP<0.01,vsPBS)Fig.4 Effect of fluticasone propionate and PBS on CBF of nasal mucosa in vivo and in vitro A: Effect of fluticasone propionate on CBF in vivo; B: Effect of fluticasone propionate on CBF in vitro (n=5; aP<0.05,bP<0.01, vsPBS)
讨 论
本研究结果发现,在体与离体鼻黏膜纤毛运动有差异,在体CBF 基础值显著高于离体,这与本课题组既往研究结果一致[13]。主要原因是离体组织局部生理环境的改变,如Ca2+浓度、ATP、pH 值及乙酰胆碱等[17-18];取材过程造成的机械性刺激可能是另一重要的影响因素。本研究的离体实验中,培养基没有淹没和破坏鼻黏膜表面的黏液层,有效减少了鼻黏膜生物结构的变化。观察的目标是位于鼻黏膜表面的纤毛,而不是组织边缘或单个纤毛细胞表面的纤毛,因此有效减少了机械性刺激的干扰。但离体组织周围的生物成分改变,如Ca2+浓度降低,可能会导致Ca2+内流减少,影响细胞内Ca2+的周期性震荡所产生的纤毛同步的异相波,鼻黏膜的CBF 会受到显著抑制[17]。同时,离体组织失去了局部的血液循环和神经调控,组织缺氧会造成细胞酸化以及纤毛直接供能物质ATP 锐减[17]。这些因素均可能是引起CBF 基础值下降的原因。
本研究首次评估了临床常用的3 种鼻用糖皮质激素——布地奈德、糠酸莫米松和丙酸氟替卡松鼻喷激素对大鼠在体和离体鼻黏膜纤毛功能的影响。结果发现,相较于离体组,鼻用糖皮质激素对在体纤毛CBF 无显著影响。本研究采用新型数码显微系统观察和分析在体鼻黏膜纤毛运动,实验操作过程对纤毛正常的生理状态干扰较小,相较于既往研究更接近纤毛运动的实际情况[13],有助于在实际临床中进一步探究鼻用糖皮质激素的纤毛毒性。既往临床研究中,Atar 等[19]采用糖精试验发现,布地奈德、糠酸莫米松和丙酸氟替卡松对人体MCC 无显著影响,与本研究的在体动物实验结果一致[7,20]。Naclerio 等[21]采用放射性粒子示踪技术,发现布地奈德会改善过敏性鼻炎患者的MCC,糠酸莫米松则对MCC 无影响,但这些临床试验无法从微观角度直接观察纤毛的实时运动情况。本研究为进一步精准评价鼻用药物的安全性提供了新的方法及数据支持。在离体实验中,我们将未稀释的鼻用糖皮质激素直接作用于鼻黏膜表面,发现60 min 内鼻用糖皮质激素可造成CBF 显著抑制。其中,布地奈德表现为可逆的纤毛抑制作用,而糠酸莫米松和丙酸氟替卡松则对CBF 呈现持续且不可逆的纤毛抑制作用。这些实验结果与既往的研究结果一致[6-7]。在体鼻黏膜不断分泌黏液,稀释并向外传输滴加在鼻黏膜表面的药物,减少药物与原位纤毛的接触时间,使药物作用时间变短。但离体鼻黏膜组织失去了分泌黏液的生理功能,且离体黏膜表面纤毛周围黏液层的生理结构不再完整,这可能也是离体鼻黏膜CBF 无法完全恢复的原因之一。
目前,各种离体评价方法,如离体组织、原代培养、气液界面培养及类器官等已广泛应用于鼻内制剂安全性的研究,但均存在不足:纤毛上皮组织在取材时会受到机械性破坏从而引起纤毛继发性运动障碍[22];原代培养的纤毛细胞表面缺乏黏液层,纤毛直接暴露于药物中[10];气液界面培养物的黏液层会过度聚集,更换培养基或添加药物后,会冲洗黏液导致CBF 增加,而24 h 内黏液再生会抑制CBF[23]。同时,由于药物在培养基内持续存在,可能会对纤毛造成持续性的影响。因此,本研究在维持纤毛原有生理环境完整性的前提下,直接观察并分析活体动物鼻黏膜上的纤毛运动,实现了对纤毛运动进行高质量、实时、稳定、微观的在体成像。该研究结果可作为鼻用药物临床前研究的在体数据的有效补充。
本研究的局限性是建立动物观察模型过程中存在有创的手术操作,只能进行一次性实验,无法继续观察药物重复暴露对CBF 的影响。本研究的在体研究结果在60 min 内表现出很好的稳定性,但由于建模方法的限制,无法观察到药物对纤毛的长期影响。已知研究表明,人类正常的黏液纤毛传输时间不超过 30 min[24]。因此,我们认为60 min 的实验观察时间是充足的。
鼻用糖皮质激素是鼻内给药的经典代表。鼻内给药不仅用于鼻腔局部疾病的治疗,还应用于全身治疗及中枢神经系统疾病的治疗[25-26]。在鼻用药物及配方应用于人体前,需采用动物研究评估其安全性。本研究所使用的在体评估系统为鼻用药物安全性和纤毛毒性研究提供了一种更客观的评价手段。同时,该方法也为直接观察人体鼻黏膜纤毛运动提供了更多的可能性,若能改良成像系统,使其具备类似鼻内镜的形态和功能,将有望发展为一种能够广泛开展的客观定量的临床检查手段,极大地提高纤毛相关疾病的临床诊断能力。
综上所述,本研究通过新型数码显微成像系统观察,发现布地奈德、糠酸莫米松和丙酸氟替卡松对离体观察的大鼠鼻黏膜的纤毛运动均产生了不同程度的抑制作用,而对在体观察的大鼠鼻黏膜纤毛运动并无显著的影响。这表明鼻用糖皮质激素无显著的纤毛毒性,具有良好的安全性;同时本研究所使用的在体评估系统弥补了离体观察与机体真实环境差异较大的不足,可用于客观评价鼻用药物的安全性和纤毛毒性。
作者贡献易文琪、刘晨:实验设计,实施实验,数据分析,数据解释,文章撰写;徐铭鸿、逄川:实验设计,数据解释,文章内容修改;王瑾、董思淇:实验设计,数据解释,提供实验试剂、经费和技术支持;陈雷:实验设计,数据解释。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:yiwenqi_028@163.com。
