全氟化碳雾化吸入对大鼠海水吸入性肺损伤治疗作用研究
2023-08-08程志鹏刘金霞苏程程梁志欣
程志鹏,刘金霞,苏程程,梁志欣
解放军总医院第一医学中心呼吸与危重症医学科,北京 100853
海水淹溺是意外伤害和死亡的常见原因之一。人体吸入海水后,海水的高渗性作用及吸入后引起的机体缺氧会引起肺部剧烈的炎症反应、氧化应激和细胞凋亡[1],进一步引发海水吸入性肺损伤,其病情凶险,致死率高[2],目前无有效治疗措施。全氟化碳(perfluorocarbon,PFC)是一种由氟和碳组成的化合物,常温下为无色无味的透明液体,性质稳定,其表面张力低,携氧能力强,在多种急性肺损伤模型中发挥抗炎、抗氧化应激、改善肺水肿和肺泡-毛细血管通透性的作用[3-5]。本研究尝试建立大鼠海水吸入性肺损伤模型,并应用全氟化碳雾化进行干预,通过组织病理学、肺泡毛细血管通透性、氧化应激和炎性指标的测定,探讨全氟化碳雾化吸入对海水吸入性肺损伤的治疗作用。
材料与方法
1 实验动物 健康雄性SD 大鼠48 只,体质量240 ~ 260 g,6 ~ 7 周龄,由解放军总医院第一医学中心动物中心提供。实验通过解放军总医院第一医学中心动物伦理委员会许可(编号:SQ2022492)。
2 主 要 试 剂 和 仪 器 全 氟 化 碳 C8F18(上 海 华捷视医疗设备有限公司);大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α) 酶联免疫吸附试验(ELISA)试剂盒(北京阳光英锐生物科技有限公司);大鼠白细胞介素(interleukin,IL)-1β、IL-6 酶联免疫吸附试验试剂盒(北京德洛思生物技术有限公司);总超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(北京乾兆信业生物科技有限公司);伊文思蓝染料(北京索莱宝生物科技有限公司);甲酰胺(北京阳光英锐生物科技有限公司);实验器材:大鼠肺部微液体量雾化器(上海玉研科学仪器有限公司,见图1)。Multiskan Spectrum 酶标仪(Thermo Electronf 公司)。雅培便携式血气分析仪I-STAT300 (美国雅培i-STAT 公司)。实验海水按照中国国家海洋局第三海洋所海洋化学研究室提供的我国东南沿海海水主要成分配置:NaCl 26.518 g/L,MgCl22.447 g/L,MgSO43.305 g/L,CaCl21.141 g/L,KCl 0.725 g/L,NaHCO30.202 g/L,NaBr 0.083 g/L。

图1 大鼠肺部微液体量雾化针及雾化效果图F ig.1 MicroSprayer aerosolizer and its effect
3 动 物 模 型 制 备 及 分 组 使 用10% 水 合 氯 醛(2 mL/kg)腹腔注射麻醉,仰卧位固定,逐层切开颈部皮肤,暴露并切开气管后,置入18 G 气管插管,以2 mL/kg 剂量在气管内滴注人工海水,4 min 内完成。灌注后大鼠立即出现呼吸困难,口唇发绀,经气管插管喷出粉红色泡沫样液体,立即行右侧股动脉穿刺采血,测定动脉氧分压(PaO2)。如大鼠造模后死亡,记录死亡数量,计算致死率(致死率=死亡数/海水吸入总数,海水吸入总数 =SW、SP 组大鼠数量 + 死亡大鼠数量)。
32 只雄性SD 大鼠适应性喂养3 d 后,按照随机数字表法分为0.9% 氯化钠注射液组(N 组)、PFC 雾化吸入组(P 组)、海水吸入 + 0.9%氯化钠注射液组(SW 组)、海水吸入 + PFC 雾化吸入组(SP 组),每组8 只。SW组和SP 组大鼠在造模后30 min,用肺部微量液体雾化器给予0.9%氯化钠注射液(2 mL/kg)和PFC (2 mL/kg),造模4 h 后暴露胸腔,心脏穿刺放血处死大鼠。N 组和P 组不进行肺损伤处理,气管插管后30 min 分别用肺部液体定量雾化器注入0.9%氯化钠注射液(2 mL/kg)和PFC (2 mL/kg),气管插管4 h 后暴露胸腔,心脏穿刺放血处死大鼠。
4 血清炎症因子、氧化应激因子检测 大鼠处死后心脏穿刺采血3 mL 于促凝管内,4℃冰箱内静置30 min,3 000 r/min 离心10 min,取上清,按照ELISA 试剂盒说明书检测血清L-1β、IL-6、TNF-α、髓过氧化物酶(myeloperoxidase,MPO)、SOD、丙二醛(malondialdehyde,MDA)含量。
5 肺泡灌洗液炎症因子检测 大鼠采血后,剪开胸部皮肤及胸壁,暴露右侧肺门,止血钳结扎右侧肺门,5 mL 4℃ 0.9%氯化钠注射液分3 次注入气管插管灌洗,每次将0.9%氯化钠注射液在肺内保留1 ~ 2 min 后缓慢抽出,获取肺泡灌洗液后过滤、离心,取上清测定IL-1β、IL-6、TNF-α 含量。
6 肺组织病理学观察 取右肺下叶,10%中性甲醛固定48 h,经过常规脱水、石蜡包埋、切片,HE 染色后光镜下观察肺组织病理变化。分别从中性粒细胞浸润、间质水肿、出血和透明膜形成这4 个方面对肺损伤严重程度评分(正常:0 分;轻度:1 分;中度:2 分;重度:3 分;极重度:4 分),将各方面评分合并起来得到肺损伤评分[6]。
7 肺泡-毛细血管通透性检测 通过测定支气管肺泡灌洗液中的蛋白质含量、伊文斯蓝和肺湿干比来评估肺泡-毛细血管屏障的通透性。BCA 法测定肺泡灌洗液蛋白含量。取右肺上叶,0.9%氯化钠注射液冲洗后,用滤纸吸取表面液体和血液,称重并记录为湿重。随后将其放入65℃恒温烘干箱中烘干72 h 后称重记为干重,计算肺湿/干比。16 只雄性SD 大鼠,随机分为4 组(分组及处理同上),每组4 只。于处死前30 min 经右侧股静脉注射2%伊文斯蓝染料(20 mg/kg),处死后立即用0.9%氯化钠注射液心脏灌注直至血液变清亮,分离肺组织称重,置入99.5% 甲酰胺溶液(4 mL/g 组织)中,37℃避光孵育48 h,5000 r/min 离心30 min后取上清液,在620 nm 波长下用分光光度法测定组织浸出液中伊文思蓝含量。
8 统计学处理 采用SPSS 23.0 软件进行统计分析,计量资料以x¯±s表示,多组间均数比较采用单因素方差分析,两两比较采用Turkey 法。采用GraphPad Prism 9 软件绘图。P<0.05 为差异有统计学意义。
结 果
1 建模情况 本实验共计54 只SD 大鼠(入组48 只大鼠,死亡6 只),其中SW 组、SP 组大鼠共30 只(造模成功24 只,死亡6 只)。大鼠海水吸入后出现呼吸暂停,持续3 ~ 6 s 后呼吸恢复,出现呼吸费力、浅快,气管插管见大量泡沫样液体溢出,行右侧股动脉穿刺,测动脉血气PaO2<60 mmHg (1 mmHg=0.133 kPa),提示建模成功。
2 PFC 雾化吸入可改善大鼠海水吸入性肺损伤炎症反应 与N 组相比,SW 组血清和肺泡灌洗液中TNF-α、IL-1β、IL-6 水平显著升高(P<0.05,图2);SP 组血清和肺泡灌洗液中TNF-α、IL-1β 水平较SW 组降低(P<0.05,图2);血清IL-6 水平在SW 组与SP 组间差异无统计学意义(P>0.05,图2)。提示海水吸入促进大鼠肺部炎症反应,而全氟化碳雾化吸入可减轻大鼠肺部炎症反应。

图2 各组大鼠血清和肺泡灌洗液中TNF-α、IL-1β、IL-6 浓度F ig.2 Concentration of TNF-α, IL-1β and IL-6 in BALF of the rats in each group
3 PFC 雾化吸入可改善大鼠海水吸入性肺损伤氧化应激 与N 组相比,SW 组血清中MPO、MDA水平升高,SOD 降低;SP 组血清MDA 水平较SW组降低、SOD 水平较SW 组升高(P<0.05,图3);血清MPO 水平在SW 组与SP 组间差异无统计学意义(P>0.05,图3)。提示海水吸入后大鼠氧化应激反应激活,PFC 雾化吸入可抑制氧化应激。

图3 各组大鼠血清MPO、MDA、SOD 浓度Fig.3 Sera MPO, MDA and SOD concentration of the rats in each group
4 PFC 雾化吸入可缓解大鼠海水吸入性肺损伤与N 组相比,SW 组大鼠肺损伤评分显著升高(P<0.05),具体表现在肺组织内大量中性粒细胞浸润,肺泡间隔增宽、纤维化,伴有明显肺泡出血、水肿、塌陷。SP 组大鼠肺损伤较SW 组显著减轻(图4),肺损伤评分降低(P<0.05)(图5),提示PFC 雾化吸入可改善大鼠海水吸入后肺损伤。
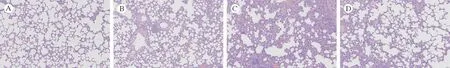
图4 各组大鼠肺组织HE 染色病理结果(200×)Fig.4 HE staining pathological results of lung tissues of rats in each group (200×)
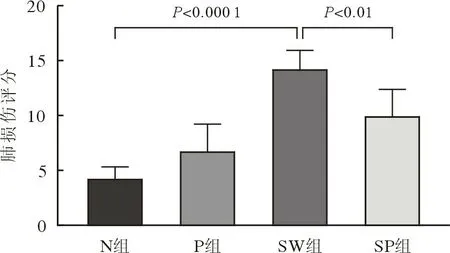
图5 各组大鼠海水吸入性肺损伤病理评分Fig.5 Pathological score of seawater inhalation lung injury in the rats of each group
5 PFC 雾化吸入可改善海水吸入性肺损伤大鼠肺水肿、肺泡-毛细血管通透性 与N 组相比,SW 组大鼠肺湿干比、肺泡灌洗液蛋白含量、肺组织伊文思蓝含量显著升高(P<0.05,图6、图7、图8);SP 组大鼠肺干湿比、肺组织伊文思蓝含量较SW 组降低(P<0.05,图6、图7、图8);肺泡灌洗液蛋白含量在SW 组与SP 组间差异无统计学意义(P>0.05,图6)。提示海水吸入可引起大鼠肺组织毛细血管通透性增加,PFC 雾化吸入可改善海水吸入后大鼠肺血管通透性。

图6 各组大鼠肺组织湿干比和肺泡灌洗液蛋白含量Fig.6 Wet-to-dry ratio and alveolar lavage fluid protein content oflung tissues in the rats of each group
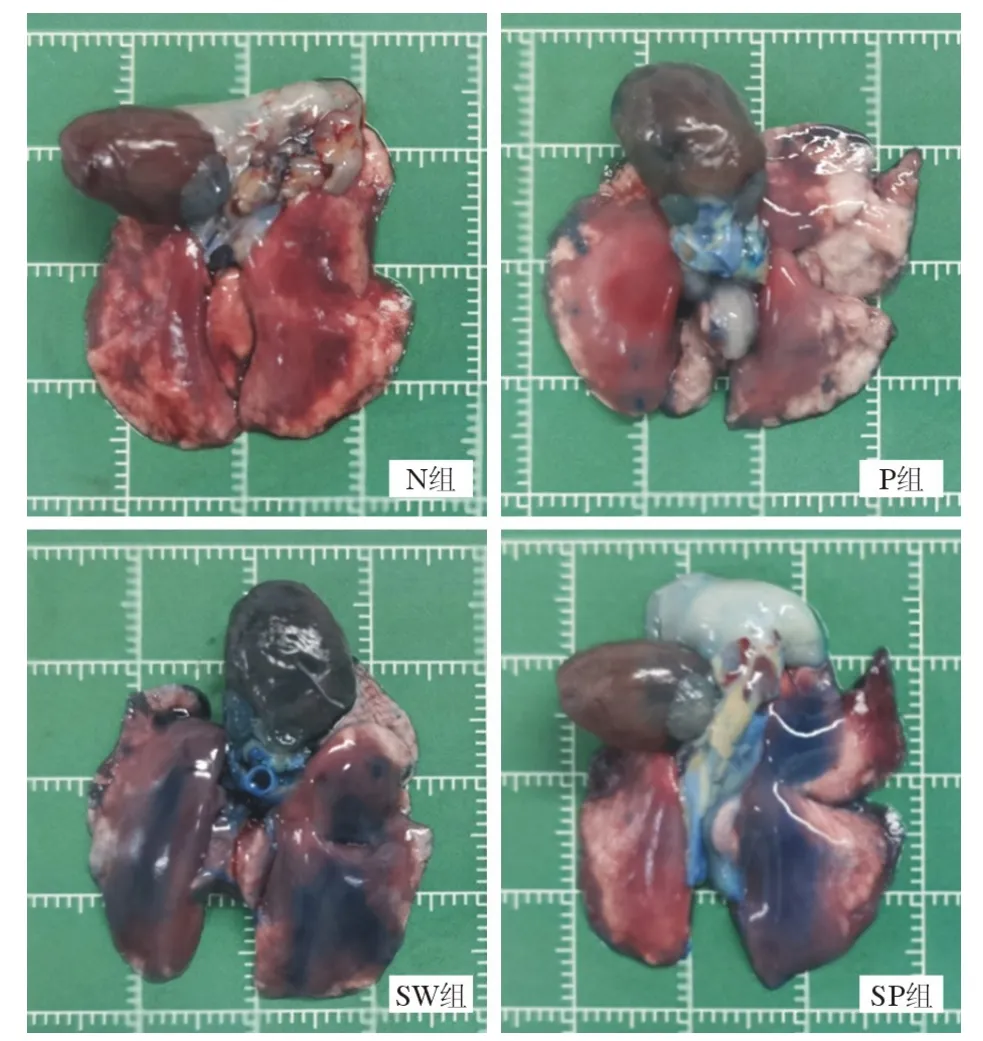
图7 各组大鼠肺组织伊文思蓝染色后肺标本Fig.7 Lung specimens after Evans blue staining of lung tissues inthe rats of each group
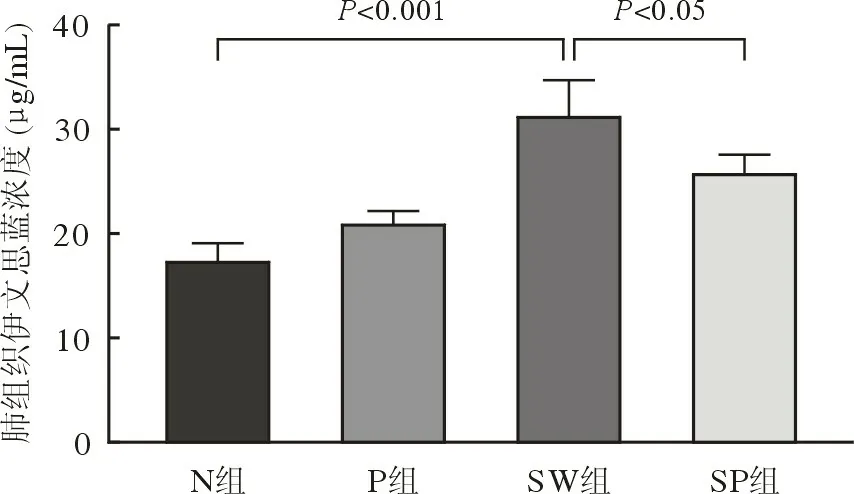
图8 各组肺组织伊文思蓝含量F ig.8 Evans blue content level in lung tissues of each group
讨 论
海水吸入性肺损伤是临床急危重症,救治难度大,致死率高,目前针对海水吸入性肺损伤治疗主要采用肺泡灌洗、机械通气、气管功能支持等,但整体存活率仍较低[1-7]。PFC 具有良好的气溶特性及抗炎、抗氧化作用,动物实验发现PFC 气化吸入能改善海水吸入性肺损伤,降低致死率,但PFC 气化吸入需结合呼吸机使用,无法避免呼吸机相关肺损伤,且PFC 用量较大,价格高昂,不利于临床推广。本研究采用肺部微量液体雾化器,可将PFC 雾化并导入大鼠气道,避免了呼吸机相关肺损伤,同时增加了PFC 在气道作用时间,可减少全氟化碳用量。本研究通过构建大鼠海水吸入肺损伤模型,探讨PFC 雾化吸入对海水吸入性肺损伤的治疗作用,以期为海水吸入性肺损伤患者的救治提供新的治疗方法。
本研究中,在大鼠气管内注入人工海水后立即出现呼吸暂停、急促、费力,气管插管大量泡沫样液体溢出,股动脉PaO2<60 mmHg,考虑与海水刺激气道引起气道痉挛、黏液分泌和气道堵塞有关。大鼠肺组织HE 染色可见肺间质水肿、中性粒细胞浸润、肺泡破坏,提示肺损伤,与田冶等[8]的研究结果一致。
本研究显示,与对照组相比,海水吸入后大鼠血清TNF-α、IL-1β、IL-6 水平升高,PFC 雾化吸入显著降低上述炎症因子水平,提示PFC 雾化吸入能抑制海水吸入引起的肺部炎症反应,改善肺部病理进展。研究发现,海水吸入可通过刺激HIF-1α 表达,进而通过“HIF-1α-VEGF-肺血管通透性-肺水肿”和“HIF-1α-前炎症因子(TNF-α、IL-1β、IL-6)-肺组织炎症反应”两条通路引起肺组织炎症[9-10],肿瘤相关研究发现PFC 具有抑制HIF-1α作用[11-12],但PFC 能否通过抑制HIF-1α 表达改善海水吸入性肺损伤炎症反应需进一步研究。
MDA 为氧自由基攻击生物膜的产物,其水平可间接反映机体细胞受氧自由基攻击的严重程度[13-14]。MPO 是中性粒细胞内合成的重要杀菌物质,可利用过氧化氢和氯离子产生次氯酸盐,并形成具有氧化能力的自由基。MDA 和MPO 均可提示体内过度氧化应激状态。SOD 是体内重要的抗氧化酶,可快速清除过量的活性氧,减轻组织损伤。本研究发现,与N 组相比,SW 组MPO 活性、MDA 含量升高,SOD 活性降低,PFC 雾化吸入后能显著降低MPO 活性、MDA 浓度,并提升SOD 活性,提示PFC 雾化吸入能抑制海水对肺组织的氧化应激损伤。
肺毛细血管通透性增高是急性肺损伤的主要病理特征之一。静脉注射伊文思蓝染料并测定其组织含量是目前国内外常用的观察毛细血管通透性的方法[15-16]。伊文思蓝是一种常用的偶氮染料制剂,在血液中与血浆白蛋白有很高的亲和力,正常状态下血浆白蛋白无法通过毛细血管屏障。当毛细管管通透性增高时,伊文思蓝可随着血浆白蛋白进入组织间隙。本研究发现大鼠海水吸入4 h 后,肺组织伊文思蓝含量和肺泡灌洗液蛋白含量较N 组显著增高,说明其毛细血管通透性增高,与Pang 等[17]对肺泡毛细血管通透性研究结果一致。本研究在给予PFC 雾化吸入后,可显著改善毛细血管通透性。另外,由于高渗性海水进入肺泡腔,毛细血管中的水分迅速进入肺组织和肺泡腔,引起肺水肿[1]。本研究中海水吸入组湿干比较对照组高,提示肺水肿,而PFC 雾化吸入后可改善肺水肿,与既往研究一致[18]。肺泡基底膜的是维持血管通透性重要成分,中性粒细胞分泌的基质金属蛋白酶9 可降解基底膜蛋白,导致血管通透性增高[19]。研究表明,全氟化碳可抑制海水淹溺兔肺部基质金属蛋白-9,改善肺血管通透性和肺损伤[20]。另外,肺泡上皮细胞膜Na+通道含量下降与海水淹溺所致肺血管通透性增高有关,PFC 能促进上皮细胞Na+通道表达,可能也参与了PFC对海水淹溺所致肺血管通透性干预性作用。
本研究表明,全氟化碳雾化吸入能改善大鼠海水吸入性肺损伤,可能与调节炎症反应、氧化应激状态和肺泡毛细血管通透性有关。
作者贡献程志鹏:总体构思,进行实验,数据分析处理,文章撰写;刘金霞、苏程程:协助实验;梁志欣:监督指导,方法设计,资金获取。
利益冲突所有作者声明无利益冲突。
数据共享声明本篇论文相关数据可依据合理理由从作者处获取,Email:chengzhipeng301@163.com。
