产环糊精葡萄糖基转移酶苦橙内生细菌的分离鉴定
2023-08-08朱国威李丽芬傅楠楠李子院柴寿海李海云
朱国威,李丽芬,傅楠楠,李子院,柴寿海,李海云*
(1.桂林理工大学化学与生物工程学院,广西 桂林 541004;2.广西桂林鹏宇兄弟柑桔产业开发有限责任公司,广西 桂林 542500)
环糊精(cylcodextrin,CD)是环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase,CGTase)通过催化可溶性淀粉得到的不同分子量的环状低聚糖[1],其中基础环糊精为α-CD、β-CD 和γ-CD,含有不同的葡萄糖基分子[2-3]。CGTase 是一种能够通过分子内转糖基化反应催化淀粉及相关物质合成环糊精的胞外酶[4-5],隶属糖基水解酶[6],CGTase 是一种多功能酶,可催化4 种不同的反应类型,包括歧化反应、环化反应、偶合反应和水解反应[7]。其中环化反应主要功能为催化分子内转糖基反应,是环糊精葡萄糖基转移酶最基本的特征反应;而偶合反应的作用机理是打开环糊精的环,和环化反应相反,利用部分片段与直链麦芽低聚糖相结合;歧化反应又可以打开直链麦芽低聚糖,将目的片段和其他受体结合,相互结合共同催动天然产物的转糖基反应[8]。除生产环糊精和功能性寡糖,环糊精葡萄糖基转移酶还可以催化糖基化反应,对黄酮类化合物如芦丁、橙皮苷等黄酮类化合物进行酶法改造,从而改善其理化性质[9],广泛应用在农业、食品工业、化妆品、药品等诸多领域。目前获取CGTase 的途径为利用产酶菌株直接发酵[10]、对菌株的目的基因片段克隆表达、利用基因构建技术对目的特殊片段进行改变[11]。Martins 等[12]筛选出产环糊精葡萄糖基转移酶菌株黏琼脂芽孢杆菌(Bacillusagaradhaerens)酶活力为0.31U/mL。张佳瑜等[13]筛选出产α-CGTase 菌株浸麻类芽孢杆菌(Paenibacillus macerans),并对该菌株基因片段克隆优化,酶活力由1.9 U/mL 提升到4.5 U/mL。雷新辉[14]筛选菌株产酸克雷伯氏菌(Klebsiella oxytoca)通过基因诱变,酶活力由0.64 U/mL 提升到了5.68 U/mL。
柑橘属是一种芸香科植物[15],果中含有大量黄烷酮、黄酮和多甲氧基黄酮等物质[16],提取物多用于食品、医药等行业[17-18],而苦橙属于柑橘属,果内含有丰富橙皮苷、柚皮苷、川陈皮素等黄酮类化合物[19],具有抗氧化、抗菌、提高免疫力等多种功效。利用环糊精葡萄糖基转移酶对柑橘黄酮进行糖基化结构修饰有望拓展其应用[20]。研究表明,内生菌不仅获得了与宿主产生相同或相似产物的能力,还具有产生宿主所不能产生的物质的能力,包括物质代谢、能量代谢和生物转化[21]。本研究从苦橙内生细菌中分离筛选高产CGTase的菌株,以期为环糊精的多元化开发及柑橘黄酮类物质的糖基化结构修饰提供新的菌株来源。
1 材料与方法
1.1 材料与试剂
苦橙(Citrus aurantium Linn.):2021 年9 月采摘于广西壮族自治区桂林市永福县苏桥镇。
LB 培养基:蛋白胨10 g、氯化钠10 g、酵母粉5 g、琼脂15 g,加水定容至1 L,pH7.1~7.2。
淀粉-碘筛选培养基:可溶性淀粉10 g、琼脂20 g,水定容至1 L,121 ℃高温灭菌后,单个平板加入20 mL戈卢布碘液浸泡过夜。
酚酞-甲基橙筛选培养基:可溶性淀粉10 g、K2HPO40.2 g、酵母膏5 g、MgSO4·7H2O 0.2 g、酚酞0.3 g、蛋白胨5 g、甲基橙0.1 g、琼脂10 g,水定容至1 L,121 ℃高温灭菌15 min 后添加Na2CO30.2 g。
产酶液体培养基:K2HPO40.2 g、可溶性淀粉10 g、MgSO4·7H2O 0.2 g、蛋白胨5 g、Na2CO30.2 g、酵母膏5 g,水定容至1 L,自然pH 值,121 ℃灭菌15 min。
可溶性淀粉、酚酞、甲基橙、蛋白胨、碳酸钙、琼脂、氢氧化钠、酵母膏(均为分析纯):西陇化工有限责任公司;磷酸氢二钾、七水硫酸镁、溴甲酚绿(均为分析纯):天津市大茂化学试剂厂;引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')、1492R(5'-TACGGCTACCTTGTTACGACTT-3')、细菌DNA 提取试剂盒:上海生物工程有限公司。
1.2 仪器与设备
可见分光光度计(VIS-7220N):北京瑞利分析仪器有限公司;电泳仪(JY5000):北京君意东方电泳器有限公司;恒温振荡培养箱(LRH-150-Z):珠江韶关市泰宏医疗器械有限公司;超净工作台(CJ-1SFS):天津市泰斯特仪器有限公司;立式压力蒸汽灭菌器(BXM-30R):上海博讯实业有限公司医疗设备厂;全自动数码凝胶成像系统(Tanon-1600):上海天能科技有限公司;PCR扩增仪(2720-Thermal-Cycler):美国应用生物系统公司;数显恒温水浴锅(HH-S2 型):金坛市医疗仪器厂。
1.3 方法
1.3.1 样品处理
选取健康无病虫害的完整苦橙果实,用清水清洗表皮异物后,将苦橙置于75%乙醇中浸泡1 min,然后用无菌水清洗3 次,吸取100 μL 第3 次清洗液涂布于LB平板培养,检验是否消毒彻底,若有菌生长,需重新对材料消毒[22]。将经表面消毒无菌的苦橙果实置于无菌粉碎机中粉粹后过60 目筛,取适量粉碎物按1∶9(g/mL)加入LB 液体培养基中,在37 ℃培养箱内振荡培养24 h。取培养液1 mL,用无菌水梯度稀释至10-2~10-5,各取100 μL 涂布于甲基橙-酚酞培养基表面,倒置于37 ℃培养箱培养24 h,挑取在红色背景下出现黄色光圈的菌落在LB 固体培养平板进行多次划线纯化直至获得纯菌落。所得菌株编号后,接种于LB 试管斜面保存。
1.3.2 菌株初筛
将分离纯化的苦橙内生细菌接种于LB 培养平板上37 ℃活化12 h,挑取一环接种于50 mL 产酶液体培养基中,37 ℃、160 r/min 振荡培养24 h 得种子液;种子液按4%接种量接种于装有50 mL 产酶液体培养基的250 mL 锥形瓶中,37 ℃、160 r/min 振荡培养72 h 后,4 ℃、5 000 r/min 离心10 min,取上清液,即为粗酶液,置4 ℃冰箱保存。
制备淀粉-碘、酚酞-甲基橙筛选平板,用打孔器打孔(d=1 cm),并在孔内加入200 μL 粗酶液,置于40 ℃恒温培养箱反应2 h,观察变色圈,计算各透明圈直径/孔径的比值,挑选比值大的菌株进行产酶复筛。
1.3.3 菌株复筛
1.3.3.1 淀粉水解酶酶活的测定
取10 μL 粗酶液于试管中,加入0.2 mL 0.2 mol/L甘氨酸缓冲液(pH9.0),再加入0.2 mL 0.2%可溶性淀粉溶液,充分振荡混匀,置于40 ℃恒温水浴锅中反应10 min 后,立即加入0.5 mL 0.5 moL/L 醋酸终止反应,最后加入3 mL 0.005%碘液,20 ℃保温15 min,测定700 nm 波长处吸光度。以不加酶液为对照组,酶活单位定义为使吸光度下降10%所需的酶量[23]。按下列计算淀粉水解酶酶活。
式中:N 为淀粉水解酶酶活,U/mL;A0为对照组的吸光度;A1为样品组的吸光度;M 为稀释倍数。
1.3.3.2 环化酶酶活的测定
取0.1 mL 粗酶液于干燥试管中,加入0.9 mL 预先用50 mmol/L 磷酸盐缓冲液(pH6)配制的1%可溶性淀粉溶液作为底物,随后让底物和粗酶液充分混合均匀,置于50 ℃恒温水浴激活,反应10 min。分别按下述方法测定α-CGTase、β-CGTase 和γ-CGTase 活性。
加入1.0mL10mol/L 盐酸,加入1.0 mL 用50 mmol/L磷酸缓冲液配制的0.1 mmol/L 甲基橙溶液显色,振荡混合器振荡使显色混合均匀,20 ℃保温15 min,让酶促产物和显色剂充分混合,在505 nm 下测定吸光度,对应标准曲线计算出α-CD 含量并计算酶活[24]。
加入3.5 mL 30 mmol/L NaOH 中断酶促反应,加入0.5 mL 由5 mmol/L Na2CO3溶液配制的0.02%酚酞显色,使用振荡混合器振荡使显色混合均匀,20 ℃保温15 min,让酶促产物和显色剂充分混合,在550 nm 下测定吸光度,对应标准曲线计算出β-CD 含量并计算酶活[25]。
加入50μL1.0mol/L 的盐酸,随后加入2mL0.2mol/L柠檬酸缓冲液(pH4.2)和100 μL 5 mmol/L 溴甲酚绿溶液显色,使用振荡混合器振荡使显色混合均匀,20 ℃保温15 min,让酶促产物和显色剂充分混合,在615 nm下测定吸光度,对应标准曲线计算出γ-CD 含量并计算酶活[26]。
环糊精标准曲线的绘制:分别称取α、β、γ-环糊精标准品各0.5 g,用水溶解定容,配成0.5 mg/mL 环糊精标准溶液,分别吸取0、0.1、0.2、0.3、0.4、0.5、0.6 mL标准溶液用蒸馏水补至1 mL,按照上述方法进行反应,以环糊精含量为x 轴,吸光度为y 轴分别绘制α-CD、β-CD 和γ-CD 标准曲线。
酶活单位定义为每分钟产1 μmol 环糊精所需酶量[27]。
1.3.3.3 菌株生长曲线测定
按照4%接种量,将菌株种子液接种于50 mL/250 mL发酵培养基中,相隔4 h 在600 检测波长下测定吸光度制定生长发育曲线。
1.3.4 菌株鉴定
1.3.4.1 形态学鉴定
将分离纯化后的菌株接种于LB 固体培养基,置于37 ℃培养箱中培养12 h,观察菌落大小、形状、颜色等形态特征,并进行革兰氏染色观察细菌的微观形态[28]。
1.3.4.2 生理生化试验
参照文献[29]方法,对菌株进行淀粉水解、明胶液化、糖(葡萄糖、乳糖、麦芽糖)发酵试验、吲哚试验、甲基红试验、H2S 产生试验等基本生理生化反应试验。
1.3.4.3 分子生物学鉴定
利用细菌总DNA 提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)试剂盒依次对菌株进行DNA 提取和扩增,其中引物为27F 和1492R。PCR扩增程序为95 ℃热变性5 min;94 ℃、40 s;55 ℃、40 s,72 ℃、2 min,循环40 次;72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测合格后,由生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI(https://www.ncbi.nlm.nih.gov/)中心上进行同源性比对分析,并利用MEGA11 软件采用邻接法结合构建系统发育树,确定菌株归属[30]。
2 结果与分析
2.1 菌株初筛结果
通过筛选平板从苦橙内生细菌中分离纯化出4 株内生细菌,菌株编号为KCEB01、KCEB02、KCEB03、KCEB04,菌株淀粉-碘筛选平板显色结果如图1 所示。

图1 苦橙内生细菌淀粉-碘筛选平板褪色结果Fig.1 Results of starch-iodine screening plate of bitter orange endophytes
菌株发酵产淀粉水解酶,水解淀粉使淀粉无法和碘液进行反应生成蓝色背景,光圈越大,所产淀粉水解酶活性越强。如图1 所示,菌株KCEB01、KCEB02、KCEB03 和KCEB04 光圈大小分别为2.3、2.0、2.4 cm和2.9 cm。菌株酚酞-甲基橙筛选平板显色结果如图2 所示。

图2 苦橙内生细菌酚酞-甲基橙筛选平板褪色结果Fig.2 Results of phenolphthalein-methyl orange screening plate of bitter orange endophytes
如图2 所示,菌株所产环糊精能包埋酚酞-甲基橙筛选平板中酚酞而呈现黄色光圈,光圈越大,所产CGTase 酶活性越强。4 株菌株均能通过降解培养基中可溶性淀粉产生环糊精,利用酚酞能够在环糊精的疏水空腔形成无色二价阴离子原理,包合作用形成黄色光圈,菌株KCEB01、KCEB02、KCEB03、KCEB04 光圈分别为1.7、1.5、1.9、2.2 cm。
初筛结果表明所筛的4 株苦橙内生细菌不仅具有水解活性,还具有环化活性,从而确定4 株菌株均可产CGTase 酶。根据酚酞-甲基橙筛选平板及淀粉-碘筛选平板光圈,判断菌株KCEB04 产CGTase 酶活力远超其他3 株,选择菌株KCEB04 进行下一步研究。
2.2 复筛结果
2.2.1 环糊精标准曲线
分别绘制α-CD、β-CD 和γ-CD 的标准曲线,结果如图3 所示。
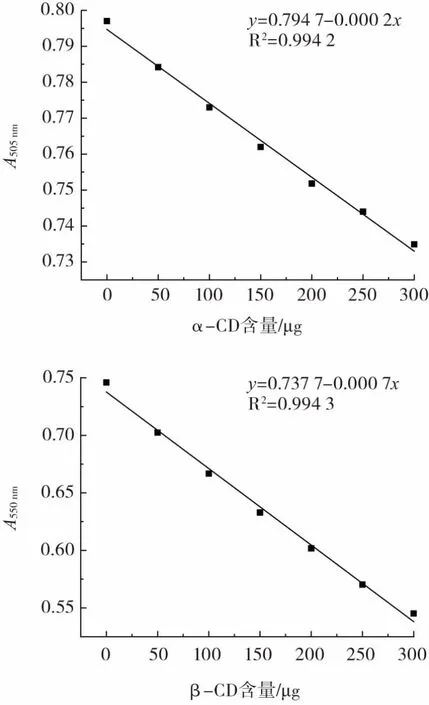

图3 环糊精标准曲线Fig.3 Standard curve of cyclodextrin
如图3 所示,在酸性(pH1.1~1.4)条件下,α-CD 能够包埋甲基橙使其褪色,吸光度随着α-CD 含量的增加而降低,标准曲线呈线性,R2=0.994 2,回归方程为y=0.794 7-0.000 2x,可用于测定样品中α-CD 含量。
在碱性(pH9~10)条件下,β-CD 能够和酚酞形成包结物,使碱性酚酞褪色,吸光度随着β-CD 含量的增加而降低,标准曲线呈线性,R2=0.994 3,回归方程为y=0.737 7-0.000 7x,可用于测定样品中β-CD 含量。
在酸性(pH4.1)条件下,γ-CD 使溴甲酚绿发生增色反应,吸光度随着γ-CD 含量的增加而增加,标准曲线呈线性,R2=0.999 4,回归方程为y=0.279 5+0.000 2x,可用于测定样品中γ-CD 含量。
2.2.2 菌株KCEB04 生长曲线
菌株KCEB04 生长曲线见图4。
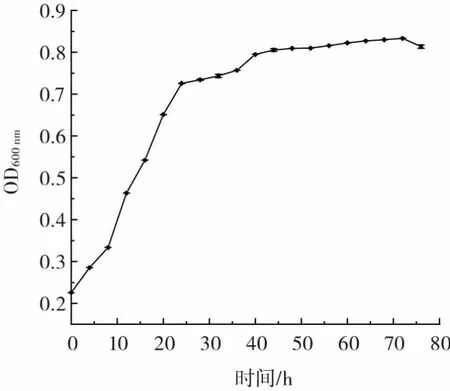
图4 菌株KCEB04 生长曲线Fig.4 Growth curve of strain KCEB04
由图4 可知,菌体在24 h 结束快速增长的对数期,开始趋于平稳状态。在72 h 后菌体开始走向衰亡。
2.2.3 产环糊精葡萄糖基转移酶酶活测定
根据初筛结果得知,菌株KCEB04 具有环化活性和水解活性,而环化活性可作用于淀粉产生α、β、γ-环糊精,在菌株生长的对数期(24 h)和稳定期(72 h)取样测定各种酶酶活,结果见表1。

表1 菌株KCEB04 酶活力测定Table 1 Determination of enzyme activity of strain KCEB04
由表1 可知,菌株在对数期已经产淀粉水解酶及环糊精葡萄糖基转移酶,时间延长到稳定期,酶活力一直处于增加状态,其中α-CGTase 酶活力最高,酶活力在稳定期达到1.65 U/mL,其次为γ-CGTae,酶活力为1.05 U/mL,β-CGTase 酶活力最低,酶活力为0.44 U/mL,而淀粉水解酶在稳定期酶活力为5 884.35 U/mL。
2.3 菌株KCEB04 的形态学及生理生化反应鉴定
菌株KCEB04 菌落形状及革兰氏染色如图5 所示,菌株KCEB04 生理生化特性的测定结果见表2。

表2 菌株生理生化结果Table 2 Biological biochemical results of strains

图5 菌株形态学鉴定Fig.5 Morphological identification of strains
由图5 和表2 可知,菌株KCEB04 分别在筛选培养基及LB 培养基上培养10~12 h,观察菌落近圆形,颜色呈乳白色,有异味,菌落表面光滑、隆起、黏稠,相邻菌落容易发生融合,用接种环挑取出现拉丝现象,革兰氏染色为阴性,显微镜下菌株形态为杆状或短杆状,根据菌株的基本形态学鉴定和菌株特有的生理生化特征,再参考《常用细菌系统鉴定手册》,发现分离出来的菌株KCEBO4 与产酸克雷伯氏菌相似。
2.4 KCEB04 菌株16SrDNA 序列测定及系统发育树分析
KCEB01、KCEB02、KCEB03 和KCEB04 菌株的DNA特异性扩增产物琼脂糖凝胶电泳图如图6 所示。系统发育树见图7。
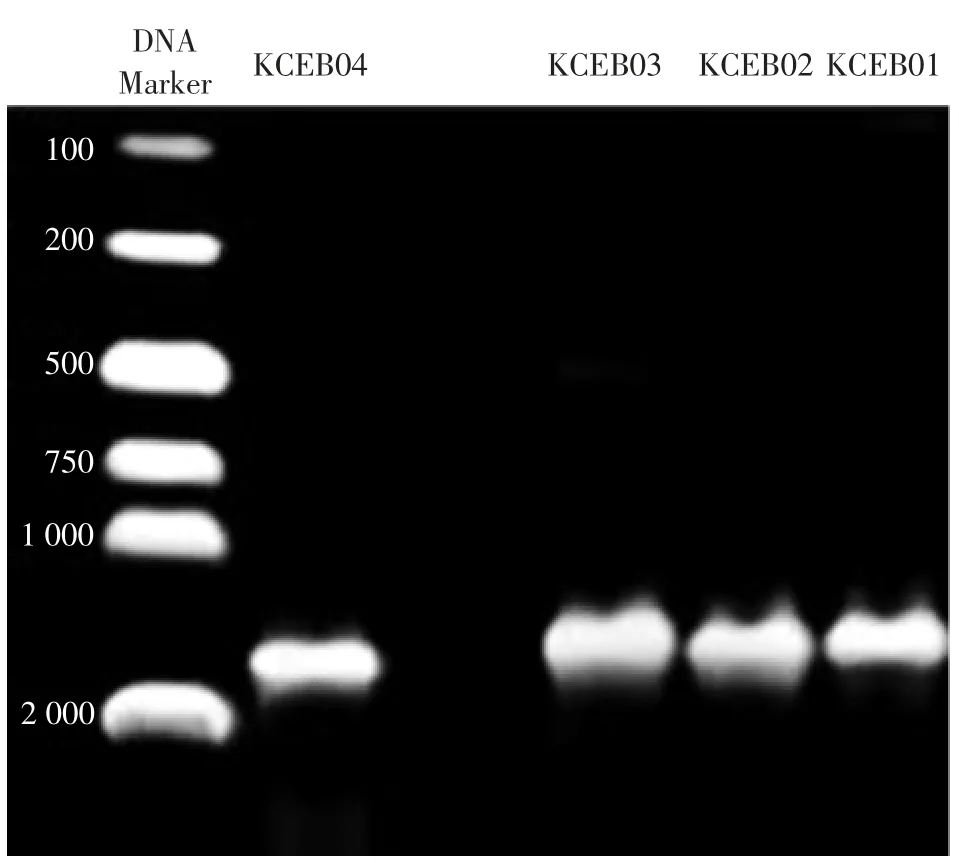
图6 菌株特异性条带Fig.6 Strain specific band

图7 依据16S rDNA 基因序列比对构建的系统发育树Fig.7 Phylogenetic tree construction based on 16S rDNA gene sequence alignment
由图6 可见,扩增后获得核酸片段大小约为1500 bp的目的条带,目的条带未呈现多带拖尾现象特异性强。同源性序列比对分析结果表明,菌株KCEB04 的碱基序列和NCBI 基因库中产酸克雷伯氏菌(Klebsiella oxytoca)的16SrDNA 序列同源性高达99%,而菌株KCEB01、KCEB02、KCEB03 与肺炎克雷伯氏菌(Klebsiella pneumoniae)基因序列同源性相近,结合菌株KCEB04 形态学和生理生化特征,最终确定菌株KCEB04 为产酸克雷伯氏菌(Klebsiella oxytoca)。
3 结论
本试验通过利用酚酞-甲基橙筛选平板以及淀粉-碘筛选平板褪色远离筛选高产CGTase 的菌株KCEB04 通过形态、生理生化反应和16S rDNA 序列测定及系统发育树分析,鉴定菌株KCEB04 为产酸克雷伯氏菌(Klebsiella oxytoca),该菌株以送往微生物保藏中心进行保藏,保藏编号为CGMCCNO.25392,菌株KCEB04 经过实验室摇瓶发酵证实,不仅具有水解酶活还具有环化酶活,作用于1%的可溶性淀粉,该菌株α-CGTase 酶活为1.65 U/mL、β-CGTase 酶活力为0.44 U/mL、γ-CGTase 酶活力为1.05 U/mL、淀粉水解酶活为5 884.35 U/mL。
自然界中产CGTase 的微生物多为芽孢杆菌属,包括软化、环状、嗜热芽孢杆菌等多种微生物,但是大多研究只针对一种环糊精葡萄糖基转移酶研究。本研究对筛选菌株KCEB04 产淀粉水解酶、α-CGTase、β-CGTase、γ-CGTase 进行全面研究,合理并充分开发菌株产酶能力,为环糊精的酶法制备以及黄酮类化合物的转糖基反应提供技术支持,为该菌株的工业化应用提供理论支撑。
