吴茱萸碱对肺癌荷瘤小鼠生长及HIF-1α/VEGF信号通路的影响
2023-08-07张秋莹王小波谢明水
李 玲 刘 杨 夏 凡 张秋莹 王小波 谢明水
(1 湖北医药学院附属随州医院,随州,441300; 2 湖北医药学院附属随州医院转化医学中心,随州,441300)
肺癌是全球发病率最高的恶性肿瘤,占每年新发恶性肿瘤的10%以上,严重威胁人们的生命健康[1]。传统治疗肺癌的手段包括手术、化疗等,而手术治疗存在复发等问题,且很多患者由于发现较晚,错过了手术治疗的最佳时期[2]。化疗药物如顺铂等虽能抑制肿瘤生长,但是存在不良反应大、耐药等问题[3]。因此,开发新的治疗肺癌的药物已成为当今研究的热点。近年来研究发现,一些中药中提取的成分对肺癌具有明显的抑制作用,姜黄素可通过调控PI3K/AKT/mTOR信号通路,抑制肺癌细胞浸润与转移[4],刺五加多糖可通过调控Wnt/β-catenin信号通路,对非小细胞肺癌细胞增殖及转移发挥抑制作用[5],灵芝孢子粉及其提取物可通过抑制血管生成,降低肺癌荷瘤小鼠肿瘤生长[6]。吴茱萸碱是中药吴茱萸中主要的生物碱类物质,具有一定的抗肿瘤作用,体外实验发现吴茱萸碱可促进肺癌细胞凋亡[7]。然而,对吴茱萸碱对肺癌的在体抗肿瘤研究较少[8]。本实验以Lewis肺癌细胞荷瘤小鼠模型为研究对象,评估吴茱萸碱的在体抗肺癌作用,并从调控血管生成及HIF-1α/VEGF信号通路入手,初步探究吴茱萸碱治疗肺癌的在体作用机制。
1 材料与方法
1.1 主要试剂及仪器 试剂:吴茱萸碱[分子式:C19H17N3O;分子量:303.36 Da;纯度≥98%;化学物质登录(Chemical Abstracts Service,CAS)号:518-17-2]购自四川维克奇生物科技有限公司;顺铂注射液(规格10 mg/支)购自齐鲁制药有限公司(批号:8K029A89);罗斯威尔公园纪念研究所(Roswell Park Memorial Institute,RPMI)1640培养基(货号:11875119)、胎牛血清(Fetal Bovine Serum,FBS,货号:10100147)、青霉素/链霉素(货号:15140148)、胰酶(货号:25200072)购自美国Gibco生物有限公司;RNA提取(货号:DP419)、反转录(货号:KR106-02)、扩增试剂盒(货号:FP205-02)购自天根生物科技有限公司;免疫组织化学一抗VEGF(货号:ab1316)、缺氧诱导因子-1α(Hypoxia-inducible Factor-1α,HIF-1α)(货号:ab1)、CD31(货号:ab182981)购自英国Abcam生物科技有限公司。仪器:光学显微镜(Nikon,日本,型号:ECLIPSE TS100);荧光定量PCR仪(Bio-RAD,美国,型号:iQTM5)。
1.2 小鼠Lewis肺癌细胞体外培养 小鼠Lewis肺癌瘤株购于中国科学院上海生命科学研究院。细胞复苏时取液氮保存的小鼠Lewis肺癌瘤株37 ℃水浴融化,加入RPMI 1640完全培养液(90%1640培养液+10%胎牛血清+1%青霉素/链霉素),于37 ℃,5%CO2培养箱中培养,次日换液,至80%左右融合时用胰酶消化传代,3 d传代1次[9]。
1.3 荷瘤小鼠模型的建立 选取40只雄性C57BL/6小鼠,体质量(20.0±2.0)g,购于北京华阜康实验动物技术有限公司,动物许可证号:SYXK(京)2019-0028。动物级别:无特定病原体(Specific Pathogen Free,SPF)级别,室温(22±2)℃,给予无菌饲料及无菌水。将培养后的Lewis细胞用胰蛋白酶消化,调整细胞浓度至约1×107个/mL。充分摇匀瘤细胞悬液,于右腋窝皮下接种瘤细胞悬液0.2 mL,接种后7 d成瘤[10]。该实验被湖北医药学院附属随州医院伦理委员会批准(伦理审批号:2020-06)。
1.4 实验分组及给药方案 将成瘤后的小鼠平均分为模型对照组、阳性对照组及吴茱萸碱低、高剂量组,每组10只。模型对照组每天灌胃生理盐水0.2 mL,阳性对照组小鼠于第1、3、5、7、9、11、13天腹腔注射顺铂2 mg/kg,吴茱萸碱低、高剂量组小鼠每天分别灌胃吴茱萸碱10、20 mg/kg,连续灌胃14 d。
1.5 一般情况观察 给药期间第0、3、6、9、12天运用游标卡尺测量各组小鼠肿瘤长径与短径,计算肿瘤体积,计算公式为:肿瘤体积(cm2)=肿瘤长径(cm)×短径(cm)2/2;给药14 d后,测量各组小鼠体质量,之后收集分离肿瘤、胸腺、脾组织,称取各组织重量,计算抑瘤率、胸腺指数及脾指数,抑瘤率计算公式为:抑瘤率(%)=[模型对照组平均瘤重(g)-药物干预组平均瘤重(g)]/模型对照组平均瘤重(g)×100%;胸腺指数(mg/g)=胸腺重量(mg)/体质量(g),脾指数(mg/g)=脾重量(mg)/体质量(g)。
1.6 定量PCR(Quantitative PCR,qPCR) 运用试剂盒提取小鼠肿瘤组织中的总RNA,逆转录合成cDNA。以cDNA作为模板,按照试剂盒说明分别加入引物和SuperReal PreMix Plus等,扩增反应条件:95 ℃ 15 min,95 ℃ 20 s,56 ℃,20 s,40循环。qPCR仪检测各组小鼠肿瘤组织中血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)及缺氧诱导因子-1α(Hypoxia-inducible Factor-1α,HIF-1α) mRNA表达,采用β-actin为内参。具体引物序列见表1。

表1 引物序列
1.7 免疫组织化学 将1.5中收集的小鼠肿瘤运用甲醛溶液固定,之后进行脱水、透明、包埋、切片,免疫组织化学染色观察吴茱萸碱干预后各组小鼠肿瘤组织中VEGF、HIF-1α、血小板-内皮细胞黏附分子(Platelet Endothelial Cell Adhesion Molecule-1,PECAM-1,CD31)表达情况。一抗稀释倍数:VEGF(1∶400),HIF-1α(1∶200),CD31(1∶2 000)。光学显微镜对肿瘤组织免疫组织化学结果进行拍照,运用Image J软件对拍照后的图片中VEGF及TGF-β1阳性表达区域进行量化,计算出平均光密度。同时在200×视野下随机选取3个视野,分别计数CD31阳性表达血管数目,取平均值计算组织微血管密度(Microvessel Density,MVD)。

2 结果
2.1 吴茱萸碱对Lewis肺癌荷瘤小鼠肿瘤生长及脏器指数的影响 与模型对照组比较,阳性对照组、吴茱萸碱各给药剂量组小鼠肿瘤生长显著减缓,肿瘤体积减小(P<0.05或P<0.01)。见图1。吴茱萸碱干预14 d后,阳性对照组及吴茱萸碱各给药剂量组小鼠肿瘤重量显著减少(P<0.05或P<0.01),抑瘤率分别为53.13%、20.49%、38.54%。脏器指数结果显示,阳性对照组小鼠胸腺、脾指数较模型对照组比较明显降低(P<0.05或P<0.01),吴茱萸碱各给药剂量组胸腺、脾指数与模型对照组比较差异无统计学意义(P>0.05)。见表2。
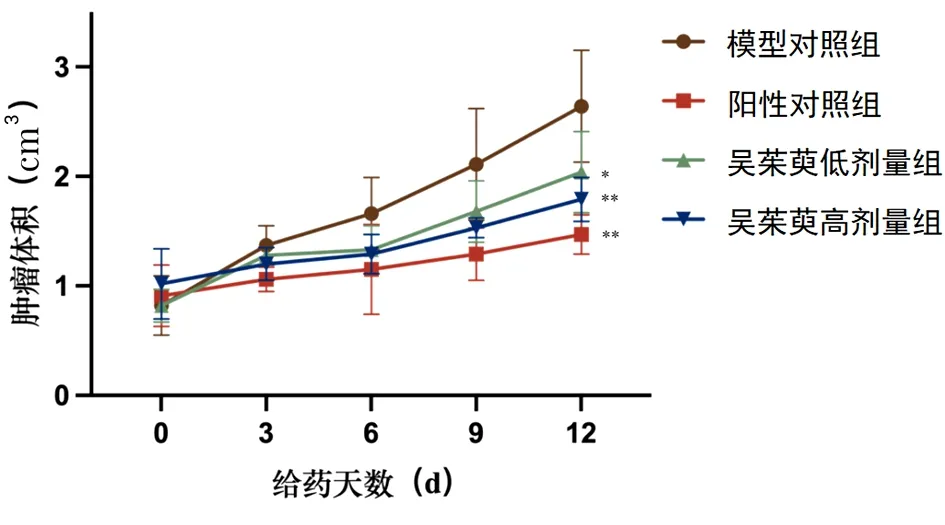
图1 吴茱萸碱干预期间各组小鼠肿瘤生长曲线(n=10)

表2 吴茱萸碱干预14天后各组小鼠肿瘤重量、抑瘤率及脏器指数
2.2 吴茱萸碱对Lewis肺癌荷瘤小鼠肿瘤组织中HIF-1α及VEGF mRNA表达的影响 吴茱萸碱干预14 d后,与模型对照组比较,阳性对照组及吴茱萸碱高剂量组小鼠肿瘤组织中HIF-1α基因表达显著下调(P<0.01),阳性对照组及吴茱萸碱低、高剂量组小鼠肿瘤组织中VEGF基因表达显著下调(P<0.01)。见图2。

图2 吴茱萸碱干预14 d后各组小鼠肿瘤组织HIF-1α、VEGF mRNA表达水平
2.3 吴茱萸碱对Lewis肺癌荷瘤小鼠肿瘤组织中HIF-1α及VEGF蛋白表达及MVD的影响 吴茱萸碱干预14 d后,与模型对照组比较,阳性对照组及吴茱萸碱低、高剂量组肿瘤组织中HIF-1α及VEGF阳性表达明显降低(P<0.01)。见图3,表3。吴茱萸碱干预14 d后,阳性对照组及吴茱萸碱低、高剂量组肿瘤组织中MVD显著减少(P<0.01)。见图4,表4。
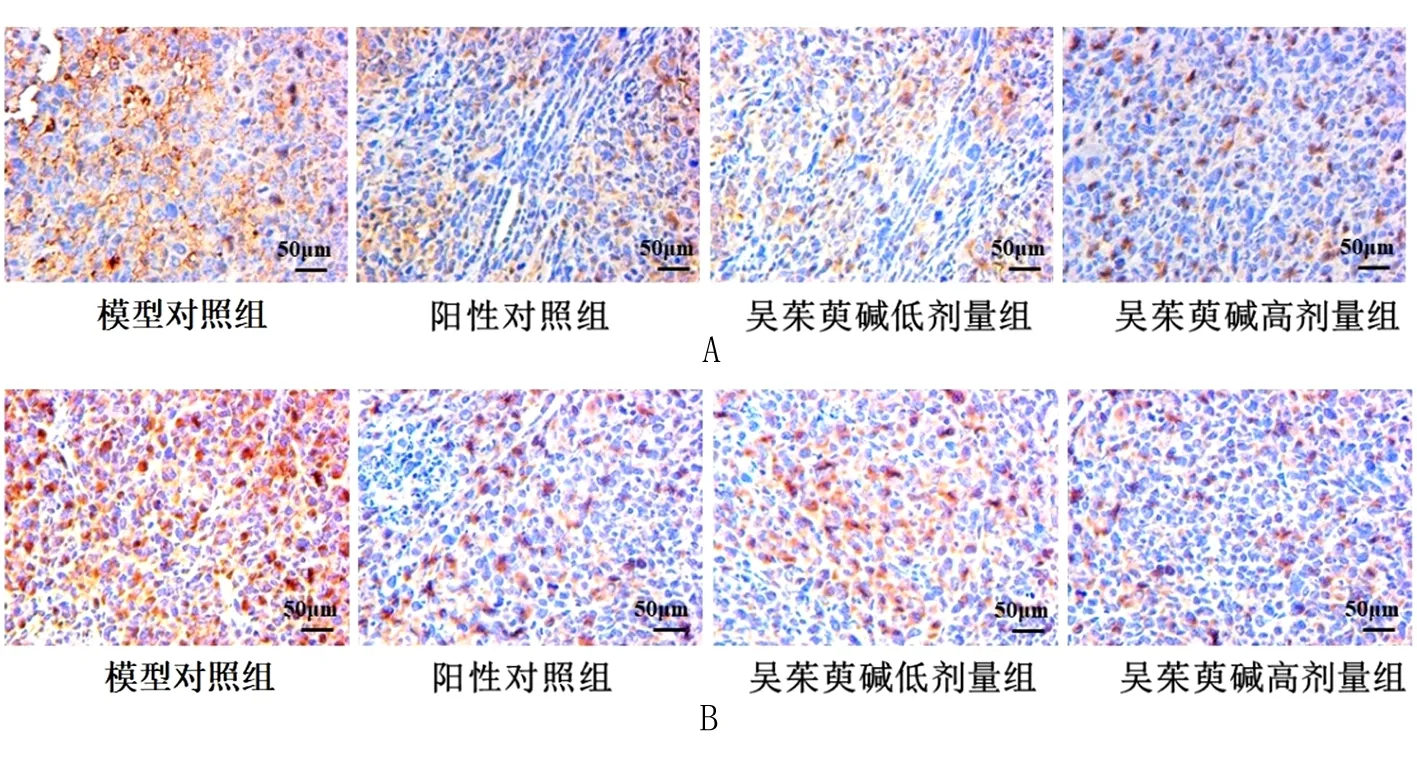
图3 吴茱萸碱干预14 d后各组小鼠肿瘤组织HIF-1α、VEGF蛋白表达(×200)

图4 吴茱萸碱干预14 d后各组小鼠肿瘤组织CD31蛋白表达(免疫组织化学染色,×200)

表3 各组小鼠肿瘤组织HIF-1α及VEGF免疫组织化学平均光密度值

表4 各组小鼠肿瘤组织MVD水平
3 讨论
本研究所运用的Lewis小鼠肺癌细胞系,常用于在体肺癌荷瘤模型实验[11]。相比其他人源肺癌细胞株,Lewis细胞更易成瘤,所需注射细胞数量少,且由于其来源于C57BL/6小鼠,不需要运用裸鼠进行实验,可在SPF级环境下进行,大幅度提高了实验的可操作性,目前在抗肺癌药物的在体实验中应用广泛[12]。在注射7 d后,小鼠腋窝下可触及明显的肿块,提示造模成功[13]。本研究结果表明,吴茱萸碱干预14 d过程中,与生理盐水干预小鼠比较,肿瘤生长明显减缓,且干预后肿瘤重量显著降低,低、高剂量组抑瘤率分别达到了20.49%、38.54%,这些结果表明吴茱萸碱具有在体抗肺癌生长的作用。此外,本研究选取顺铂作为阳性对照[14],顺铂干预小鼠抑瘤率高于吴茱萸碱高剂量组。然而顺铂组小鼠出现脾、胸腺指数显著降低,表明顺铂干预对小鼠免疫功能构成一定的影响。而吴茱萸碱干预组小鼠脾、胸腺指数未出现明显降低,提示吴茱萸碱对小鼠免疫功能影响较小,相比于顺铂更加安全。然而,由于本研究只进行了脏器指数的统计,吴茱萸碱能否在临床上作为一种安全有效的治疗肺癌的药物,仍需要进一步实验验证。
本研究还发现吴茱萸碱干预后肿瘤组织血管生成数量显著降低,此外,吴茱萸碱还可下调肿瘤组织中VEGF及HIF-1α表达。肿瘤的生长浸润需要血管输送能量物质,抑制肿瘤血管的生长为开发抗肿瘤药物提供了新思路[15-16]。HIF-1α/VEGF信号通路的激活是血管生成过程中的重要环节[17]。正常情况下,细胞中的HIF-1α可在脯氨酰羟化酶作用下被降解。肿瘤细胞增殖迅速,代谢旺盛,使其周围长期缺氧,缺氧可引发脯氨酰羟化酶活性减退,使HIF-1α无法被降解,这时HIF-1α会进入细胞核,促进其下游相关基因VEGF的表达,VEGF可使血管通透性增高,诱导血管内皮细胞的增殖,进而对肿瘤组织中血管生成起促进作用[18-20]。
综上所述,本研究表明吴茱萸碱具有在体的抗肺癌作用,其作用机制可能是通过下调肺癌荷瘤小鼠肿瘤组织中VEGF及HIF-1α表达,抑制其血管生成。
吴茱萸碱具有抗肺癌荷瘤小鼠作用,且其作用机制可能与减少肿瘤组织中HIF-1α及VEGF表达从而抑制肿瘤中血管生成相关。虽然吴茱萸碱对小鼠脏器指数无明显影响,但其安全性(如对肝肾功能、血常规、凝血功能的影响)仍需要在体内实验中进一步验证。此外,吴茱萸碱的体内抗肿瘤作用及对血管生成的影响虽已验证,但仍需要在体外实验中进一步探索。吴茱萸碱作为一种潜在的抗肿瘤药物,能否应用于临床仍需要深入研究。
利益冲突声明:作者声明没有利益冲突。
