瞬时受体电位香草酸亚型1在缺血性中风机制及相关中药的研究进展
2023-08-07张鸿瑞赖新星高永红曹克刚许颖智薛冰洁李丹溪刘珍洪
张鸿瑞 高 颖,2 赖新星,2 高永红 曹克刚,2 许颖智,2 薛冰洁,2 李丹溪,2 刘珍洪,2
(1 北京中医药大学东直门医院,北京,100700; 2 北京中医药大学中医脑病研究院,北京,100700)
中风是世界第二大致死疾病,亦是我国成人致死的首要原因,中风带来的负担日益加重[1]。其中,缺血性中风(Ischemic Stroke,IS)占70%以上。脑组织缺血后诱发能量衰竭、细胞内钙超载、兴奋性毒性、神经炎症、血脑屏障损伤、氧化应激等一系列复杂的级联损伤,最终导致细胞程序性凋亡和脑组织永久性坏死[2]。其中Ca2+稳态破坏(Ca2+内流所致钙超载)发生较早,是脑缺血后级联损伤的上游关键环节,与兴奋性毒性和神经炎症等病理事件串扰互作[3-5]。既往N-甲基-D-天冬氨酸(N-methyl-D-aspartic Acid,NMDA)和α-氨基-3羧基-5-甲基-4-异口恶唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic Acid,AMPA)谷氨酸受体被认为是中风后神经元Ca2+内流的主要受体,大量神经保护剂的研发以NMDA和AMPA受体为靶标。然而NMDA和AMPA拮抗剂的临床试验均因治疗窗口窄和不良反应而未能显示出预期的效果[6]。近年来,诱导Ca2+内流的非谷氨酸机制越来越受到关注。其中钙通道瞬时受体电位香草酸亚型1(Transient Receptor Potential Vanilloid 1,TRPV1)不仅参与中风后钙稳态,而且对兴奋性毒性、神经炎症等病理过程发挥重要调控作用,成为神经保护药物研发的新兴靶标[7]。TRPV1属于瞬时受体电位通道(Transient Receptor Potential,TRP)家族,1997年由诺尔贝生理学或医学奖获得者David Julius教授从大鼠背根神经节(Dorsal Root Ganglia,DRG)中发现并克隆。TRPV1可被外源性物质如辣椒素、大麻素等激活,也可被热刺激(>43 ℃)、H+(pH<6.0)等伤害性刺激和内源性物质激活[8]。另外,相关研究陆续发现调控TRPV1激活/抑制是中药发挥抗缺血损伤的重要机制。本文将从TRPV1参与IS的病理机制及中风中药中TRPV1激动剂/抑制剂进行梳理,挖掘临床防治IS的新策略。
1 TRPV1的结构及分布
1.1 结构 TRP家族是一类位于细胞膜上的非选择性阳离子通道,首个TRP通道由COSENS和MANNING[9]在果蝇中发现。TRP通道在哺乳动物中共有28个成员,根据氨基酸序列的同源性分为TRPC、TRPV、TRPM、TRPA、TRPML及TRPP 6个亚群[10]。TRP通道均由4个相同或相似的亚基组成,每个亚基中跨膜结构域S1~S4组成传感区,S5与S6之间有供离子通过的孔道环,位于细胞内的N端与C端,在不同的亚群中存在结构差异[10]。人类TRPV1基因位于染色体17p13,编码形成839个氨基酸95 kD大小的TRPV1蛋白[11]。N端的33个氨基酸残基形成可与钙调蛋白结合的3个亲水性锚蛋白重复序列;C端的TRP样结构域中Glu684-Arg721被认为是TRPV1四聚体化的相关区域[12]。
1.2 分布 TRPV1在神经元、小胶质细胞等脑组织中广泛分布[13]。脑血管内皮细胞中也发现有TRPV1的表达[14]。另外,海马CA1~CA3区、齿状回的锥体神经元、小脑皮质及多数浦肯野细胞的胞体和轴突周围,以及基底神经节、丘脑、下丘脑、大脑脚、脑桥核、导水管周围灰质与小脑齿状核均发现TRPV1的表达[15]。
2 TRPV1在IS病理发生中的作用
2.1 钙超载 Ca2+在神经元兴奋性、突触可塑性及程序性细胞死亡中发挥重要作用,Ca2+升高影响IS神经功能预后[16]。缺血后Ca2+大量内流引起钙超载,激活半胱氨酸蛋白酶,降解细胞骨架蛋白、膜受体和代谢相关酶[17]。钙超载还导致谷氨酸释放,过度激活谷氨酸受体,产生兴奋性毒性,最终导致神经元死亡[16]。同时,细胞内Ca2+通过电压依赖性阴离子通道和Ca2+单向转运体进入线粒体,胞质钙浓度升高可引发线粒体钙超载[16,18]。线粒体钙超载导致线粒体功能障碍,线粒体肿胀、外膜破裂,释放促凋亡蛋白,诱导神经元凋亡[19]。此外,细胞内Ca2+还通过激活氧合酶,影响线粒体Ca2+稳态和能量代谢等,促进活性氧(Reactive Oxygen Species,ROS)产生,诱导氧化应激[17]。TRPV1作为非选择性阳离子通道,主要渗透Ca2+和Na+,PCa/PNa为9.6[20]。辣椒素是TRPV1的典型激动剂,半数应浓度(Median Effective Concentration,EC50)为39.1 nmol/L[8]。谷氨酸刺激NMDA受体过度激活,诱发Ca2+内流。在培养的大鼠皮层神经元中,3 μmol/L辣椒素预处理1 h可以明显降低谷氨酸诱发的钙内流,并且下调NMDA的表达丰度,在TRPV1敲除神经元中这种作用消失,提示辣椒素依赖TRPV1作用来降低谷氨酸诱发的钙内流和下调NMDA表达[20]。TRPV1过度激活是有害的,可以导致线粒体Ca2+稳态失衡,破坏线粒体膜电位,诱导ROS产生和细胞色素C释放增加,导致细胞凋亡[21]。辣椒素持续激活TRPV1后,可导致通道脱敏,抑制Ca2+内流[22]。TRPV1激活促进钙超载和TRPV1激动剂辣椒素抑制钙超载这二者之间的矛盾,目前更多学者认为辣椒素抑制钙超载主要是由TRPV1脱敏所致[23]。
2.2 兴奋性毒性 谷氨酸是中枢神经系统中主要的兴奋性神经递质,介导兴奋性突触传递,过高的谷氨酸水平可引发兴奋性毒性,导致中风后神经元死亡[24]。钙超载与兴奋性毒性相互影响,中风后钙超载引起神经元去极化,释放谷氨酸,持续激活突触后NMDA受体等谷氨酸受体,导致Ca2+内流再次增加,形成细胞内Ca2+升高与谷氨酸异常释放的恶性循环[16]。IS后迟发性细胞死亡与经NMDA受体内流的Ca2+诱发的兴奋性毒性密切相关[25]。辣椒素不仅可调节谷氨酸释放,还可调节NMDA受体谷氨酸受体的表达,缓解IS后兴奋性氨基酸毒性损伤。大鼠大脑中动脉闭塞(Middle Cerebral Artery Occlusion,MCAO)手术前3 h腹腔注射辣椒素(0.2 mg/kg),24 h进行气相色谱-质谱联用技术(Gas Chromatography-mass Spectrometry,GC-MS)代谢组检测,发现辣椒素预处理后皮质谷氨酸恢复至正常水平,推测辣椒素通过降低兴奋性氨基酸的释放发挥神经保护作用[26]。在培养的大鼠皮层神经元中,不同剂量的辣椒素(3 μmol/L、10 μmol/L)预处理30 min可以抑制谷氨酸诱导的兴奋性毒性。辣椒素处理0.5 h后可降低MCAO大鼠大脑梗死周围区NMDA受体亚基GluN1的蛋白丰度,60 min后降低GluN2B的蛋白丰度,保护大脑皮质神经元免于兴奋性毒性损伤[20]。TRPV1基因敲除小鼠中,辣椒素抑制谷氨酸诱导的兴奋性毒性的作用消失,提示辣椒素依赖TRPV1机制来抑制兴奋性毒性。
2.3 神经炎症 中风后继发的神经炎症可导致细胞死亡。源自于免疫介质的促炎信号激活小胶质细胞、星形胶质细胞等脑固有免疫细胞,释放白细胞介素-1(Interieukin-1,IL-1)、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)等炎症介质导致炎症反应损伤,并促进其他炎症细胞向缺血区域浸润,加剧脑损伤[27]。小胶质细胞同时也分泌IL-10等抗炎因子发挥保护作用[28]。侧脑室注射辣椒平可抑制磷酸化c-Jun氨基末端激酶(p-c-Jun N-terminal Kinase,p-JNK)和磷酸化p38促分裂原活化的蛋白激酶(p38 Mitogenactivated Protein Kinase,p-p38MAPK)表达[29],抑制TRPV1,降低MCAO小鼠IL-1β的表达并减少杏仁核小胶质细胞的激活,减轻炎症反应[30]。TRPV1拮抗剂AMG517和AMG9810可降低IS后血清TNF-α水平,提高血清IL-10水平,减少IS后炎症反应,抑制神经元死亡,降低脑梗死体积[31-32]。AMG9810还可通过抑制梗死周围区域Toll样受体2和Toll样受体4的mRNA表达,缓解神经功能障碍[33]。核因子κB、p38MAPK与JNK信号通路参与神经炎症并导致不同程度的缺血后神经损伤。电针预处理降低MCAO大鼠神经元TRPV1的表达,抑制核因子κB转录活性和p38MAPK激活,抑制氧化应激损伤、降低炎症介质的产生[34-35],这些研究都提示TRPV1与神经炎症之间存在正相关,即激活TRPV1可促进神经炎症;抑制TRPV1可减轻神经炎症,实现神经保护作用。但有研究报告短暂性大脑中动脉阻塞(Transient Middle Cerebral Artery Occlusion,tMCAO)大鼠灌胃50 mg/kg、100 mg/kg辣椒素可增加海马组织TRPV1表达,减少TNF-α、IL-1β分泌,通过MAPK/环氧合酶-2(Cyclooxygenase,COX-2)信号通路抑制小胶质细胞的过度活化[36]。但辣椒素减少炎症介质分泌是否依赖TRPV1机制尚需要进一步验证。
2.4 自噬 IS发生后神经元、胶质细胞及脑内皮细胞均可发生自噬,清除受损的细胞器及蛋白质,但不足或过度的自噬可破坏细胞稳态,导致细胞死亡[37]。一方面TRPV1促进自噬,消除自噬不足状态,达到神经保护作用。TRPV1激动剂辣椒素可通过促进氧糖剥夺/复氧(Oxygen-glucose Deprivation/Re-oxygenation,OGD/R)小胶质细胞自噬,降低缺血再灌注损伤导致的小胶质细胞炎症损伤[38],TRPV1抑制剂iRTX则拮抗OGD/R小胶质细胞自噬,加重氧化应激诱导的小胶质细胞凋亡[39]。另一方面,当自噬过度激活时,可通过抑制TRPV1发挥神经保护作用。辣椒平可下调小鼠脑杏仁核区自噬相关蛋白Beclin-1和微管相关蛋白轻链3(Light Chain Protein 3,LC3),并可能通过激活调控自噬的主要信号通路磷脂酰肌醇3激酶(Phosphoinositide 3-kinase,PI3K)/蛋白激酶B(Protein Kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(Mammalian Target of Rapamycin,mTOR)通路,抑制自噬的过度激活,发挥神经保护作用[40]。
2.5 脑血流 IS后缺血再灌注损伤导致血管收缩和扩张的物质释放失衡,内皮素、血管紧张素Ⅱ、血栓素A2等缩血管物质大量释放,一氧化氮、前列环素等扩血管物质释放减少,导致微血管收缩-舒张功能失调。内皮型一氧化氮合酶(Endothelial Nitric Oxide Synthase,eNOS)在脑血流维持和中风预防中具有显著作用,辣椒素激活蛋白激酶A,促进eNOS磷酸化,改善脑基底动脉内皮依赖性血管舒张功能,扩张脑动脉,延缓中风的发生[14]。脑缺血会损害大脑中动脉的肌源性反应,辣椒素预处理可改善大脑中动脉远端肌源性张力,降低梗死体积[41-42]。辣椒素可通过增加大脑中动脉平均血流速度,降低搏动指数,产生与蝶腭神经节电刺激类似的增强侧支血流作用[43]。因此,TRPV1能够改善血管动力学,维持脑组织血液循环,促进侧支循环,调节脑血流。此外,TRPV1对血脑屏障不利,TRPV1拮抗剂辣椒平可缓解缺血再灌注后血脑屏障通透性的改变,保护血脑屏障[44]。
2.6 保护性低温 低温可降低需氧量、保障贮能、提高细胞存活率,不同程度地促进神经系统新陈代谢与神经递质释放,被认为是脑缺血缺氧损伤颇具价值的神经保护疗法[45]。TRPV1通道可调节体温,保护缺血缺氧脑组织。二氢辣椒碱(Dihydrocapsaicin,DHC)激活TRPV1可诱导体温降低,减轻皮质梗死及继发产生的丘脑损伤,抑制星形胶质细胞增殖,保护神经元,并促进IS后远期神经功能的恢复[46]。低剂量DHC联合物理降温可降低ROS,抑制细胞凋亡,减轻神经功能障碍,高剂量DHC则没有表现出神经保护作用[45]。TRPV1激动剂Rinvanil激活TRPV1受体同样可减少tMCAO小鼠O2消耗量,降低体温,从而减轻缺血性脑损伤[47]。然而,内源性TRPV1选择性激动剂N-油酰多巴胺诱导的低体温则未观察到积极的治疗作用[48]。不同种类及剂量TRPV1激动剂诱导低温的神经保护作用存在一定差异,可能由于TRPV1受体结构具有复杂性,导致在不同条件下激活TRPV1时可能同时诱导大量细胞内Ca2+进入、谷氨酸释放,产生兴奋性毒性和氧化应激等有害反应。见图1。
3 TRPV1与中药
我国中药普及度高,患者依从性好,潜在受益人群广泛,中国国家卒中登记结果显示,70.6%的IS住院患者使用中医药治疗[49]。目前已有多种具有神经保护作用的中药成分被证实为TRPV1的激动剂/抑制剂。
3.1 激动剂 吴茱萸中吴茱萸碱与吴茱萸次碱被发现可激活TRPV1。吴茱萸碱促进TRPV1通道依赖的星形胶质细胞保护性自噬[50];吴茱萸次碱激活DRG中的TRPV1,增加降钙素基因相关肽(Calcitonin Generelated Peptide,CGRP)的表达,降低血压[51]。生姜主要成分6-姜酚通过促进TRPV1/FAF1复合物解离介导的自噬抑制核苷酸结合寡聚化结构域样受体蛋白3(Nucleotide-binding Oligomerization Domain-like Receptor Protein 3,NLRP3)炎症小体和凋亡[52]。羌活水提物及醇提物中均含有TRPV1激动剂,通过激活TRPV1发挥作用[53]。此外,胡椒碱与大蒜素均对TRPV1有激活作用,并能对抗缺血性脑损伤[54-57]。临床IS常用药全蝎与蜈蚣被发现可激活TRPV1,但其抗缺血脑损伤作用是否依赖TRPV1机制需要深入探究[58-60]。见表1。
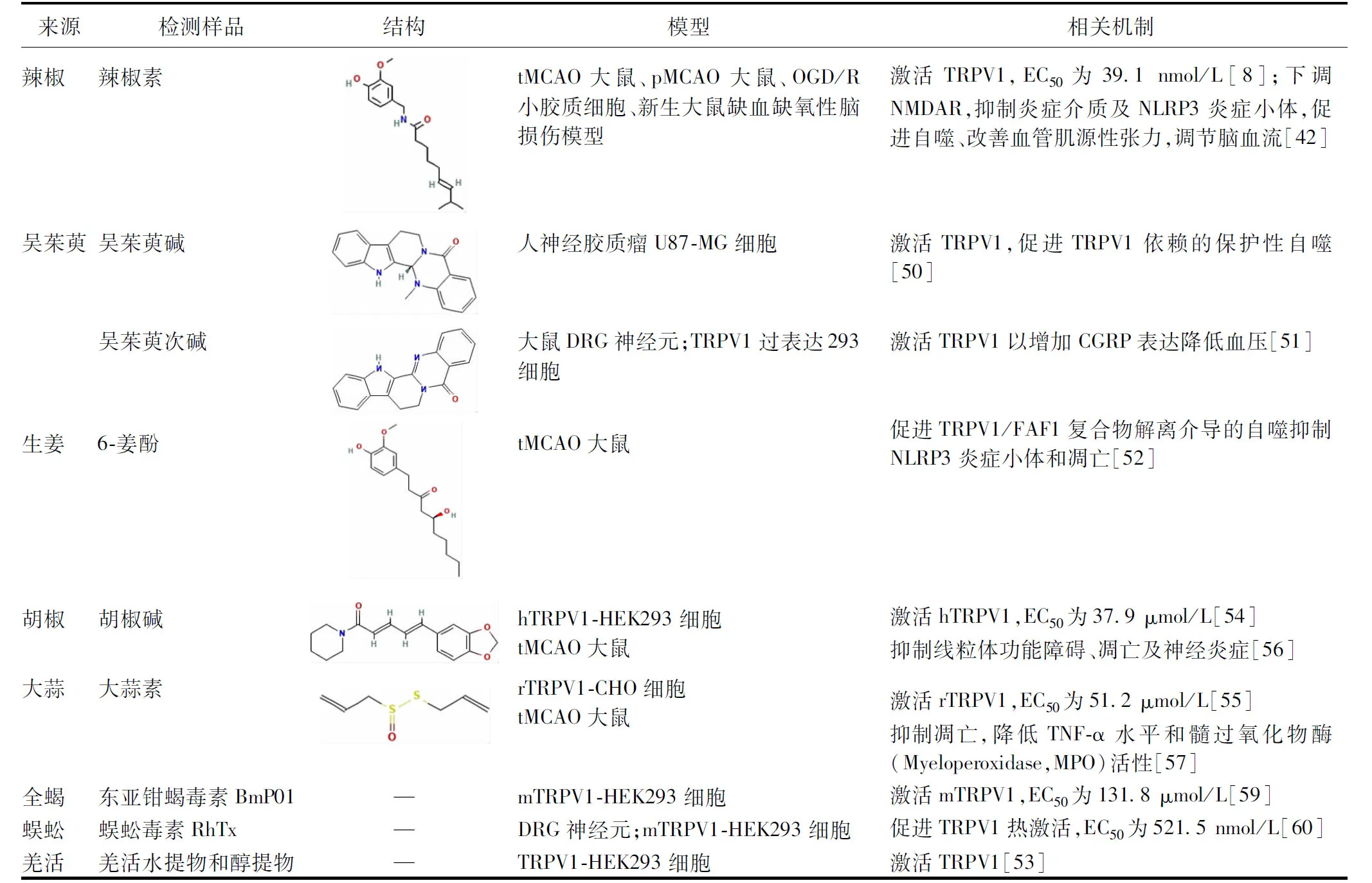
表1 中药TRPV1激动剂在IS中的作用
3.2 抑制剂 TRPV1抑制剂中亦具有神经保护作用。天然冰片可下调海马CA1、CA3区中TRPV1的表达,促进神经递质γ-氨基丁酸的释放,减少海马神经元的损伤[61]。龙血竭中的剑叶龙血素A、B,可通过拮抗TRPV1减轻兴奋性谷氨酸毒性,保护血脑屏障功能,抑制神经细胞凋亡[62]。牡荆素通过抑制TRPV1受体的过度激活,减少缺血缺氧性脑损伤新生小鼠脑梗死的体积[63]。黄芩苷及大黄素在体外均可下调DRG神经元中TRPV1 mRNA的表达水平并抑制细胞内Ca2+水平升高[64-65]。枇杷叶提取物及其有效成分熊果酸可抑制辣椒素诱导TRPV1稳转细胞中的Ca2+内流[66]。葛根素可抑制DRG中TRPV1表达,抑制神经性疼痛[67]。此外,中药大黄、黄连,中药成分川芎嗪、阿魏酸、芍药苷均可抑制TRPV1[68-72]。见表2。

表2 中药TRPV1抑制剂在IS中的作用
4 小结
TRPV1作为TRP家族中的一类非选择性阳离子通道,主要转运Ca2+和Na+。激活TRPV1后脱敏,可抑制谷氨酸诱导的钙超载及兴奋性毒性,抑制TRPV1则可缓解神经炎症。TRPV1激活还可促进自噬发生,在机体自噬不足时发挥神经保护作用。此外,激活TRPV1可维持脑血流,诱导保护性低温,降低脑组织缺血损伤。TRPV1的多途径调控作用为IS新药的研发提供新思路。
5 讨论
自辣椒素受体成功克隆以及冷冻电镜解析其结构后,靶向TRPV1的研究成为全世界关注的热点。TRPV1具有一个显著性特征:脱敏,包括急性脱敏和快速脱敏[81]。急性脱敏即随着激动剂刺激时间的延长,诱发的TRPV1电流振幅不断减小;快速脱敏即指重复、短时间使用激动剂刺激,TRPV1电流振幅逐渐减小。脱敏与细胞内Ca2+水平变化密切相关[81]。TRPV1脱敏特性被认为是其发挥神经保护作用的重要策略[23,82]。辣椒素结合在蛋白的细胞内侧位置以激活TRPV1通道。
目前的研究支撑辣椒素依赖TRPV1机制来抑制谷氨酸诱导的钙超载及下调NMDA的表达,抑制兴奋性毒性,极有可能由TRPV1脱敏所致[23]。其次,激活TRPV1具有促炎作用,抑制TRPV1可降低神经炎症[32]。另外,TRPV1促进自噬,这个功能是否发挥神经保护作用取决于机体状态,当机体自噬不足时,激活TRPV1发挥保护作用[38]。当自噬过度激活,则抑制TRPV1发挥抗缺血损伤作用[40]。此外,激活TRPV1诱导Ca2+内流引起eNOS的磷酸化从而诱导NOS产生和促进CGRP的释放被认为是引起血管舒张的2条重要途径。TRPV1还能够促进侧支循环维持脑血流,诱导保护性低温,发挥神经保护作用[42,45]。总之,激动TRPV1并不能一直发挥神经保护作用。因此,临床在选择TRPV1相关药物时应该紧密结合病理状态。同时TRPV1激动剂可增加血脑屏障的通透性,可能增加出血风险,对于脑出血患者需谨慎使用[83]。
另外,TRPV1可预防中风的发生。有研究表明激活TRPV1能减少泡沫细胞的形成,抑制中风危险因素动脉粥样硬化,延迟易卒中型自发性高血压大鼠中风发作,延长生存时间[14,84]。近年来,越来越多的临床研究认为辣椒素在中风后遗症期具备良好的应用前景[85-86]。目前已有大量可作用于TRPV1受体的药物被证实具有潜在的神经保护作用,靶向TRPV1已然成为IS药物研发的新策略。
利益冲突声明:无。
