核糖核苷酸还原酶M2在小脑髓母细胞瘤中的功能及机制
2023-08-07张晨璐
张 琪,吴 菁,张晨璐,
(1.复旦大学附属中山医院肿瘤内科,上海 200032;2.复旦大学附属金山医院肿瘤内科,上海 201508)
髓母细胞瘤是儿童常见的中枢神经系统恶性肿瘤,占儿童颅内胚胎源性肿瘤的63%[1]。外科、放疗和化疗的综合运用已经使得髓母细胞瘤患者的生存率有了很大的提高,然而仍有25%~30%的患者死于该病。治疗会给患者带来不同程度的长期后遗症,约70%接受治疗的患者存在听力丧失、认知障碍等[2]。核糖核苷酸还原酶(ribonucleotide reductase,RR)是DNA合成和DNA修复的关键酶,存在于所有真核生物和一些原核生物中,由M1亚基(RRM1)和M2亚基(RRM2)组成[3]。准确的DNA 复制和修复对于所有多细胞生物的正常发育、生长和无瘤生存至关重要。RRM2 作为核糖核苷酸还原酶的限速酶,其过度表达与多种癌症的预后不良相关[4-5]。在RRM2转基因小鼠模型中,RRM2的过度表达可诱导肺癌发生,可与DNA错配修复缺陷协同促进肺肿物向恶性肿瘤转变[6]。然而RRM2在小脑髓母细胞瘤中的作用及机制研究尚不清楚。本研究旨在探讨RRM2 在小脑髓母细胞瘤中的生物学功能和分子机制,为髓母细胞瘤的治疗提供新思路。
1 材料与方法
1.1 主要试剂
RRM2 抗体、GAPDH 抗 体购自Santa Cruz 公司。CCK-8试剂盒购自同仁公司。Transwell 小室购自美国康宁公司。细胞周期试剂盒和凋亡试剂盒购自北京索莱宝公司。DMEM、MEM、胎牛血清、胰蛋白酶均购自Gibco公司。RRM2过表达及敲低慢病毒购自上海吉凯基因。
1.2 小脑髓母细胞瘤细胞系和肿瘤组织临床样本芯片
细胞系Daoy 购自中国科学院上海细胞库,D283细胞系购自美国细胞培养物收藏中心(American Type Culture Collection,ATCC)细胞库,以上2 种细胞系由本实验室保存。本研究所使用的小脑髓母细胞瘤和癌旁组织临床样本芯片购自陕西爱维拉生物科技有限公司,货号为DC-Bra01022。
1.3 实验方法
1.3.1 通过GEO 数据库分析髓母细胞瘤患者RRM2表达水平和生存的关系对GEO 数据库(GSE85217)中612 例髓母细胞瘤患者的生存和基因表达信息进行分析,继续通过对GEO 数据库(GSE86574、GSE74195、GSE35493)中髓母细胞瘤和正常小脑组织RRM2 的表达水平进行分析,然后对RRM2 在髓母细胞瘤不同分子分型中表达水平进行比较。进一步通过免疫组化染色在组织样本芯片上验证。
1.3.2 免疫组化实验将组织芯片脱蜡、水化等处理后,使用PBS洗涤3次,每次5 min。置入柠檬酸缓冲液中进行抗原修复,高温加热7 min,缓冲液中浸泡5 min,再次使用PBS 洗涤。加入RRM2 一抗(sc-398294,小鼠)抗体按1∶500稀释,4 ℃过夜。PBS清洗3 次,每次5 min,加入辣根过氧化物酶标记的二抗,室温孵育30 min,PBS 洗涤3 次后,进行DAB 显色及苏木素复染。乙醇、二甲苯脱水后,使用中性树胶封片。显微镜下观察拍照。
1.3.3 细胞培养及慢病毒感染Daoy 细胞(含1%青、链霉素双抗和10%胎牛血清的DMEM 培养基)及D283细胞(含1%青、链霉素双抗和10%胎牛血清的MEM培养基)分别于37 ℃、CO2体积分数为5%的培养箱中培养,每2~3 d进行传代。将处于对数生长期的Daoy或D283细胞接种至6孔板,分为过表达实验,即对照组(空载体慢病毒)和RRM2 过表达组;敲低实验,即shRNA 对照组(含无义链的慢病毒)和RRM2 敲低组。培养至70%汇合度时,分别加入慢病毒,6 h 后更换培养基。48 h后细胞表达荧光,利用嘌呤霉素进行抗性筛选,建立稳定感染细胞株Daoy 和D283 并进行后续体外实验。慢病毒过表达载体为pGC-FU-3FLAGCBh-gcGFP-IRES-puromycin,敲低载体为pFU-GW-016。敲低RRM2 的慢病毒靶向序列为cgGAGGAGAG AGTAAGAGAAA。
1.3.4 Western blot 实验细胞用胰蛋白酶消化,PBS 清洗后离心,加入蛋白裂解液,收集蛋白上清。将变性后的蛋白样品进行蛋白电泳后,转膜。经5%脱脂奶粉封闭1 h后,分别加入1∶1 000稀释的一抗(RRM2 抗体、GAPDH 抗体),4 ℃孵育过夜。PBST 洗膜,再以1∶2 000 稀释的二抗(辣根过氧化物酶标记山羊抗鼠IgG),室温孵育2 h,加入化学发光剂后利用成像系统分析蛋白表达水平。
1.3.5 CCK-8 细胞增殖实验细胞用胰蛋白酶消化后重悬,进行细胞计数,在96 孔板中每孔加入5×103个细胞,每个时间点设置3 个复孔。分别在4 个不同时间点即0、24、48和72 h,加入CCK-8试剂,孵育0.5~2 h后使用酶标仪检测D(450)值。
1.3.6 Transwell 实验细胞用无血清培养基稀释为5×105/mL,将200 μL 细胞悬液加入24 孔板上层小室,含有10% FBS 培养基的500 μL 细胞悬液加入到下层小室,继续孵育48 h。吸去培养基,用4%甲醛固定15 min,用0.5%结晶紫染色15 min,观察细胞迁移情况。
1.3.7 细胞周期和细胞凋亡检测细胞经胰蛋白酶消化后收集,使用PBS 漂洗2 次。用结合缓冲液重悬细胞并加入PI,避光孵育15 min后,采用流式细胞仪检测细胞周期;用结合缓冲液重悬细胞,并加入Annexin V-FITC 和PI,避光孵育15 min 后,采用流式细胞仪检测细胞凋亡情况。
1.3.8 转录组测序(RNA-seq)为了探索RRM2 在髓母细胞瘤中发挥功能的相关分子机制,我们对敲低RRM2 的髓母细胞瘤细胞系Daoy 进行了转录组测序(RNA-seq)检测分析。RRM2 敲低组和对照组细胞系Daoy,由诺禾致源医学公司进行RNA提取和检测,建库后进行Illumina 测序,对原始数据进行过滤后,使用HISAT2 v2.0.5 将预处理序列与参照基因组比对。后续使用DESeq 1.20.0软件进行两组之间的差异表达分析;使用Cluster Profiler 3.4.4 软件分析KEGG 通路中差异表达基因的统计富集。
1.4 统计学方法
采用GraphPad Prism 8.0.1 软件进行数据分析和绘图。数据以±s表示,实验组和对照组比较采用配对或独立样本t检验,以α=0.05为检验水准。
2 结 果
2.1 RRM2在髓母细胞瘤中高表达
对GEO 数据库(GSE85217)中612 例髓母细胞瘤患者的生存和基因表达信息进行分析,结果发现高表达RRM2 的髓母细胞瘤患者相较于低表达组的总生存期更短、预后更差(图1A)。继续通过对GEO 数据库(GSE86574、GSE74195、GSE35493)中髓母细胞瘤和正常小脑组织RRM2 的表达水平进行分析,发现RRM2在髓母细胞瘤中较正常小脑组织高表达(P<0.01,图1B)。根据基因改变,髓母细胞瘤可以分为4个分子亚型,分别是WNT 型、SHH 型、第3 组(Group3)、第4组(Group4)[7]。其中WNT型预后最好,5年生存率超过95%;而第3组预后最差,5年生存率小于60%。GEO数据库(GSE85217)分析结果显示RRM2 在4 种不同分子亚型中表达水平不同,RRM2 在第3 组中表达量最高,在SHH型表达量最低(图1C)。进一步通过免疫组化染色,证实RRM2 在髓母细胞瘤组织中的表达水平明显高于正常组织(图1D)。
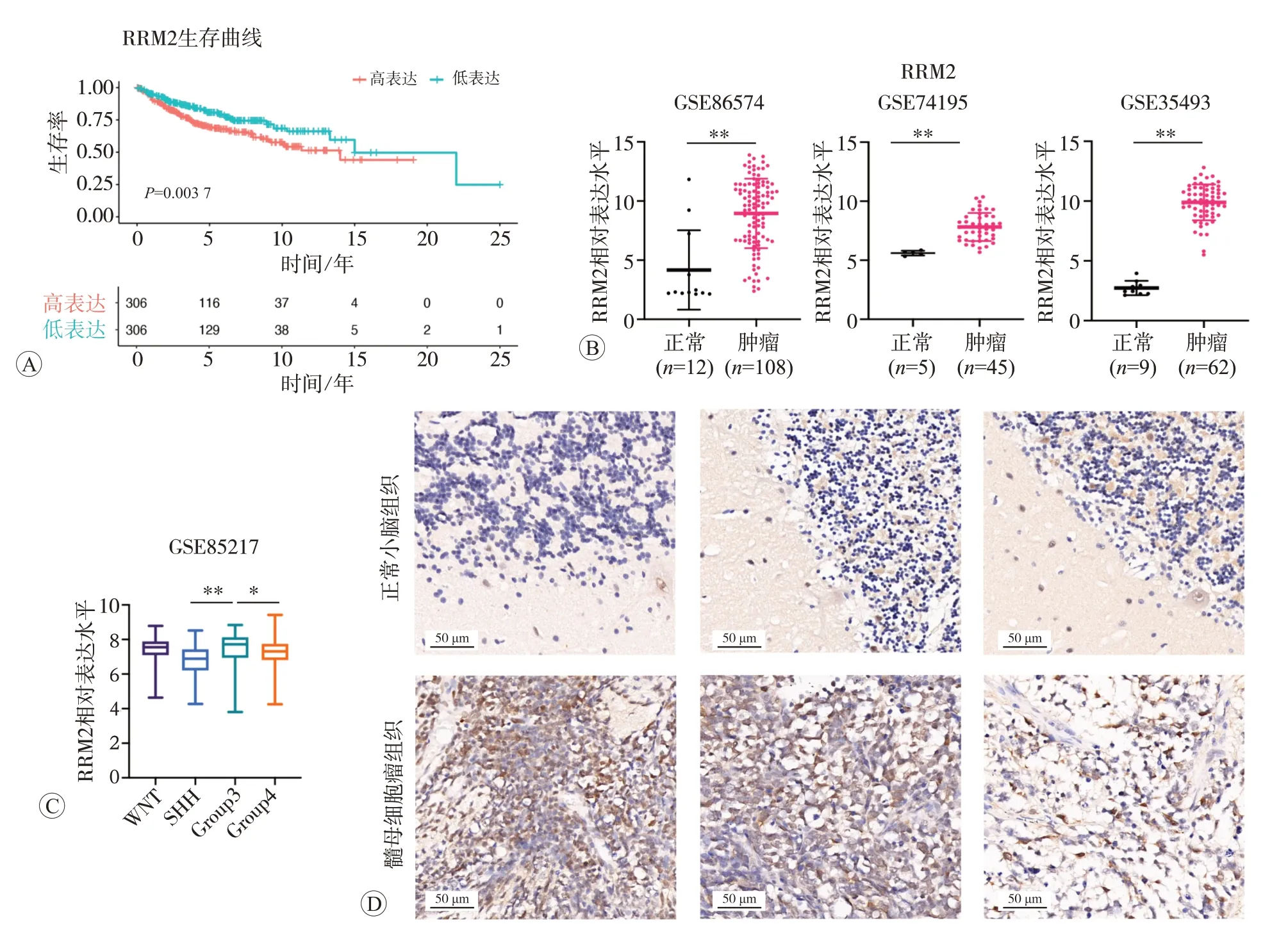
图1 RRM2在小脑髓母细胞瘤中高表达
2.2 RRM2增强髓母细胞瘤细胞的增殖和迁移能力
利用慢病毒系统构建过表达RRM2 和敲低RRM2的稳定转染细胞系Daoy 和D283。Western blot 检测了不同细胞系中RRM2 蛋白的表达水平(图2A)。体外CCK-8 实验结果显示,过表达RRM2 的Daoy 和D283细胞增殖能力均明显高于对照组,而敲低RRM2基因的Daoy和D283细胞增殖能力明显低于对照组(均为P<0.01,图2B)。Transwell 实验结果表明,在Daoy 中过表达RRM2 能够增强肿瘤细胞的迁移能力,敲低RRM2减弱细胞的迁移能力(图2C和D)。
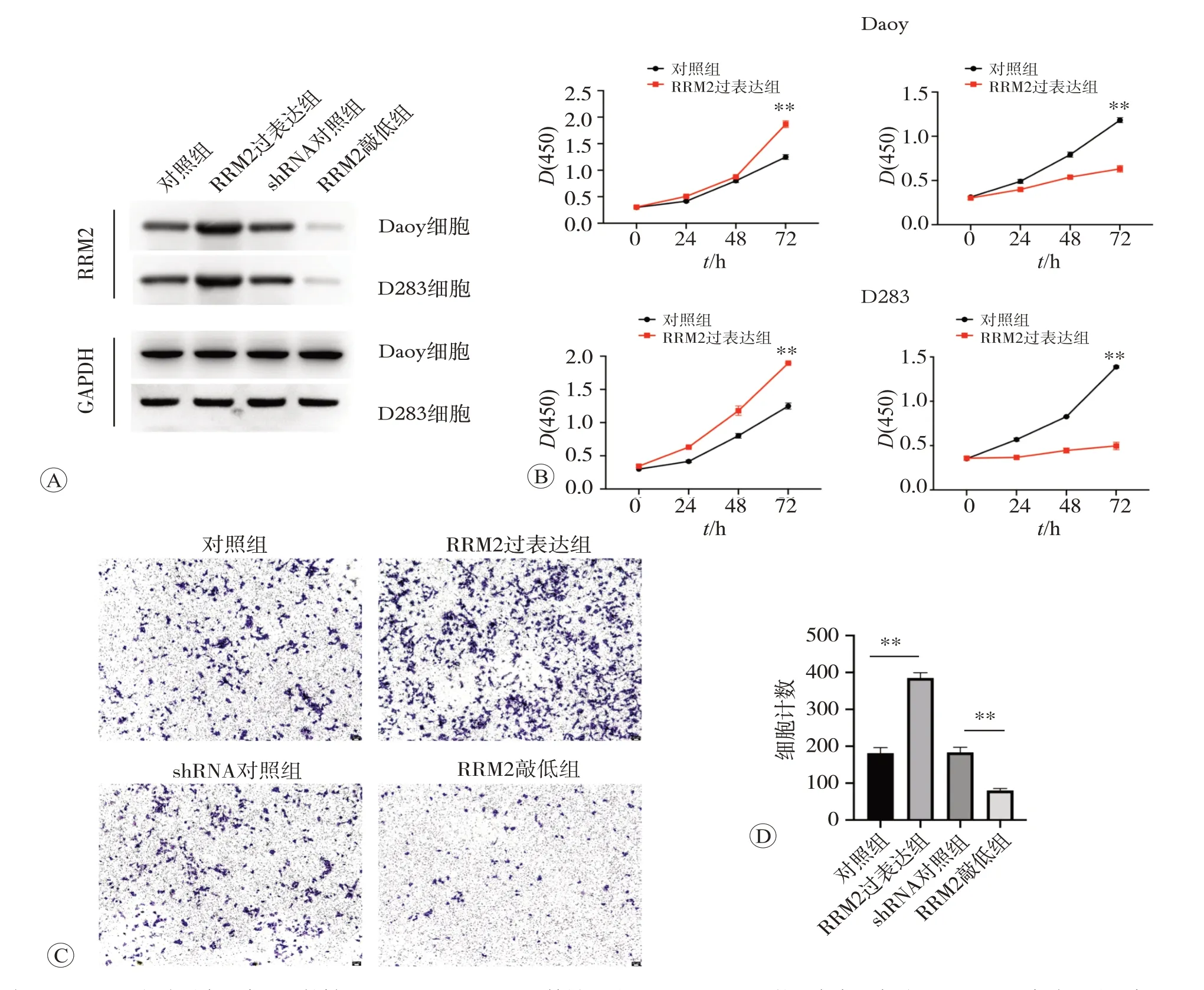
图2 RRM2促进髓母细胞瘤细胞系的增殖和迁移
2.3 RRM2影响髓母细胞瘤细胞的周期和凋亡
结果显示,在Daoy 和D283 细胞中过表达RRM2可增加S 期细胞比例、减少G0/G1 期细胞比例;敲低RRM2 则减少S 期细胞比例、增加G0/G1 期细胞比例(均为P<0.01,图3A 和B)。细胞凋亡检测实验显示,在Daoy 和D283 细胞中,过表达RRM2 减少早期凋亡(Annexin V+PI-)和晚期凋亡(Annexin V+PI+)的细胞比例。而敲低RRM2 能够显著增加早期凋亡和晚期凋亡的细胞比例(均为P<0.01,图3C 和D)。细胞凋亡实验结果见表1。
表1 RRM2对髓母细胞瘤细胞凋亡的影响(±s,%)
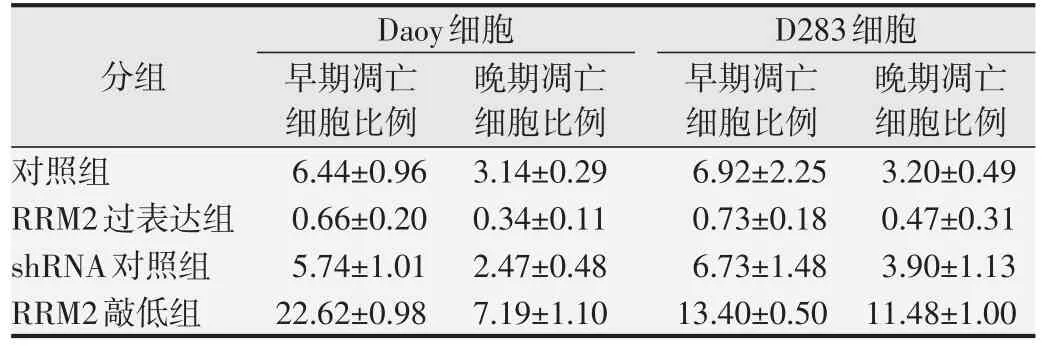
表1 RRM2对髓母细胞瘤细胞凋亡的影响(±s,%)
分组对照组RRM2过表达组shRNA对照组RRM2敲低组Daoy细胞早期凋亡细胞比例6.44±0.96 0.66±0.20 5.74±1.01 22.62±0.98晚期凋亡细胞比例3.14±0.29 0.34±0.11 2.47±0.48 7.19±1.10 D283细胞早期凋亡细胞比例6.92±2.25 0.73±0.18 6.73±1.48 13.40±0.50晚期凋亡细胞比例3.20±0.49 0.47±0.31 3.90±1.13 11.48±1.00
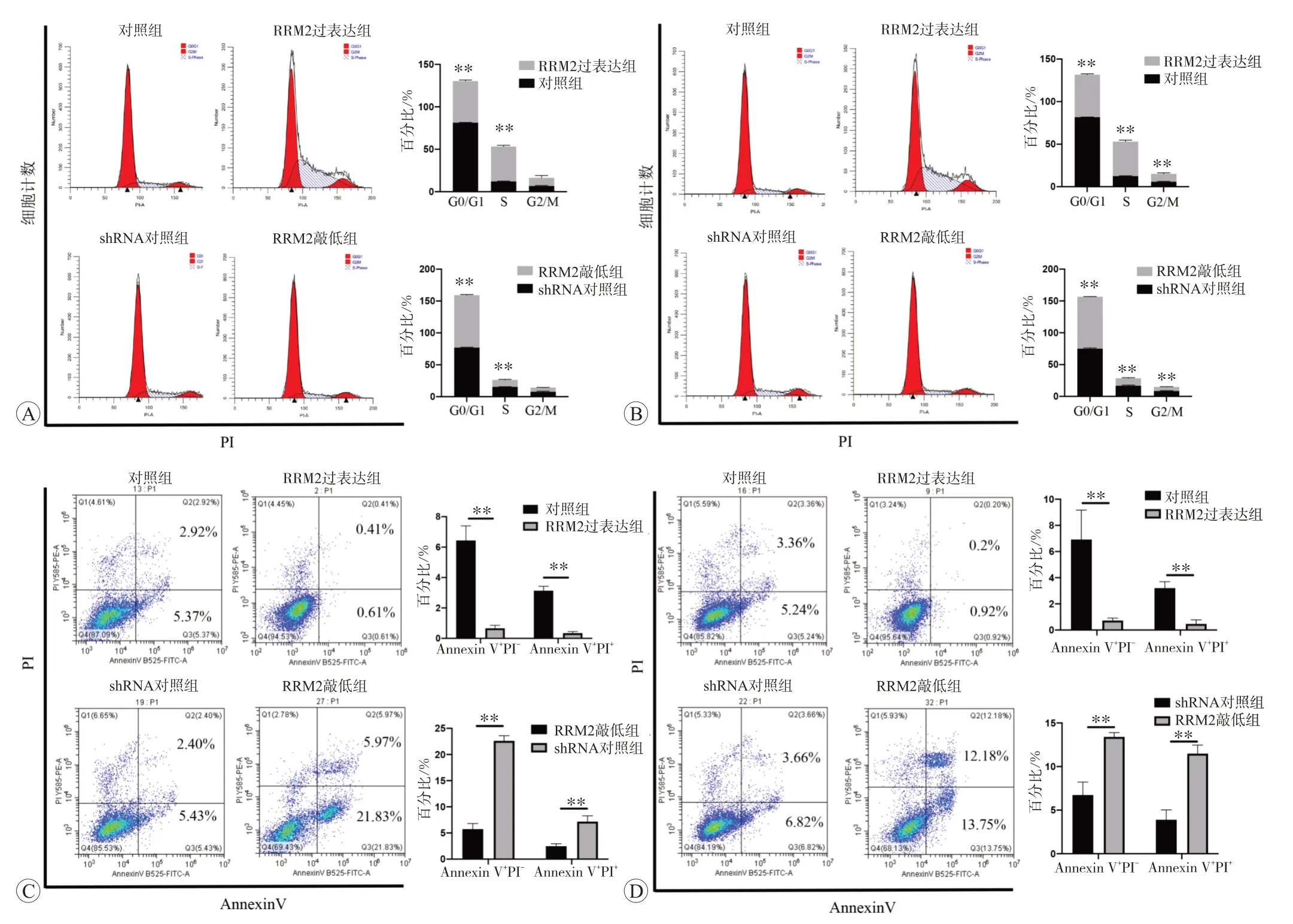
图3 RRM2增加S期细胞比例并减少细胞凋亡
2.4 RNA-seq分析结果
火山图结果显示敲低RRM2 后表达水平发生变化的基因,其中有3 454个基因表达上调,3 332个基因表达下调(图4A)。KEGG 分析显示RRM2 敲低后受到影响的信号通路,包括FOXO、细胞周期、核糖体生物合成等信号通路(图4B)。后续将通过更多分子实验明确RRM2发挥促癌作用的下游信号通路。
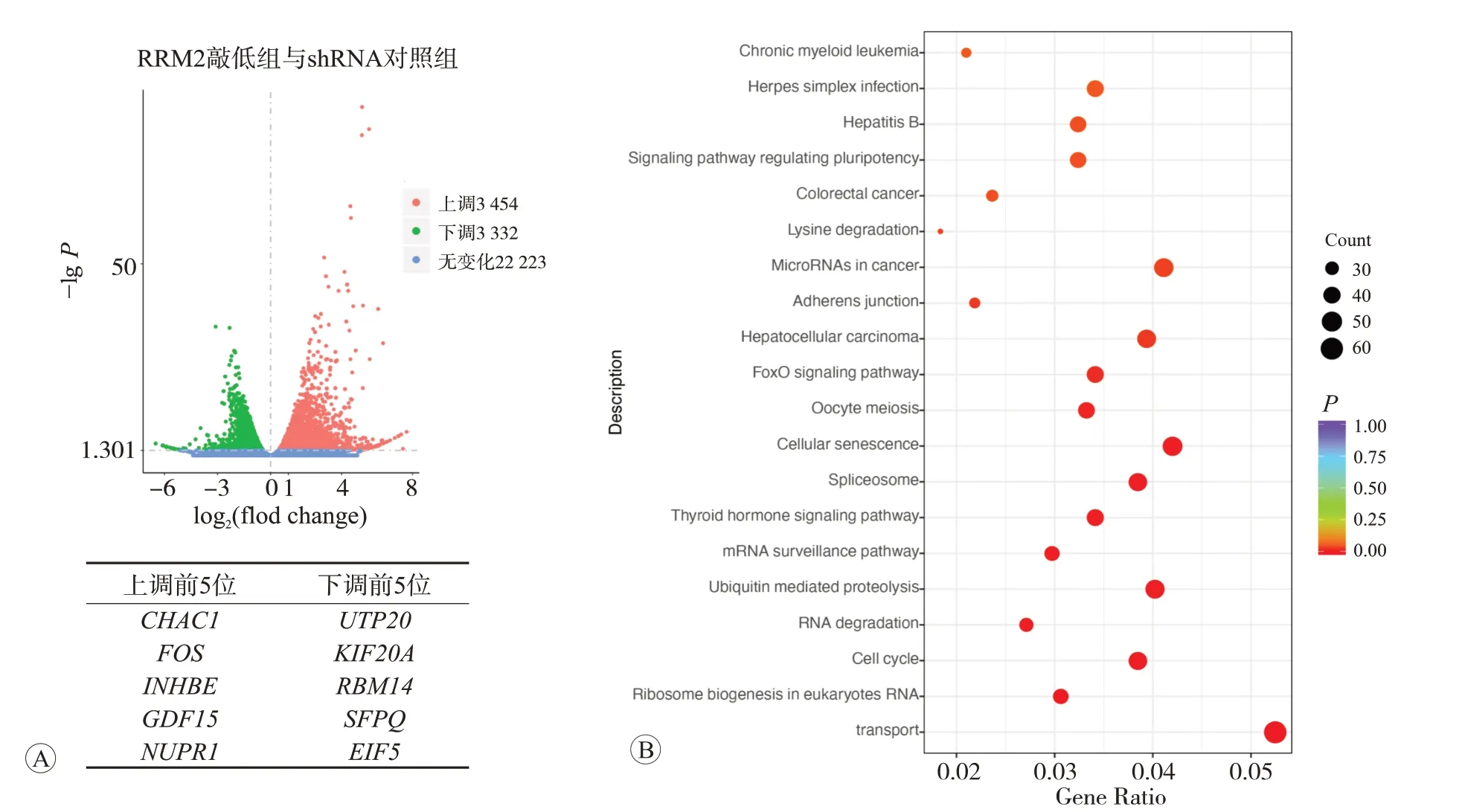
图4 Daoy细胞敲低RRM2的RNA-seq分析结果
3 讨 论
髓母细胞瘤是一种主要发生在儿童的恶性中枢神经系统肿瘤,近年来随着生物技术的发展和研究的推进,促进了人们对髓母细胞瘤生物学特点和发病机制的理解[8]。通过基因组、表观基因组、转录组和蛋白质组等不同维度的研究,绘制成髓母细胞瘤发生、发展、复发和耐药的分子图谱,也为改进诊断和治疗措施提供了新希望。尽管该肿瘤的治疗情况较十余年前已有较高的提升,但仍有接近20%~30%的患者在接受综合治疗后死亡,因此也亟需新的治疗策略。
RRM2是核糖核苷酸还原酶的M2亚单位,是DNA合成和修复过程中的关键酶[9-10]。RRM2被认为行使着癌基因的作用,在多种类型的恶性肿瘤中表达升高[11-12]。在本研究中通过数据库分析发现RRM2 在小脑髓母细胞瘤中呈高表达,并和小脑髓母细胞瘤的预后不良有关。进一步通过临床组织标本,在蛋白水平验证RRM2 在小脑髓母细胞瘤中的表达高于正常小脑组织。
RRM2 的致癌能力在多种类型的恶性肿瘤中已有报道。既往的研究结果显示,在人胶质母细胞瘤中,RRM2 能够促进细胞增殖、迁移和侵袭,并减少细胞凋亡[13];在鼻咽癌中,RRM2 过表达增强了集落形成以及细胞增殖、迁移和侵袭[14]。本研究通过体外实验,明确了RRM2 的促癌作用,证实RRM2 能够促进髓母细胞瘤细胞系的增殖和迁移,增加S 期细胞的比例,并能抑制肿瘤细胞的凋亡,表明RRM2 在髓母细胞瘤的发展中起着重要作用。
以往的研究结果表明,RRM2 能够调控AKT、WNT 等信号通路[15]。例如在肾癌中RRM2 能够通过上调ANXA1 的表达激活AKT 通路,从而促进肿瘤生长和舒尼替尼耐药[16]。目前对RRM2 在小脑髓母细胞瘤中发挥生物学作用的分子机制仍然缺乏综合性了解。在本研究中,通过RNA-seq 测序和KEGG 分析提示差异基因主要富集的生物学过程,其中包括FOXO 信号通路、细胞周期等。FOXO3属于FOXO 家族的一个亚型,是抑癌基因,在调控肿瘤细胞增殖、转移、细胞周期、凋亡、DNA 损伤等过程中发挥重要作用[17]。在前列腺癌中AKT能够通过磷酸化FOXO3,使其失去转录活性,并从细胞核向细胞质转移[18]。因此我们推测,RRM2可能通过AKT/FOXO3通路调控髓母细胞瘤的发展,但需要进一步的深入研究。
综上所述,本研究通过数据库、临床样本和体外实验证实了RRM2 在小脑髓母细胞瘤中发挥促癌基因的作用。通过对其上下游分子机制深入研究,RRM2有可能作为评估髓母细胞瘤恶性程度、预后和治疗靶点的潜在分子。
