细胞分裂周期相关因子2的研究进展
2023-08-07李仁燕
杜 威,李仁燕,杨 丹,
(1.重庆医科大学附属第二医院,重庆 400010;2.重庆市人口和计划生育科学技术研究院,重庆 400020)
肿瘤的发生发展是一个十分复杂的过程,表现出不同的生物学特征,通常具有基因组不稳定性的特征[1]。大多数肿瘤细胞具有形态与功能的改变。细胞核结构及染色体的改变是许多肿瘤诊断、分期和预后评估的重要生物标记。
细胞分裂周期相关因子2(cell division cycle associated 2,CDCA2)作为细胞周期分裂相关调控因子,也是磷酸酶1γ(phosphatase 1γ,PP1γ)的调节亚基[2],CDCA2/PP1γ复合体对多个信号通路十分重要。蛋白的磷酸化调控是一些信号通路的“开关”,具有使信号通路激活或失活的作用。CDCA2/PP1γ与蛋白激酶共同介导特定底物的磷酸化修饰,在细胞染色体分离、染色体重建、核膜重塑、异染色体形成与DNA损伤修复等方面均具有重要功能,并且它与肿瘤的发生、发展、预后具有密切的关系。深入探索CDCA2分子的功能及其作用机制,有利于为肿瘤的靶向治疗、诊断提供新的理论依据。
1 概 述
CDCA2基因最早于2001 年被发现,定位于8 号染色体(8p21.1),并被认为是一种新的细胞周期相关基因[3]。研究发现,CDCA2是磷酸酶PP1的调节亚基,在有丝分裂后期它可以招募PP1 定位到染色体(recruits PP1 onto mitotic chromatin at anaphase,Repo-Man),因此也被命名为Repo-Man[2]。CDCA2基因具有复杂的结构与功能,含有1 023个氨基酸,其全长的结构域包括:N 端(1~135 残基)与importin β蛋白相互作用的结构域,中间区域为分别与磷酸酶PP1、PP2A 相互作用的RVTF结构域、LSPI结构域以及与CDK1/Cycllin B结合的一段保守序列(403~550 残基),C 端为与组蛋白结合(histone bingding,HB)的结构域[4-6]。研究发现,CDCA2 的N 端结构域可被激酶CDK/Cyclin B 磷酸化修饰,其磷酸化状态影响CDCA2 与importin β的相互作用,并且这种相互作用在有丝分裂后期才开始形成,并能维持到细胞间期[5,7]。RVTF结构域是PP1与CDCA2相互作用的关键位点,当RVTF 突变为RATA 时,它们之间的相互作用明显减弱。此外,CDK 磷酸化中间保守序列中的S400、T412、T419 位点也可以明显抑制PP1 与CDCA2 的相互作用。相反,CDK磷酸化LSPI结构域,CDCA2与PP2A的相互作用增强[5]。简言之,CDCA2 与相关蛋白的集合能力与其磷酸化状态密切相关,其功能会随着CDK/CyclinB 在细胞周期中的活性变化而变化。因此,CDCA2在不同时期的功能具有明显差异,导致了其功能的复杂性。
研究表明,CDCA2 的定位会随着细胞周期变化。细胞间期,CDCA2定位于细胞核;当细胞进入有丝分裂早期,定位至细胞质;而随着有丝分裂后期开始,重新定位到染色体[5]。接下来,本文将对CDCA2的不同功能进行阐述。
2 CDCA2调控染色质重组、核膜重塑与异染色质的形成
细胞增殖过程中,有丝分裂前期染色体凝集是实现后期染色体均等分离的重要条件[8]。如果染色体前期凝集或后期解凝集过程异常,细胞分裂将出现染色体分离滞后,这是导致子代细胞染色体异倍体出现的重要原因之一。染色体凝集主要受由凝缩蛋白和组蛋白翻译后修饰共同调控[8-11],凝缩蛋白由染色体结构维持蛋白(structure maintenance of chromosome,Smc)2 和4 及3 种非Smc 蛋白组成的。研究表明,在DT40 细胞中敲除Smc2,影响后期凝缩蛋白从着丝粒附近脱离,导致细胞产生大量的染色体分离滞后,而外源过表达与PP1结合缺陷的突变体CDCA2RATA能够挽救这一现象[12]。此外,被激酶Aurora B磷酸化的组蛋白H3第10位丝氨酸(H3S10ph),是调控有丝分裂前期染色体凝集状态的重要标记分子[13]。后期CDCA2招募PP1定位染色体,使H3S10ph 去磷酸化,抑制凝缩蛋白与染色体结合[14-16],有利于姐妹染色单体的分开。因此,CDCA2/PP1 对子代细胞完成正确的染色体重塑是必不可少的。
细胞核膜在有丝分裂前期破裂,末期重新形成。末期核膜重塑(nuclear envelope organization)是保证子代细胞基因组稳定的重要过程[17]。如前所述,在有丝分裂后期开始时,CDCA2的定位重新转移至染色体外围(chromosome periphery)。研究表明,CDCA2 的N 端(1~135 aa)与 核 纤 层 蛋 白Importin β、Nup153具有直接或间接的相互作用,可促进Importin β等蛋白定位染色质,调控末期核膜重塑,并且这种机制对核膜重塑的调控是不依赖于PP1的[5,18-19]。见图1。当敲除CDCA2的N端或使N 端持续磷酸化时,CDCA2 与Importin β的相互作用明显减弱,细胞出现显著的核膜重塑缺陷[5]。还有研究表明,有丝分裂末期,CDCA2 的第762 位赖氨酸(K62)被苏木化修饰(SUMO),可增强CDCA2 与核纤层蛋白Lamin A 的相互作用,CDCA2/PP1使Lamin A去磷酸化,可促进子代细胞核纤层的再生[20]。由此可见,CDCA2与核纤层蛋白的相互作用及调控,对核膜重塑十分关键。

图1 CDCA2与其他蛋白结合位点示意图[5]
细胞完成有丝分裂后,进入间期,CDCA2/PP1同样具有重要的功能。CDCA2 通过与核孔复合物(nuclear pore complex,NPC)成员Nup153 间接作用,定位在染色体外围与核篮(nucleopore basket),CDCA2/PP1 使组蛋白H3 第28 位 丝 氨 酸(H3S28)去磷酸化,促进异染色质蛋白1(heterochromatin protein1,HP1)焦点的再形成,触发异染色质标记分子H3K27me3、H3K9me3 的局部富集,其中CDCA2 与H3K27me3具有直接相互作用,调控异染色质形成[21]。研究还表明,CDCA2 与组蛋白变体H2AZ、H3.3 富集于亚端粒(subtelomeric)区域,对该区域多梳调基因的表达十分重要[21]。综上,有丝分裂末期,CDCA2/PP1 参与调控染色质重组与核膜重塑;间期,具有调控异染色质的形成的功能。
3 CDCA2与激酶Aurora B激酶
Aurora B 作为染色体乘客复合体(chromosomal passenger complex,CPC)唯一的蛋白激酶成员[22-25],可磷酸化定位着丝粒的MACK、Ndc80C/Hec1等蛋白,具有纠正着丝粒-微管连接错误的功能,它是维护染色体整倍体的重要分子[26-30]。CPC 在着丝粒处的定位,具有纠正着丝粒-微管连接错误的功能。有丝分裂前期,CPC主要定位于染色体臂,中期被招募至着丝粒附近。激酶Haspin磷酸化组蛋白H3的第3位苏氨酸(H3T3ph),是负责招募CPC 至着丝粒定位的重要标记分子之一[31-34]。研究表明,CDCA2/PP1 复合体可使H3T3ph 去磷酸化[35]。早期,被CDK 多位点磷酸化的CDCA2 与PP1 相互作用较弱,可保护H3T3ph 水平,促进其对Aurora B 着丝粒定位的招募。同时,激酶Aurora B、PLK1多位点磷酸化Hapin,可促进Haspin的活性,增强H3T3ph[36];Aurora B磷酸化CDCA2的第893位丝氨酸(S893ph)。前中期,S893ph是促使CDCA2从染色体脱离的关键标记分子[4],CDCA2从染色体脱离可维持H3T3ph水平。由此可见,CDCA2 既作为Aurora B 的底物,同时也能调控Aurora B在着丝粒处募集,影响其对着丝粒-微管连接错误的纠正功能。随着细胞开始进入有丝分裂末期,磷酸酶PP2A 靶向S893ph,从而使S893ph 水平降低,使CDCA2 重新定位至染色体,CDCA2/PP1 靶向组蛋白H3 的尾部,使H3T3ph、H3S10ph等分子去磷酸化,调控染色体正确分离。见图2。
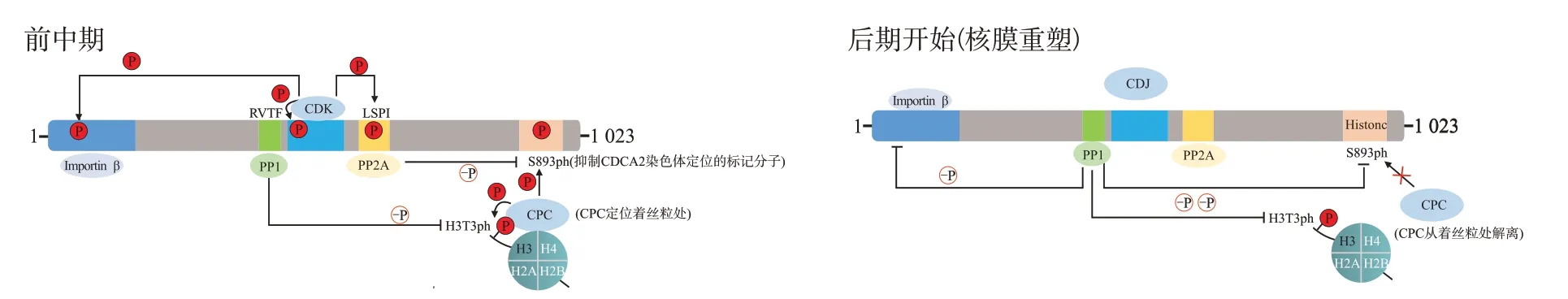
图2 CDCA2与磷酸酶PP1、PP2A协调CPC调控H3T3ph[5,7]
此外,研究还发现CDCA2、Aurora B分别在某些肿瘤中表达上调,但两者之间的关系并不清楚。进一步分析CDCA2 与Aurora B均表达上调的肿瘤,发现其主要原因是在肿瘤细胞周期中两者均经历了蛋白降解调控途径,并且2种蛋白水平出现类似的变化趋势。当Repo-Man 过表达时,肿瘤细胞对Aurora B 抑制剂较敏感。当Aurora B 和Repo-Man 共同上调时,肿瘤细胞对Aurora B抑制剂更敏感[37]。该研究还发现,在未来对肿瘤的治疗过程中,可将Aurora B 抑制剂与CDCA2 靶点联合作用治疗肿瘤,增加药物靶向性。
4 CDCA2与DNA损伤修复
细胞在复制、新陈代谢等内源性因素或电离辐射、化疗药物等外源因素的情况下,可能会产生不同程度的DNA 损伤[38]。针对这些损伤,细胞进化出一些保护机制,通常称为DNA损伤反应(DNA damage response,DDR),包括DNA损伤修复与细胞周期检查点等信号传导通路[39-40]。DDR 的激活依赖于共济失调毛细血管扩张突变基因(ataxia telangiectasia mutated,ATM)和其他激酶蛋白的磷酸化,PP1等磷酸酶是调控DNA损伤修复的重要蛋白分子[41-43]。如果DDR 调控异常,将导致细胞基因组不稳定,出现细胞生长停滞、死亡,甚至导致肿瘤的发生[44]。关于CDCA2 在DNA 损伤修复中的功能探索,Peng 等[45]研究报道,在非洲爪蟾卵母细胞中,CDCA2通过靶向PP1负调控ATM活性,从而影响DNA 损伤检查点。敲低CDCA2,ATM 活性明显增强;过表达野生型CDCA2 可明显抑制ATM 活性,而过表达与PP1结合位点缺失的突变体,ATM活性并不会受到抑制[45]。
细胞发生DNA损伤时,细胞周期检查点被激活,延迟细胞周期进程,直到这些损伤被修复。细胞周期检查点包括G1/S、S期、G2/M,检查点的异常调控可导致染色体畸变,是肿瘤发生、发展的重要原因之一[46]。据报道,CDCA2在肺腺癌中高表达,敲低CDCA2,可使CCNE1 表达下调,细胞被阻滞在G1/S期,过表达CDCA2 可明显促进细胞增殖。CDCA2 在KYSE450、TE13 食管鳞状细胞癌细胞中表达也上调,敲低CDCA2,并使用X 射线照射处理,细胞出现明显的G2/M 阻滞[47]。此外,在口腔鳞状细胞癌中,与单独使用顺铂处理相比,敲低CDCA2与顺铂联合使用,可明显促进细胞自噬[48]。这表明,抑制CDCA2 表达在增强放疗效果和增强致DNA 损伤类化疗药物疗效等方面具有很大潜力,进一步对CDCA2的深入研究可为开发新的抗肿瘤药物提供理论依据。
5 CDCA2与肿瘤
自CDCA2基因被鉴定以来,关于Repo-Man 表达水平与肿瘤恶性程度间相关性的首次报道是对神经母细胞瘤的研究。Ryu 等[49]通过对神经母细胞瘤患者的生存分析发现,CDCA2 高表达的患者,其预后明显较差[49]。通过对比不同肿瘤与正常组织中的CDAC2 表达,大多数肿瘤组织的CDCA2 均表达较高。除此之外,CDCA2 还在黑色素瘤、肝癌、结直肠癌、前列腺癌、食管鳞状上皮癌等肿瘤细胞中表达上调[50-53]。研究表明,在比较一系列不同恶性程度的黑色素瘤细胞的基因表达谱中发现,CDCA2主要源自原发性病灶,提示它的高表达与黑色瘤的恶性程度相关[54]。在肝癌发展过程中,CDCA2高表达,促进肝癌细胞的增殖,其机制是激活PI3K/AKT 信号通路,靶向Cyclin D1,调控细胞周期[50];同时研究表明,CDCA2高表达与肝癌的病理分级和TNM分期呈正相关,并且它可以作为肝癌预后判断的标记分子[55]。此外,在肝癌中,低甲基化的CDCA2可显著降低T 细胞和细胞毒性淋巴细胞的免疫浸润水平[56]。在结直肠癌中,CDCA2 的高表达可上调Cyclin D1 的表达,促进细胞周期进程。在前列腺癌细胞中,CDCA2与前列腺癌进展正相关[52],研究表明,CDCA2 可能通过HIF-1a/SMAD3 信号通路调控前列腺癌的发生发展。在食管鳞状细胞癌中,CDCA2的高表达与KYSE450 和TE13 细胞系的增殖密切相关,CDCA2 通过细胞周期与G2/M检查点,调控食管鳞状细胞癌的抗辐射能力。
综上,CDCA2 表达水平上调可能是人类肿瘤的一个特征,它在晚期癌症中的过度表达,可能与肿瘤的不良预后相关。尽管还需要更多的科学数据来验证CDCA2与肿瘤预后的关系,具体的分子机制还需要进一步探索,但是以上关于CDCA2与肿瘤关系的初步研究,表明CDCA2与肿瘤发生发展具有密切的关系。
6 结语与展望
目前为止,关于CDCA2调控基因组稳定性的研究,一方面是在有丝分裂早期,CDCA2/PP1 通过H3T3ph 分子调控CPC 复合体着丝粒定位,保证染色体正确分裂;后期,CDCA2与凝缩蛋白共同调控着丝粒附近姐妹染色单体的凝聚力,维持染色体的正常结构;末期,CDCA2/PP1 通过介导Importin β、Nup153、Lamin A 等蛋白分子的染色质定位,调控核膜重塑;分裂完成后的间期,CDCA2与H3K27me3直接相互作用,调控异染色质的形成。另一方面是在DNA 损伤时,CDCA2 通过靶向ATM、细胞周期检查点等参与调控DNA 损伤修复过程。然而,目前关于CDCA2定位由前中期定位胞浆到后期转移至染色体定位的具体调控机制仍不清楚。虽然已有文献报道,在前中期,Aurora B、CDK1 磷酸化CDCA2,使其定位至胞浆,但是是否还存在其他激酶共同参与,以及后期去磷酸化后的CDCA2又被哪些分子将其招募染色体定位是不明确的,它们之间具体的调控机制还需要进一步的探索。同时,CDCA2与染色体结合的区域是否受组蛋白翻译后修饰分子调控,及其是否会随着这些标记分子在细胞周期中的变化而改变;以及CDCA2 招募ATM 等分子参与DNA 损伤修复是否受这些组蛋白翻译后修饰分子的调控仍需进一步研究。
关于CDCA2与肿瘤的相关研究还处于初步阶段。目前,虽然发现CDCA2的高表达与肿瘤密切相关,但是关于其对肿瘤发展、预后相关的分子机制还十分不清楚。因此,还需要对CDCA2蛋白进一步深入研究,为肿瘤的早期诊断、靶向治疗等提供新的理论依据。
