δ-HPMA颗粒的合成及其吸附刚果红试验研究
2023-08-05李中林吕凤程李义兵蒋学先
李中林,王 丁,吕凤程,邹 婷,李义兵,蒋学先
(1.桂林理工大学 材料科学与工程学院,广西 桂林 541000;2.桂林理工大学 有色金属与材料加工新技术教育部重点试验室,广西 桂林 541000;3.桂林理工大学南宁分校 冶金与资源工程系,广西 南宁 530000)
刚果红是一种常见的偶氮染料,处理不当会对环境和人类健康造成重大威胁[1-2]。目前,去除废水中刚果红的技术主要有生物降解法、氧化法、膜分离法、吸附法[3-7]等。其中,吸附法应用最为广泛,而吸附剂是实现高效、低成本吸附的关键。因此,开发一种对刚果红具有高吸附性能的吸附剂尤为重要。
高纯介孔氧化铝(High-purity Mesoporous Alumina,HPMA)是一种超细粉体材料[8],因具有优良的催化活性和吸附性能[9-12],已被广泛应用于陶瓷、涂料、航空航天、荧光支持、单晶材料、催化剂支持等高科技领域。目前,我国HPMA材料主要依赖进口,因此,研发更经济高效的HPMA合成工艺以缓解材料供应不足具有重要意义。
试验研究了以工业氢氧化铝为原料,采用重溶-重结晶法制备一种高纯δ-HPMA纳米颗粒吸附材料,考察了各因素对产品纯度及杂质去除率的影响,确定了最佳工艺条件。对材料的物化性质、物相、形貌进行表征,探讨了δ-HPMA纳米颗粒对刚果红的吸附热力学及动力学,以求为高效快速吸附水溶液中刚果红提供可选择的吸附材料。
1 试验部分
1.1 试验原料及试剂
工业Al(OH)3:来自西陇科学股份有限公司,主要化学组成见表1。
试验试剂:氢氧化钠、氢氧化铝、盐酸、刚果红、无水乙醇,均为分析纯,购自西陇科学股份有限公司。
1.2 试验设备及仪器
电子分析天平,EL104型,梅特勒-托利多仪器有限公司;集热式磁力加热搅拌器,DF-101S型,金坛市医疗仪器厂;鼓风电热恒温干燥箱,DHG-9076A型,上海精宏试验设备有限公司;超声波冲洗仪,KQ3200DE型,昆山市超声仪器有限公司;超纯水机,WP-UP-Ⅳ-20型,四川沃尔特科技发展有限公司;X射线粉末衍射仪,X’Pert PRO型,以Cu Kα作为辐射源,荷兰帕纳科公司;场发射电子扫描显微镜,S-4800型,日本高新技术公司;X射线能谱仪(EDS),X-max 50型,日本HORIBA公司;表面积和孔隙测定仪,NoVA 1200e型,康塔克默仪器贸易(上海)有限公司;紫外可见光谱仪,UV-9000S型,日本岛津公司。
1.3 δ-HPMA纳米颗粒的制备
在一定温度条件下,工业Al(OH)3用高浓度NaOH溶液重溶得到铝酸钠溶液(NaAl(OH)4),重溶过程中,只有微量Fe2O3杂质与NaOH反应生成NaFe(OH)4进入溶液。而混合溶液中的SiO2与NaOH在重溶和种分阶段反应生成的可溶性硅酸钠(Na2SiO3)则继续与NaAl(OH)4反应生成水合铝硅酸钠沉淀(Na2O·Al2O3·1.7SiO2·nH2O)。由于种分过程中Al(OH)3晶体慢慢长大后发生团聚,晶间和晶体内会残留和吸附一定量Na2O杂质,使所得Al(OH)3粉末中Na2O含量较高。为了进一步降低产物中Na2O含量,在酸性水热条件下,采用超声冲击使晶体中残留的Na2O脱落。超声波波长短,近似直线传播,能量较集中,对微粒具有分散冲击作用,能够渗透到Al(OH)3晶粒微孔中,其产生的高压、高强冲击波可大幅降低分子间的作用力,能有效阻止Na2O发生团聚和吸附。整个过程中发生的主要化学反应如下:




称量219.4 g NaOH和281.4 g工业Al(OH)3置于水浴锅中。用400 mL高纯水在95 ℃水浴条件下搅拌至固体全部溶解,过滤后稀释至一定质量浓度,加入5 g分析纯Al(OH)3作为晶种,种分后过滤干燥。在500 ℃下焙烧种分所得中间产物Al(OH)3粉末,再将其与稀盐酸一起加入反应釜中,在200 ℃下反应4 h,洗涤沉淀物,过滤,干燥,磨细。沉淀物再在900 ℃下焙烧1.5 h,并在酸性环境下超声加热0.5 h,洗涤至中性,干燥,得目标产物Al2O3-δ-HPMA。
1.4 δ-HPMA纳米颗粒的表征
采用X射线粉末衍射仪分析δ-HPMA纳米颗粒的物相特性;采用场发射电子扫描显微镜观察材料的形貌与孔结构,用配置的X射线能谱仪(EDS)分析样品表面各元素成分及含量;采用场发射透射电子显微镜(FETEM)对氧化铝材料的形貌进行进一步表征;采用表面积和孔隙测定仪,通过液氮吸附法测定吸附剂的比表面积、孔隙体积和孔径分布;分别用BET和BJH模型计算氧化铝的比表面积和孔径。
1.5 δ-HPMA纳米颗粒吸附刚果红
为研究δ-HPMA纳米颗粒对刚果红的吸附性能和动力学,取10 mg/L刚果红溶液200 mL于烧杯中,缓慢滴入0.1 mol/L盐酸溶液,调节溶液pH至4,加入δ-HPMA纳米颗粒100 mg。随后将烧杯置于恒温水浴锅中,控制搅拌速度145 r/min,温度25 ℃。吸附一定时间后取刚果红溶液,离心,取上清液,用分光光度计测定吸光度,计算刚果红质量浓度。再将测定后溶液重新倒入原溶液中。刚果红吸附量(qt)计算公式为
式中:qt—吸附t时间时刚果红吸附量,mg/g;ρ0—初始刚果红质量浓度,mg/L;ρt—吸附t时间时刚果红质量浓度,mg/L;V—溶液体积0.2 L;m—δ-HPMA纳米颗粒用量,g。
为研究吸附热力学,配制一系列不同质量浓度的刚果红溶液,质量浓度范围为6~20 mg/L。取不同质量浓度的刚果红溶液各200 mL,分别置于烧杯中,再分别加入100 mgδ-HPMA纳米颗粒。在25 ℃条件下,将混合溶液搅拌24 h,待吸附达到平衡,离心,取4 mL上清液,用紫外可见光谱仪进行分析。刚果红平衡吸附量qe的计算公式为
式中:qe—刚果红平衡吸附量,mg/g;ρ0—初始刚果红质量浓度,mg/L;ρe—吸附平衡时刚果红质量浓度,mg/L;V—溶液体积,0.2 L;m—δ-HPMA纳米颗粒用量,g。
2 试验结果与讨论
2.1 δ-HPMA纳米颗粒的表征
2.1.1 XRD表征
所制备吸附剂的XRD图谱如图1所示。可以看出:所制备吸附剂的主要衍射峰均为δ-Al2O3的衍射峰,符合δ-Al2O3标准卡片(PDF#:29-0063)的衍射峰。说明此材料为高纯度的δ-Al2O3纳米颗粒。
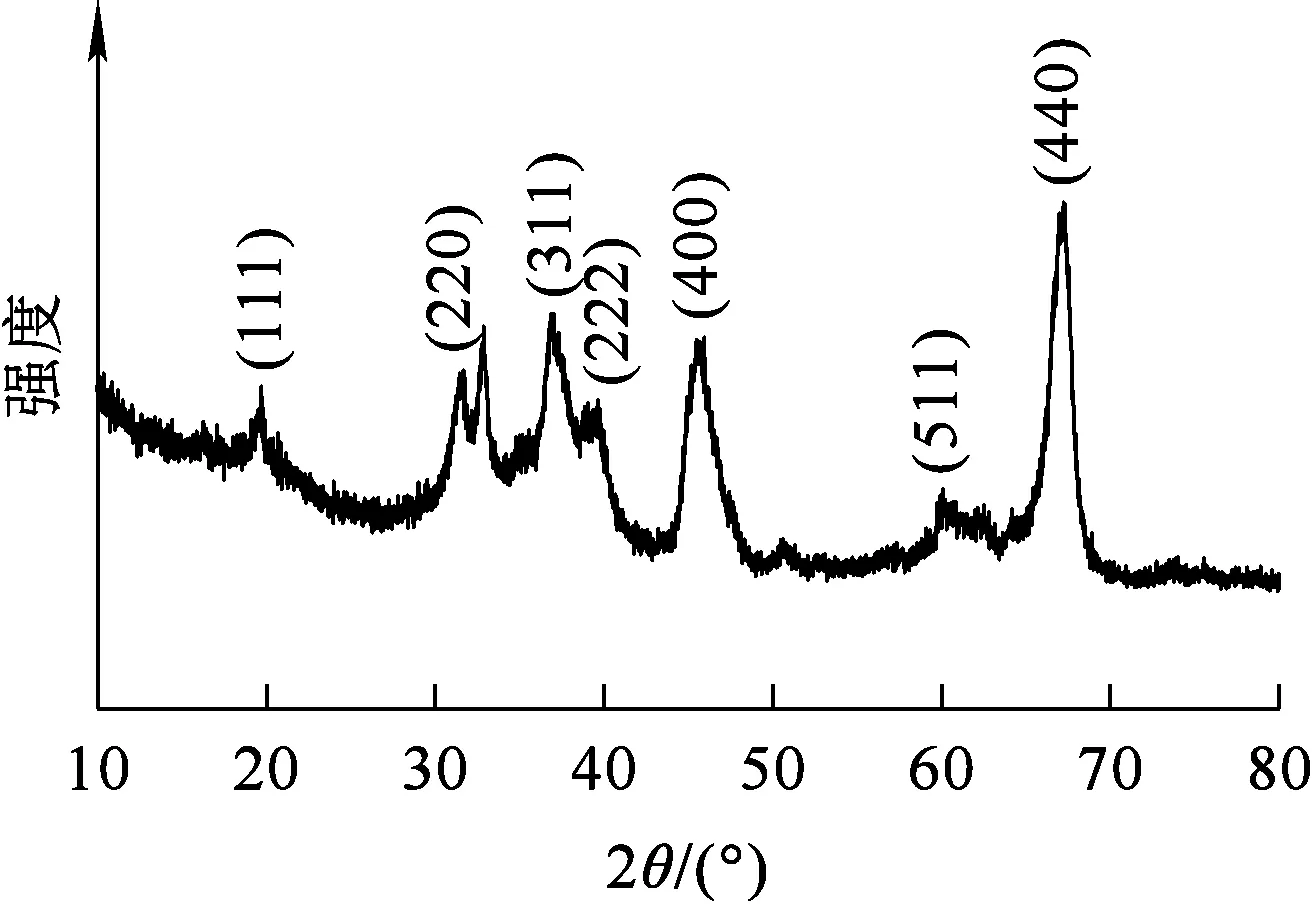
图1 δ-Al2O3纳米颗粒的XRD图谱
2.1.2 吸附—脱附等温线及孔径分布
样品N2吸附—脱附等温曲线和孔径分布如图2所示。可以看出:吸附等温曲线为典型的Ⅳ型等温线形状,并带有H1型滞后环,根据IPUAC的分类[13],产物为介孔材料。
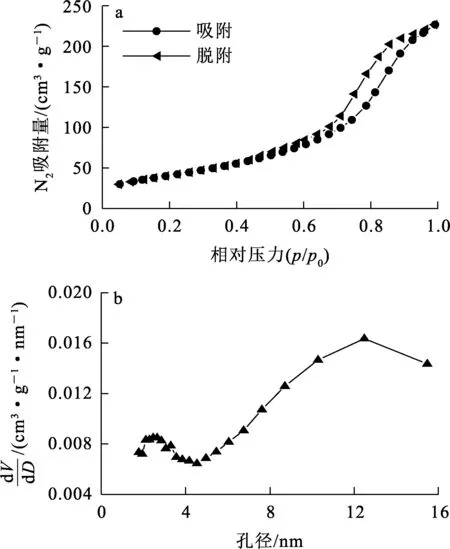
图2 δ-HPMA纳米颗粒的N2吸附—脱附等温曲线(a)及孔径分布(b)
2.1.3 SEM、TEM表征
δ-HPMA纳米颗粒的SEM和TEM分析结果如图3所示。可以看出:产物形貌为块状颗粒上附着的类似于金字塔的细小圆锥形颗粒,粒径为400~600 nm,表面无明显的孔结构。结合Al(OH)3结晶机制可知:结晶初期,NaAl(OH)4溶液处于过饱和状态,主金字塔侧面通过填充扭结部位形成次金字塔并继续生长,次生金字塔出现在前核簇中;金字塔底部则以填充螺旋结构的方式逐渐展开。结晶后期,溶液饱和度逐渐降低,侧面仅通过填充扭结部位生长,螺旋结构也转变为逐渐收缩变形的螺旋,初期的锥形颗粒渐渐变形为最终的块状颗粒[14]。

图3 δ-HPMA纳米颗粒的SEM(a)、TEM(b)分析结果
2.1.4 杂质含量及表面物理性能
δ-HPMA纳米颗粒中杂质质量分数及脱除率见表2,表面物理性能见表3。可以看出:3种杂质SiO2、Fe2O3、Na2O的质量分数均较低,纯度高达99.958%,杂质总脱除率为98.031%;δ-HPMA纳米颗粒的比表面积为102.35 m2/g,孔隙体积为0.12 cm3/g,孔径大小为6.5 nm,说明此工艺所合成的氧化铝材料为δ-HPMA纳米颗粒,纯度达3N级。
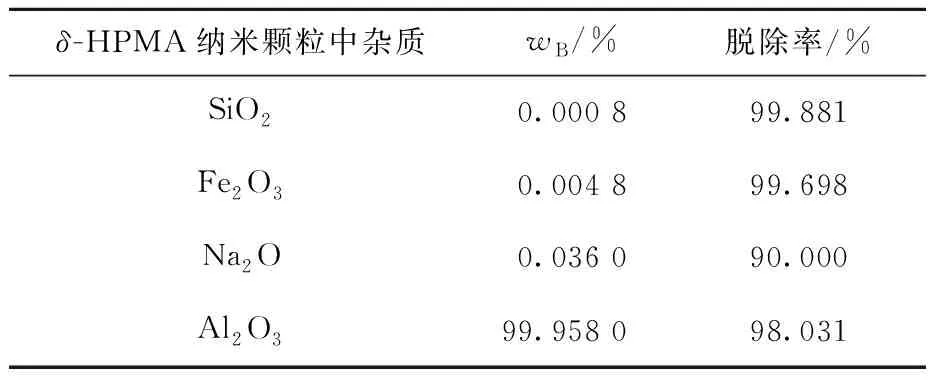
表2 δ-HPMA纳米颗粒中杂质质量分数及脱除率
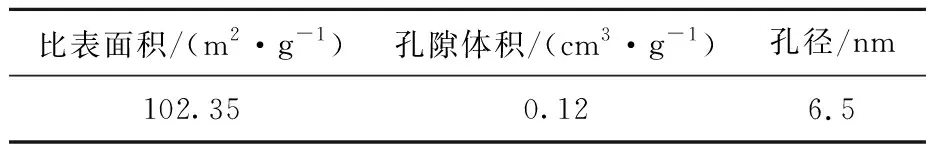
表3 δ-HPMA纳米颗粒的比表面积及孔结构特征
2.2 吸附动力学
在温度25 ℃、吸附剂用量100 mg、刚果红质量浓度10 mg/L、pH=4条件下,δ-HPMA吸附刚果红的动力学曲线如图4所示。
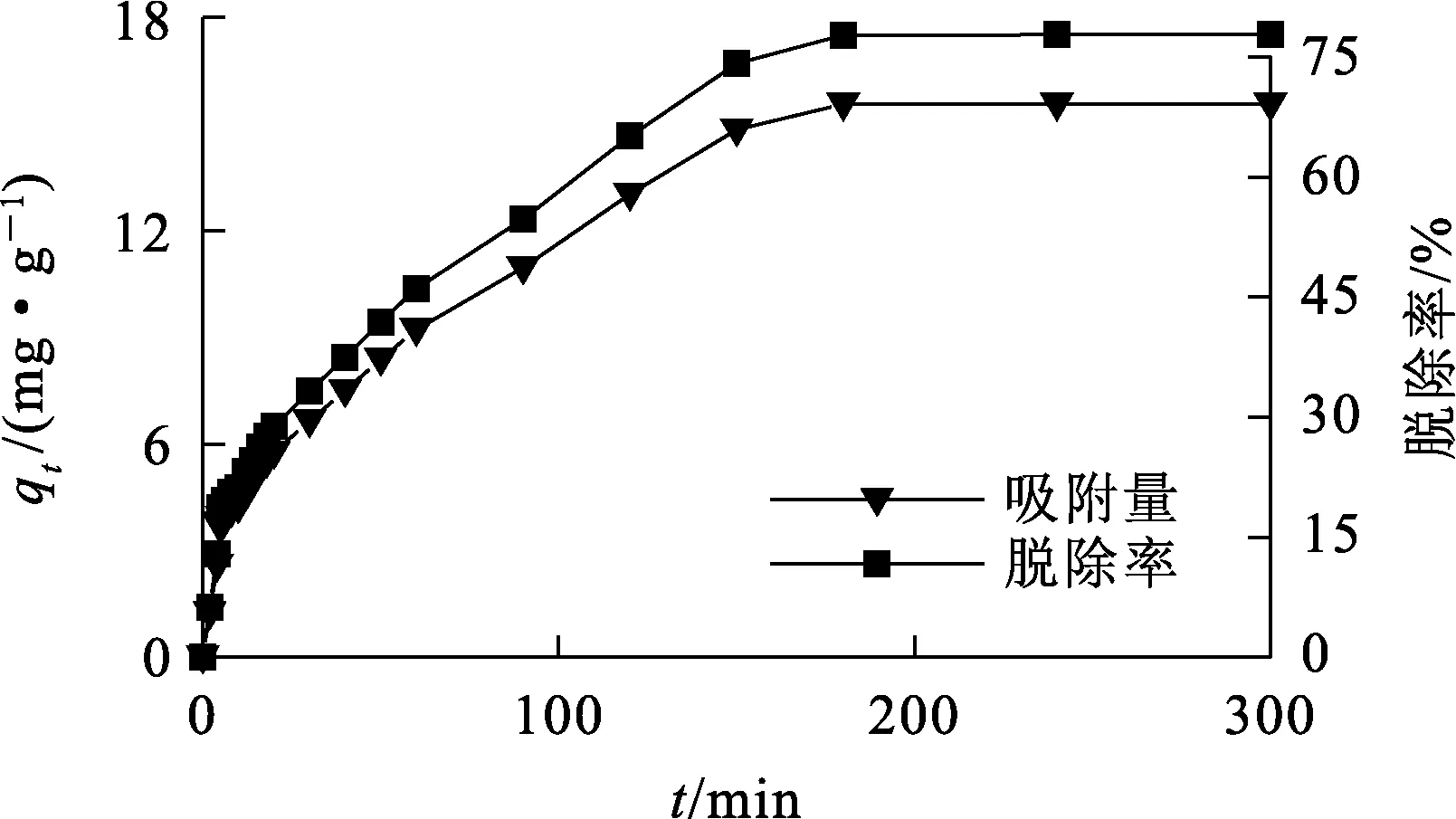
图4 δ-HPMA吸附刚果红的动力学曲线
由图4看出:吸附初期(0~20 min),吸附速率较快,这是由于溶液中初始刚果红质量浓度较高,刚果红分子扩散到吸附剂外表面的驱动力较大,吸附速率较快,吸附量呈上升趋势。但随吸附剂表面活性位点逐渐被占据至饱和,在吸附240 min时达吸附平衡,此时刚果红平衡吸附量仅为15.56 mg/g,去除率为77.80%。这是因为吸附在δ-HPMA纳米颗粒表面的刚果红离子和刚果红溶液之间存在排斥力,使得纳米颗粒表面剩下的空位很难进一步被刚果红占据所致[14-15]。
吸附动力学在吸附研究中起着至关重要的作用,不仅可以非常准确地表达出污染物在吸附过程中的动态去除率和吸附量变化曲线,还可以在推测吸附机制时提供相当实用的数据和有力的依据。采用准一级和准二级动力学模型对试验数据进行拟合,结果如图5和表4所示。
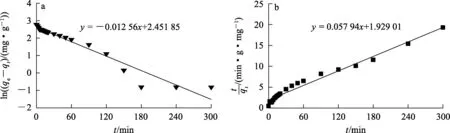
图5 δ-HPMA吸附刚果红的准一级(a)、准二级(b)动力学拟合曲线

表4 刚果红在δ-HPMA纳米颗粒上的吸附动力学参数
准一级动力学模型:
ln(qe-qt)=lnqe-k1t;
准二级动力学模型:
式中:qe—吸附平衡时刚果红吸附量,mg/g;qt—吸附t时间刚果红吸附量,mg/g;t—吸附时间,min;k1—准一级动力学吸附速率常数;min-1;k2—准二级动力学吸附速率常数,g/(mg·min)。
由表4看出:准一级动力学模型线性拟合相关系数较低,仅为0.703 15,说明吸附剂对刚果红的吸附不适合用准一级动力学模型描述;而准二级动力学模型的平衡吸附量拟合理论值为17.259 2 mg/g,接近试验值16 mg/g,相关系数高达0.977 1,说明吸附过程更符合准二级动力学模型。
为了进一步研究内部颗粒的扩散进程,用Weber和Morris提出的内部颗粒扩散模型[3]拟合上述试验数据。一般而言,吸附量相对于t0.5的分布要比相对于t的更有规律。内部颗粒扩散模型为:
qt=kdit0.5+ci。
式中:kdi—吸附过程中第i个阶段内扩散模型吸附速率常数,ci—内扩散模型常数。
线性拟合的各阶段曲线斜率kdi越大说明该阶段吸附速率越快;ci为每个阶段曲线的截距,ci越大边界层效应越明显,吸附速率越慢。对于内部粒子扩散模型而言,qt相对于t0.5在每一个吸附阶段应该是线性相关的,若曲线通过原点,曲线截距为0,则无边界层效应。即吸附速率限制过程只取决于内部粒子扩散速率,曲线斜率可直接反应材料的吸附速率。各阶段均以t0.5为自变量,qt为因变量,分别绘制每个吸附阶段的吸附曲线,结果如图6和表5所示。
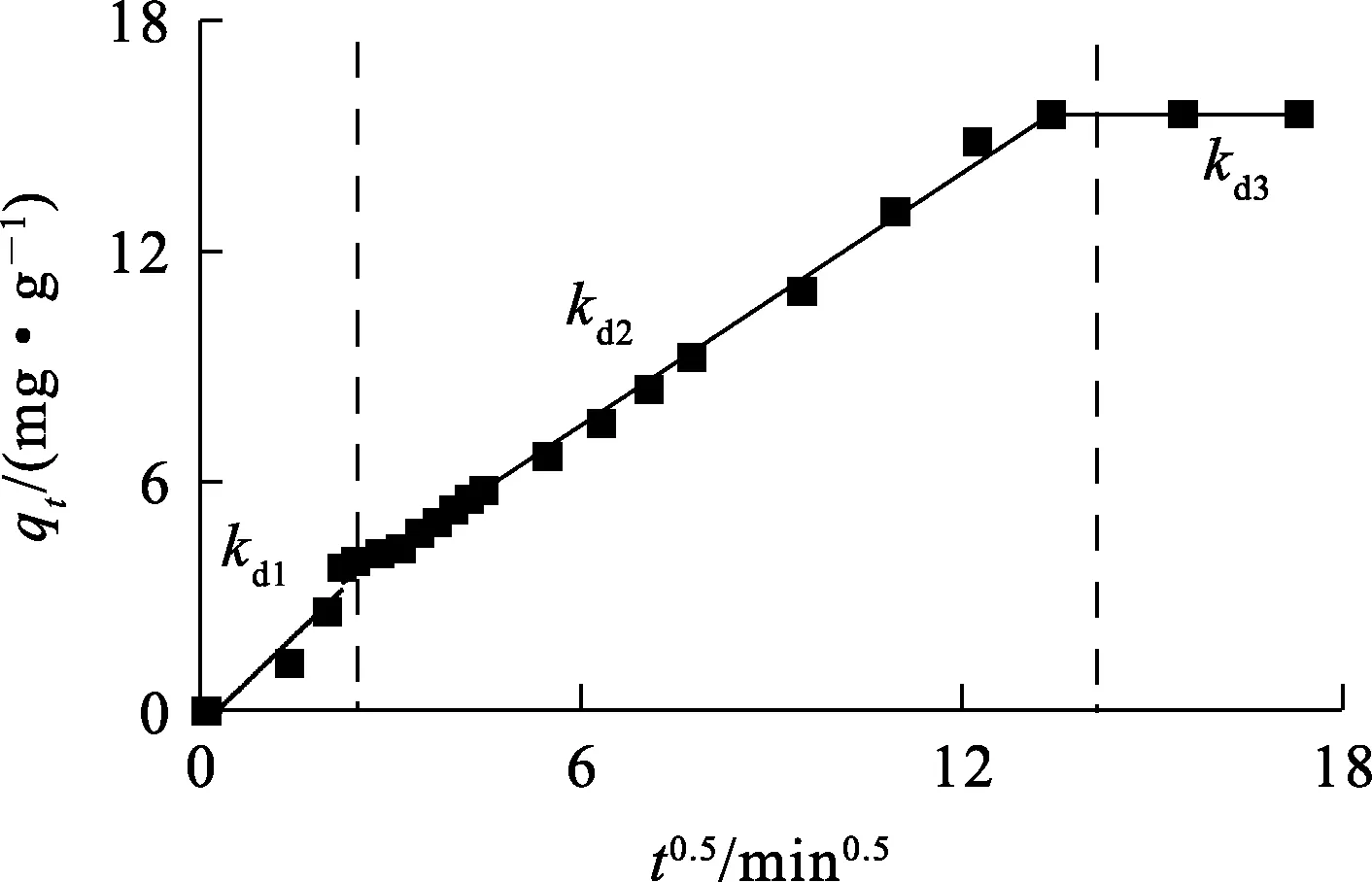
图6 δ-HPMA吸附刚果红的内部粒子扩散模型拟合曲线
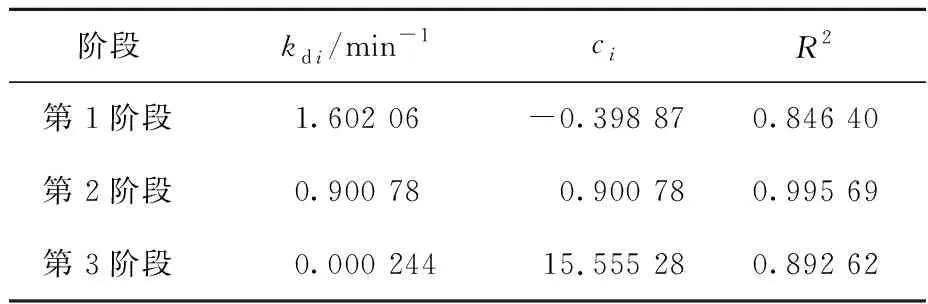
表5 内部颗粒扩散模型常数和其他相关系数
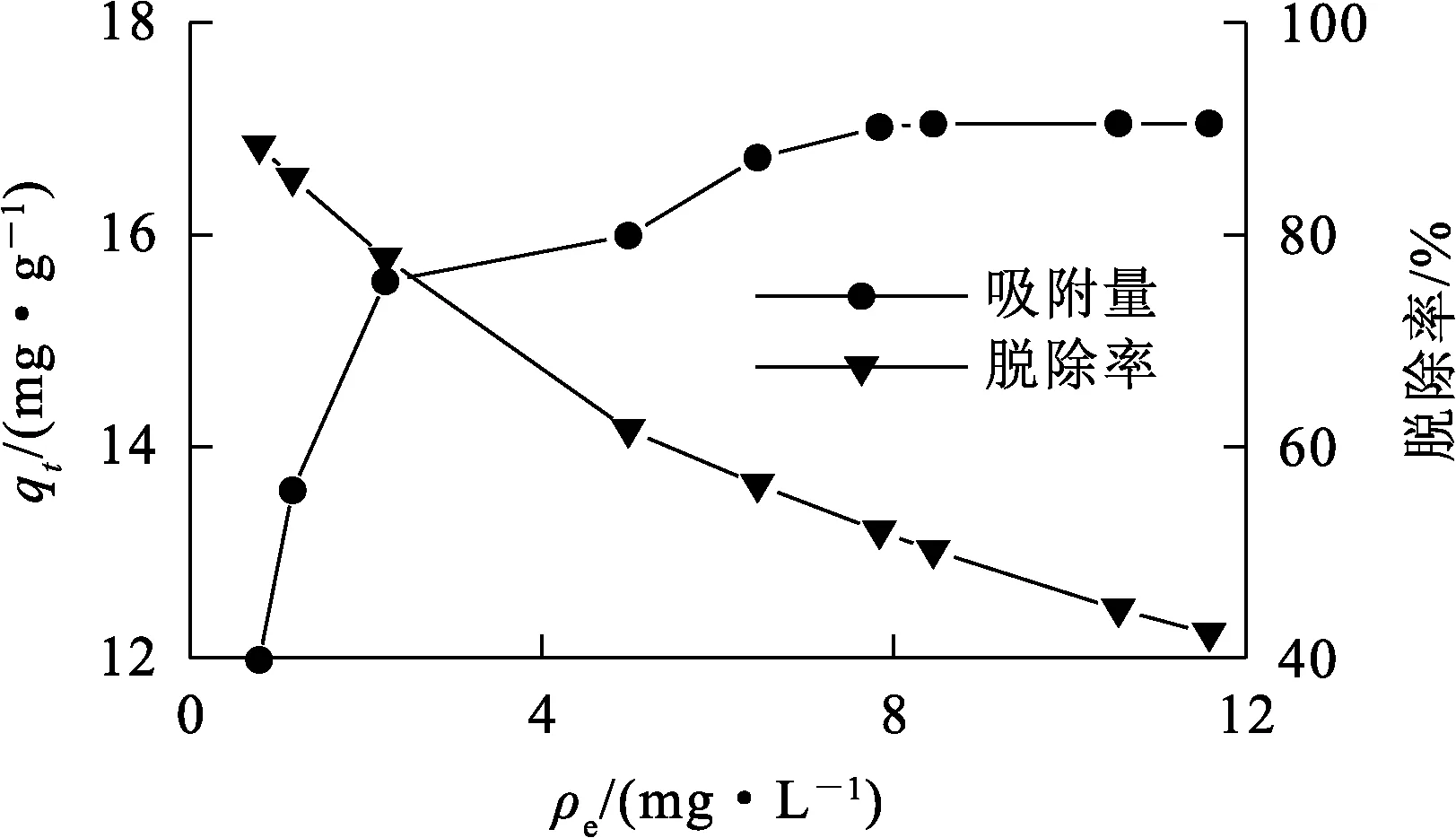
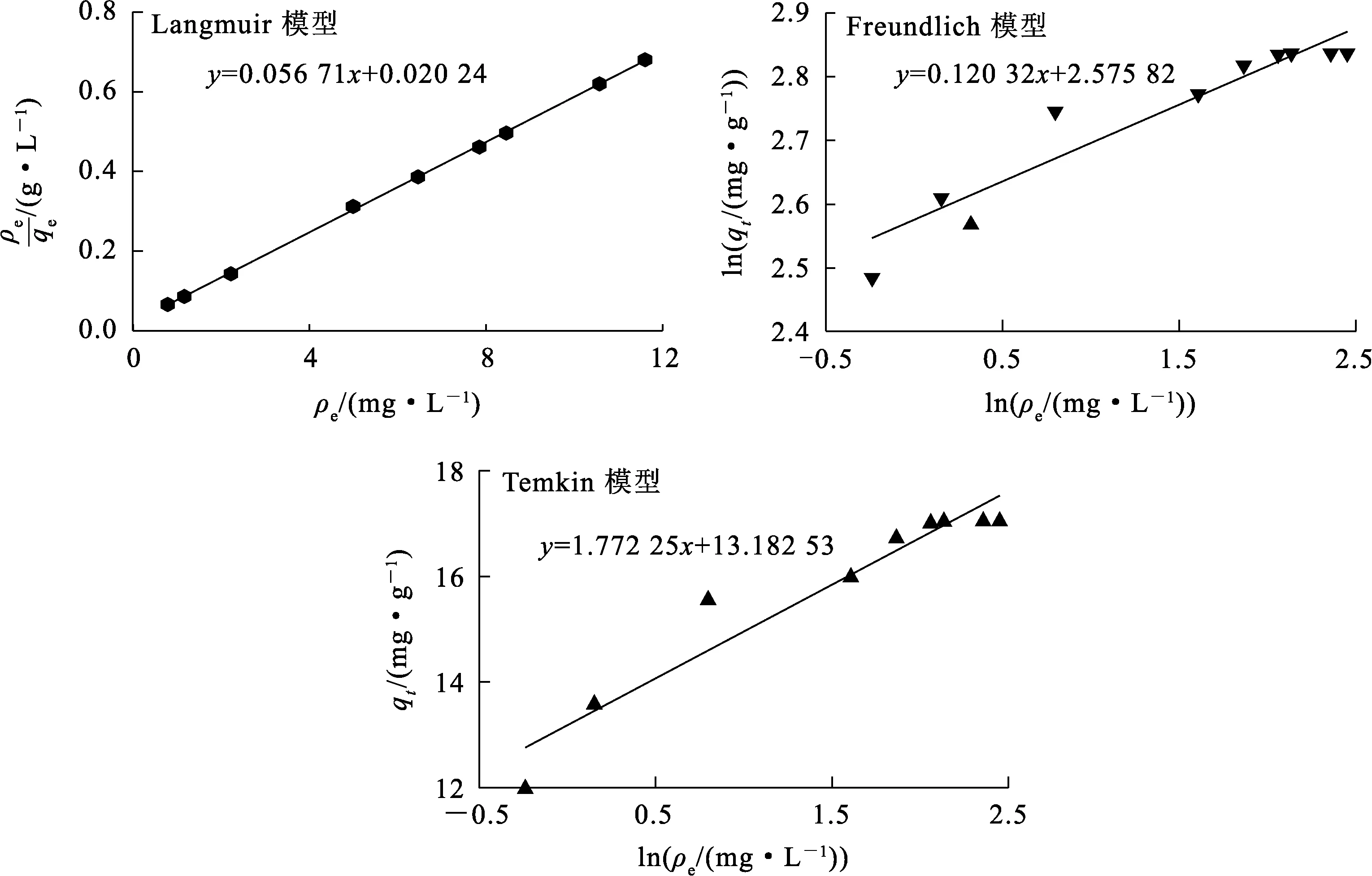
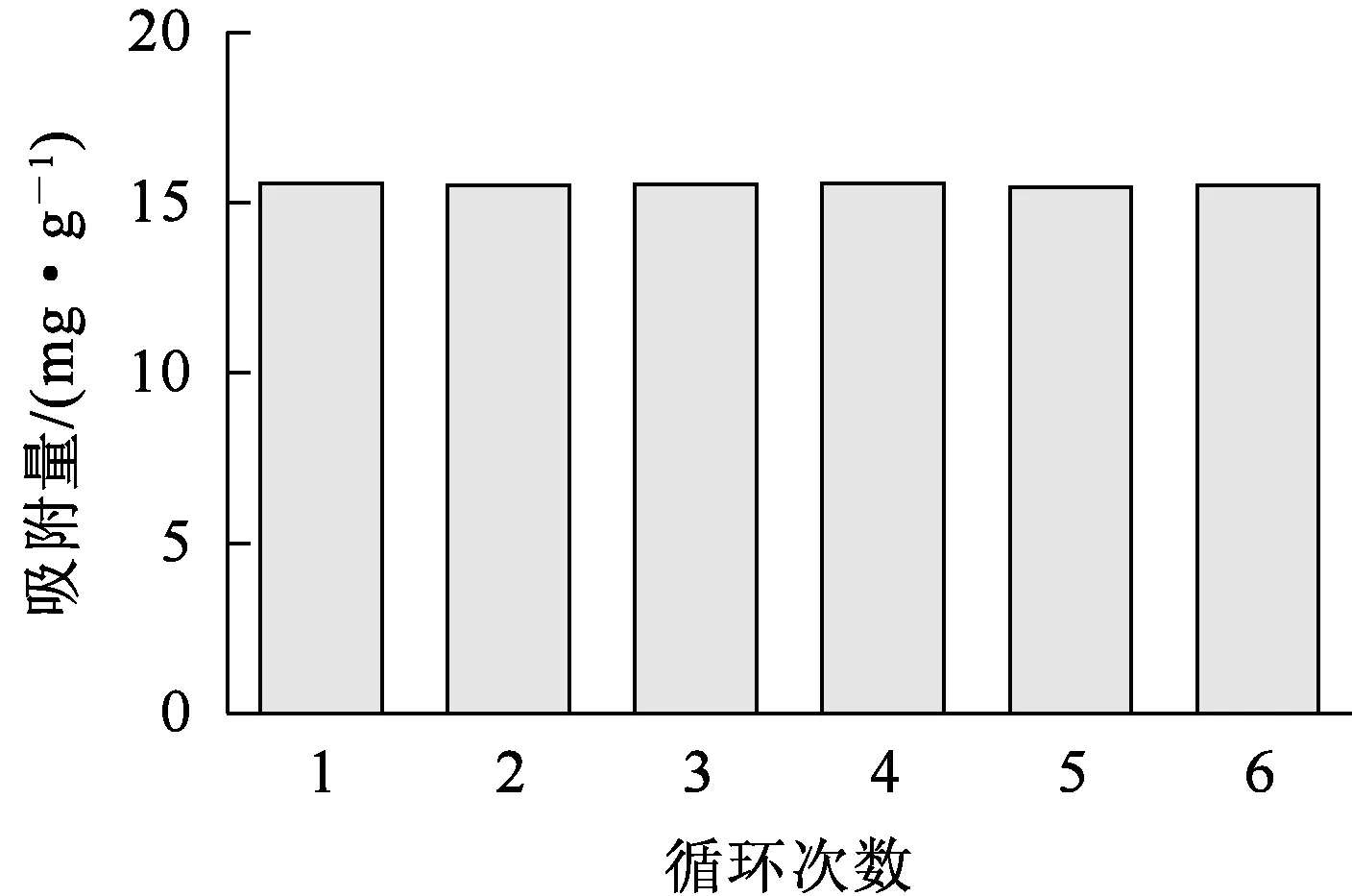
由图6、表5看出,δ-HPMA对刚果红的吸附过程可分为3个阶段:第1阶段(吸附前5 min),由于初始刚果红质量浓度较高,吸附速率很快,此阶段为瞬时吸附,也称为外部吸附,kd1=1.602 06,c1=-0.398 87;第2阶段(吸附5 min后),刚果红质量浓度逐渐降低,吸附速率明显下降,该阶段为渐进式或缓慢吸附阶段,吸附速率受到限制,kd2=0.900 8,c2=0.900 78;随刚果红质量浓度急剧下降,内部粒子的扩散速度十分缓慢,吸附过程进入第3阶段,即吸附平衡阶段,kd3=0.000 244,c3=15.555 28。综上得知,kd1>kd2>kd3,c1 δ-HPMA吸附刚果红的热力学曲线及脱除率随平衡质量浓度的变化曲线如图7所示。 图7 δ-HPMA吸附刚果红的热力学曲线及去除率随平衡质量浓度的变化曲线 由图7看出:随吸附平衡时刚果红质量浓度升高,δ-HPMA对刚果红的平衡吸附量升高,吸附能力增强,饱和吸附量为17.05 mg/g;而刚果红吸附率则随平衡质量浓度升高而降低。 吸附热力学模型是描述在吸附剂表面吸附物质分布的数学模型[16-17]。目前,由Langmuir[18]、Freundlich[19]和Temkin[20]提出的非线性热力学模型常被用来研究吸附机制。试验通过这3种等温吸附模型对试验数据进行拟合,判定吸附是发生在单层(Langmuir)、多层(Freundlich)还是通过扩散(Temkin)。拟合结果如图8和表6所示。 图8 δ-HPMA吸附刚果红的Langmuir、Freundlich、Temkin等温吸附模型拟合曲线 表6 δ-HPMA吸附刚果红的等温吸附模型拟合参数 Langmuir等温吸附模型: Freundlich等温吸附模型: Temkin等温吸附模型: 式中:ρe—吸附平衡时刚果红质量浓度,mg/L;qe—吸附平衡时刚果红吸附量,mg/g;qm—刚果红饱和吸附量,mg/g;kL—Langmuir等温吸附常数,L/mg;kF—Freundlich等温吸附常数,mg1-1/n·L1/n·g-1;kT—Temkin模型的等温线常数,L/mg;R—理想气体常数,J/(mol·K);T—热力学温度,K。 由表6看出:Langmuir模型拟合相关系数为0.999 65,而Freundlich模型和Temkin模型远低于Langmuir模型线性拟合相关系数,分别为0.893 17和0.915 47。说明Langmuir模型拟合效果更好,δ-HPMA对刚果红的吸附过程更符合Langmuir等温吸附模型,吸附过程符合表面单分子层的物理吸附,未发生化学反应[21]。经计算可知,δ-HPMA对刚果红的吸附饱和量为17.633 6 mg/g。 为了探究δ-HPMA对刚果红的循环吸附能力,将吸附刚果红后的δ-HPMA经反复洗涤后进行再生处理。在温度25 ℃、吸附剂用量100 mg、刚果红质量浓度10 mg/L、pH=4条件下,考察再生后δ-HPMA的吸附性能,重复进行吸附—脱附试验6次,结果如图9所示。可以看出:经过6次吸附—脱附,δ-HPMA对刚果红的吸附量基本稳定不变,说明δ-HPMA具有较优异的循环吸附稳定性。 图9 δ-HPMA的循环吸附性能 以工业氢氧化铝为原材料,采用重溶-重结晶法,在超声波冲击和热稀酸作用下,可合成δ-HPMA纳米颗粒吸附剂,纯度高达99.958%,属3N级。在适宜条件下,针对质量浓度为10 mg/L的刚果红染料废水,用100 mgδ-HPMA纳米颗粒进行吸附,刚果红平衡吸附量为15.56 mg/g,去除率为77.80%。吸附过程可用准二级动力学模型和Langmuir等温吸附模型描述。用Langmuir等温吸附模型计算所得δ-HPMA纳米颗粒对刚果红的饱和吸附量为17.633 6 mg/g,说明δ-HPMA纳米颗粒在适当功能化后可用于去除废水中的刚果红。后续可通过结构改造等方式对δ-HPMA纳米颗粒吸附材料进行修饰,进一步提高其对刚果红的吸附性能。2.3 吸附热力学

2.4 循环吸附能力
3 结论
