锰氧化物沸石的制备及其对锰离子的吸附性能研究
2023-08-05傅金祥袁雅姝于鹏飞
金 星,傅金祥,袁雅姝,于鹏飞
(沈阳建筑大学 市政与环境工程学院,辽宁 沈阳 110168)
受土壤中锰矿物、气候和水文环境等条件的影响,地下水中锰元素(Mn2+)含量有可能超标[1]。根据GB 5749—2022,饮用水中锰质量浓度应低于0.1 mg/L。锰含量超标会对人体造成伤害,同时也可能对环境造成危害[2-4]。因此,降低水中锰含量至标准以下,具有重要意义。
目前,净水厂的除锰滤池一般采用石英砂或锰砂滤料建造,待滤料成熟后,其表面会形成“锰质活性滤膜”[5-6],其主要成分是锰氧化物(MnOx,x≥1.5)[7]。这是由于Mn2+吸附在滤膜表面,被溶解氧氧化为MnOx,而MnOx对Mn2+继续起到吸附和催化氧化作用,形成自催化氧化过程。此法除锰的关键在于锰质活性滤膜的形成。因此,在滤料吸附饱和前形成锰质活性滤膜,对除锰滤池滤后水“投产即达标”具有重要意义。有研究表明氧化剂可促进滤膜成熟,如高锰酸钾快速启动法可使滤料成熟期缩短至15 d[8],臭氧快速启动法可在5 d后使滤后水锰质量浓度降至0.1 mg/L[9]。
天然沸石是一种良好的阳离子吸附剂[10],在我国分布广,价格低,在水处理领域应用广泛[11-13]。与石英砂和锰砂滤料相比,天然沸石密度更小、比表面积更大,对Mn2+吸附量更高。
试验研究了以天然沸石作为基质材料,表面负载由高锰酸钾和硫酸锰制得的锰氧化物,制备锰氧化物沸石。通过SEM、EDS、XPS、BET等表征了锰氧化物沸石的结构特性,采用静态吸附试验考察了锰氧化物沸石对Mn2+的吸附性能,并通过连续过滤试验分析了锰氧化物沸石的除锰性能和成熟时间,以期为去除水中的锰提供一种可选择的新吸附材料。
1 试验部分
1.1 试验原料、试剂及仪器
天然沸石:取自辽宁省葫芦岛市,化学式为Na(AlSi5O12)·4H2O,粒径0.5~0.8 mm。
模拟含锰废水:用一水合硫酸锰配制锰质量浓度为2 mg/L的模拟含锰废水,pH=7.5。
主要试剂:高锰酸钾、一水合硫酸锰、甲醛溶液、乙二胺四乙酸二钠、盐酸羟胺、氨水、氢氧化钠、硼酸、氯化钾,所用化学试剂均为分析纯,国药集团化学试剂有限公司;水,去离子水。
主要仪器:分光光度仪(上海光谱仪器,SP-752),厌氧培养箱(上海龙跃仪器,LAI-3),溶解氧仪(美国哈希仪器,HQ-30d),pH仪(美国哈希仪器,HQ-40d),慎密电子天平(上海舜宇恒平科学仪器,JA2003),蠕动泵(保定兰格恒流泵,BT100-2J),反冲洗泵(上海瀛力泵业,DBZ-037),电热鼓风干燥箱(上海博迅仪器,BGZ-70),有机玻璃过滤柱(内径40 mm,高200 mm),扫面电子显微镜(捷克TESCAN MIRALMS),能谱分析仪(捷克TESCAN Xplore 30型),X射线光电子能谱分析仪(Hermo Scientific K-Alpha),比表面积分析仪(康塔Autosorb-IQ-MP)。
1.2 锰氧化物沸石的制备
天然沸石过20目筛,在温度105 ℃条件下烘干至恒重。将质量浓度3.16 g/L的KMnO4溶液,逐滴加入101.4 g/L MnSO4·H2O溶液中,4 mol/L NaOH溶液调节溶液pH,控制pH保持在7~8之间,至上清液恰好呈无色,形成锰氧化物沉淀,化学反应见式(1)。经快速滤纸过滤后,去离子水淋洗沉淀物3次。将滤纸上沉淀物与10 g天然沸石于烧杯中混合,以10 r/min速度持续搅拌,同时在105 ℃烘干。待锰氧化物在天然沸石表面形成覆盖层,制得锰氧化物沸石。
(1)
1.3 锰氧化物沸石的表征
SEM分析观察锰氧化物沸石表面形态结构;EDS分析测定表面元素组成;XPS分析测定表面元素价态;BET分析测试比表面积和孔径分布。
1.4 锰氧化物沸石吸附特性的测试
1)吸附等温线
锰氧化物在吸附和催化氧化Mn2+过程中均释放H+,使pH降低,而锰氧化物对Mn2+的吸附能力和催化氧化速率均会随pH降低而减弱[14]。配制pH=7.5的H3BO3-KCl-NaOH缓冲溶液,在缓冲溶液中加入一定质量天然沸石或锰氧化物沸石形成悬浊液,同时配制一定浓度的模拟含锰废水。用氮气吹脱2种溶液直至无法检测出溶解氧,在厌氧箱中静置30 min,使溶液中氮气分压与厌氧箱中氮气分压平衡。将模拟含锰废水加入悬浊液中,在转速50 r/min下吸附,直至吸附达到饱和。每隔一定时间取悬浊液过0.22 μm滤膜,检测滤液中Mn2+含量。每组试验均进行3次,取平均值。锰平衡吸附量计算公式为
(2)
式中:qe—平衡吸附量,mg/g;ρ0—悬浊液中初始Mn2+质量浓度,mg/L;ρe—吸附平衡时Mn2+质量浓度,mg/L;V—悬浊液体积,L;m—天然沸石或锰氧化物沸石投加量,g/L。
2)连续过滤
天然沸石和锰氧化物沸石过滤柱,滤层高度80 mm,滤层体积100 cm3,天然沸石滤料、锰氧化物沸石质量110.0、80.1 g,进水Mn2+质量浓度2 mg/L,控制pH在7~8之间,水力停留时间10 min,反冲洗强度以滤料流态化临界值为准。连续运行30 d,分别测定滤后水中Mn2+质量浓度。根据天然沸石和锰氧化物沸石吸附等温线,计算过滤柱吸附量(式(3))。根据每日滤后水Mn2+质量浓度和滤后水体积,计算累积除锰量(式(4))。
ma=m0qe;
(3)
(4)
式中:ma—滤柱吸附量,mg;m0—滤料质量,g;m—累积除锰量,mg;n—过滤柱运行时间,d;ρ1、ρ2—滤柱进水和出水中Mn2+质量浓度,mg/L;Vn—第n天滤柱滤后水体积,L。
2 试验结果与讨论
2.1 锰氧化物沸石表征
2.1.1 SEM及EDS表征
天然沸石和锰氧化物沸石的SEM分析结果如图1所示,EDS能谱分析结果如图2所示。可以看出:天然沸石表面粗糙,具有明显棱角,棱角之间构成细微孔道和大量空穴,主要组成元素为Si、O、Al和Na,未检测到Mn元素。锰氧化物沸石与天然沸石相比结构发生了较大变化,原有棱角消失,部分孔道和空穴被覆盖,表面被球状颗粒物堆积覆盖,球状颗粒物间形成新的空穴,表面结构更加复杂立体,主要组成元素为Si、O、Al、Na和Mn。

a—天然沸石;b—锰氧化物沸石。图1 天然沸石和锰氧化物沸石的SEM分析结果
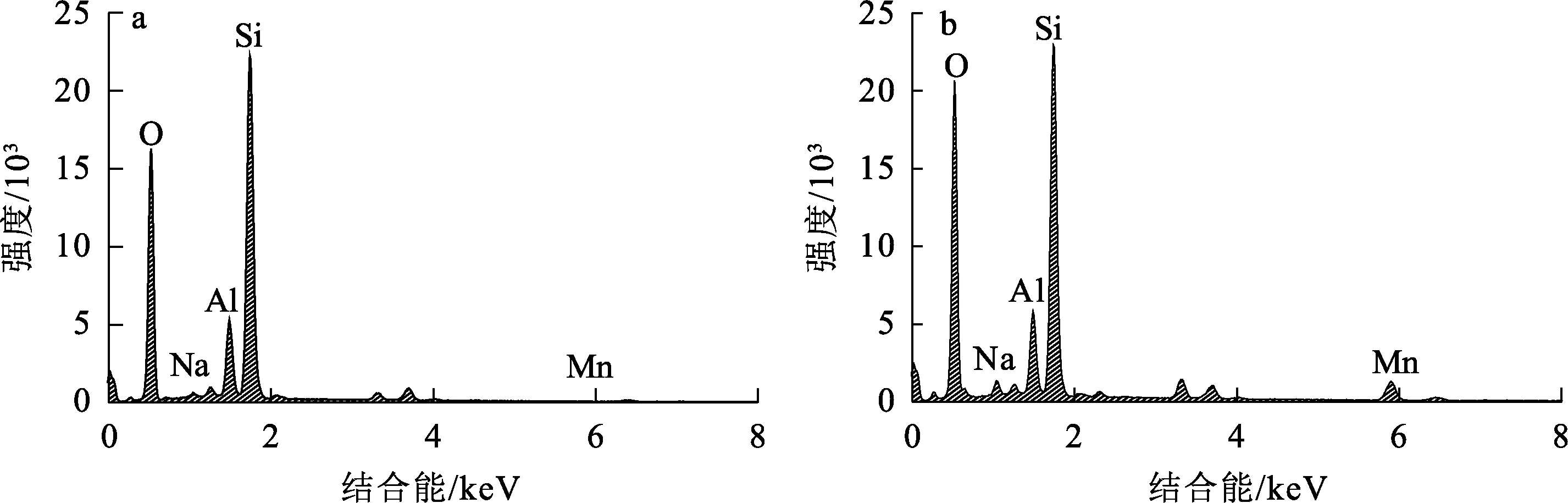
a—天然沸石;b—锰氧化物沸石。图2 天然沸石和锰氧化物沸石的EDS能谱
天然沸石和锰氧化物沸石组成元素占比见表1。可以看出:由于锰氧化物沸石表面被覆盖,Si和Al原子数与天然沸石相比明显下降,而Na元素有少量增加,可能是因为天然沸石能吸附金属阳离子[15],将溶液中少量Na+吸附至其表面;锰氧化物沸石中出现Mn元素,说明锰氧化物已经成功负载在天然沸石表面,改变了天然沸石原有的形态结构和物质组成。
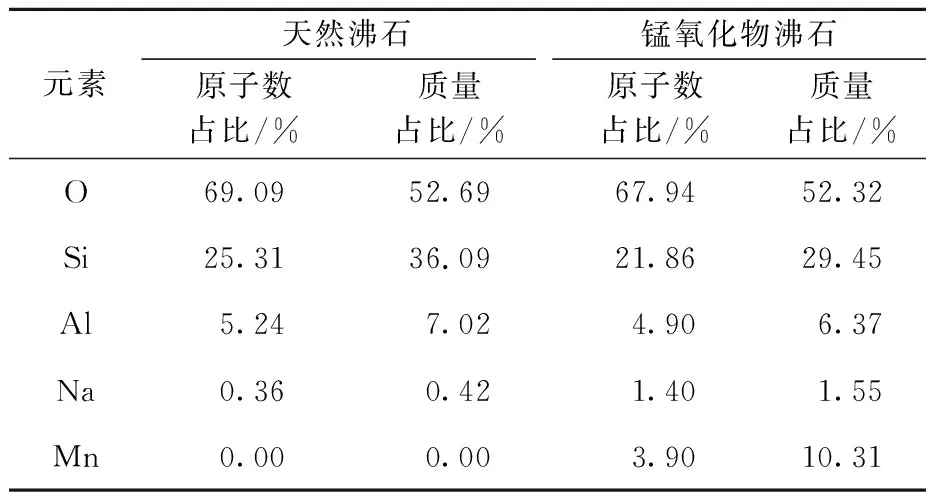
表1 天然沸石和锰氧化物沸石组成元素占比
2.1.2 XPS表征
天然沸石和锰氧化物沸石Mn 2p轨道的XPS能谱如图3所示。可以看出:天然沸石Mn元素的XPS能谱中并未出现明显的峰信号,且强度很低,这说明天然沸石中几乎不含Mn元素,这一结果与EDS能谱分析结果一致;锰氧化物沸石Mn 2p轨道的XPS能谱中出现2个明显的峰,强度也较高,说明锰氧化物沸石表面含Mn元素。

图3 天然沸石和锰氧化物沸石XPS能谱
针对Mn元素具体价态进行分峰拟合和定量分析,在对应结合能处计算峰面积,分析锰存在形式及原子占比,结果见表2。可以看出:2p3/2轨道分为2个峰,对应结合能为642.4、640.9 eV,峰面积分别为58 471.60、7 177.15 cps.eV;Mn 2p1/2轨道分为2个峰,对应结合能为654.0、653.0 eV,峰面积分别为30 224.14、3 709.89 cps.eV;其中642.4、654.0 eV对应MnO2的特征峰,原子数占比为89.08%;640.9、653.0 eV对应MnO的特征峰[16],原子数占比为10.92%。说明锰氧化物沸石表面的锰氧化物主要以MnO2为主,含有少量MnO。因净水厂除锰滤池成熟的锰质活性滤膜的主要成分为MnO2[17],说明锰氧化物沸石与锰质活性滤膜物质组成相似。
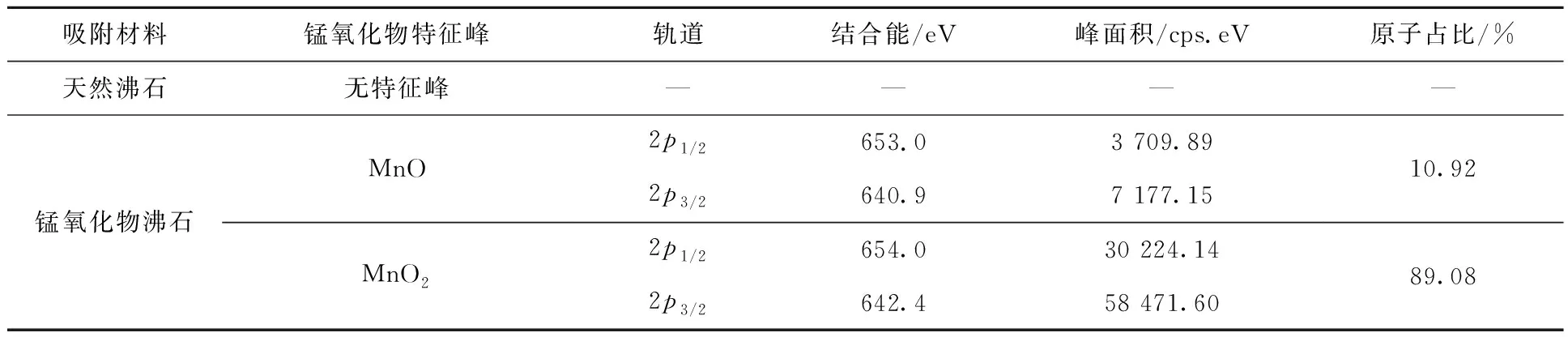
表2 天然沸石和锰氧化物沸石表面锰存在形式及对应原子占比
2.1.3 BET表征
天然沸石和锰氧化物沸石BET分析结果如图4所示。可以看出:天然沸石、锰氧化物沸石比表面积分别为10.679、34.054 m2/g;天然沸石、锰氧化物沸石孔径分布分别在4.2~24、2.5~24 nm区间。锰氧化物沸石比表面积更大,孔径分布范围更宽。天然沸石在2.5~3.5 nm孔径范围内几乎无明显孔道,负载锰氧化物后,孔道数量显著增加;天然沸石孔道集中分布在3.5~12 nm区间,在这一孔径范围内,锰氧化物沸石孔道数量远高于天然沸石;在12 nm孔径以上,天然沸石和锰氧化物沸石孔道数量基本一致。孔径范围的增大和孔道数量增加使锰氧化物沸石具有更大比表面积,吸附点位更多,有利于提高吸附容量。
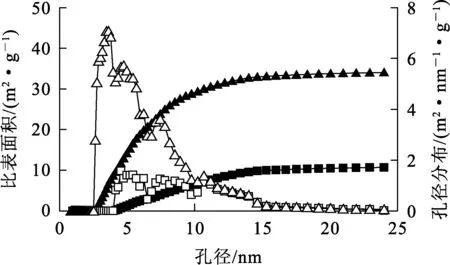
锰氧化物沸石:—▲—比表面积;—△—孔径分布。天然沸石:—■—比表面积;—□—孔径分布。图4 天然沸石和锰氧化物沸石的BET分析结果
2.2 锰氧化物沸石的吸附性能
天然沸石和锰氧化物沸石对Mn2+的吸附等温线如图5所示。可以看出:天然沸石和锰氧化物沸石对Mn2+的平衡吸附量均随Mn2+质量浓度增大而升高。Mn2+质量浓度大于8 mg/L后,天然沸石对Mn2+的平衡吸附量升高幅度较缓,Mn2+质量浓度增至32 mg/L后,几乎无变化;二者对Mn2+的吸附等温线均属于Ⅰ型吸附曲线;在相同Mn2+平衡质量浓度下,锰氧化物沸石对Mn2+吸附量远高于天然沸石,这是由于负载锰氧化物后,天然沸石的比表面积有较大提升,吸附点位增加。因模拟含锰废水pH=7.5,高于二氧化锰的等电点pHz=2.8±0.3[18],二氧化锰表面发生酸性离解,表面电荷为负,使二氧化锰具有吸附水中阳离子能力,进而促进锰氧化物沸石吸附能力提升。

图5 天然沸石和锰氧化物沸石对Mn2+的吸附等温线
采用Langmuir和Freundlich等温吸附模型对天然沸石和锰氧化物沸石吸附Mn2+过程进行拟合分析,结果见表3。可以看出:天然沸石的Langmuir和Freundlich等温吸附模型相关系数分别为0.966和0.808,说明Langmuir模型能更好地描述天然沸石吸附Mn2+过程,天然沸石表面均一,各处吸附性能相同,吸附是单分子层的,最大吸附量0.995 mg/g;锰氧化物沸石的Langmuir和Freundlich等温吸附模型相关系数较为接近,分别为0.960和0.948,相较而言,Langmuir吸附模型相关系数更高,锰氧化物沸石对Mn2+的最大吸附量为5.498 mg/g,远高于天然沸石。综上,用Langmuir等温模型能更为准确地描述锰氧化物沸石对Mn2+的吸附过程。

表3 天然沸石和锰氧化物沸石吸附等温线参数
2.3 锰氧化物沸石连续过滤除锰特性分析
天然沸石和锰氧化物沸石连续过滤除锰效果对比如图6所示。可以看出:天然沸石在过滤初期有一定除锰能力。第1天,过滤柱滤后水中Mn2+质量浓度为0.82 mg/L,去除率57.26%;随运行时间延长,滤后水中Mn2+质量浓度逐渐升高,去除率降低;在第5天基本失去除锰能力,去除率降至10%左右。锰氧化物沸石在30 d运行周期内,除锰效果良好,去除率一直保持在95%以上,滤后水中Mn2+质量浓度始终在0.1 mg/L以下,符合《生活饮用水卫生标准》(GB 5749—2022)要求。
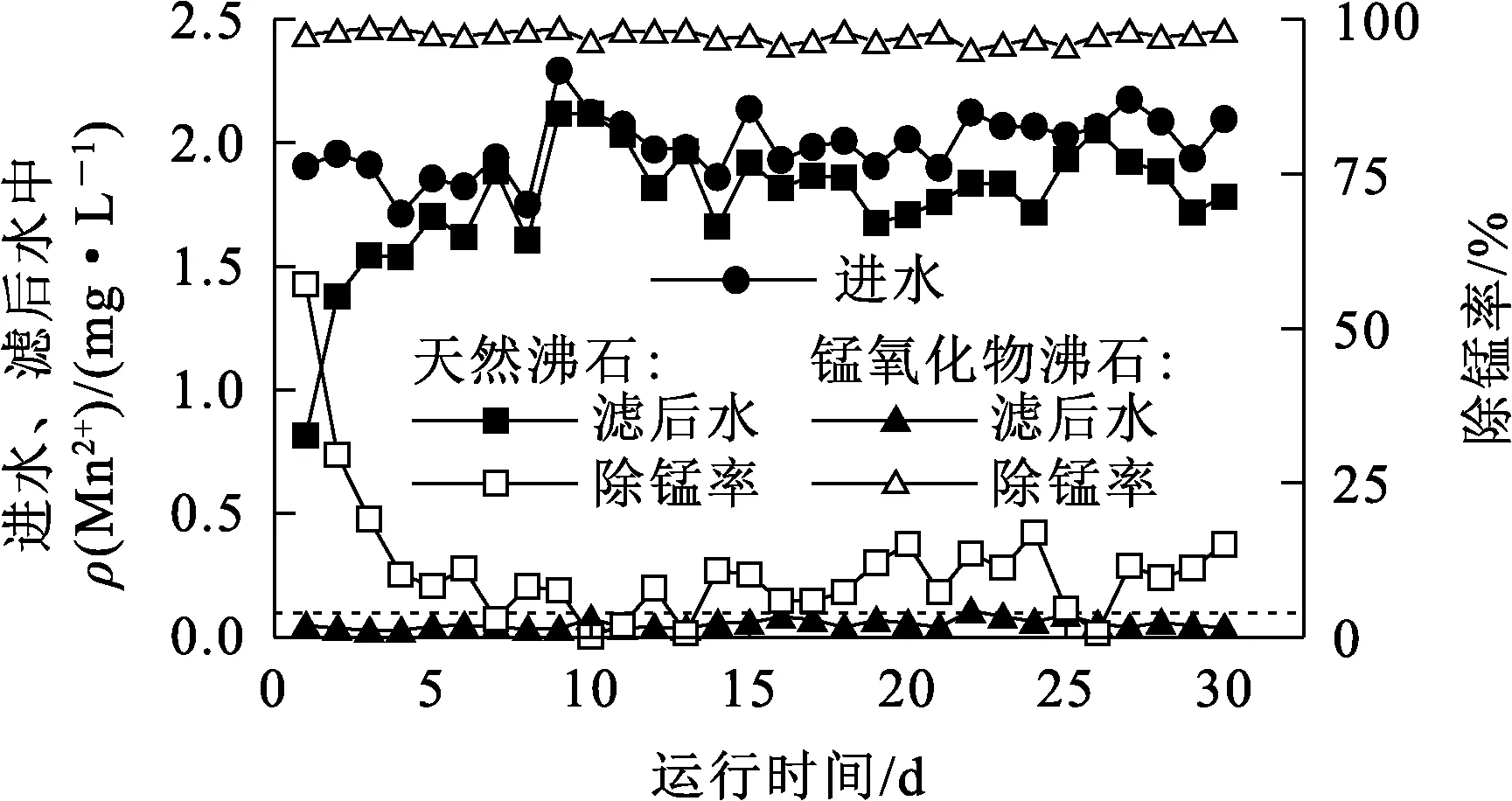
图6 天然沸石和锰氧化物沸石的连续过滤除锰效果对比
天然沸石和锰氧化物沸石的累积除锰量变化曲线如图7所示。可以看出:天然沸石过滤柱累积除锰量为94.74 mg,锰氧化物沸石过滤柱累积除锰量为806.42 mg。根据天然沸石和锰氧化物沸石Langmuir模型计算得出,过滤柱吸附容量分别为100.6、157.0 mg。可见,天然沸石过滤柱累计除锰量接近于吸附容量,而锰氧化物沸石累积除锰量远远超过吸附容量,说明锰氧化物沸石对水中Mn2+的去除不仅仅来自于吸附作用。根据文献[14]的结论,锰氧化物能有效降低水中Mn2+浓度,吸附初始阶段Mn2+吸附在锰氧化物表面,在锰氧化物的催化作用下,Mn2+被溶解氧氧化为更高价态的锰氧化物,沉淀在氧化物表面,新产生的锰氧化物继续对Mn2+进行吸附和催化氧化,形成自催化氧化过程。这一作用机制也是净水厂锰质活性滤膜除锰的作用机制。但锰质活性滤膜的成熟需要较长时间,而制备的锰氧化物沸石在过滤除锰初期就能达到成熟锰质活性滤膜的除锰效果,在超出吸附容量后去除率仍保持在95%以上,说明锰氧化物沸石除锰无需成熟时间。
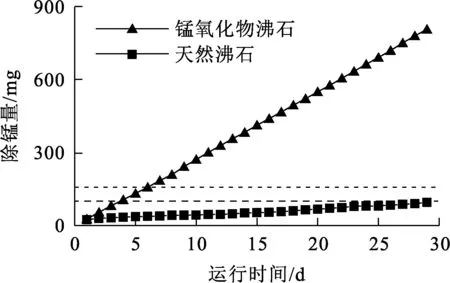
图7 天然沸石和锰氧化物沸石的过滤柱累积除锰量变化曲线
几种吸附剂对Mn2+吸附能力和连续除锰特性的对比结果见表4。
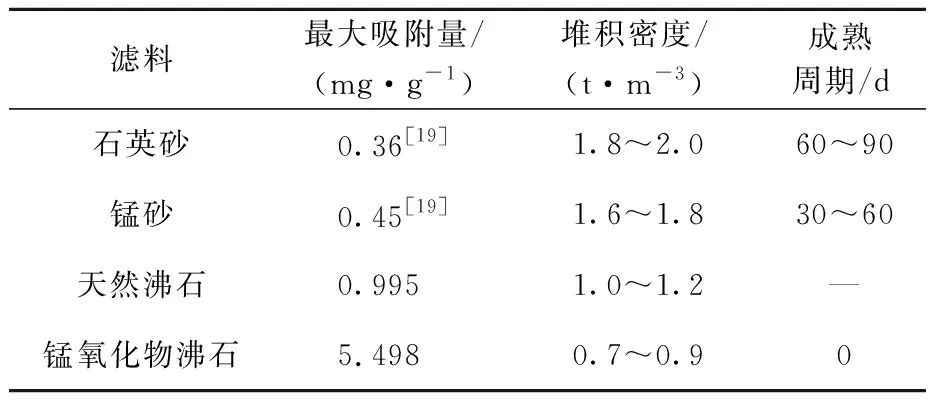
表4 石英砂、锰砂、天然沸石、锰氧化物沸石除锰特性
由表4看出:净水厂普遍使用的石英砂和锰砂滤料的吸附量较小,但二者经过数月成熟期后均具有连续除锰能力,形成了锰质活性滤膜,成熟周期长,密度大;天然沸石吸附量高于石英砂和锰砂,堆积密度较低,试验中发现在30 d运行周期内并未形成锰质活性滤膜;锰氧化沸石最大吸附量远超其他3种滤料,堆积密度最小,相同大小的净水厂滤池用量也最小,且无需成熟期,能实现“投产即达标”,是一种优秀除锰滤料。
3 结论
在天然沸石表面负载由KMnO4和MnSO4生成的锰氧化物制备锰氧化物沸石是可行的。由于锰氧化物沸石具有更宽的孔径分布范围和更大的比表面积,对Mn2+的吸附能力远高于天然沸石。连续过滤除锰试验结果表明,锰氧化物沸石在使用初期即能使滤后水中Mn2+达到饮用水标准要求,对Mn2+去除率达95%以上,在超出吸附容量后仍具有除锰能力,无需成熟期,是一种吸附性能较好的除锰材料。
