基于金纳米粒子的荧光适配体传感器检测食品中的17β-雌二醇
2023-08-05韦庆益林轩然张佩瑶孙大文蒲洪彬
韦庆益,林轩然,张佩瑶,孙大文,蒲洪彬
(华南理工大学食品科学与工程学院,现代食品工程研究中心,广东省冷链食品智能感知与过程控制工程技术研究中心,广东 广州 510006)
17β-雌二醇(17β-estradiol,E2)是一种能够促进动物生长、提高奶牛产奶量的甾体雌激素,20世纪80年代以来在畜牧业中得到了广泛应用,但在2003年被欧盟要求永久禁止在畜禽养殖业中使用[1]。许多研究报道,E2是一种典型的环境内分泌干扰化学物,存在于不同国家的地表水中,并且乳制品中也含有高量的内源性E2[2]。毒理学实验表明,即使低浓度的E2残留物通过食物链进入生物体,也会干扰正常的内分泌功能,造成有害影响,如不孕不育、血脑屏障损伤、乳腺癌和睾丸癌发病率的增加[3-4]。E2在畜牧业中的应用在中国也被禁止,并且国际食品法典委员会和中国食品安全国家标准均规定动物性食品中不得检出E2[1]。美国国家环保局在2012年提出地表水中E2的最大残留量为1.47 pmol/L,日本也在2015年实施了新的规定,将饮用水中的E2限制在0.294 nmol/L[5]。因此,发展有效的方法灵敏地检测食品样品和水环境中的E2具有重要意义。
迄今为止,基于高效液相色谱(high performance liquid chromatography,HPLC)、气相色谱、质谱等的仪器分析方法已被广泛应用于E2的检测,其结果具有较高的准确性和灵敏度,然而这些方法需要复杂的样品预处理和专业的技术技能[6-8]。此外,基于抗体的免疫方法在E2检测中具有较高的灵敏度和特异性,然而抗体的产生耗时,而且易受外界环境的影响[9]。适配体是一种单链DNA或RNA,能与靶标进行特异性结合,它作为E2识别元件的替代品已经被开发的非常有前景[10-11],其中与荧光方法相结合的适体传感器因其灵敏度高、特异性强、重复性好、操作简便等优点受到了研究者的广泛关注。碳量子点(carbon quantum dots,CQDs)作为一种新兴荧光碳纳米材料,具有荧光性能稳定、低毒、生物相容性好、易溶于水、易合成和生产成本低等优点,已被广泛用于构建荧光传感器对环境和食品中的有害物质进行检测[12-15]。荧光传感器常利用荧光共振能量转移(fluorescence resonance energy transfer,FRET)效应改变探针的荧光强度,FRET简单来说就是当荧光供体(此为CQDs)的发射光谱与猝灭剂的紫外-可见吸收光谱重叠,且CQDs与猝灭剂的距离在10 nm以内,处于激发态的CQDs就会将能量转移至处于基态的猝灭剂,表现出CQDs荧光的猝灭[16]。常见的荧光猝灭剂种类较多,其中金纳米粒子(gold nanoparticles,AuNPs)凭借其易于控制的粒径大小、良好的生物相容性和优异的荧光猝灭能力而广泛用于光学和生物传感器之中[17]。
综上考虑,本实验拟将CQDs与AuNPs结合,利用FRET效应构建一种荧光适体传感器用于E2的检测。首先通过酰胺反应将E2的短链适配体P1连接在CQDs上,AuNPs加入后适配体会与AuNPs靠近,从而触发CQDs与AuNPs间的FRET效应,导致CQDs的荧光猝灭。当加入目标物E2后,适配体P1与E2间更强烈的亲和力使P1从AuNPs表面脱离,CQDs的荧光得以恢复,并以此建立荧光恢复强度与E2浓度的线性关系,达到定量检测E2的目的。此外该荧光短链适体传感器对牛奶和环境水样中的E2进行检测,其结果与HPLC方法结果一致,以证明该传感器在实际应用中的潜力。
1 材料与方法
1.1 材料与试剂
柠檬酸(C6H8O7)、乙二胺(C2H8N2)、柠檬酸三钠(trisodium citrate,Tc,C6H5Na3O7)、1-(3-二甲胺丙基)-3-乙基碳二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)上海麦克林生物化学有限公司;四氯金酸(chloroauric acid,HAuCl3·HCl·4H2O)、双酚A(bisphenol A,BPA)、己烯雌酚(diethylstilbestrol,DES)、雌酮(estrone,E1)、三氟乙酸 上海阿拉丁试剂有限公司;E2、雌三醇(estriol,E3)上海源业生物科技有限公司;E2短链适配体[18](P1,5′-NH2-(CH2)6-AAG GGA TGC CGT TTG GGC CCA AGT TCG GCA TAG TG-3′)生工 生物工程(上海)股份有限公司;磷酸缓冲液(phosphate buffer,PB,pH 7.2,10 mmol/L)用KH2PO4和Na2HPO4•12H2O制备。除注明外,所有试剂都是分析纯,未进行进一步的纯化。整个实验过程使用的是由Milli-Q水净化系统净化的超纯水。DNA试剂均用超纯水溶解配制后置于-20 ℃冰箱冷藏。
1.2 仪器与设备
AL204电子天平 梅特勒-托利多仪器公司;DKZ-2B 恒温水浴摇床 上海一恒科学仪器有限公司;TW-3021HR 高速冷冻离心机 安徽嘉文仪器装备公司;JUPITER-B高通量微波消解/萃取仪 上海新仪科技有限公司;RF-6000荧光分光光度计、UV-1800紫外-可见分光光度计 日本岛津公司;Merlin FE-EM扫描电子显微镜 德国卡尔蔡司公司;JEM-1400 Plus透射电子显微镜 日本JEOL公司;Nicolet-iS50傅里叶红外光谱(Fourier transform infrared spectrometer,FTIR)仪 美国赛默飞科技公司;Acquity Are高效液相色谱仪 上海沃特世科技有限公司。
1.3 方法
1.3.1 CQDs的制备及表征
CQDs制备参照本团队之前的研究[19],利用高通量封闭式微波消解/萃取仪快速完成。具体步骤是先将2 g柠檬酸和1.043 mL乙二胺分别作为碳源和氮源溶解在20 mL超纯水中,溶解完全后将其放入微波消解仪中,仪器的加热温度和加热功率分别设为200 ℃、600 W,加热5 min即完成了CQDs的快速制备。获得的溶液自然冷却后首先用0.22 μm的微孔膜过滤,然后用截留分子质量为1000 Da的透析袋透析36 h以获得纯化的CQDs溶液,将其贮存在4 ℃的冰箱中备用。CQDs的形貌大小通过透射电子显微镜进行观察,其光学性质通过紫外-可见(ultravioletvisible,UV-Vis)光谱和荧光光谱进行研究,另外通过FTIR探究CQDs表面官能团的种类。
1.3.2 CQDs-P1的制备及表征
E2短链适配体(P1)在CQDs上的标记参考Cao Xiaodong等[20]的步骤,首先称取40 mg EDC和20 mg NHS溶解在2 mL PB中,将上述纯化后的2 mL CQDs溶液混合并持续振荡1 h以活化CQDs上的羧基,随后加入10 μL浓度为100 μmol/L的P1溶液并于37 ℃继续振荡1 h。将获得的CQDs-P1溶液透析12 h以去除多余的P1和CQDs,然后将其储存在4 ℃备用。P1的连接通过UV-Vis光谱和琼脂糖凝胶电泳表征。
1.3.3 AuNPs的制备与表征
AuNPs制备是以经典的柠檬酸盐还原法[21]为基础,稍加调整合成,其所用的玻璃器皿在使用之前均用王水(HCl∶HNO3=3∶1)浸泡过夜然后用超纯水冲洗。制备的具体步骤如下:首先量取60 mL超纯水倒入150 mL锥形瓶中,随即加入1 mL 5 g/L的四氯金酸溶液并将锥形瓶置于磁力加热搅拌器上开始加热,溶液沸腾2 min时开始磁力搅拌(1000 r/min)并加入700 μL柠檬酸三钠溶液(1%),观察溶液颜色变化,在其颜色稳定后继续加热令其保持沸腾5 min,反应结束后让其自然冷却至室温,体积浓缩5 倍后4 ℃冷藏待用。后续实验可通过调整柠檬酸三钠溶液的体积制备不同粒径的AuNPs。AuNPs的大小形貌通过SEM图像和UV-Vis光谱表征。
1.3.4 实验条件优化
为获得最佳的检测性能,对猝灭剂AuNPs的参数(包括粒径、添加体积)、荧光猝灭时间和E2与P1的孵育时间进行优化。
1.3.4.1 AuNPs粒径优化
按照1.3.1节方法通过添加500、600、700、800 μL和900 μL柠檬酸三钠溶液分别合成粒径约为50、42、39、32 nm和15 nm的AuNPs,将其先作体积5 倍浓缩处理,然后移取100 μL浓缩后的AuNPs溶液加入到100 μL CQDs-P1溶液中,再加入300 μL PB使反应总体积为500 μL,轻柔振荡30 min,反应结束后选用激发波长350 nm对混合溶液在370~600 nm范围内的荧光光谱进行扫描测定,同时将100 μL CQDs-P1溶液加入到400 μL PB溶液中作为对照,观察不同粒径AuNPs对CQDs荧光的猝灭情况。
1.3.4.2 AuNPs添加体积优化
在100 μL CQDs-P1溶液中分别加入100、150、200、250、300 μL浓缩后的39 nm的AuNPs溶液,之后加入PB使反应总体积为500 μL,轻柔振荡30 min,同样地将100 μL CQDs-P1溶液加入到400 μL PB溶液中作为对照,反应结束后对所制样品进行荧光测定,观察添加不同体积的AuNPs对CQDs荧光的猝灭情况。
1.3.4.3 荧光猝灭时间优化
在100 μL CQDs-P1溶液中先加入200 μL浓缩后的39 nm的AuNPs溶液,再加入200 μL PB,分别轻柔振荡5、10、15、20、25、30 min,同样地将100 μL CQDs-P1溶液加入到400 μL PB溶液中作为对照,反应结束后对所制样品进行荧光测定,观察AuNPs加入不同时间后对CQDs荧光的猝灭情况。
1.3.4.4 E2与P1孵育时间优化
在100 μL CQDs-P1溶液中先加入200 μL浓缩后的39 nm的AuNPs溶液,再加入100 μL PB,轻柔振荡20 min后加入100 μL浓度为10-6mol/L的E2标准溶液,分别孵育15、30、45、60、75、90 min,反应结束后测量其荧光强度(F),同时测量200 μL AuNPs和200 μL PB加入100 μL CQDs-P1中振荡20 min后的荧光强度(F0),观察E2与P1孵育不同时间后对CQDs荧光的恢复情况。
1.3.5 E2标准溶液检测
E2标准品用甲醇溶解成10-3mol/L的母液,然后用超纯水稀释成不同浓度待用。对于E2的检测,在100 μL CQDs-P1溶液中先加入200 μL浓缩后的39 nm的AuNPs溶液,再加入100 μL PB,轻柔振荡20 min后分别加入100 μL不同浓度的E2标准溶液(10-9~10-4mol/L),然后孵育60 min,反应结束后测量其荧光强度(F),同时测量200 μL AuNPs和200 μL PB加入100 μL CQDs-P1中振荡20 min后的荧光强度(F0),观察不同浓度E2溶液加入后对CQDs荧光的恢复情况。
1.3.6 实际样品加标检测
考虑到E2的实际存在情况,选用在广东广州超市购买的牛奶作为实际样品进行检测,同时收取中心湖公园(广东广州)的湖水和实验室的自来水进一步验证该荧光适体传感器的实用性。牛奶的前处理过程如下:将5 mL牛奶加入到20%三氟乙酸溶液中,调节pH 4.6,然后将该混合物置于45 ℃水浴10 min使牛奶中的蛋白质沉淀,随即在10 ℃、10000 r/min离心15 min,收集上清液并用0.22 μm微孔滤膜过滤2 次,然后将其与 500 μg/mL的E2储备溶液混合,制备E2质量浓度为5、12.5 μg/mL和25 μg/mL的实际样品加标溶液。水样的前处理过程如下:自来水简单地用0.22 μm微孔滤膜过滤两次,湖水在室温25 ℃沉淀一夜,然后上清液经滤膜过滤两次,其加标溶液的制备与牛奶样品加标溶液的处理过程相同,分别得到5、12.5 μg/mL和25 μg/mL的湖水和自来水样加标溶液。实际样品的检测过程按照标准溶液中E2的检测方法(1.3.5节)进行,获得对应的荧光强度,E2最终加标质量浓度为1、2.5、5 μg/mL。同时对未加标的牛奶样品和水样也进行了检测。另外,采用HPLC对同样加标的实际样品进行检测,进一步验证荧光传感器的检测结果。
1.4 数据分析
所有荧光测量都制备3 份平行样品,并且使用平行样的荧光平均值及其标准差作为最终结果。所有数据都由Excel 2019和Origin 2019b软件进行处理和分析。实验选取F-F0为荧光输出信号,其中F0和F分别为不存在E2和存在E2时的荧光信号,也即加入AuNPs荧光被猝灭和再加入E2荧光被恢复的荧光强度。此外,按3s/k和10s/k计算荧光适体传感器的检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ),其中s为空白样品在442 nm处荧光强度的标准差,k为标准曲线的斜率[22]。
2 结果与分析
2.1 基于AuNPs的荧光适体传感器检测E2的原理
AuNPs是一种消光系数高、具有拉曼增强特性且尺寸容易控制的金属纳米材料,并且基于其高消光系数,AuNPs还是一种优良的荧光猝灭剂,在光学传感中有着出色的表现[17]。因此本实验利用AuNPs的荧光猝灭作用建立了一种灵敏、准确、快捷的荧光适体传感器。其检测原理如图1所示,首先利用酰胺反应在CQDs上连接E2的短链适配体P1,形成CQDs-P1,然后通过柠檬酸盐还原法合成了酒红色的AuNPs,当在离心管中加入这二者时,由于适配体碱基间的金属配位作用,AuNPs对适配体具有较强的吸附亲和力[23],CQDs-P1会吸附在AuNPs表面,而CQDs的荧光发射光谱与AuNPs的紫外吸收光谱有较大的重叠,当它们相互靠近时且CQDs与AuNPs的距离在10 nm以内时,处于激发态的CQDs就会将能量转移至处于基态的猝灭剂AuNPs,即FERT效应,表现为CQDs的荧光被猝灭;当目标物E2加入溶液体系后,适配体P1更倾向于与E2结合从而离开AuNPs表面,缺乏近距离这一条件后FRET不再发生,CQDs的荧光得以恢复,因此可以通过建立E2浓度与荧光恢复程度的线性关系达到定量检测E2的目的。
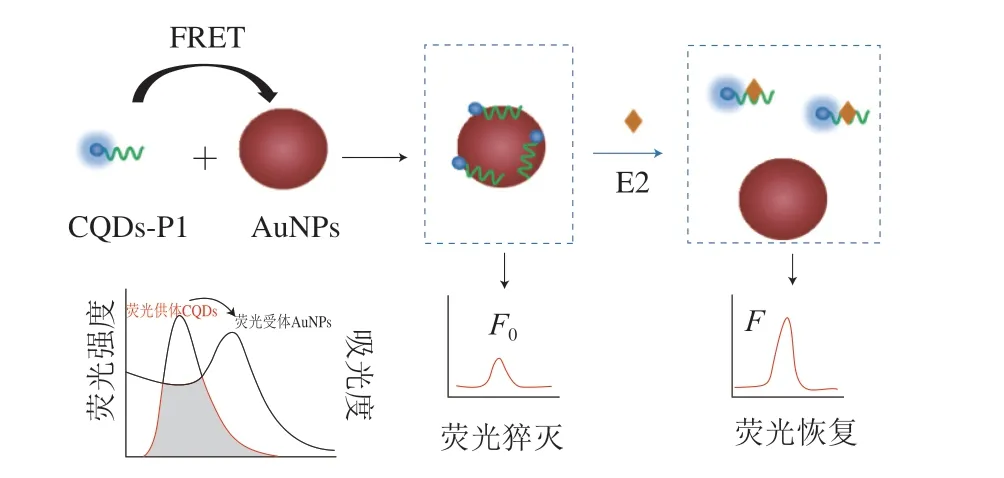
图1 基于AuNPs的荧光适体传感器检测E2的原理图Fig.1 Schematic diagram of the fluorescence aptasensor for E2 detection based on AuNPs
2.2 CQDs的表征
通过微波辅助水热法快速合成荧光CQDs,其形貌特征通过透射电子显微镜图像进行观察,如图2A所示,CQDs外观接近球形并且在溶液中分散均匀,其粒径在2.0~6.0 nm之间,平均值在3.5 nm左右。CQDs的紫外和荧光性能如图2B所示,可以观察到CQDs的最佳荧光激发波长和发射波长分别位于350 nm和442 nm,并且由于芳香族C=C键的π-π*跃迁和C=O键的n-π*跃迁,CQDs的UV-Vis光谱在239 nm和346 nm处分别有一个吸收峰[24]。图2B右上角的插图显示了合成的CQDs在自然光下呈现浅黄色(左),在365 nm的紫外灯照射下会发出明亮的蓝色荧光(右),表明制备的CQDs具有良好的荧光性能。此外,利用FTIR光谱对CQDs表面的官能团进行研究,结果如图2C所示,很明显在3250 cm-1附近出现了一个强宽峰,这归因于O—H和N—H的伸缩振动[25],另外在1683 cm-1和1257 cm-1观察到的两个吸收峰分别是由C—O和C—N的伸缩振动引起,在1544 cm-1和1378 cm-1出现的吸收峰分别是N—H和—CH2的变形振动导致,最后在1186、1072 cm-1和992 cm-1处观察到的弱吸收峰是由C—OH的伸缩振动引起,这与Liu Yingnan等[26]报道的结果一致。FTIR的结果表明CQDs表面氨基、羧基和 羟基等诸多官能团的存在,这也是CQDs具有良好水溶性的原因。
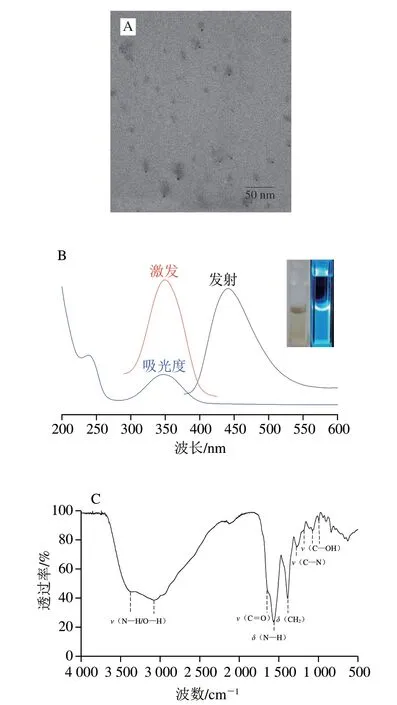
图2 CQDs的表征Fig.2 Characterization of CQDs
2.3 CQDs-P1的表征
通过UV-Vis光谱表征E2短链适配体P1在CQDs上的连接,如图3A所示,单独的P1由于其碱基在260 nm观察到明显的紫外吸收峰[27],单独的CQDs在346 nm和249 nm两个位置出现了紫外吸收峰,而连接了P1的CQDs同时在346 nm和260 nm左右出现了归属于P1和CQDs的紫外吸收峰,初步证明了CQDs-P1的形成。图3B是琼脂糖凝胶电泳的实验结果,泳道1是CQDs,在紫外灯的照射下观察不到DNA条带的存在,泳道2是适配体P1,可以看见清晰明亮的DNA条带出现,泳道3代表与CQDs反应后的P1,由于连接了CQDs,P1的迁移率降低[20],导致其条带明显落后泳道2,其下方的另外一条条带应该是多余的未连接的P1,该结果更为有力地证明了CQDs-P1的成功合成。
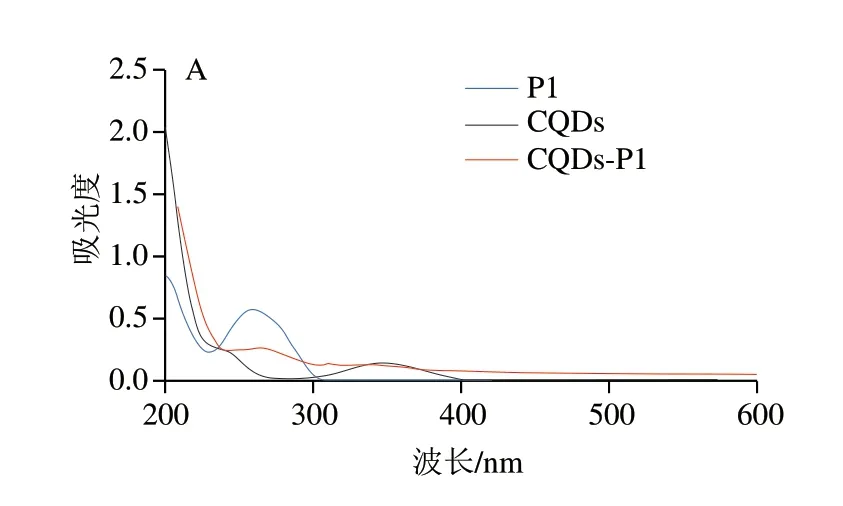
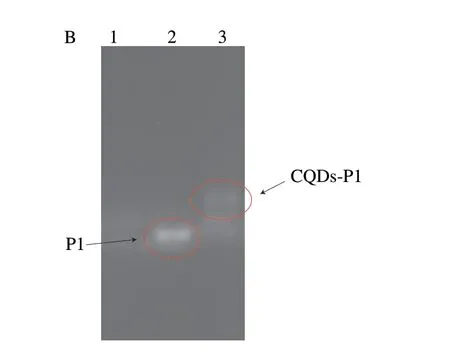
图3 CQDs、P1和CQDs-P1的UV-Vis光谱(A)和 琼脂糖凝胶电泳(B)图 Fig.3 UV-Vis absorption spectra (A) and agarose gel electropherograms (B) of CQDs,P1 and CQDs-P1
2.4 AuNPs的表征
从图4A可以看出,加入700 μL柠檬酸盐还原出的AuNPs呈现近圆形,粒径在30~40 nm范围内,与理论计算值相近,但大小均匀性不是很好,这可能是一步还原法的不足之处。图4B中展示了所合成的AuNPs在527 nm处由于Au的表面等离子体共振所引起的宽紫外吸收带[28],可以观察到它和CQDs的荧光发射光谱有较大面积的重合,符合FRET发生的条件之一,右上角的插图是AuNPs的图片,可以看到AuNPs在自然光下呈现粉紫色,以上结果证明了AuNPs的成功合成和AuNPs作为优良荧光猝灭剂的潜力。
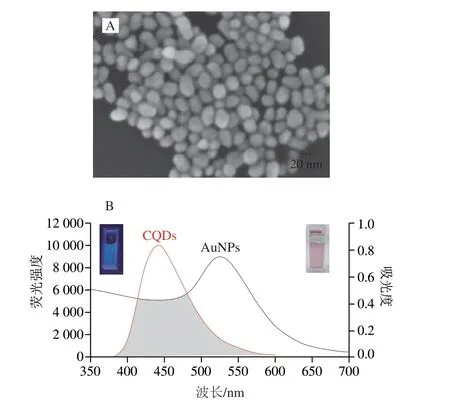
图4 AuNPs的SEM(A)和CQDs的荧光光谱和AuNPs的 UV-Vis光谱(B)图像Fig.4 SEM image of AuNPs (A) and UV-vis absorption spectra of AuNPs and fluorescence emission spectra of CQDs (B)
2.5 E2检测的可行性分析及检测条件优化
2.5.1 可行性分析
为确定该荧光适体传感器的可行性,以E2终浓度为2×10-7mol/L的样品组进行荧光测试。如图5所示,CQDs-P1表示100 μL CQDs-P1与400 μL PB混合均匀后测试得到的荧光光谱,其荧光强度最高;CQDs-P1+ AuNPs表示200 μL AuNPs与200 μL PB加入到100 μL CQDs-P1溶液中,然后轻柔振荡20 min后测试得到的荧光光谱,可以看出其荧光强度明显降低,证明CQDs的荧光确实能被AuNPs有效猝灭;CQDs-P1+AuNPs+E2则表示200 μL AuNPs与100 μL PB加入到100 μL CQDs-P1溶液中轻柔振荡20 min,再加入100 μL 10-6mol/L E2孵育60 min后测试得到的荧光光谱,相较于被猝灭的荧光强度,能观察到加入E2后其荧光有明显的恢复,证明E2与其适配体结合并将其带离了AuNPs表面,使得CQDs荧光恢复。由此可知,将该荧光适体传感器用于E2的检测可行。
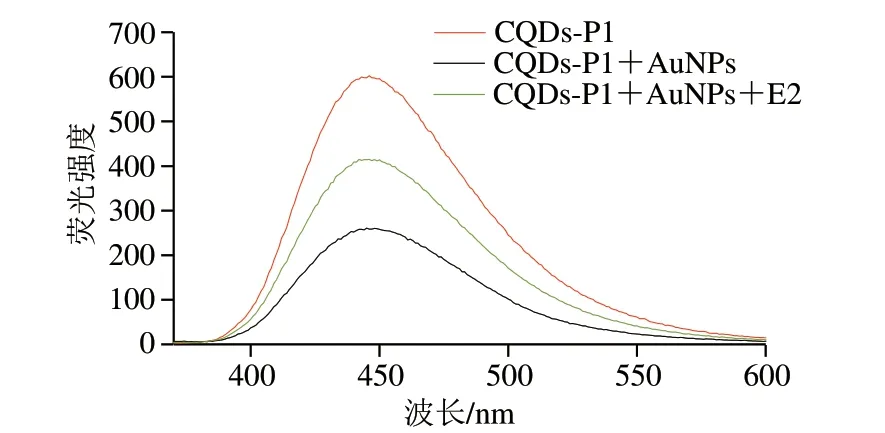
图5 CQDs-P1、CQDs-P1+AuNPs、CQDs-P1+ AuNPs+E2的荧光光谱Fig.5 Fluorescence spectra of CQDs-P1,CQDs-P1+AuNPs and CQDs-P1+AuNPs+E2
2.5.2 AuNPs粒径优化
为探究不同粒径的AuNPs对CQDs荧光的猝灭效果,首先通过添加不同体积的Tc制备不同粒径的AuNPs,对应UV-Vis光谱如图6A所示,随着Tc溶液添加量从500 μL增加到900 μL,还原得到的AuNPs其表面等离子体共振峰位置从531 nm逐渐蓝移至522 nm,通过紫外峰位置与AuNPs粒径的关系[29]换算得知其粒径分别为50、42、39、32、15 nm,右上角的插图显示了随着粒径的减小(Tc溶液添加量的增加),AuNPs溶液的颜色逐渐由紫红色转变成亮酒红色。随后将合成的不同粒径的AuNPs溶液用于猝灭CQDs的荧光,结果如图6B所示,在AuNPs加入体积固定为100 μL的前提下,不同粒径的AuNPs对CODs荧光的猝灭效率相差不大,都能猝灭CQDs 30%左右的荧光,39 nm的AuNPs表现出最佳的荧光猝灭效率,可能是因为这个粒径大小的AuNPs在溶液中比较稳定,并且适合吸附大量的CQDs-P1,因此AuNPs的粒径优化为39 nm。根据紫外吸光度与该粒径大小的AuNP浓度关系[29]换算得到,合成并浓缩5 倍后39 nm的AuNP浓度大约为 4.57×10-10mol/L。
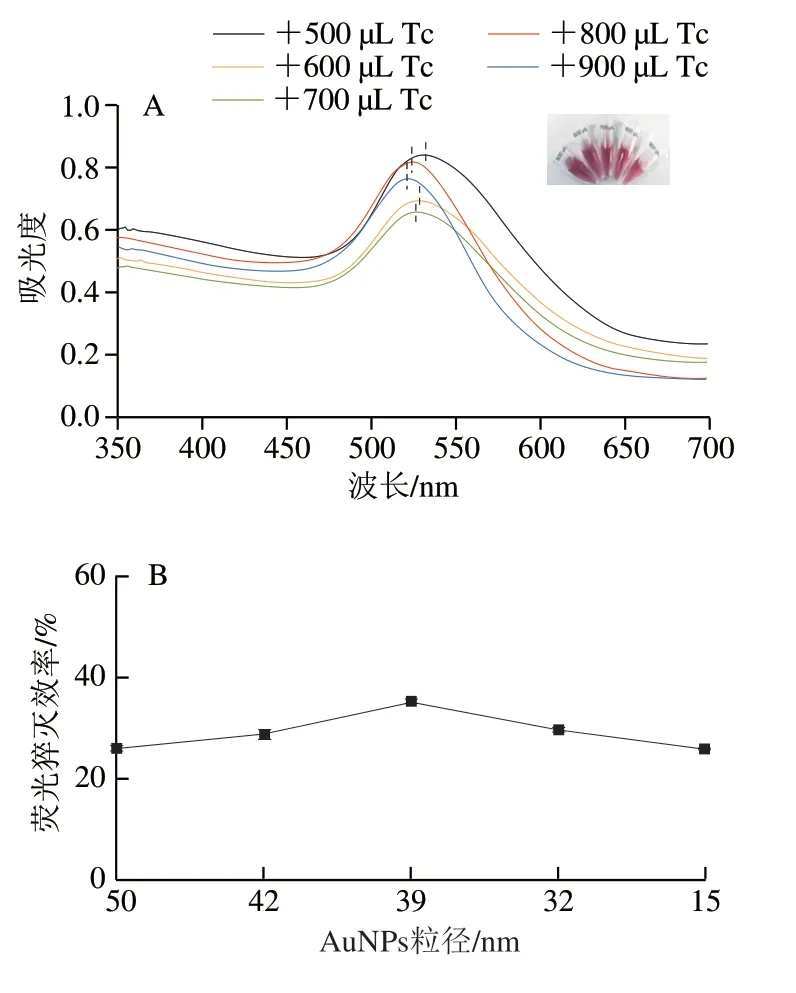
图6 添加不同Tc体积AuNPs的UV-Vis光谱(A)和不同粒径 AuNPs对CQDs荧光的猝灭效率(B)Fig.6 UV-Vis spectra of AuNPs with different volumes of added Tc (A) and fluorescence quenching efficiency of AuNPs with different particle sizes on CQDs (B)
2.5.3 AuNPs添加体积和猝灭时间优化
在AuNPs粒径优化为39 nm的基础上,进一步对AuNPs的添加体积和猝灭时间进行优化。在CQDs-P1的溶液中分别加入100、150、200、250、300 μL的AuNPs溶液进行荧光猝灭实验,结果如图7A所示,随着AuNPs溶液的添加体积从100 μL增加到200 μL,CQDs的荧光猝灭程度逐渐增加,而当AuNPs溶液的添加体积进一步增加时,CQDs的荧光猝灭程度却在逐渐降低,这可能是因为溶液体系中AuNPs浓度较大,容易发生聚集,导致AuNPs沉降[30],进而影响到其对CQDs荧光的猝灭,因此AuNPs的添加体积优选为200 μL。图7B是200 μL浓度约为4.57×10-10mol/L的AuNPs加入到CQDs-P1溶液中不同时间后对CQDs荧光的猝灭效率,可以看到随着时间的延长,AuNPs对CQDs荧光的猝灭效率越来越高,说明越来越多的CQDs-P1吸附到AuNPs上,荧光猝灭效率在20 min之后达到平稳,此时应该已经达到吸附饱和状态,因此AuNPs对CQDs的猝灭时间优化为20 min。
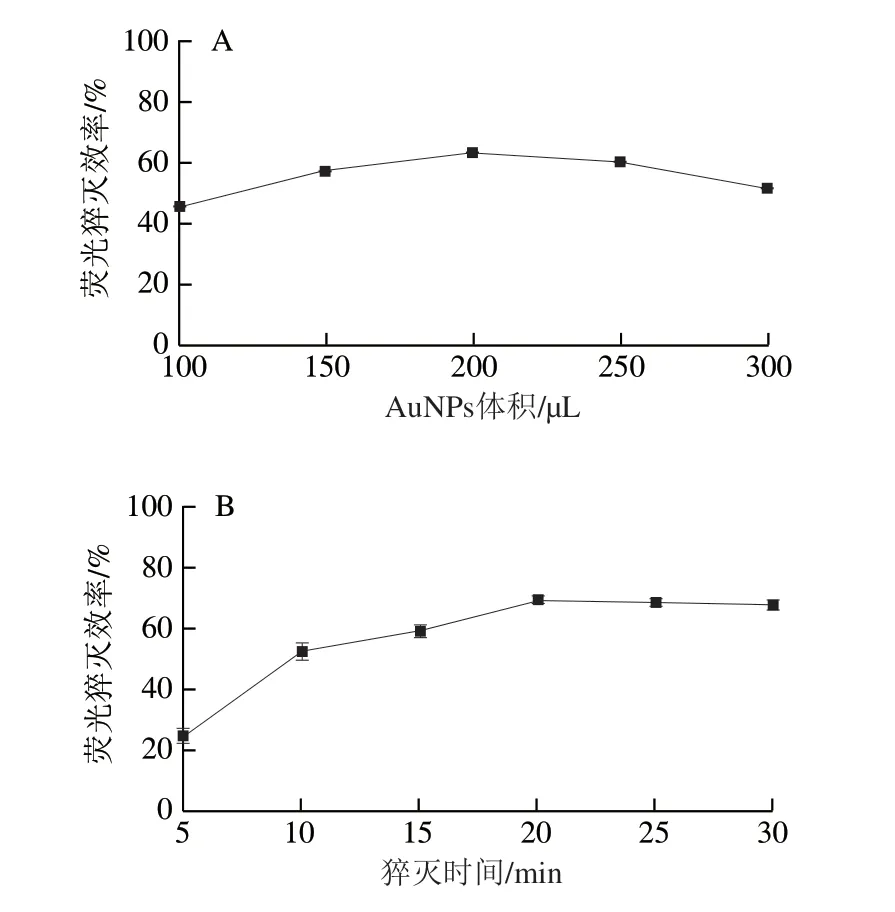
图7 不同AuNPs添加体积(A)和AuNPs添加不同时间后(B)对 CQDs的荧光猝灭效率Fig.7 Effect of AuNPs amount (A) and quenching time (B) on fluorescence quenching efficiency of CQDs
2.5.4 E2与P1孵育时间优化
为获得最佳的荧光恢复效果,对E2加入不同时间后CQDs荧光恢复的情况进行探究。图8是E2与CQDs-P1/AuNPs溶液体系分别孵育15、30、45、60、75、90 min后的相对荧光强度(F-F0,F0为CQDs荧光被AuNPs猝灭后的荧光强度,F为猝灭后再加入E2的荧光强度),即荧光的恢复程度,随着孵育时间的延长,体系的F-F0越来越高,表明越来越多的P1与E2结合并不再吸附在AuNPs表面,从而引起CQDs荧光的恢复,体系的F-F0在60 min后趋于稳定,表明此时E2能结合的P1达到了最大值。因此荧光的恢复时间优化为60 min。
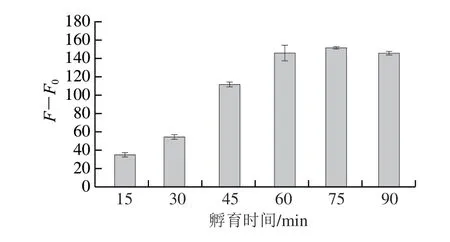
图8 E2与P1孵育不同时间后体系的相对荧光强度Fig.8 Effect of incubation time between E2 and P1 on relative fluorescence intensity (F-F0) of the system
2.6 荧光适体传感器检测E2的灵敏度测试
AuNPs可以通过FRET猝灭CQDs的荧光,而E2加入后会与其适配体P1结合从而破坏FRET,使得CQDs的荧光有一定程度的恢复,不同浓度的E2会引起CQDs荧光不同程度的恢复,基于此可以实现E2的定量检测。在优化的检测条件下,AuNPs先与CQDs-P1溶液混合以猝灭其荧光,然后加入不同浓度的E2标准溶液(10-10~10-5mol/L)孵育60 min,反应完成后进行荧光测试,结果如图9A所示,CQDs-P1溶液具有最高的荧光强度,加入AuNPs后其荧光被大幅度猝灭(F0),随着加入E2浓度的增大,CQDs的荧光强度逐渐恢复的越来越高(F),可以观察到E2最终浓度低至2×10-10mol/L 时几乎就起不到恢复CQDs荧光的作用了。以E2最终浓度(2×10-9~2×10-5mol/L)的对数值为横坐标,对应的相对荧光强度为纵坐标绘制标准曲线(图9B),拟合得到线性方程y=58.50x+558.95,决定系数R2为0.992。在此基础上,计算出该荧光适体传感器测定E2的LOD为3.4×10-10mol/L,LOQ为1.0×10-9mol/L。结果表明,该传感器对痕量E2的定量检测具有宽广的检测范围和较高的灵敏度。
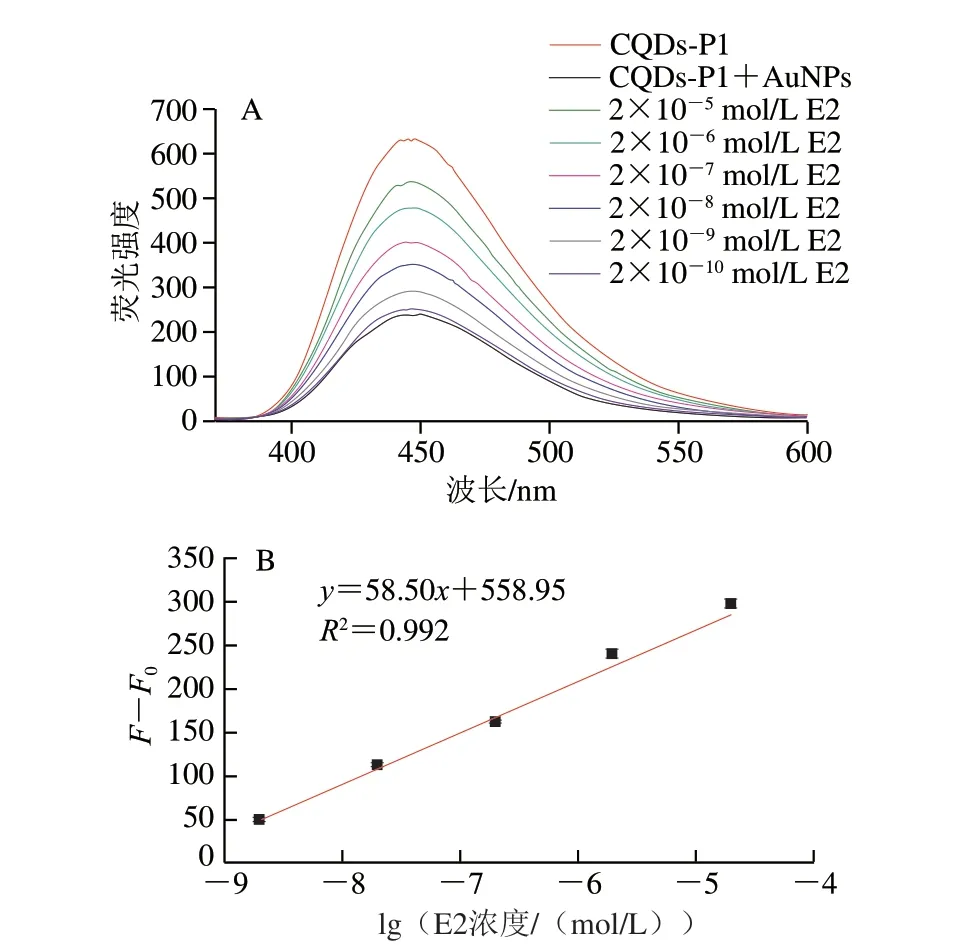
图9 E2适体传感器的荧光光谱(A)和适体传感器的F-F0 与E2浓度对数值之间的线性关系图(B)Fig.9 Fluorescence spectra of aptasensor with E2 concentration ranging from 2 × 10–10–2 × 10–5 mol/L (A) and linear plot between F–F0 of aptasensor and logarithm of E2 concentration ranging from 2 × 10–10–2 × 10–5 mol/L (B)
2.7 荧光适体传感器检测E2的特异性及重复性测试
为研究该适体传感器的特异性,同样地选用E1、E3、DES、BPA这些E2类似物和Ca2+、Fe3+、K+、Mg2+、Na+、Zn2+、S、Cl-这些可能与E2共存的离子进行实验,这些干扰物质的最终浓度为2×10-6mol/L,E2的最终浓度为2×10-7mol/L。如图10A所示,可以看出CQDs荧光被AuNPs猝灭后,只有加入E2或者将E2连同干扰物一起加入才能引起荧光大幅度的恢复,而单独加入上述干扰物质几乎不会引起荧光强度的变化,表明适配体只会特异性地与E2结合从而恢复CQDs的荧光,该结果证明了所构建的荧光适体传感器在检测E2时具有良好的选择性。另一方面,为了研究该荧光适体传感器用于E2检测的重复性,制备了10组E2最终浓度为2×10-7mol/L 的平行样品用于实验,其对应的相对荧光强度F-F0如图10B所示,可以看出这10 组平行样品的荧光恢复程度接近,计算其F-F0的相对标准偏差(relative standard deviation,RSD)为5.0%,说明该荧光适体传感器对E2的检测同样具有良好的重复性。
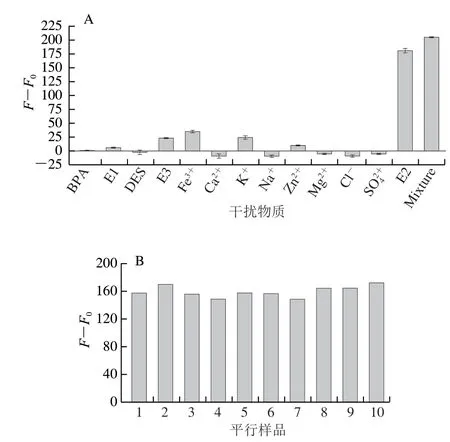
图10 E2与不同干扰物加入检测体系后适体传感器(A)和10 组2×10-7 mol/L E2平行样品(B)的相对荧光强度Fig.10 Relative fluorescent intensities of aptasensor with 10–6 mol/L interferences and 10–7 mol/L E2 (A) and relative fluorescent intensities of 10 parallel samples of E2 at 10–7 mol/L (B)
2.8 实际样品中E2的检测
该研究选择牛奶、湖水和实验室自来水作为实际样品对E2进行加标检测,将其按照1.3.6节经过简单的预处理后制备成E2的加标溶液,然后与CQDs-P1和AuNPs的混合溶液孵育60 min后进行荧光测试,其中E2的加标终质量浓度为1、2.5、5 μg/mL。另外也对未添加E2的牛奶和水样进行了检测,将其作为对照结果。表1 显示在对照中未检测到E2的存在,原因可能是所选取的牛奶和水样中E2的浓度低于该适体传感器的检出限;此外,不同E2加标质量浓度的牛奶样品获得的回收率为89.67%~108.66%,对应的RSD在3.8%~6.3%之间,两种水样中得到的E2回收率在90.34%~113.36%之间,RSD均小于5%;HPLC方法检测实际样品中的E2得到的回收率在81.53%~115.44%之间,RSD为0.6%~9.4%。从结果可以得出该荧光适体传感器的检测结果与HPLC方法得到的检测结果较为一致,表明该荧光适体传感器在监测实际样品中E2的含量时具有良好的准确度和精度[31],并且有望作为一种简便快捷的传感方法在现实场景中准确灵敏地检测痕量的E2残留。
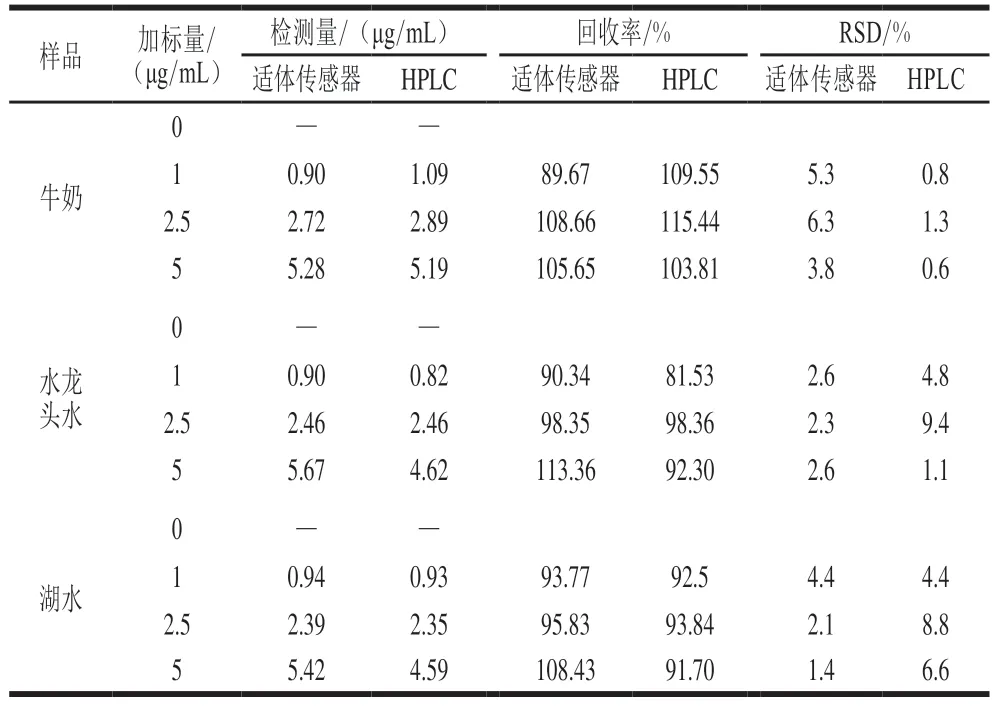
表1 适体传感器与HPLC方法测定实际样品中E2含量的回收率Table 1 Recoveries of E2 in spiked real samples by this aptasenor and HPLC
3 结论
利用AuNPs对CQDs荧光的猝灭作用建立了一种用于E2检测的荧光适体传感器,结果显示该传感器对E2具有宽广的检测范围(2×10-5~2×10-9mol/L),且LOD能达到3.4×10-10mol/L,E2和其短链适配体的高亲和性赋予了该传感器良好的选择性,最后将其用于牛奶和湖水等实际样品中E2的检测,得到的回收率为89.67%~113.36%,RSD为1.4%~6.3%,其结果与HPLC方法检测E2得到的结果较为一致,表明该传感器具有实际的应用潜力。
