基于代谢组学法鉴定液体果蜡中漂白紫胶的模型构建
2023-08-05张雯雯唐保山邢淑婕马金菊雷福厚
李 坤,张雯雯,,唐保山,邢淑婕,马金菊,朱 静,雷福厚,张 弘,
(1.信阳农林学院食品学院,河南 信阳 464000;2.中国林业科学研究院高原林业研究所,国家林业和草原局特色森林资源工程技术研究中心,云南 昆明 650233;3.广西民族大学 广西林产化学与工程重点实验室,广西林产化学与工程协同创新中心,广西 南宁 530006)
为了保持水果和蔬菜较好的感官品质、微生物安全和营养价值,延长果蔬贮藏期和货架期,保鲜处理是果蔬采后管理的重要环节。液体果蜡是一种用于果蔬处理的涂膜剂,是广泛使用的果蔬涂膜保鲜剂[1]。液体果蜡涂覆在果蔬表面形成一层多孔、连续的不规则薄膜,可以很好地抑制各种生理生化的反应速率,减少水分和营养物质的流失,保持果蔬的品质[2-3]。出于安全、环保和优质的因素,可食性液体果蜡在果蔬中的应用也愈发受到人们的青睐。
紫胶是紫胶虫分泌的一种呈紫红色的天然混合物,也叫赤胶或虫胶,中药学上称为紫草茸。紫胶是目前已经开发利用的唯一一种动物树脂,主要由紫胶树脂、色素和蜡组成[4-6]。紫胶树脂经过漂白,去除紫胶黄色素,便得到漂白紫胶[7-9]。漂白紫胶具有原料天然、无毒的特点,且具有良好的成膜性、生物相容性和可降解性,是中国[10]和联合国粮农组织及世界卫生组织[11]允许在食品和药品领域添加的齐聚物,在果蔬保鲜领域应用 极广[12]。然而,由于近年来紫胶价格波动,市场上出现了冒充漂白紫胶基液体果蜡的假冒液体果蜡产品。中国已发生数件因液体果蜡中是否含有漂白紫胶的争议而引发的商业纠纷案件。然而,由于缺乏相应的检测手段,不仅从业者面对琳琅满目的样品时难以辨别,相关管理部门也显得无能为力。
紫胶树脂是由多种脂肪酸和倍半萜烯酸组成的内酯和交酯[13],是一系列复杂单体形成的聚酯混合物,没有固定的结构和组成,这给紫胶的检测带来了极大的困难。漂白紫胶是紫胶树脂经漂白后形成的浅色紫胶树脂,漂白过程中除色素等发色基团被破坏外,同时不同程度地对紫胶树脂产生影响,这无疑加剧了紫胶树脂结构和组成的复杂性。在液体果蜡配方中,漂白紫胶 是成膜基质,此外还含有其他类型聚合物或辅助性添加物[14],这些物质的干扰再次增加了漂白紫胶检测的难度。目前,紫胶的检测方法可采用光谱法[15],其虽可与紫胶结构产生直接的关联,但当紫胶存在于混合物中时可靠性急剧下降。此外,Wang Lili[16]和Sutherland[17]等分别采用气相色谱-质谱联用及热裂解气相色谱-质谱联用在分子水平上获得紫胶组成的详细信息。然而,由于气相色谱需要化学或热预处理,容易造成紫胶组成的信息丢失[18]。为此,Tamburini[18]和Coelho[19]等探索了以 液相色谱-串联四极杆飞行时间质谱(liquid chromatography-quadrupole time-of-flight mass spectrometry,LC-QTOF-MS)的方法检测紫胶的工作。这不仅促使业界深入认识了紫胶的化学组成,同时给液体果蜡保鲜涂膜中漂白紫胶的定性检测带来了启示。
代谢组学是一种旨在识别和量化小分子代谢物的新型研究手段,它从整体角度出发,运用现代检测技术对目标物中尽可能多的代谢产物进行分析检测。代谢组学与现代仪器分析方法和化学计量学的结合大幅促进了其在食品领域的应用。随着高精度、高分辨仪器的发展和数据库的不断完善,目前,已在微生物代谢[20]、药物开发[21]、毒性评价[22]等领域广泛应用。
本实验借鉴代谢组学的研究思路和方法,通过LC-QTOF-MS和蒸发光散射检测器(evaporative lightscattering detector,ELSD)结合的方式,对漂白紫胶的组成成分进行鉴定分析,并筛选出其共性化合物组分,从而建立漂白紫胶的定性分析方法。最后,通过商业化液体果蜡和对照品的验证性分析证明方法的可靠性,为液体果蜡产品中漂白紫胶的定性鉴定提供科学依据。
1 材料与方法
1.1 材料与试剂
漂白紫胶分别来自B(17 个样本)、D(27 个样本)、L(54 个样本)、X(18 个样本)和Z(18 个样本)5 个组。5 组样品分别购自云南省漂白紫胶的五家主要生产企业:安宁戴科精细化工有限公司、昆明西莱克生物科技有限公司、贝思帝诺生物科技(昆明)有限公司、云南泽林林业科技有限公司、墨江县洪森虫胶有限公司(样本编码与企业无对应关系)。
GL-1实验室中制备,漂白紫胶质量分数9%的液体果蜡产品;GL-2~GL-4为中国市场随机购买的商业液体果蜡产品。
(±)-9,10,16-三羟基棕榈酸标准品(纯度≥98%)TCL(上海)化成工业发展有限公司;甲醇、乙腈(均为色谱纯)赛默飞世尔科技(中国)有限公司;甲酸(分析纯)天津风船化学试剂科技有限公司。
1.2 仪器与设备
6540LC-QTOF-MS仪、1260B型蒸发光散射检测器 美国Agilent有限公司;AB204-S电子天平 梅特勒-托利多(中国)有限公司;FD-1C-50冷冻干燥机 北京 博医康实验仪器有限公司;PURELAB ELGA纯水机 莱特莱德(北京)环境技术股份有限公司;78-1磁力加热搅拌器 金坛市杰瑞尔电器有限公司;高纯氮(纯度≥ 99.999%)昆明广瑞达气体有限公司。
1.3 方法
1.3.1 漂白紫胶样品的预处理
称取漂白紫胶样品各20 g放入250 mL带冷凝器的圆底烧瓶中,各加入200 mL质量分数25%氢氧化钠溶液在90 ℃搅拌反应30 h。反应停止后各加入饱和氯化钠溶液200 mL进行盐析,盐析目的是去除大部分的紫胶桐酸(aleuritic acid,Ale),此为Ale的碱水解制备方 法[23-24],以免Ale单一组分含量过高对其他化合物的检测灵敏度和准确性造成干扰。然后用硅藻土作为过滤介质进行抽滤,滤液用18%盐酸溶液酸化至弱酸性,之后离心,沉淀用水洗至中性,最后冷冻干燥备用。
1.3.2 液体果蜡样品的预处理
量取各商用液体果蜡100 mL,其他步骤与1.3.1节保持一致。
1.3.3 HPLC-QTOF-MS分析条件
色谱条件:Zorbax 5 SB-C18色谱柱(250 mm× 4.6 mm,5 µm);柱温30 ℃;进样体积10 µL;流动相为乙腈(A)-0.1%甲酸溶液(B)进行梯度洗脱;洗脱程序:0~60 min,5%~100% A、95%~0% B;流速1.0 mL/min。
ELSD参数:雾化器温度60 ℃;蒸发管温度60 ℃;气体流速1.6 L/min(高纯氮)。
质谱条件:电喷雾电离源,负离子模式;喷雾电压为3500 V;工作气为氮气,雾化气压力35 psi;离子源温度350 ℃;碰撞能量10 eV;碰撞能量范围±1.0 eV。建立信息关联采集方法结合动态背景扣除,设置一级 质谱质量扫描范围m/z100~1700,二级质谱质量扫描范围为m/z50~1700,在每个循环内同时进行10 个MS/MS扫描。
1.3.4 质控样本
质控(quality control,QC)主要是为了保证样品检测过程的准确性,对提取或检测过程中差异较大的样品或代谢物质进行分析判断[25-26]。QC样本由不同来源的5 组样本目标物等量混合制备而成,共3 个重复,用来分析样品在相同处理方法下的重复性。在仪器分析过程中,每5 个检测样本加入一个QC样本,通过对不同QC样本展示分析,考察整个分析过程的重复性。
1.3.5 数据处理与化学计量学分析
使用Qualitative Analysis B.06.00软件对HPLC-MS数据进行处理,之后结合网络数据库和相关文献记载(表1)进行对比,结合标准品验证,确定物质结构。化合物确定后,通过HPLC-ELSD归一法计算相对含量,最后将处理的数据矩阵导入SIMCA 14.1软件,进行无监督的主成分分析(principal component analysis,PCA)和有监督的偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)等多元统计分析,再根据变量投影重要性(variable importance in projection,VIP)和组间变化的显著性(P<0.05)进行差异性化合物和共性化合物的筛选[27-28]。

表1 文献中组成紫胶树脂单体的已知化合物Table 1 Compounds from shellac monomer reported in the literature
2 结果与分析
2.1 漂白紫胶中靶向化合物的确定
从结构看,漂白紫胶是由种类众多的环状组分和链状组分形成的内酯与交酯;从组成看,漂白紫胶是由一系列结构类似化合物组成的复杂混合物,并且漂白紫胶的结构和组成还受到不同漂白工艺的影响,这些影响给漂白紫胶的检测带来了极大的不确定性[29-30]。因此,直接以漂白紫胶为靶向化合物进行差异或共性化合物的鉴定分析时难度较大,尤其靶向化合物的鉴定十分困难。为解决上述问题,选择组成漂白紫胶单体的链状和环状化合物进行靶向化合物的筛选。由图1可知,漂白紫胶鉴定的化合物为15 种,其中环状组分为8 种,链状组分为7 种,具体化合物见表2。
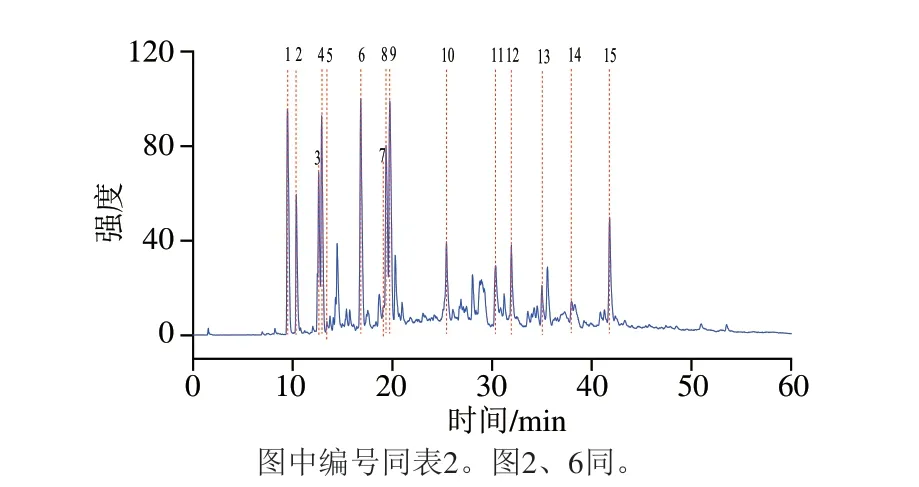
图1 LC-QTOF-MS检测样品的总离子流图Fig.1 Total ion flow chromatogram of compounds from bleached shellac samples detected by LC-QTOF-MS

表2 LC-QTOF-MS在目标物中检测到的特征标记化合物Table 2 Overview of characteristic biomarker compounds detected by LC-QTOF-MS
2.2 漂白紫胶样品的HPLC-ELSD定量检测
在检测中发现,由于不同结构单体化合物电离响应性的差异,目标物的质谱检测器和ELSD的响应强度存在明显区别[31]。依据2 种检测器的响应差异,进一步将在HPLC-ELSD中响应信号不明显的LSA、LJA和BA去掉,从而将漂白紫胶靶向化合物的筛选范围限定在12 种化合物中(图2)。考虑到不同来源的漂白紫胶分析是以寻找共性靶向化合物为目的,因此,为了消除质谱检测时电离响应性差异所带来的离子丰度差异,获得化合物更加真实的含量数据,在以LC-QTOF-MS中化合物的分子质量和碎片完成靶向化合物的鉴定后,选择以HPLC-ELSD的方法对漂白紫胶单体的化合物组成进行峰面积归一法的定量分析,以靶向化合物含量进行代谢组学的聚类和差异性分析。
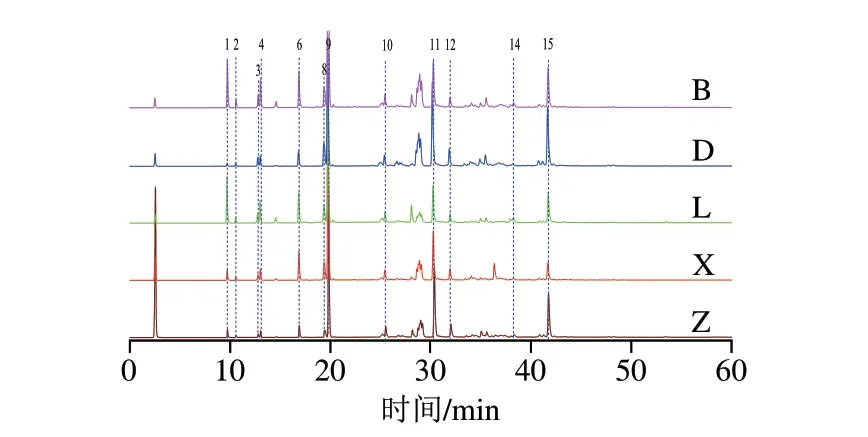
图2 不同组漂白紫胶的HPLC-ELSD定量分析图Fig.2 Quantitative analysis of target compounds from different groups of bleached shellac by HPLC-ELSD
2.3 靶向代谢组学模型的建立和分析
2.3.1 聚类分析
为进一步明确不同来源漂白紫胶在单体组成上的聚类特征,首先对样本进行无监督模式下的PCA。如图3a 所示,6 个PC的相关性仅达到95.9%,PC1、PC2、PC3的占比为87.8%。这说明各个来源组的样本较为分散,聚类特征不明显。PCA虽然能够有效地提取主要信息,但是对于相关性较小的变量不敏感,而PLS-DA可以使组间区分最大化,有利于寻找差异性化合物。在无监督PCA基础上进行有监督模式下的PLS-DA,由图3b可知,QC样本聚类明显,表明实验操作及仪器稳定,数据可靠。L组的样品相对分散,B组的样品聚类明显。说明PLS-DA模型解释度较好,相比于PCA模型效果更好。且PLS-DA模型的为0.999,R2Y为0.589,Q2为0.54,3 个参数值均大于0.5,说明模型建立合理有效[32]。
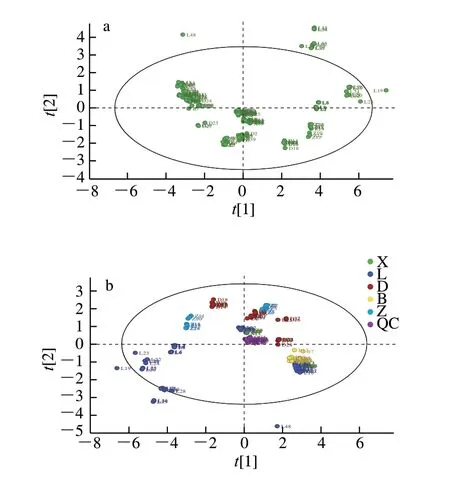
图3 靶向化合物的无监督PCA(a)和有监督PLS-DA(b)得分图Fig.3 Score plots of PCA (a) and PLS-DA (b) of target compounds
2.3.2 果蜡保鲜剂中紫胶树脂的靶向代谢组学鉴定模型
为了直观呈现12 种靶向化合物在不同5 个来源组漂白紫胶中的分布情况,将化合物含量绘制热图(颜色编码刻度表示每个化合物的相对含量:绿色为含量低,红色为含量高)。如图4所示,5 个来源组漂白紫胶中单体化合物的含量及分布均有差异。B组漂白紫胶中的 16-HAA、9,10-DAA、9,10-DEA含量较为丰富;D组漂白紫胶中的Ale、9,10-DAA、LA、LLA、9,10-DTA的含量相对丰富;L组漂白紫胶中的9,10-DTA、SA、JA、JAI、SAI、LLA、16-H-9-A含量相对丰富;X组漂白紫胶中的LA、9,10-DEA、9,10-DAA、JAI、16-HAA、16-H-9-A的含量相对丰富;Z组漂白紫胶中的Ale、SAI、SA、JA、JAI、LLA、LA的含量相对丰富。

图4 靶向化合物热图Fig.4 Heatmap of target compounds
液体果蜡是以漂白紫胶为选择性配方之一的商业化产品,一般不以漂白紫胶原料来源对产品做有效区分。换言之,液体果蜡中的漂白紫胶原料可能来源于任意一个组。因此,为增加定性检测方法的可靠性,必须要求在靶向化合物中所筛选出的标志性化合物是5 个组的共性化合物,且含量差异较小。热图虽然可以直观地显示各种化合物的含量水平与分布情况,但哪些化合物可作为不同组漂白紫胶的共性化合物,并可用于漂白紫胶的定性分析并不能直接给出结论。为此,采用代谢组学差异性分析的方法,进一步对不同靶向化合物在5 个组漂白紫胶中的代表性进行分析。
如图5a所示,化合物离中心点越近,说明该化合物在5 个组中的共性越强,离中心点越远,则表示该化合物在5 个组中的差异性越大。显然,16-H-9-A、Ale、16-HAA、9,10-DTA、LA是偏离中心点较远的化合物,说明其在5 个组中有较大的差异。为量化评价这种差异性,通过化合物(变量)的VIP值对相关性进行排序,结果如图5b所示。通常认为VIP值大于1的化合物,可作为差异性化合物。相反,VIP值小于1的化合物,则可作为共性化合物[33-34]。因此,漂白紫胶的共性化合物(标志性化合物)有7 种,按照相关性由大到小排序为SAI、9,10-DEA、JA、SA、LLA、JAI、9,10-DAA;差异性化合物共5 种,按照差异性由大到小的顺序为16-H-9-A、Ale、16-HAA、9,10-DTA、LA。对比上述7 种共性化合物后发现,仅有9,10-DEA和9,10-DAA为链状组分,其余5 种均为环状萜烯。而在5 种差异性化合物中,仅有LA为环状组分,其余4 种均为链状脂肪酸。在化合物本身对紫胶树脂的标识性方面,脂肪酸具有更加广泛的来源和丰富的结构,因此,环状萜烯酸相对特殊的结构和组成更加适合作为漂白紫胶的特征标识物用在液体果蜡中漂白紫胶的鉴定分析中。
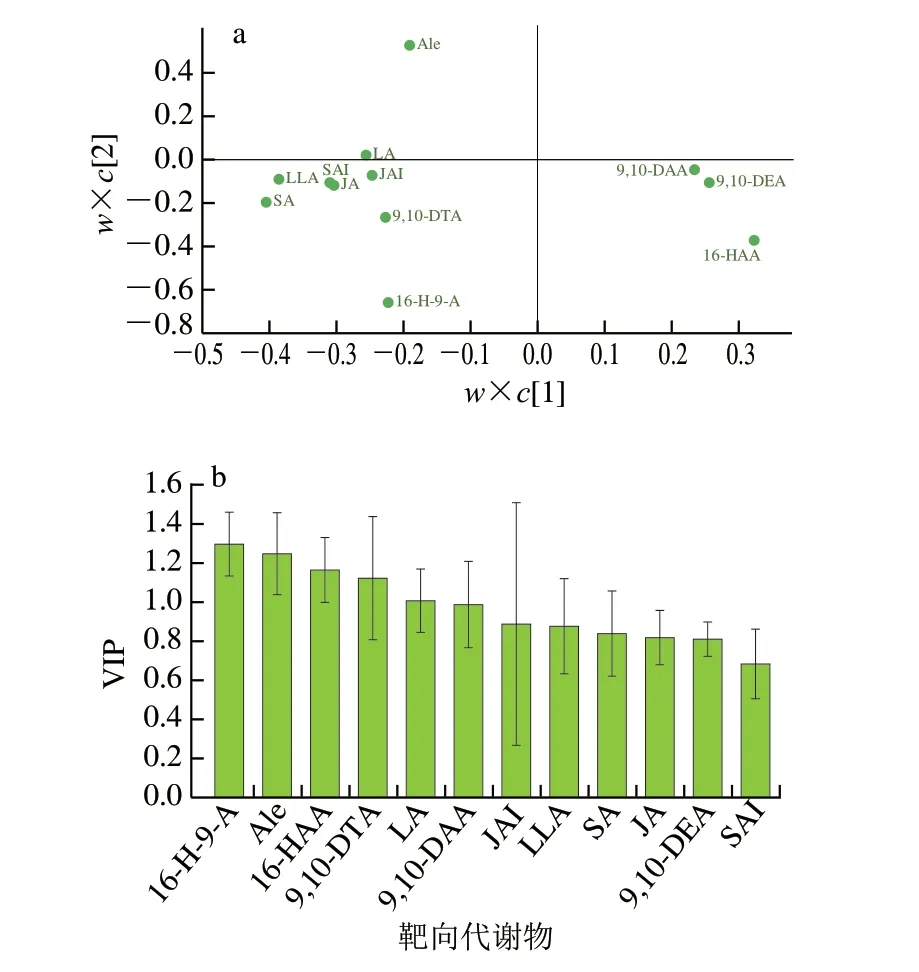
图5 靶向代谢物的PLS-DA载荷图(a)和VIP值(b)Fig.5 Loading plot (a) and VIP values (b) of PLS-DA for target compounds
2.4 商业化液体果蜡中漂白紫胶的鉴定分析
以上述筛选出的标志性化合物为依据、从市场随机购买不同品牌并在产品说明书中标明含有漂白紫胶的液体果蜡商业产品(GL-2~GL-4)为检测样品、实验室自制的样品(GL-1)作为对照品,按照1.3.2节方法进行样品处理后进行HPLC-ELSD检测,结果如图6所示。在本研究所选的3 种市售液体果蜡产品中,GL-2检出了本实验鉴定的12 种靶向化合物,且与对照品(GL-1)的鉴定结果高度一致。从GL-4样品的色谱图中看出,该液体果蜡中不含有漂白紫胶中的靶向化合物,可基本判断该液体果蜡产品中不含有漂白紫胶。在GL-3样品中未检测到漂白紫胶树脂的共性化合物,但从色谱图中看出GL-3样品中检测出了Ale组分,而Ale组分是本研究得出的差异性化合物之一,目前,依据公开的文献资料,在除紫胶以外的其他物质中,未见发现Ale的研究报道,因此从理论上来讲,Ale可作为漂白紫胶的标识性化合物。但根据上述代谢组学的鉴定结果,仅以Ale作为液体果蜡中漂白紫胶的标识性化合物时不仅含量波动大,影响其检测准确性;且Ale作为一种多羟基脂肪酸类的化合物已是成熟的商业化产品,可通过在配方中添加的方式达到规避检测的目的。因此,不能仅凭借GL-3样品中含有Ale就判定该产品中含有漂白紫胶,这也是本研究筛选共性化合物的意义所在,只有同时含有7 种共性化合物才可作为漂白紫胶定性的依据。因此,GL-3、GL-4样品中不含漂白紫胶,GL-2中含有漂白紫胶。综上可见,本研究建立的标识性化合物筛选方法,对果蔬保鲜液体果蜡中漂白紫胶的定性分析具有较高的可靠性。

图6 HPLC-ELSD法检测商业化液体果蜡产品的色谱图Fig.6 Chromatograms of target compounds in commercial liquid fruit wax products detected by HPLC-ELSD
3 结论
针对液体果蜡中是否添加漂白紫胶的问题,借鉴代谢组学的方法,采用基于LC-QTOF-MS结合ELSD的检测技术,通过收集不同来源且具有代表性的漂白紫胶开展系统研究。由无监督的PCA和有监督的PLS-DA多元统计分析,鉴定出12 种已知代表性的化合物。结合化合物VIP值大小,分为7 种共性化合物(SAI、9,10-DEA、JA、SA、LLA、JAI、9,10-DAA)和5 种差异性化合物(16-H-9-A、Ale、16-HAA、9,10-DTA、LA)。为增加检测方法的可靠性,以共性化合物为生物标识物,在市售的商业化液体果蜡产品中验证了该方法的可行性。结果表明,本研究可为液体果蜡中是否含有漂白紫胶的鉴定分析提供新思路和科学依据。
