太平猴魁茶栽培品种‘柿大茶’品系间代谢物及遗传进化分析
2023-08-05周汉琛刘亚芹杨霁虹徐玉婕雷攀登
周汉琛,刘亚芹,王 辉,杨霁虹,徐玉婕,雷攀登
(安徽省农业科学院茶叶研究所,安徽 黄山 245000)
‘柿大茶’是我国著名的有性系茶树品种,由其嫩梢加工的太平猴魁绿茶花香明显,且滋味醇厚鲜爽,品质优异。挥发性物质分析显示醇类化合物在太平猴魁绿茶中的含量较高(相对含量可达到36%~62%),比如芳樟醇、芳樟醇氧化物、香叶醇及2-乙基-1-己醇等[1]。研究显示,兰花香的重要贡献者茉莉酮酸甲酯及其异构体在太平猴魁绿茶中含量丰富,对太平猴魁绿茶的花香贡献较大[2]。新近研究显示,‘柿大茶’品种加工的太平猴魁绿茶,与非‘柿大茶’茶树品种加工的绿茶在香气品质、挥发物含量上均有较大差异[3],即‘柿大茶’品种加工的太平猴魁绿茶的香气品质更优异。此外,研究还表明不同‘柿大茶’品系加工的绿茶,在香气品质上也存在明显差异[3],推测‘柿大茶’不同品系间存在遗传多样性,使得次级代谢产物积累有差异。前期研究即表明,‘柿大茶6号’、23号绿茶香气、滋味品质显著优于‘柿大茶7号’品系绿茶[4]。不同产地的‘太平猴魁’绿茶在表儿茶素(epicatechin,EC)、没食子儿茶素(gallocatechin,GC)、咖啡碱、表没食子儿茶素(epigallocatechin,EGC)含量分布上也存在差异[5]。简单重复序列(simple sequence repeat,SSR)分析表明,‘柿大茶’群体种中具有相对较高的遗传多样性[6]。
茶叶品质与茶树品种、栽培管理及加工工艺密切相关[7-10]。优良茶树品种的选育对茶叶品质的提升至关重要。‘柿大茶’茶树品种嫩梢持嫩性较强,由其加工的太平猴魁绿茶,外形苍绿、壮实;香气、滋味品质俱佳(图1)。为获得较为优异的‘柿大茶’品种,当地对加工成品茶品质较为优异的‘柿大茶’单株进行了扦插与培育。目前较优异的‘柿大茶’品系有‘高家早’(gaojiazao,GJZ)、‘黄种’(huangzhong,HZ)、‘柿大茶2号’(shidacha No.2,SDC2)、‘柿大茶6号’(shidacha No.6,SDC6)、‘广阳早’(guangyangzao,GYZ)等(图1)。‘凫早2号’(fuzao No.2,FZ2)为无性系茶树品种,从祁门杨树林群体种中选育而来;‘舒茶早’(shuchazao,SCZ)茶树品种选育于安徽舒城群体种。目前这两个无性系品种在黄山茶区栽种较为广泛,在黄山市黄山区(太平猴魁绿茶主产区)也有一定栽种面积。已有研究表明不同‘柿大茶’品系加工绿茶存在差异,使得太平猴魁绿茶品质不稳定。本研究拟基于挥发性与非挥发性代谢物分析,结合RNA-seq测序分析技术,研究不同‘柿大茶’品系间、‘柿大茶’与非‘柿大茶’品种间的物质基础及遗传背景差异,旨在为后续‘柿大茶’优异品种选育提供理论参考。
1 材料与方法
1.1 材料与试剂
‘柿大茶’品系来源于黄山市猴坑村品种园,包含GJZ、HZ、SDC2、SDC6及GYZ;非‘柿大茶’茶树品种FZ2和SCZ来源于安徽省农科院茶叶研究所商山基地。转录组测序分析时,采取4月份一芽二叶嫩梢并立即置于干冰中,后贮存在-80 ℃冰箱,用于后续分析。
正构烷烃(C5~C20)美国Sigma 公司;试剂A(Buffer A-1,0.12 mol/L,pH 2.9)、试剂B(Buffer B-1,0.3 mol/L,pH 4.2)、试剂C(Buffer C-4,0.3 mol/L,pH 8.0)、试剂D(500 mmol/L NaOH,0.68 mmol/L EDTA)德国赛卡姆公司。
1.2 仪器与设备
57348-U 50/30 μm DVB/CAR/PDMS纤维头 德国默克公司;7697A-7890A气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪、DB-5MS色谱柱(30 m×0.25 mm,0.25 μm)、液相色谱柱InfintyLab Proshell 120 SB-C18(150 mm×4.6 mm,2.7 μm)美国Agilent公司;LC-2010高效液相色谱(high performance liquid chromatography,HPLC)仪 日本岛津公司;433D氨基酸分析仪 德国赛卡姆公司。
1.3 方法
1.3.1 绿茶样品前处理
绿茶加工中的鲜叶原料来源于黄山市黄山区(太平猴魁绿茶主产区);7 个茶树品种(品系)栽种地理位置相对一致。依据太平猴魁绿茶加工标准(DB 34/T 258—2012《太平猴魁茶工艺规程》)将7 个品种嫩梢制成绿茶样,主要步骤如下:摘取一芽二三叶嫩梢于室内摊放4~6 h;深锅杀青3~4 min后手工捏尖、理条、压制;毛火100 ℃、9~10 min;足火70 ℃、30 min;三烘85 ℃、20 min。绿茶样贮藏于-20 ℃冰箱,用于后续代谢物分析。
1.3.2 感官审评
由6 位审评专家依据国家茶叶审评标准(GB/T 23776—2018《茶叶感官审评方法》)中的绿茶审评办法对7 个绿茶样的香气、滋味品质进行描述与评分。具体步骤如下:准确称取3.0 g茶样,于150 mL 98 ℃水中冲泡4 min后,倒出茶汤,其中叶底用于香气品质审评,茶汤用于滋味审评。香气、滋味品质审评采用百分制:绿茶具有鲜醇、醇厚鲜爽、浓醇鲜爽等滋味品质特征,得分范围为90~99;尚醇厚、清爽品质特征得分范围为80~89;浓涩、青涩、欠醇品质特征得分范围为70~79。香气评价中,具有嫩香、花香等品质特征得分范围为90~99;清香、尚高爽品质特征得分范围为80~89,而具有尚纯、熟闷等香气品质特征的绿茶得分范围为70~79。
1.3.3 挥发性化合物测定
采用顶空固相微萃取(headspace-solid phase microextraction,HS-SPME)对7 个绿茶样中的香气进行吸附[3,11]。同时为探究茶汤中花香类化合物含量差异,参照Flaig等[12]研究方法,以1∶50(茶水比)配制茶汤,冷却至室温后取10 mL茶汤利用50/30 μm DVB/CAR/PDMS纤维头于40 ℃水浴吸附40 min。每个样品重复3 次。
G C-M S 检测条件:D B-5 M S 色谱柱(30 m× 0.25 mm,0.25 μm);进样口温度260 ℃;不分流。SPME纤维头吸附结束后立即于进样口解吸附5 min,升温程序如下:初始温度为40 ℃并保留5 min,后以 4 ℃/min速率升到200 ℃并保留2 min,再以10 ℃/min速率升到280 ℃并保留5 min。载气为高纯氦气(>99.99%),载气流速为1 mL/min。离子源温度为为230 ℃;四极杆温度为150 ℃;电子能量为70 eV;质量扫描范围为30~600 u。
化合物鉴定采用保留指数法,即利用正构烷烃计算化合物保留指数,并与NIST数据库(https://webbook.nist.gov/chemistry/)进行比对,定性化合物。化合物定量采用样品中化合物峰面积与标准品峰面积之比计算含量(μg/kg或μg/L)。
1.3.4 儿茶素、咖啡碱含量分析
准确称取0.25 g绿茶样,加入8 mL沸水;90 ℃水浴7 min后收集茶汤。此步骤重复提取3 次后混合茶汤提取液,并利用超纯水稀释4 倍。采用0.22 μm水系膜过滤茶汤后,用于HPLC。每个样品重复3 次。
HPLC条件:InfintyLab Proshell 120 SB-C18(150 mm× 4.6 mm,2.7 μm);流动相A为0.04%磷酸溶液;流动相B为乙腈;流动相C为甲醇;流速为1.0 mL/min;检测波长为280 nm;柱温箱温度为40 ℃。洗脱条件:0~1 min,90% A,7.5% B,2.5% C;1~23 min,85% A,11.2% B,3.8% C;23~23.1 min,15% A,85% B;23~35 min,15% A,85% B;35~50 min,90% A,7.5% B,2.5% C;50~60 min,90% A,7.5% B,2.5% C。
儿茶素类物质和咖啡碱定性鉴定依据标准品出峰时间;化合物定量(mg/g)依据已绘制的儿茶素物质、咖啡碱标准曲线计算。
1.3.5 游离氨基酸含量测定
参考文献[4,13]方法,采用氨基酸分析仪测定茶汤样品中游离氨基酸。样品配制与儿茶素分析中的提取、稀释方法一致。每个样品重复3 次。色谱柱为LCA K07/Li(150 mm×4.6 mm);流动相和衍生相流速分别为0.45 mL/min和0.25 mL/min。试剂A、试剂B、试剂C和试剂D用于流动相分析。茚三酮缓冲液(1 L:20 g茚三酮,600 mL甲醇,400 mL钾钠缓冲液)。流动相梯度:0~1 min,80% A,20% B;1~3 min,79% A,21% B;3~8 min,61% A,39% B;8~20 min,43% A,57% B;20~24 min,43% A,57% B;24~36 min,100% B;36~42 min,100% C;42~47 min,76% C,24% D;47~61 min,76% C,24% D;61~61.1 min,100% D;61.1~68 min,100% D;68~68.1 min,100% A;68.1~84 min,100% A。检测波长分别为570 nm和440 nm。
游离氨基酸定性以标准品出峰时间为基准;化合物定量(mg/g)以样品中的峰面积与标准品峰面积之比计算含量。
1.3.6 茶树嫩梢转录组测序分析
7 个茶树品种(品系)嫩梢(一芽二叶)的转录组测序及遗传进化树分析由广州基迪奥生物公司完成。主要步骤如下:提取茶树嫩梢的RNA并反转录成cDNA用于文库构建。测序平台为Illumina Novaseq6000(广州基迪奥公司)。测序完成后,通过软件过滤低质量数据、去除接头序列等,以获得高质量转录组数据。以舒茶早基因组序列(http://tpdb.shengxin.ren/)为参考基因组,利用MUSCLE(http://www.drive5.com/muscle/)分析不同茶树品种(品系)中基因家族进化关系,构建进化树;利用Stringtie重构转录本,并利用RSEM计算样本中基因转录水平。
1.4 数据分析
利用SPSS 19.0软件中的Duncan计算法分析样品中代谢物积累的差异(P<0.05);利用SIMCA 14.0软件对不同茶树品种(品系)中的代谢物、基因转录水平进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 感官审评结果
本研究依据太平猴魁绿茶加工工艺:摊放、杀青、捏尖、压制、干燥,将以上7 个茶树品种(品系)嫩梢加工成绿茶。滋味审评结果显示,‘柿大茶’品系绿茶GJZ、GYZ及非‘柿大茶’品种绿茶FZ2具有鲜醇品质特征,滋味感官审评得分较高;HZ、SDC2、SDC6绿茶滋味鲜爽度不足,得分相对较低;SCZ绿茶滋味醇厚度、鲜爽度均不足,得分最低。香气评审结果显示,GJZ、HZ绿茶具有花香品质特征,得分较高,其次为SDC2绿茶;FZ2和SCZ品种鲜叶加工的太平猴魁绿茶香气品质有差异,前者香气品质较佳(表1)。
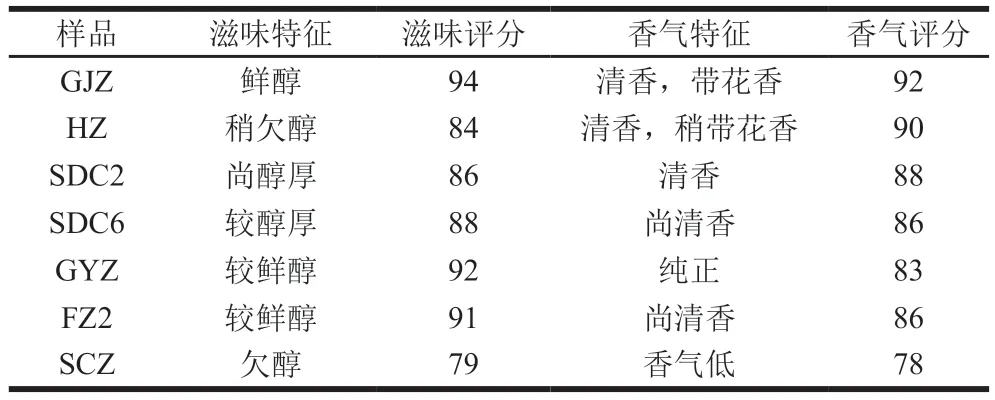
表1 ‘柿大茶’和非‘柿大茶’茶树品种绿茶及感官审评Table 1 Sensory evaluation results of ‘Shidacha’ and non-‘Shidacha’ green tea
2.2 代谢物分析
利用HPLC和氨基酸分析仪分析7 种绿茶茶汤中的儿茶素类、咖啡碱及游离氨基酸等主要的非挥发性组分。结果表明,酯型儿茶素表儿茶素没食子酸酯(epicatechin gallate,ECG)和表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)在‘柿大茶’品种绿茶中的含量较高;简单型儿茶素表儿茶素(epicatechin,EC)、儿茶素(catechin,C)和EGC在‘柿大茶’与非‘柿大茶’绿茶中的差异不明显;咖啡碱含量在各绿茶中差异较大,其中在SDC2绿茶中含量最高,在GYZ绿茶中含量最低(表2)。除HZ绿茶中的儿茶素类物质总量明显高于其他品种绿茶外,在同一工艺下,各绿茶中儿茶素总量差异较小,比如在GJZ、SDC2、SDC6、GYZ、FZ2绿茶间均未达到显著差异(P>0.05)(图2)。游离氨基酸分析显示,游离氨基酸总量在‘柿大茶’绿茶HZ中最高,达到62.47 mg/g,其次为FZ2绿茶(59.02 mg/g);除SCZ绿茶(29.88 mg/g)的氨基酸总量较低外,其他4 个绿茶(GJZ、SDC2、SDC6、GYZ)中的游离氨基酸总量无显著差异,分布范围为42.02~49.97 mg/g。茶氨酸含量在各绿茶中的差异较大,在‘柿大茶’绿茶HZ中含量最高,达到干质量的5%(表2)。

表2 绿茶中主要滋味成分含量Table 2 Contents of major taste compounds in green tea samplesmg/g


图2 花香类化合物在7 个绿茶茶汤中的含量Fig.2 Contents of floral aroma volatiles in seven tea infusion samples
分析7 种绿茶中的挥发性代谢物。基于前期的研究结果[3],表明‘柿大茶’绿茶中的糖苷类化合物及与逆境胁迫相关的化合物含量较高,比如香叶醇、芳樟醇、橙花叔醇、吲哚、茉莉酮等。图2表明,GJZ、HZ、SDC6绿茶中的挥发性物质总量明显高于其他品种绿茶;FZ2绿茶挥发性物质总量与SDC6绿茶无显著性差异;SDC2、GYZ、SCZ绿茶中的挥发性物质总量相近,无显著差异。利用HS-SPME-GC-MS分析绿茶茶汤中花香类的化合物,结果显示,糖苷类化合物(芳樟醇氧化物和芳樟醇、香叶醇)在各绿茶茶汤中差异较大,以芳樟醇及其氧化物为例,除GYZ绿茶外,其在‘柿大茶’绿茶茶汤中的含量均较高。与逆境胁迫相关的花香类化合物分析显示,吲哚、茉莉酮、橙花叔醇等在香气得分较高的茶汤中的含量均较高。在感官审评中SDC2香气品质要优于SCZ、GYZ绿茶,而3 个绿茶中的香气物质总量无显著性差异。花香类物质分析显示,芳樟醇氧化物、芳樟醇、香叶醇、茉莉酮以及橙花叔醇等在SDC2茶汤中的含量显著高于GYZ和SCZ。
2.3 遗传进化分析
为探究‘柿大茶’品系间、‘柿大茶’与非‘柿大茶’茶树品种间在遗传背景上的差异,以7 个茶树品种嫩梢为研究对象,通过RNA-seq技术分析7 个茶树品种鲜叶中的全基因组转录水平变化。结果显示,以全基因组转录水平为变量进行PCA,SCZ、FZ2和GYZ相距较近(以不同象限为准),为第1组;SDC2和SDC6为第2组,而GJZ和HZ分别单独一组(图3A)。‘柿大茶’品系SDC2和SDC6间的全基因组转录水平相似度非常高,差异表达基因较少(差异倍数大于2,假阳性率<0.05),这表明SDC2和SDC6品系可能来源于相同的‘柿大茶’单株。利用Diamond和OrthoMCL软件鉴定同源基因以确定基因家族分布情况,结果显示,‘柿大茶’茶树品种基因家族数量高于非‘柿大茶’茶树品种。基于筛选的单拷贝直系同源基因家族构建遗传进化树(图3B),结果显示SDC2和SDC6在同一分枝上,这与全基因组转录水平分析相一致;GJZ单独在一亚分枝上;FZ2和SCZ在同一小亚分枝上;‘柿大茶’品系GYZ和HZ与非‘柿大茶’茶树品种FZ2和SCZ聚在一个大亚分枝上。
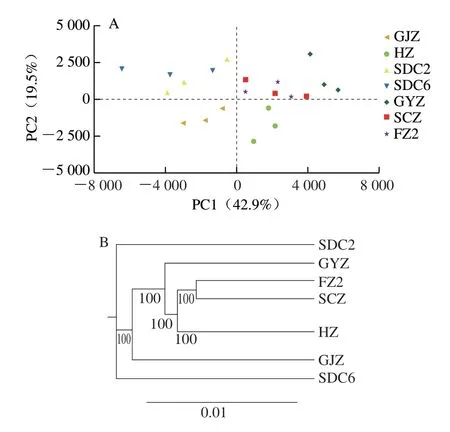
图3 全基因组转录水平PCA(A)及遗传进化树构建(B)Fig.3 PCA plot (A) and phylogenic tree (B) of seven tea varieties
2.4 萜类代谢途径关键酶基因转录水平差异分析
萜类物质是茶树中重要的一类化合物,尤其是单萜类、倍半萜类化合物,具有较强的挥发性,对茶树响应逆境胁迫及成品茶风味的形成均具有重要作用,比如芳樟醇、芳樟醇氧化物、香叶醇及橙花叔醇等[14-17]。单萜类物质一般是通过质体中的2-C-甲基-赤藓糖醇-4-磷酸(methylerythritol-phosphate,MEP)途径生成前体物质牻牛儿基焦磷酸(geranyl diphosphate,GPP),后续再由萜类合成酶催化生成;倍半萜类物质则是通过细胞质中的甲羟戊酸(mevalonate,MVA)途径生成前体物质法尼烯焦磷酸(farnesyl diphosphate,FPP)[18-19]。通过感官审评及代谢物分析显示,‘柿大茶’与非‘柿大茶’茶树品种绿茶在香气品质上差异明显,且在挥发性萜类物质积累上存在显著差异。本研究重点分析了MEP和MVA途径中的关键酶基因在7 个茶树品种中的转录水平变化,结果显示,在MVA途径中(图4),AACT基因在茶树中存在3 个同源基因(CSS0031828.1、CSS0022458.1、CSS0000979.1),其中AACT1的转录水平在SCZ、FZ2中较低(FPKM值约为1),在‘柿大茶’品种中的FPKM值约为6~7;AACT3在各个茶树品种中的表达量均较低,且在HZ、GYZ中FPKM值为0;HMGS(CSS0012119.1)、HMGR(CSS0020332.1、CSS0027456.1、CSS0044307.1、CSS0045944.1)、MVK(CSS0041428.1)、PMK(CSS0034538.1、CSS0011945.1)、PMD(CSS0049709.1)等关键酶基因在不同茶树品种中的转录水平差异不明显,其中MVK基因在GJZ、SDC2、SDC6、FZ2品种中的转录水平较高;基因IDI2(CSS0014154.1)在非‘柿大茶’品种FZ2和SCZ中的表达量(FPKM值约为23~32)显著高于‘柿大茶’品种(FPKM值约为1~3)。
图4 MVA和MEP途径中关键酶基因转录水平分析Fig.4 Transcription analysis of key enzyme genes involved in MVA and MEP pathways
在MEP 途径中,DXS(CSS 0018056.1)、DXR(CSS0045852.1)、MCS(CSS0021900.1)基因转录水平在各茶树品种中的差异不大;CMS(CSS 0021874.1)、CMK(CSS 0004136.1、CSS0031944.1)基因在SCZ、FZ2中的转录水平显著高于‘柿大茶’品系(图4)。
2.5 与花香类化合物生物合成相关的关键酶基因转录水平分析
通过MVA和MEP途径中关键酶基因的分析,显示这两条通路上的基因转录水平在‘柿大茶’与非‘柿大茶’品种间的差异不明显。‘柿大茶’品种绿茶中含有较高含量的花香类化合物,比如香叶醇、芳樟醇、芳樟醇氧化物、橙花叔醇、吲哚、苯乙醇及茉莉内酯等。这些花香类化合物的生成与茶树内源次级代谢途径中的关键酶基因表达密切相关[20-22]。因此,本研究着重分析了香叶醇、芳樟醇、橙花叔醇、苯乙醇、吲哚及茉莉内酯生物合成相关的关键酶基因转录水平变化。结果显示香叶醇合成酶基因CsGES(CsTPS10、CSS0027229.1)在‘柿大茶’品系中的转录水平(FPKM值约为2~3)显著低于非‘柿大茶’茶树品种(FPKM值约为10~11);(R)-芳樟醇合成酶CsRLIS(MT178265)在SDC6中的转录水平最高,在非‘柿大茶’茶树品种中的转录水平均较低,而(S)-芳樟醇合成酶CsSLIS(KF006849.1)在GYZ、FZ2品种中的转录水平较高,其次为HZ和SCZ。CsTSA(KX022968)和CsTSB2(KX022970)协同催化底物IGP生成吲哚[21]。转录水平分析显示CsTSA在非‘柿大茶’品种中表达量更高,在‘柿大茶’品系中的表达量较为一致;CsTSB2在不同茶树品种中的转录水平差异较大,在SDC2和SDC6中的转录水平最高(FPKM值为6),其次为HZ(FPKM值为2),而在非‘柿大茶’品种中该基因的FPKM值较低,约为0.2。CsPAR(MF977691)为苯乙醇生物合成途径中的关键酶基因,其在非‘柿大茶’茶树品种FZ2和SCZ中的表达量较高。茉莉内酯生物合成相关的关键酶基因CsLOX1(EU195885)在各茶树品种中的表达量变化较为一致;橙花叔醇合成酶基因CsNES(KY033151)在‘柿大茶’品系中的转录水平(FPKM值约为18-27)显著高于FZ2(FPKM值约为12)和SCZ(FPKM值约为8)。

图5 与花香类化合物合成相关的关键酶基因在不同茶树 品种中的转录分析Fig.5 Transcription analysis of key enzyme genes involved in the biosynthesis of floral aroma volatiles
3 讨论与结论
本研究通过相同工艺将5 个‘柿大茶’品系及2 个非‘柿大茶’茶树品种加工成绿茶,分析挥发性及非挥发性代谢物含量变化,同时基于RNA-seq技术分析7 个茶树品种鲜叶中的全基因组转录水平。挥发性代谢物分析显示,花香类化合物在‘柿大茶’品种绿茶茶汤中含量较高,比如香叶醇、芳樟醇、吲哚、茉莉酮及橙花叔醇等。香叶醇和芳樟醇是茶树中重要的单萜类化合物,前者具有玫瑰香型,后者具有花香特征,对绿茶、红茶的香气品质形成具有重要贡献[8,23]。香叶醇和芳樟醇都属于单萜类化合物,由萜类合成酶催化前体物质GPP生成。本研究中显示合成GPP的MEP途径中的关键酶基因在‘柿大茶’和非‘柿大茶’品种中的转录水平均较高,且CMK、CMS两个关键酶基因在FZ2和SCZ中的转录水平反而高于‘柿大茶’茶树品种。后续通过分析香叶醇合成酶基因CsGES及芳樟醇合成酶基因CsRLS和CsSLS的转录表达,显示CsGES在非‘柿大茶’FZ2和SCZ中的转录水平更高,而芳樟醇合成酶CsRLS在‘柿大茶’品系中的转录水平普遍更高。CsRLS是负责茶树中(R)-型芳樟醇生物合成的重要功能酶基因[24],且(R)-型芳樟醇香气阈值较低(约为0.8 μg/L),相比(S)-型芳樟醇(阈值约为7.4 μg/L)更易被人嗅觉感知[25-26]。因此,推测(R)-型芳樟醇可能是‘柿大茶’品系绿茶花香更显的重要因素。吲哚、橙花叔醇均具有花香特性,是乌龙茶中重要的呈香化合物[27-28]。本研究结果显示合成吲哚的关键酶基因CsTSB2在非‘柿大茶’茶树品种的中转录水平极低,推测是FZ2和SCZ绿茶中吲哚含量较低的原因。
感官审评与滋味成分分析表明‘柿大茶’与非‘柿大茶’在滋味品质上的差异不突出,比如非‘柿大茶’FZ2绿茶滋味鲜醇,审评得分显著高于‘柿大茶’绿茶HZ、SDC2和SDC6。此外,对儿茶素合成途径中关键酶基因的分析也表明(结果未列出),这些通路上的关键酶基因转录水平在7 个茶树品种中的差异不显著。Xia Enhua等[29-30]研究表明,‘中国种’茶树(Camellia sinensisvar.sinensis)在人工选育干扰下,与挥发性化合物代谢相关的基因变异较多,且存在基因复制事件。本研究中的遗传进化树分析结果显示,‘柿大茶’品系与非‘柿大茶’品种FZ2和SCZ遗传背景确实存在差异。因此,推测‘柿大茶’茶树品种在人工选育影响下,某些挥发性代谢物合成通路的进化对其成品茶香气品质形成较为有利。
综上所述,本研究着重分析了‘柿大茶’与非‘柿大茶’茶树品种遗传背景的差异和其加工绿茶品质及代谢物差异,结果表明‘柿大茶’在遗传背景上有别于非‘柿大茶’茶树品种FZ2和SCZ。‘柿大茶’品种加工的绿茶在香气品质上较为优异,与其花香类化合物代谢途径中关键酶基因的表达量较高相关。本研究结果对后续选育优异的‘柿大茶’品种有重要指导作用,同时对高香类茶树品种选育提供了理论参考。
