包埋花色苷的海藻酸钙-乳清分离蛋白 复配凝胶的制备与表征
2023-08-05宋江流杨静怡高彦祥毛立科
宋江流,杨静怡,高彦祥,毛立科
(中国农业大学食品科学与营养工程学院,北京 100083)
花青素是一种水溶性色素,属于类黄酮的酚类化合物,自然条件下花青素很少单独存在,一般与一个或 多个糖类物质以糖苷键形式连接形成花色苷。花色苷拥有抗氧化、抗衰老、维护心血管健康、预防慢性疾病等多种保健功能,在食品、医药和美妆领域有很好的应用前景[1]。花色苷的稳定性易受到pH值、温度、光照和金属离子等因素影响[2]。常用的提升花色苷稳定性方法包括化学改性、添加辅色剂和凝胶包埋法[3],其中凝胶包埋法因为对花色苷结构影响小,并对环境友好,而受到越来越多的关注。
海藻酸钠,又称藻酸钠、海草酸钠,主要存在于海藻细胞间质和细胞壁中。海藻酸钠中G单元上的Na+可以通过与二价金属阳离子发生置换反应形成水凝胶。海藻酸钠的增稠性和凝胶性,使其在食品制备、药品研发和功能因子包埋等领域应用广泛。仅由海藻酸钠制备的凝胶机械性能差、持水能力弱,其黏弹性受聚合度影响较大,在实际包埋功能因子的应用过程中往往存在钙化膜机械性能差、包埋功率低、贮存过程中易破裂等缺点[4]。现代科学常采用将海藻酸钠与其他高分子材料复配的方式改善单一海藻酸盐的不足,常用的复配物包括蛋白质、多糖和脂质。倪芳芳[5]以海藻酸钠和明胶为壁材,制备了包埋植物乳杆菌JYLP-326和姜黄素的水凝胶珠,结果显示,复配包埋能有效提升包埋物的贮存稳定性和热稳定性。Komoto等[6]使用海藻酸钠和壳聚糖制备了新型聚电解质复合物凝胶,结果显示:复配凝胶展现出更高的弹性模量。
乳清分离蛋白(whey protein isolate,WPI)由乳清蛋白经过物理加热,化学离子交换等多种方式处理得到,蛋白质含量不小于90%,主要组分包括β-乳球蛋白、α-乳白蛋白等[7-8]。WPI凝胶方式分为热致凝胶和冷凝胶两种:前者通过蛋白在热处理条件下发生去折叠,疏水基团大量聚合而形成三维网状凝胶结构;后者则是在室温下利用酸、盐或酶对蛋白进行诱导形成凝胶体系[9]。由蛋白质与多糖复配的方式制备凝胶可获得更好的机械性质、持水力、功能因子包埋释放性和结构稳定性[10]。Jie Yu等[11]使用黄原胶与大豆分离蛋白制备凝胶,发现复配凝胶可获得高硬度的3D打印食品。
目前,关于制备条件对海藻酸钠和WPI复配凝胶各项性质影响的研究还鲜有报道。本实验采用原位释放法制备包埋花色苷的海藻酸钙-WPI复配凝胶,探究原料不同处理方式下海藻酸钙-WPI复配凝胶的性质(如微观结构、流变学特性、质构特性、持水力、冻融稳定性和红外光谱)和对花色苷的保护效果,以改善单一海藻酸盐凝胶的应用效果,为多糖-蛋白复配凝胶的开发提供理论指导。
1 材料与方法
1.1 材料与试剂
海藻酸钠(分析纯)上海麦克林生化科技股份有限公司;WPI 加拿大Agropur公司;蓝莓花色苷(食 品级)广东圣嘉德生物技术公司;葡萄糖酸-δ-内酯(食品级)安琪酵母股份有限公司。
1.2 仪器与设备
PL602-S电子天平 梅特勒-托利多仪器(上海)有限公司;HWS-24电热恒温水浴锅 北京长风仪器仪表公司;CT3物性分析仪 美国Brookfield公司;SZCL-2数显智能控温磁力搅拌器 上海司乐仪器有限公司;AR-1500ex流变仪 美国TA公司;Spectrum 100型傅里叶变换红外分光光度计 美国Perkin-Elmer公司;S-3000N场发射电子扫描显微镜 日本Hitachi公司;Alpha 1-2 LD plus真空冷冻干燥器 德国Marin Christ公司。
1.3 方法
1.3.1 样品制备
1.3.1.1 包埋花色苷的海藻酸钙凝胶的制备
原位释放制备海藻酸盐凝胶的方法参照陈鸿强等[12]并稍作修改。制备质量分数1%的海藻酸钠溶液,之后加入一定浓度花色苷溶液使其在海藻酸钠溶液中质量分数达到0.2%。随后将混合溶液、质量分数1%碳酸钙悬浮液和新鲜制备的质量分数9%葡萄糖酸-δ-内酯溶液按质量比10∶2∶1混合,其中碳酸钙悬浮液在加入前需超声2 min。溶液混合后迅速以200 r/min搅拌至完全固化,之后静置凝胶24 h,待性质稳定后进行相关指标测定[12],记 为CA组。
1.3.1.2 包埋花色苷的海藻酸钙-WPI复配凝胶的制备
制备质量分数2%的海藻酸钠溶液和质量分数10%的WPI溶液,其中WPI溶液中还应含有质量分数0.01%的叠氮化钠(防止微生物的生长)。之后以1∶1的质量比将两者混合均匀并加入一定浓度花色苷溶液,使花色苷在混合溶液中质量分数达到0.2%,随后将含花色苷的海藻酸钠-WPI混合溶液,质量分数1%碳酸钙悬浮液和新鲜制备的质量分数9%葡萄糖酸-δ-内酯溶液按质量比10∶2∶1混合,其中碳酸钙悬浮液在加入前需超声2 min。混合溶液以200 r/min搅拌至完全固化,之后静置凝胶24 h,待性质稳定后进行相关指标测定,记为CA-WPI组。
1.3.1.3 包埋花色苷的海藻酸钙-热处理WPI复配凝胶的制备
制备质量分数2%的海藻酸钠溶液和质量分数10%的WPI溶液,其中WPI溶液中还应含有质量分数0.01%的叠氮化钠(防止微生物的生长)。将制备好的WPI溶液放入4 ℃冰箱中水合过夜,之后取出在85 ℃水浴中加热30 min,然后迅速在冰水中冷却到室温。后续关于原料溶液混合、添加花色苷溶液以及凝结成胶的操作与1.3.1.2节一致,记为CA-热WPI组。
1.3.1.4 包埋花色苷的共热海藻酸钙-WPI复配凝胶的制备
制备质量分数2%的海藻酸钠溶液和质量分数10%的WPI溶液,其中WPI溶液中还应含有质量分数0.01%的叠氮化钠(防止微生物的生长)。将制备好的WPI溶液放入4 ℃冰箱中水合过夜。之后,以1∶1的质量比将两者混合均匀并在85 ℃水浴中加热30 min,然后迅速在冰水中冷却到室温。再加入一定浓度花色苷溶液使其在混合溶液质量分数达到0.2%,后续关于凝结成胶的操作与1.3.1.2节一致,记为共热CA-WPI组。
1.3.2 扫描电子显微镜观察
使用场发射扫描电镜,观察1.3.1节制备的4 种凝胶形貌特征。挑取少量冷冻干燥后的凝胶固定于扫描电子显微镜样品盘上的导电双面胶带上,之后真空喷金,不同样品之间使用刻刀分割胶带以便区分观察。设定加速电压10 kV,放大倍数50、200、500 倍和2000 倍,对凝胶的剖面进行形貌观察[13]。
1.3.3 脱水收缩率和冻融稳定性测定
采用1.3.1节方法制备4 种凝胶,将搅拌均匀且尚未固化的原料混合溶液迅速倒入5 mL离心管中,控制每个离心管中凝胶的质量在6.00~7.00 g之间。于室温下稳定24 h后,将凝胶25 ℃、10000 r/min离心15 min,将管中凝胶轻轻取出,用吸水纸吸去凝胶表面水分后称质量[14]。按下式计算凝胶的脱水收缩率:
式中:m0为空离心管质量/g;m1为样品和离心管总质量/g;m2为吸干表面水分后样品和离心管总质量/g。
以凝胶冻融后的持水力代表其冻融稳定性。采用1.3.1节的方法制备4 种凝胶,将搅拌均匀且尚未固化的原料混合溶液迅速倒入5 mL离心管中,控制每个离心管中凝胶的质量在6.00~7.00 g之间。于室温下稳定24 h后,放入-20 ℃冰箱中冷冻36 h,随后于室温下解冻3 h。解冻后擦去离心管表面水分,称取离心管和样品总质量,25 ℃、10000 r/min离心15 min,将凝胶渗出水分用吸水纸擦净,称取剩余凝胶和离心管总质量[15]。按下式计算凝胶冻融后持水力:
式中:ma为空离心管质量/g;mb为样品和离心管总质量/g;mc为离心除水后样品和离心管总质量/g。
1.3.4 流变学性质测定
采用1.3.1节方法制备4 种凝胶,制成厚度为2 mm,直径为40 mm的薄片。使用流变仪研究凝胶流变性质,测量温度25 ℃,采用直径40 mm的平行板,间隙为1 mm。1)应变扫描:设置应变范围0.02%~100%,固定频率1 Hz,应变0.1%,观察凝胶的储能模量(G′)和损耗模量(G″)随应变的变化情况,记录不同凝胶的线性黏弹区。2)频率扫描:设置频率范围0.1~100 Hz,应变0.1%,观察凝胶G′和G″随频率的变化情况[16]。3)蠕变-回复测定:施加应力2 Pa,保持180 s,撤去应力后保持360 s观察凝胶恢复情况。蠕变柔量(J)可以用来表征单位应力作用下凝胶形变量大小,按下式计算量蠕变-回复率:
式中:J1为180 s蠕变柔量/(1/Pa);J2为540 s蠕变柔量/(1/Pa)。
1.3.5 机械性质测定
采用1.3.1节方法制备混合液,并在25 mL烧杯(内径34 mm,高50 mm)中成胶,保证每个烧杯中凝胶的高度相同。使用物性分析仪,通过单轴压缩测试评价凝胶的机械性能。使用直径为12 mm的圆柱形柱塞探头,以测试速率1 mm/s、压缩距离7 mm对凝胶进行测试,记录样品的硬度和黏性数据。测试速率1 mm/s、压缩距离3 mm条件下,在探头达到最大位移后维持60 s,获得样品的应力松弛曲线,并将实际曲线进行非线性拟合[17]。
1.3.6 红外光谱测定
分别称量2 mg经冷冻干燥处理的凝胶样品和198 mg溴化钾粉末,倒入玛瑙研钵中研磨均匀,于20 MPa压力下保压1 min制成压片[18]。以纯溴化钾压片作为空白对照,扫描范围4000~400 cm-1,扫描32 次,分辨率4 cm-1。
1.3.7 贮存稳定性测定
采用1.3.1节方法制备4 种凝胶,将搅拌均匀且尚未固化的原料混合溶液迅速倒入5 mL离心管中,控制每个离心管中凝胶质量在6.00~7.00 g之间。分别保持在25 ℃和4 ℃的黑暗中贮藏15 d,每3 d测定一次花色苷含量。
花色苷含量测量:取0.1 g凝胶加入4 mL pH 6.80.2 mol/L磷酸盐缓冲液中,浸泡24 h使凝胶充分破碎,室温下超声1 min,随后再加入4 mL含0.1 mol/L盐酸的95%乙醇溶液,放置24 h,使凝胶充分解离[19]。随后于25 ℃、10000 r/min离心15 min,取上清液备用。采用pH值示差法测定上清液中花色苷质量浓度,按下式计算花色苷保留率:
式中:c1为上清液中花色苷质量浓度/(mg/L);V1为上清液总体积/L;c0为第0天上清液中花色苷质量浓度/(mg/L);V0为第0天上清液总体积/L。
1.4 数据处理
2 结果与分析
2.1 海藻酸钙-WPI复配凝胶的微观结构分析
由图1可知,CA组呈半透明状的红紫色,其余3 组呈逐步变浅的紫色。颜色的变化与体系pH值有关,当存在H+或OH-时,花色苷微观能带变动,其分子结构中π电子分布状态改变,对光的吸收的反射发生变动,从而呈现出不同的颜色[20]。pH<7时,花青素呈红或粉色;pH 7~8时,花青素呈紫色。凝胶由红色向紫色的转变,初步说明WPI的添加可使体系碱性增强达到中性。此外,CA-热WPI组和共热CA-WPI组的凝胶呈现出泛白迹象,这是热处理增加蛋白质之间的相互作用,导致更多的蛋白质聚集的标志[21]。

图1 不同样品的凝胶外观Fig.1 Appearance of different gel samples
由图2可知,CA组凝胶切面呈蜂窝状结构,中空孔径大小在50 μm左右(图2C1),整体较为致密规则,凝胶表面光滑平整无突起(图2D1)。CA-WPI组中,WPI的加入未改变海藻酸钙凝胶整体的蜂窝状结构,但增加了中空孔径的大小,孔径大小在100 μm左右(图2C2),凝胶网络表面出现颗粒状聚集蛋白质,蛋白聚集体稀疏散布在海藻酸钙表面,彼此不粘黏(图2D2)。CA-热WPI组凝胶切面的蜂窝状结构出现坍塌(图2A3),凝胶表面变得粗糙(图2D3)。WPI经过热处理后天然结构被破坏,蛋白质链展开,其色氨酸基团暴露[9],并且暴露更多羟基、羧基、醛基等亲水基团,这些可与海藻酸钙凝胶之间形成生物黏附状态[22]。共热CA-WPI组凝胶切面不再呈现蜂窝状特点(图2A4),凝胶网络表面聚集大量形态规则的球状聚集蛋白质颗粒,彼此间紧密相连(图2D4)。高温处理有利于物质间的疏水相互作用,并且降低了海藻酸钠聚合物的黏性,WPI可以更好附着并稳定海藻酸钙的分子间连接区,有助于形成更密集的网络结构,同时影响海藻酸钙凝胶网络的形成。


图2 不同放大倍数下的凝胶形貌Fig.2 Micromorphology of gels at different magnifications
2.2 海藻酸钙-WPI复配凝胶的脱水收缩率和冻融稳定性分析
由表1可知,CA组和CA-WPI组的脱水收缩率最大,CA-热WPI组最小。由于实验采用内源法制备凝胶,不溶性的碳酸钙提供钙源可以使得形成的凝胶结构均匀,但也会导致碳酸钙嵌入新形成的凝胶中,限制钙离子的扩散从而影响凝胶化[23]。凝胶中不溶性的碳酸钙减弱了凝胶对水的吸收,而未加热的WPI内部亲水基团没有展开,氨基酸残基处于相对疏水环境,蛋白与海藻酸钠结合弱,因此CA组和CA-WPI组的持水力最差。热处理后的WPI与海藻酸盐形成相互作用的凝胶网络,伴随凝胶化的聚合物构象变化,水分子可以在海藻酸钙和WPI之间重新分配[24],水分移向亲水性WPI,增加了凝胶持水力。此外,加热过程会加剧水分子的热运动,导致水分子向空气中挥发,共热CA-WPI组成胶后体系内水分总量减少,因此最终形成的凝胶中CA-热WPI组脱水收缩率最小,共热CA-WPI组次之。分析凝胶冻融后的持水力可知,CA-热WPI组和共热CA-WPI组较CA-WPI组和CA组的持水力显著提升,CA-热WPI组冻融后持水力较对照组提升36.37%。未加热WPI作为双凝胶体系的填充物在低温条件下不能提升凝胶的持水力。可能是由于加热可以催化蛋白内部化学键展开,有利于形成分子间和分子内共价键,从而提高蛋白质凝胶的水合能力[25],此结果与脱水收缩率的分析结论一致。

表1 不同样品的脱水收缩率和冻融后持水力Table 1 Dehydration shrinkage rates and water-holding capacity after freezing-thawing of different gel samples %
2.3 海藻酸钙-WPI复配凝胶的流变学性质分析
由图3A可知,不同样品的G′和G″呈现相似的变化趋势。在一定应变范围内(0.02%~3.00%),复配凝胶的G′均大于G″,说明此时4 组样品以弹性为主。G′随应变增大而保持平稳的应变范围是凝胶的线性黏弹区。由图3A可知,CA组线性黏弹区为0.02%~0.1913%,CAWPI组线性黏弹区为0.02%~2.252%,CA-热WPI组线性黏弹区为0.02%~2.619%,共热CA-WPI组线性黏弹区为0.02%~2.568%;由此可见,WPI添加能有效增大凝胶的线性黏弹区范围,并且添加热处理WPI的体系展现出更好的黏弹性。线性黏弹区的扩大,说明凝胶体系弹性的提升,展现了更多液体的特征,这可能与凝胶的吸水性有关。
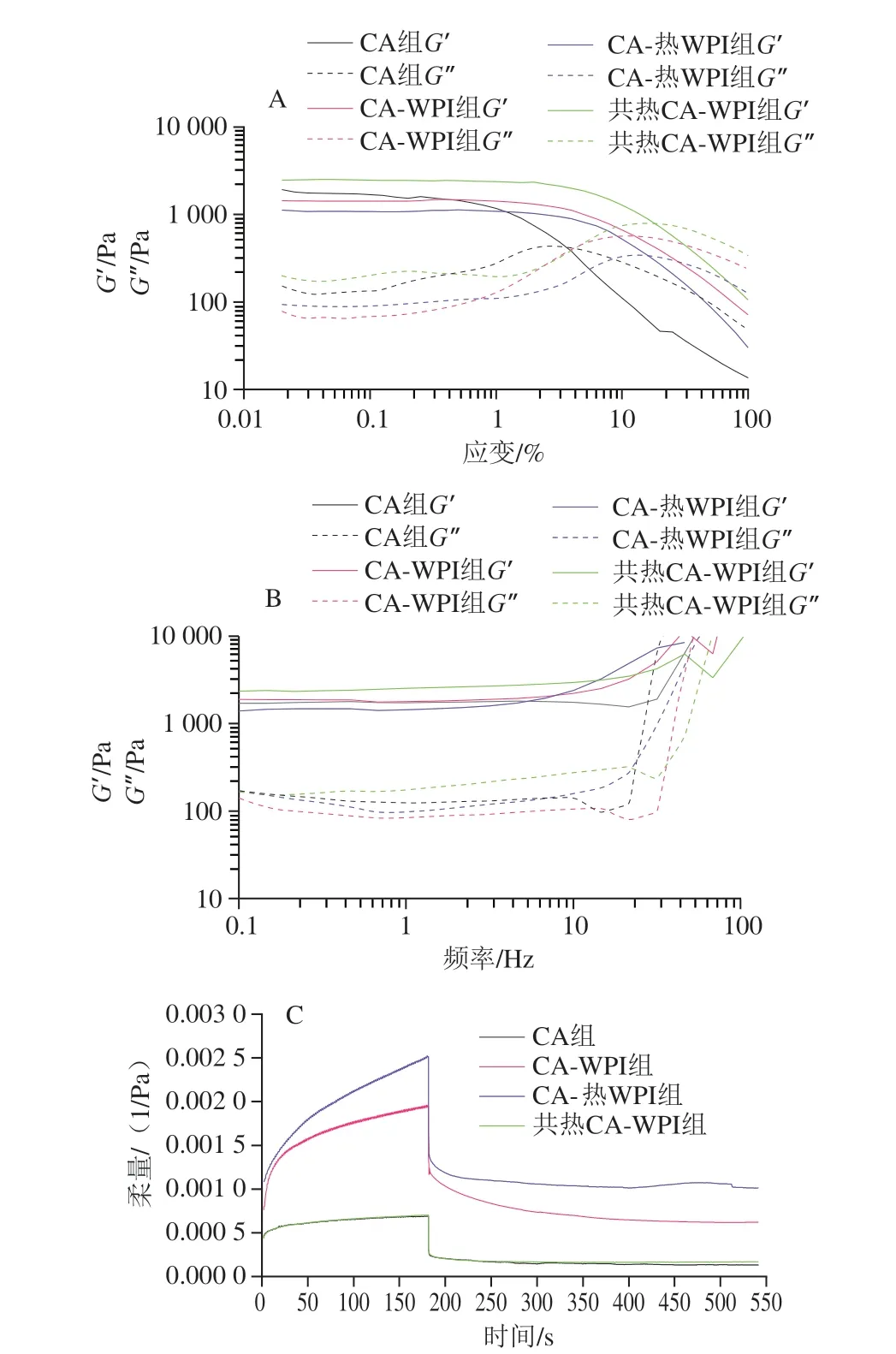
图3 不同样品的应变扫描(A)、频率扫描(B)和蠕变-回复(C)Fig.3 Strain sweep curves (A),frequency sweep curves (B) and creeprecovery curves (C) of different gel samples
由图3B可知,频率为10 Hz之前,随着频率的增加,4 组凝胶的G′、G″变化幅度不大,说明凝胶结构具有一定强度,不容易受机械力作用产生形变,并且共热处理组凝胶的强度最大[26]。由图3C计算可知,4 组样品的蠕变-回复率分别为80.9%(CA组)、68.0%(CA-WPI组)、59.9%(CA-热WPI组)、75.9%(共热CA-WPI组)。综合应变扫描结果可知,应变0.1%时,共热CAWPI组和CA组应变扫描的G′、G″值大并且拥有更好的形变恢复能力,CA-WPI组和CA-热WPI组应变扫描的G′、G″值小并且形变恢复能力较差[27]。综合频率扫描结果可知,应变0.1%、频率1~10 Hz时,相比于单一海藻酸盐体系,共热处理海藻酸钠和添加WPI会使体系模量值上升。
2.4 海藻酸钙-WPI复配凝胶的机械性质分析
由图4可知,不同组间硬度存在显著差异,CA组>共热CA-WPI组>CA-WPI组>CA-热WPI组,这与蠕变-回复率结果一致。CA组硬度最大的原因可能是由于单一海藻酸钠聚合物分子间的氢键能更好增加凝胶结构的刚性[28];结合之前持水力的结果,CA组持水力较差,因此在单轴压缩过程中,水分受挤压流失,凝胶结构更加致密,进一步增强了其硬度。有研究表明,当多糖与高浓度乳清蛋白混合时,凝胶将出现由多糖凝胶网络向蛋白质连续网络的转变,凝胶不再是自支撑的,导致凝胶硬度下降[29]。此外,由图4可知,共热CA-WPI组黏度明显高于其余3 组,结合2.1节的微观结构可知,共热后体系中的蛋白呈现密集的球状聚集体并且彼此连接,凝胶与探头的接触面增大,这可能是共热CA-WPI组具有较强凝胶黏度的原因。

图4 不同样品的机械性质Fig.4 Mechanical parameters of different gel samples
应力松弛实验通过给予凝胶恒定形变使其弹性应变转化为塑性应变。由图5可知,CA组和共热CA-WPI组受力后产生弹性应变最大,并且下降幅度高,而CA-WPI组和CA-热WPI组产生的弹性应小,下降幅度低。初始应力排序为CA组>共热CA-WPI组>CA-WPI组>CA-热WPI组,这与硬度实验结果一致。

图5 不同样品的应力松弛特征Fig.5 Stress relaxation characteristics of different gel samples
2.5 海藻酸钙-WPI复配凝胶的红外光谱分析
由图6可知,花色苷中2-苯基苯并吡喃的C=C的伸缩振动峰出现在1600 cm-1附近,环上C—H的弯曲振动峰出现在1030 cm-1附近[30],环上—OH的伸缩振动峰出现在3300 cm-1附近[31],在1600~1700 cm-1没有发现明显的苯并吡喃C=O振动吸收峰[32],可能是被海藻酸钠的化学键所掩盖。整体上,花色苷的特征峰明显,说明包埋效果良好[33]。据峰值出现位置可以发现,4 种包埋方式都能有效包埋花色苷。3 组复配凝胶组除了由于混合引起的峰位移和相对强度的改变,峰值趋势相近,说明凝胶混溶交联过程对化学键影响较小,物质之间多以非共价键形式结合。
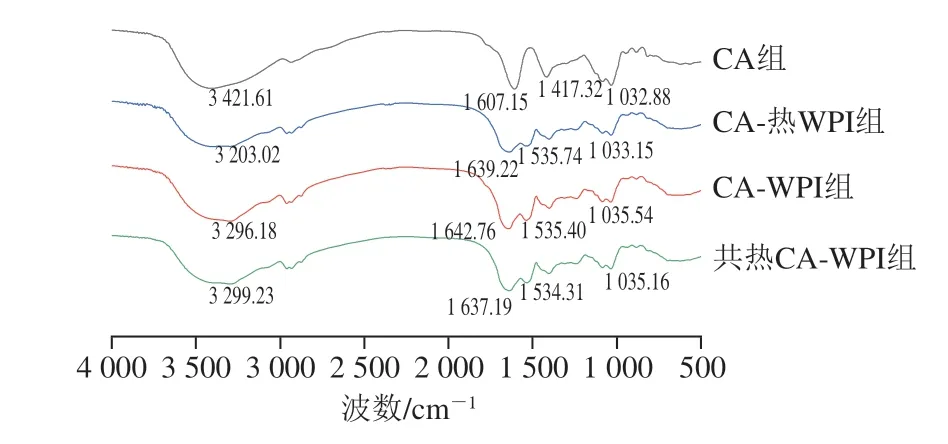
图6 不同样品的红外光谱Fig.6 FTIR spectra of different gel samples
2.6 海藻酸钙-WPI复配凝胶的贮存稳定性分析
由图7A可知,各组花色苷保留率的变化趋势近似线性。其中,CA-热WPI组的花色苷贮存稳定性最高,15 d后花色苷保留率为85.01%,其次是共热CA-WPI组,保留率为67.47%,CA组和CA-WPI组的贮存稳定性变化趋势相近,15 d后的花色苷保留率低于50%。由图7B可知,4 ℃花色苷保留率各组的变化趋势与25 ℃时相似,由于花色苷稳定性受温度影响较大,低温更有利于花色苷贮存,4 ℃花色苷损失速率更低,15 d后各组花色苷保留率均在50%以上。一方面,花色苷属于水溶性色素,凝胶体系对花色苷的保留率与凝胶持水力相关;结合持水力结果可知,持水力越强的凝胶的花色苷保留率越大。另一方面,花色苷还可以和蛋白质中多肽链的C、N和O通过氢键结合[34],进一步提高包埋的稳定性。

图7 25 ℃(A)和4 ℃(B)贮藏过程中各组样品的花色苷保留率Fig.7 Retention rates of anthocyanins embedded in different gel samples during storage at 25 (A) and 4 ℃ (B)
3 结论
从微观结构、持水能力、流变学特性和机械性质以及包埋效果等多方面探究了不同处理方式对海藻酸钙-WPI复配凝胶的性能差异。结果表明:相比于单一海藻酸盐体系,添加WPI后体系的网络结构表面粗糙度显著增加,其中共热CA-WPI组中的球状蛋白质聚集体能够均匀分布。复配热处理后WPI能提升凝胶的持水能力,其中CA-热WPI组展现出最佳的持水能力,在室温下脱水收缩率仅6.94%,冻融后持水力达58.15%。流变学特性方面,各实验组的线性黏弹区范围均增大;应变0.1%时,共热CA-WPI组体系模量和蠕变-回复率均优于对照组。机械性质方面,共热CA-WPI组黏度最高,达0.68 mJ。红外光谱结果显示,复配凝胶中花色苷的特征峰明显,包埋对花色苷的化学性质影响较小。在花色苷贮存稳定性方面,CA-热WPI组展现出最好的花色苷保留率,25 ℃贮存15 d后花色苷仅损失14.99%。
本实验探索了多糖蛋白复配凝胶体系的物化性质以及对生物活性物的包埋能力。但WPI和海藻酸钠在混合以及成胶过程中发生的具体变化和相互作用机理还有待进一步实验探究,以期将其更好地应用在实际食品产业生产中。
猜你喜欢
杂志排行
食品科学的其它文章
- 酪蛋白胶束与多元活性分子的相互作用及其复合物特性
- Effect of Soy Lecithin,Glucose Oxidase,and Transglutaminase on Dough Rheology and Quality Properties of Steamed Bread Enriched with Potato Pulp
- 不同葡萄糖当量值预消化大米膨化粉的理化性质和结构特性
- 牛蒡果胶多糖/玉米醇溶蛋白复合颗粒稳定的 Pickering乳液构建及对姜黄素的递送功效
- 热处理香榧种子油中美拉德产物的生成及其对两种总酚测定方法的影响
- 乳铁蛋白、表没食子儿茶素没食子酸酯、高甲酯果胶和β-环糊精四元复合物基高内相Pickering乳液的构建及表征
