茅台镇不同区域酱香大曲微生物群落结构及生产性能对比
2023-08-05陈绍依邱树毅吴伯天胡胜兰周鸿翔
陈绍依,郎 莹,邱树毅,吴伯天,胡胜兰,周鸿翔,
(1.贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025;2.贵州王茅酒曲研究院有限公司,贵州 贵阳 550025)
大曲作为白酒糖化发酵的发酵剂和主要原料,是经过粉碎、润粮、踩曲以及自然接种发酵而成[1],在固态发酵过程中从周围环境将功能微生物富集并导入最终成品中,在白酒酿造过程中起着至关重要的作用[2]。酱香大曲实则是一种高温大曲,其独特的微生物结构及代谢活动,决定了酱香白酒风味的形成[3]。
茅台镇盛产酱香白酒,也是优质酱香大曲的主要生产地,其大曲的微生物组成和生产性能在一定程度上使酱香白酒具有风味醇厚、口感细腻、酱香突出、空杯留香等特点[4],而影响大曲微生物结构的因素包括原料、环境、工艺、生产季节、贮藏期等[5-7]。近年来,大曲的微生物群落构成已成为一个研究热点,如Hu Yunan等[8]采用核磁共振和高通量测序分析3 种清香型大曲的微生物菌群,研究显示3 种大曲中均以乳杆菌(Lactobacillus)、魏斯氏菌(Weissella)为优势细菌,毕赤酵母属(Pichia)、覆膜孢酵母属(Saccharomycopsis)为优势真菌。Yao Jin等[9]研究14 种酱香大曲的微生物群落多样性与挥发性成分的相关性,发现茅台酒厂曲样的含氮化合物与芽孢杆菌(Bacillus)和曲霉(Aspergillus)丰度呈正相关,而其他样品的酯类与乳杆菌和曲霉丰度相关。吴树坤等[10]利用高通量测序技术对四川不同区域浓香大曲的微生物菌群进行分析,发现泸州和宜宾曲样具有相似的微生物群落结构,以高温放线菌属(Thermoactinomyces)、嗜热真菌属(Thermomyces)、魏斯氏菌属、嗜热子囊菌属(Thermoascus)为优势菌属,而遂宁的两个曲样的微生物群落结构更相似,以芽孢杆菌属、曲霉属、葡萄球菌属(Staphylococcus)为优势菌属。
有研究表明,位于茅台镇不同主酿区的茅台、钓鱼台、国台酱香白酒特征风味物质存在较大差异[11],而酱香大曲决定酱香型白酒的风格和品质,故研究茅台镇不同区域酱香大曲的微生物构成与生产性能对酱香型白酒的发展有一定推动意义。采用第3代Nanopore测序平台分析茅台镇不同区域酱香大曲的微生物构成,并分析优势微生物与微生物、生产性能和特征风味物质的相关性,旨在为酱香大曲质量标准及个性化和后期研究大曲功能性微生物提供一定理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
TS、WS、WM、MH、DJ成品曲均为贮存3 个月以上的陈曲,分别由茅台镇不同区域的酒厂提供,若以茅台镇人民政府为起始点,5 种大曲的生产位置与起始点直线距离和地理描述如表1、图1所示。大曲样品从企业采样后经粉碎混匀后装入无菌密封袋置于4 ℃冰箱备用。
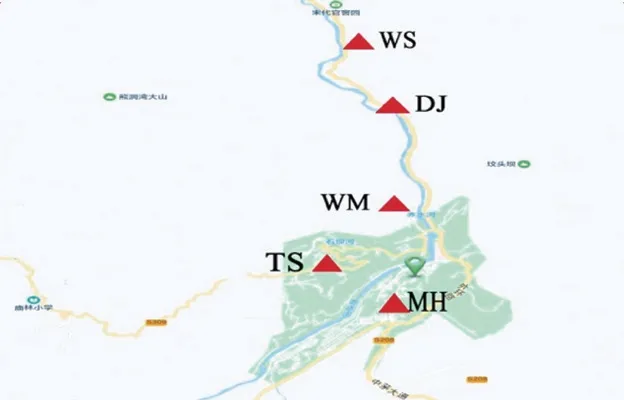
图1 不同酱香大曲采样分布图Fig.1 Sampling distribution of five Daqu samples
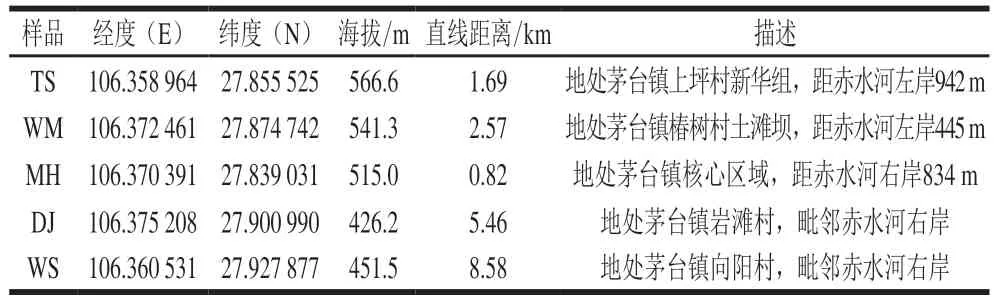
表1 5 种大曲样品地理描述Table 1 Geographical description of five Daqu samples
1.1.2 试剂
氢氧化钠、盐酸、硫酸(均为分析纯)重庆川东化工有限公司;葡萄糖(分析纯)天津市永大化学试剂有限公司;己酸(分析纯)、标准品(2-戊醇、异戊醇、正戊醇、2-壬醇、1,2-丙二醇、糠醇、壬醇、苯乙醇、乙酸乙酯、苯甲酸乙酯、丁二酸二乙酯、乙酸苯乙酯、邻苯二甲酸二丁酯、丙酸、戊酸、己酸、癸酸、苯甲醛、苯乙醛、2-壬酮、苯乙酮、愈创木酚、2-乙酰基呋喃、5-甲基-2-乙酰基呋喃)上海易恩化学技术有限公司;无水乙醇(分析纯)天津市富宇精细化工有限公司;乙酸(分析纯)、2,3-丁二醇、壬酸乙酯 上海麦克林生化科技有限公司;乙酸钠(分析纯)成都金山化学试剂有限公司;可溶性淀粉(优级纯)天津市科密欧化学试剂有限公司;正丁醇、辛醇、丁酸乙酯、乳酸乙酯、己酸异戊酯、癸酸乙酯、苯乙酸乙酯、肉豆蔻酸乙酯、乙酸、异丁酸、丁酸、异戊酸、乙缩醛、乙偶姻、4-乙基愈创木酚、三甲基吡嗪、四甲基吡嗪、叔戊醇(内标)上海阿拉丁生化科技有限公司;2-甲基丁酸乙酯 上海贤鼎生物科技有限公司;乙醛 美国Sigma-Aldrich公司;以上标准品均为色谱纯且纯度不小于97.0%。
1.2 仪器与设备
PHS-3C精密酸度计 上海大普仪器有限公司;81-2 恒温磁力搅拌器 上海司乐仪器有限公司;7890A-5975C气相色谱-质谱(gas chromatograph-mass spectrometry,GC-MS)联用仪、7890A GC仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 大曲样品总DNA的提取和质检
使用OMEGA DNA提取试剂盒直接提取大曲样品总DNA,然后采用琼脂糖电泳检测DNA片段大小分布,使用NanoDrop仪器进行质量检验,当所提DNA的荧光强度比值A260nm/A280nm在2.0~2.2范围内时,即认为所提DNA的质量达到测序要求。
1.3.2 高通量测序
将提取合格的曲样DNA送至上海派森诺生物科技有限公司,利用Ampure XP beads纯化DNA后,使用LSK109连接试剂盒中接头进行连接反应,然后用Qubit检测建好的DNA文库并定量,最后在Oxford Nanopore PromethION测序仪上进行高通量测序。
1.3.3 大曲理化指标的测定
发酵力根据吕亚楠等[12]的方法测定,其他理化指标依照QB/T 4257—2011《酿酒酒曲通用分析方法》进行检测。
1.3.4 特征风味物质的检测1.3.4.1 曲样预处理
根据苏宁等[13]方法处理并稍作修整:准确量取45 mL体积分数25%乙醇溶液,加入10.00 g曲样于100 mL三角瓶中,超声30 min后,7000 r/min离心5 min,将上层清液过0.22 μm滤膜,吸取990 μL滤液和10 μL内标(叔戊醇、乙酸正戊酯、2-乙基丁酸,体积分数为1%)至顶空瓶中,供GC-MS、GC分析。
1.3.4.2 GC-MS定性
色谱条件:SHIMADZU 221-75893-30 SH-Rtx-Wax色谱柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;检测器温度300 ℃;高纯氮气(99.999%);空气流量300 mL/min,氢气流量30 mL/min,尾吹气流量 30 mL/min;升温程序:初始温度为30 ℃,保持3 min,以3 ℃/min升温至180 ℃,再以15 ℃/min升温至210 ℃,保持8 min;分流进样,分流比30∶1。
质谱条件:电子电离源;全扫描模式(分子质量范围35.0~550.0 u);离子源温度230 ℃;电离能量70 eV;四极杆温度150 ℃。
1.3.4.3 GC定量
根据张晓婕等[14]方法对大曲风味物质进行定量,GC条件如下:SHIMADZU 221-75893-30 SH-Rtx-Wax色谱柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;检测器温度300 ℃;高纯氮气(99.999%);空气流量300 mL/min,氢气流量30 mL/min,尾吹气流量30 mL/min;升温程序:初始温度为30 ℃,保持3 min,以3 ℃/min升温至180 ℃,再以15 ℃/min升温至210 ℃,保持8 min;分流进样,分流比30∶1。定量方法:以待测物与内标物的含量比为横坐标,峰面积比为纵坐标,建立各挥发性物质的标准曲线,以1.3.4.1节方法处理曲样,采用内标法定量曲样中各挥发性物质的含量,所有曲样重复测定3 次。
1.4 数据处理与分析
1.4.1 数据处理
使用Flye(version:v2.8)对三代测序数据进行基因组拼接,同时Flye会对原始拼接结果进行5 轮纠错,得到最终的拼接结果,然后按照97%相似性对非重复序列进行操作分类单元(operational taxonomic units,OTU)聚类,使用NR数据库进行物种分类注释,采用IBM SPSS Statistics 23对理化指标做单因素方差分析。
1.4.2 数据绘图
采用USEARCH软件计算α多样性指数;Origin 2018绘制堆积图;Gephi0.9.2绘制网络图,Venn图和冗余分析(redundancy analysis,RDA)分别于http://www.cloud.biomicroclass.com/、https://hiplot-academic.com网站上完成。
2 结果与分析
2.1 大曲微生物构成及多样性分析
α多样性的Chao1、ACE指数和Shannon、Simpson指数分别反映微生物物种的丰富度和多样性,指数越高表示物种的丰富度和多样性越好。由表2可知,5 种酱香大曲的覆盖率均为100%,表示本次测序结果能真实反映曲样的微生物结构;DJ细菌的Chao1、ACE指数最高,说明DJ细菌丰富度最好;TS细菌的Shannon、Simpson指数最高,即TS细菌多样性最好。WM真菌的Shannon、Simpson指数最高,说明WM真菌多样性最好;而MH真菌的丰富度和多样性最低,可能与该酒企制曲工艺、生产原料、周围环境有关[15],或在生产发酵过程中,优势菌群替代非功能菌种[16]。
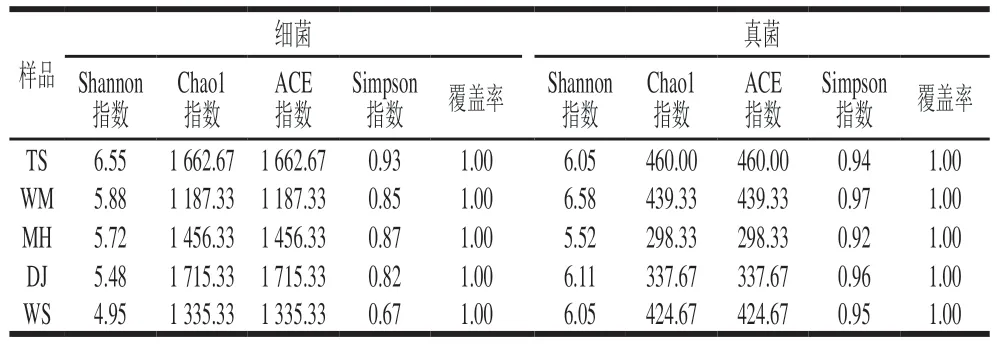
表2 大曲样品α多样性分析结果Table 2 Results of microbial α-diversity analysis of Daqu samples
5 种大曲在细菌属水平上共检测到1093 个OTU,在真菌属水平上共检测到281 个OTU,根据分类注释到的OTU绘制Venn图,可直观展示不同酱香大曲共有和特有的OTU。共有OTU是引起大曲共性的重要原因,而特有OTU是引起大曲差异的重要菌群。如图2a所示,在细菌属水平上5 种大曲含有457 个相同的OTU,OTU数依次为TS(728)>MH(706)>DJ(691)>WS(626)>WM(618),说明TS、MH、DJ细菌多样性较好,与表2结果一致;5 种大曲特有OTU数及其占比分别为70和9.92%(MH)、21和3.35%(WS)、19和2.61%(TS)、10和1.62%(WM)、6和0.87%(DJ)。如图2b所示,在真菌属水平上5 种大曲含有171 个相同的OTU,OTU数依次为:TS(264)>WM(259)>WS(255)>DJ(215)>MH(172),说明TS、WM、WS的真菌丰度较好,与表2结果一致;5 种大曲特有OTU数及其占比分别为4和1.57%(WS)、3和1.14%(TS)、1和0.47%(DJ)、1和0.39%(WM)、0和0.00%(MH)。MH特有70 种细菌物种,没有特性真菌,说明MH的70 种特性细菌是引起MH特征差异的重要微生物。
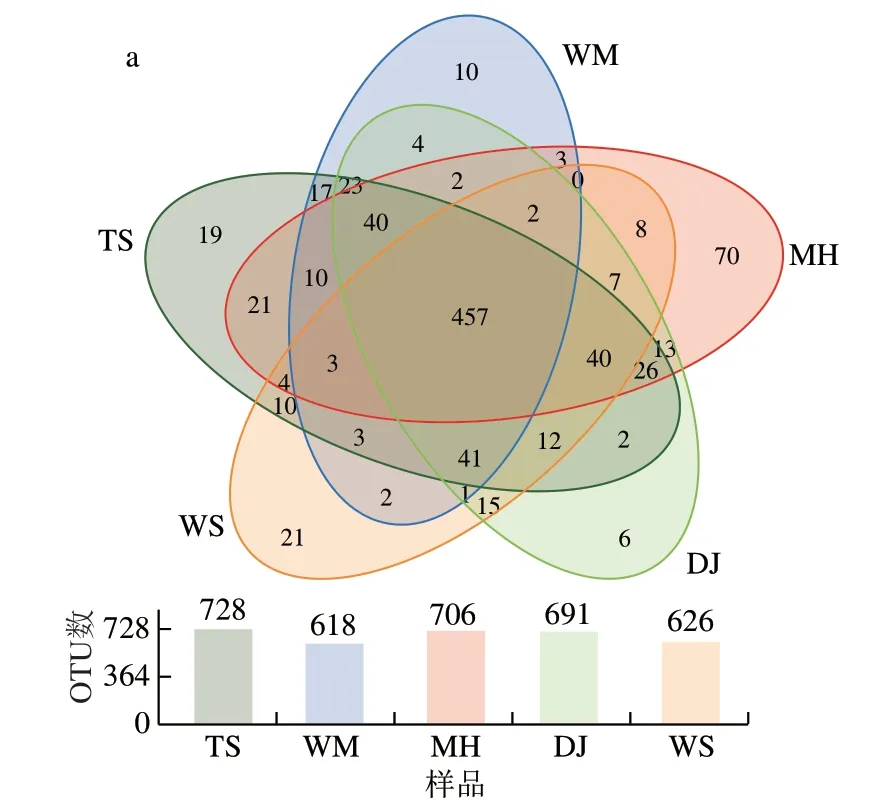
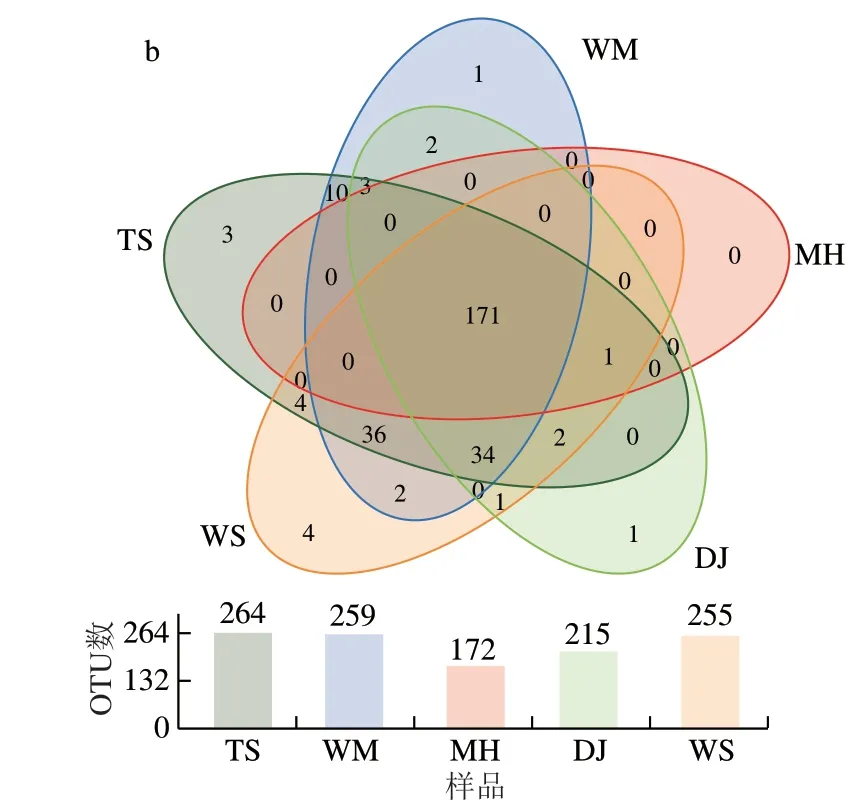
图2 不同酱香大曲OTU分布图Fig.2 Venn diagrams showing shared and unique OTUs between Daqu samples
2.2 不同酱香大曲微生物群落结构分析
酱香大曲作为一种高温大曲,其细菌占据相对的优势,是使酒体酱香风味突出的重要原因[17]。如图3所示,MH、DJ位于赤水河右岸,以细菌为优势菌群,相对丰度在79.89%以上,是典型的酱香大曲;TS、WM位于赤水河左岸,其细菌的相对丰度略高于真菌的相对丰度;WS位于赤水河右岸,真菌丰度的占比最高,其原因可能是距离中心区域最远,及其所处的微环境引起。
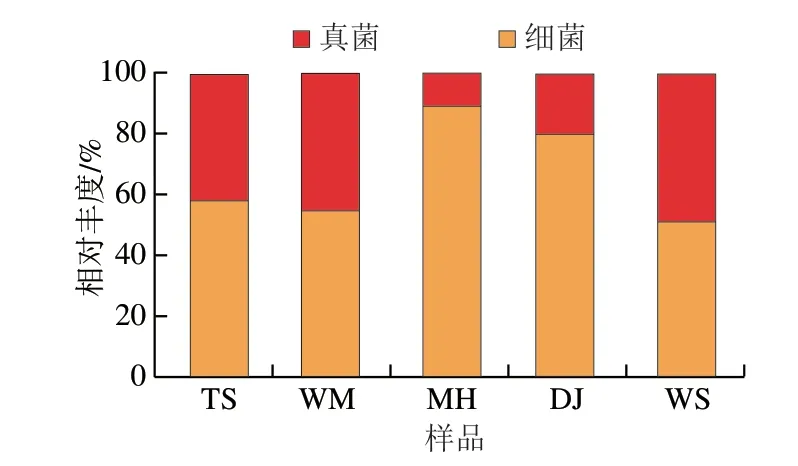
图3 不同酱香大曲属水平总体微生物群落结构Fig.3 Microbial community structure at the genus levels in Daqu
根据属水平分类注释的OTU结果,选取细菌、真菌相对丰度前20的OTU分别绘制百分比堆积柱状图。如图4a所示,细菌相对丰度较高的物种是芽孢杆菌属(Bacillus)、糖多孢菌属(Saccharopolyspora)、魏斯氏菌属(Weissella)、葡萄球菌属(Staphylococcus)、链霉菌属(Streptomyces)。芽孢杆菌属分别占MH、DJ细菌属总丰度的64%、31%,表明芽孢杆菌属是MH、DJ的绝对优势菌属,与其他学者研究的芽孢杆菌属是酱香大曲中绝对优势菌群结果一致[18-19]。高温放线菌属(Thermoactinomyces)在TS、WM、MH、DJ、WS的相对丰度依次为14.55%、5.64%、0.91%、0.10%、0.74%,在地理位置上,表明高温放线菌属可作为茅台镇赤水河左岸的优势细菌属,而在高度上,高温放线菌属更适合生存在茅台镇高海拔地区。魏斯氏菌属的相对丰度在5 种曲样顺序为TS(12.84%)>WM(9.97%)>MH(3.72%)>DJ(2.11%)>WS(0.62%),在地域上呈现出赤水河左岸>赤水河右岸、距茅台镇中心区域较近>茅台镇核心区域较远、海拔高度高>海拔高度低规律。
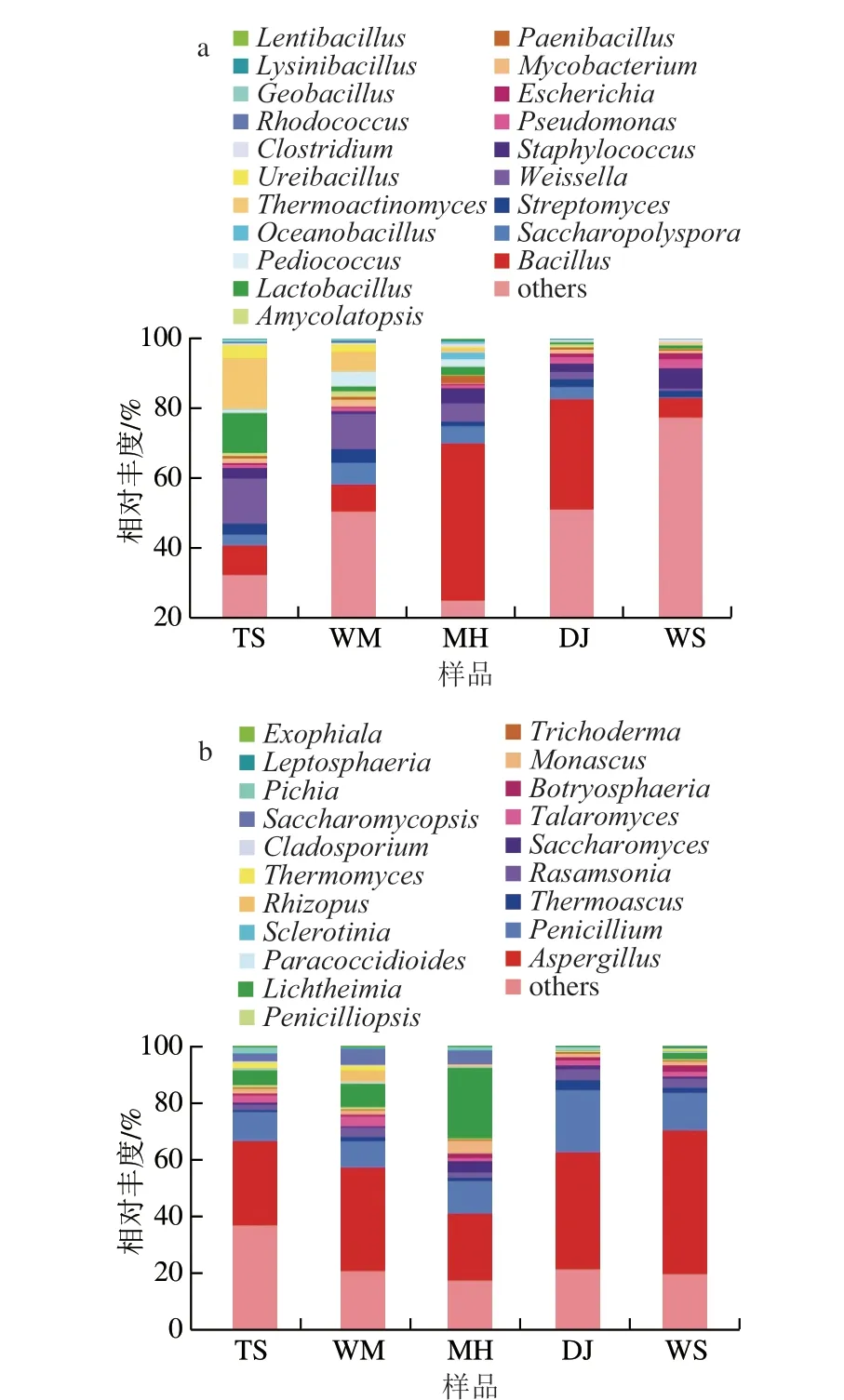
图4 不同酱香大曲属水平前20群落结构Fig.4 Top 20 most abundant microbial genera in Daqu
大曲优势菌群的代谢活动是酱香白酒风味产生的关键,芽孢杆菌属是酱香型白酒发酵过程中最重要的功能菌[20],在大曲贮藏过程中能够分泌淀粉酶、蛋白酶、纤维素酶等酶类[21-22],是酱香大曲代谢生产吡嗪类、酯类、醇类等多种风味化合物的重要菌属[23]。有研究表明,温度是影响芽孢杆菌属数量的重要因素[24],适度高温会促进芽孢杆菌属等耐热微生物的生长,抑制大多数微生物的生长,而MH和DJ的芽孢杆菌属高可能与环境及其生产控制工艺有关。高温放线菌属与芽孢杆菌属均属于耐热微生物,均能分泌淀粉酶、蛋白酶、纤维素酶[25],多存在于高温大曲中,对酱香白酒的风味有一定的贡献,有研究表明高温放线菌菌株不仅能生产其他吡嗪类化合物,还能生产具有酱香风味的愈创木酚[26]。魏斯氏菌属是产酸细菌,在大曲发酵过程中能够生产乙酸、乳酸合成乙酸乙酯、乳酸乙酯等特征风味物质[10,27]。有关魏斯氏菌属在大曲中的报道较多,Yao Su等[28]研究发现魏斯氏菌属是芝麻香型白酒高温大曲发酵过程中的第二优势菌属,在发酵过程中呈先增后降的趋势。Deng Yuke等[29]也发现魏斯氏菌属是大曲发酵过程中的优势细菌属,与本研究结果一致。乳杆菌属、魏斯氏菌属、片球菌属(Pediococcus)均属乳酸菌[28,30],在本研究均被检测到,已有研究证实乳酸菌为中高温大曲发酵过程中的优势细菌[28,31]。
如图4b所示,5 种大曲相对丰度均大于1%的优势真菌属有曲霉属(Aspergillus)、红曲霉属(Monascus)、青霉属(Penicillium)、拉萨姆氏菌属(Rasamsonia)、篮状菌属(Talaromyces),曲霉属、青霉属为大曲的绝对优势真菌。横梗霉属(Lichtheimia)、覆膜孢酵母属(Saccharomycopsis)在TS、WM、MH中的比例明显高于DJ、WS,在地域上呈现为茅台镇中心区域特有的优势真菌,在海拔上呈现为茅台镇较高海拔区域特有的优势真菌,已有研究表明横梗霉属、覆膜孢酵母属是茅台镇酱香型大曲不同主酿区的优势真菌群[32-33]。曲霉属、青霉属是高温大曲普遍存在的优势真菌属[34],能够生产淀粉酶、蛋白酶[35],对大曲的液化力、糖化力和酯化力起重要作用[36]。Xia Yu等[37]在研究酱香大曲与浓香大曲的淀粉酶活性相关蛋白时,发现相比浓香大曲,酱香大曲上调表达的淀粉酶蛋白主要取决于曲霉属。横梗霉属在酱香大曲中具有较高的耐热性,能够高产脂肪酶、蛋白酶、淀粉酶[37-38],是酱香大曲必不可少的优势菌群。有研究表明大曲发酵过程中,微生物菌群是由乳酸菌代谢驱动的自我驯化过程,而横梗霉属是中温大曲酸化后最丰富的优势菌群,其原因是横梗霉属具有将乳酸转化为丙酮酸盐的潜力,干扰乳酸菌的正反馈回路,使其能在一定浓度的乳酸环境下生存,从而成为优势菌群[30]。覆膜孢酵母属是茅台风味大曲常见的优势菌群[39],在大曲发酵过程中可以影响其他优势菌群的生长,有助于醇类、酯类、吡嗪类风味化合物的形成[40]。
2.3 不同酱香大曲微生物相关性分析
在制曲过程中,大曲中的微生物通过竞争、共生及拮抗等关系相互影响从一个相对不稳定的状态逐渐形成一个相对稳定的微生物群落,为探究茅台镇不同区域5 种酱香大曲中优势微生物之间的关系,本研究基于Spearman相关系数(|r|>0.7,P<0.01)对5 种酱香大曲的优势物种进行网络相关性分析,平均度越大、连接线越多则节点越大。如图5所示,5 种大曲正相关比例为56.88%~99.05%,负相关比例为0.95%~43.12%,距茅台镇中心区域较近的TS、WM、MH其正负相关较适中,而距茅台镇中心区域较远的DJ、WS其正相关远大于负相关。位于茅台镇赤水河右岸的MH、DJ、WS的边缘明显高于赤水河左岸的TS、WM的边缘,并且具有更高的连接性(即平均程度),表明赤水河右岸曲样微生物间的相互作用更强[41]。除DJ曲样外,其他曲样网络图分为三大模块,梭菌属(Clostridium)、慢生芽孢杆菌属(Lentibacillus)、拟青霉属(Penicilliopsis)、毕赤酵母属(Pichia)均在5 种大曲中连接点最多的模块,说明这4 类微生物菌群是5 种大曲共有的关键微生物菌群,对其他微生物菌群影响较大。值得关注的是,在DJ曲样中,酵母属(Saccharomyces)与其他优势微生物负相关;在WS曲样中,高温放线菌属、假单胞菌属(Pseudomonas)与其他优势微生物负相关;在MH曲样中,糖多孢菌属、魏斯氏菌属、埃希氏杆菌属(Escherichia)、高温放线菌属、拟青霉属、覆膜孢酵母属与其他优势微生物负相关,这些菌群对大曲微生物间的调控至关重要。而TS、WM的负相关的微生物较为混杂,这可能与地域和所处的微环境有关。图5列出了各种曲样优势菌属之间的相互关系,虽然从现有结果中很难分析出优势菌属之间关系的内在原因,但可为进一步研究菌种之间的相互作用提供依据。就目前结果看,梭菌属、慢生芽孢杆菌属、拟青霉属、毕赤酵母属与多种菌属之间存在较强的相关性,以及在各曲样中,与其他优势菌属存在负相关的菌属可以作为后续研究的重点微生物。
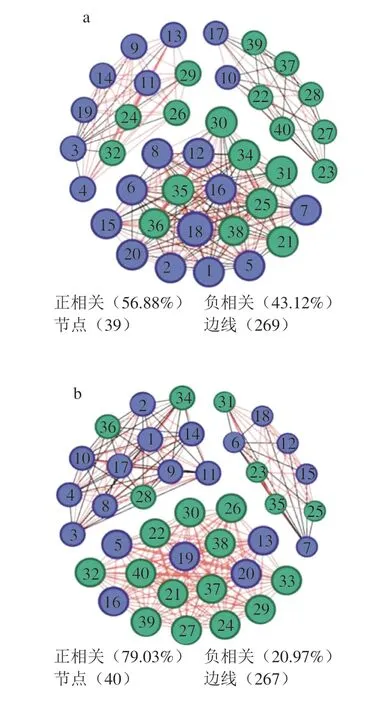
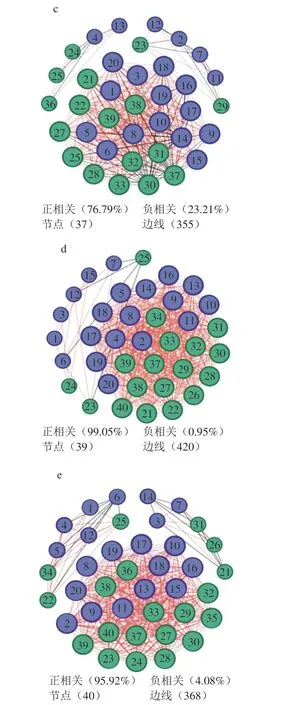
图5 不同酱香大曲微生物共生网络图Fig.5 Microbial cooccurrence networks of Daqu
2.4 不同酱香大曲微生物与理化相关性分析
大曲理化指标中的水分、酸度、淀粉含量可在一定程度上反映大曲的质量,液化力、糖化力、酯化力则反映大曲的酶系功能,而发酵力可反映大曲中某些微生物生长情况。5 种大曲理化指标均有显著差异,如表3所示,大曲水分和淀粉质量分数分别在9.12%~11.87%、55.50%~61.54%之间,水分越低即挥发程度越好,说明大曲的成熟度越好,而淀粉含量体现在制曲过程中糖化酶对淀粉的消耗[42]。WS酸度最高为(2.17±0.02)mmol/10 g,显著高于其他高温大曲,说明其内部产酸微生物代谢及产酸代谢比较旺盛,当酸度水平较高时,乳酸菌会成为大曲的优势菌群[30]。发酵力反映大曲中的某些微生物利用基质生产酒精的能力,WM、DJ的发酵力明显低于其他曲样。糖化力、酯化力、液化力的大小可反映大曲中淀粉酶、脂肪酶、蛋白酶的酶活大小,有研究表明芽孢杆菌属和霉菌是影响大曲酶活性的因 素[21,33],其中MH有较高的糖化力(251.13±4.10)U,WM有较高的酯化力(313.66±4.84)U,而DJ、WS均表现较低的液化力和糖化力。

表3 大曲样品理化指标检测结果Table 3 Physicochemical indexes of Daqu samples
采用RDA研究优势菌群与理化指标之间的相关性,其中两因素间的夹角为锐角时,表示存在正相关,反之为负相关,两因素投影到另一个因素的长度越长则相关性越大。如图6a所示,细菌中的葡萄球菌属、假单胞菌属、埃希氏杆菌属、梭菌属与水分和酸度呈正相关;高温放线菌属、尿素芽孢杆菌属(Ureibacillus)、魏斯氏菌属、糖多孢菌属与淀粉含量、糖化力、液化力和酯化力呈正相关,其中,魏斯氏菌属是影响大曲糖化力、液化力和酯化力的主要菌群,这与刘慧等[42]的研究结果一致。如图6b所示,酵母属、横梗霉属与发酵力呈正相关,且横梗霉属与糖化力相关性大于与液化力相关性,有研究表明横梗霉属与糖化酶系统的关键蛋白有关[37]。覆膜孢酵母属、嗜热真菌属与酯化力、淀粉含量、糖化力、液化力呈正相关,而覆膜孢酵母属是WM的优势菌群,说明覆膜孢酵母属是引起WM高酯化力的关键菌群。
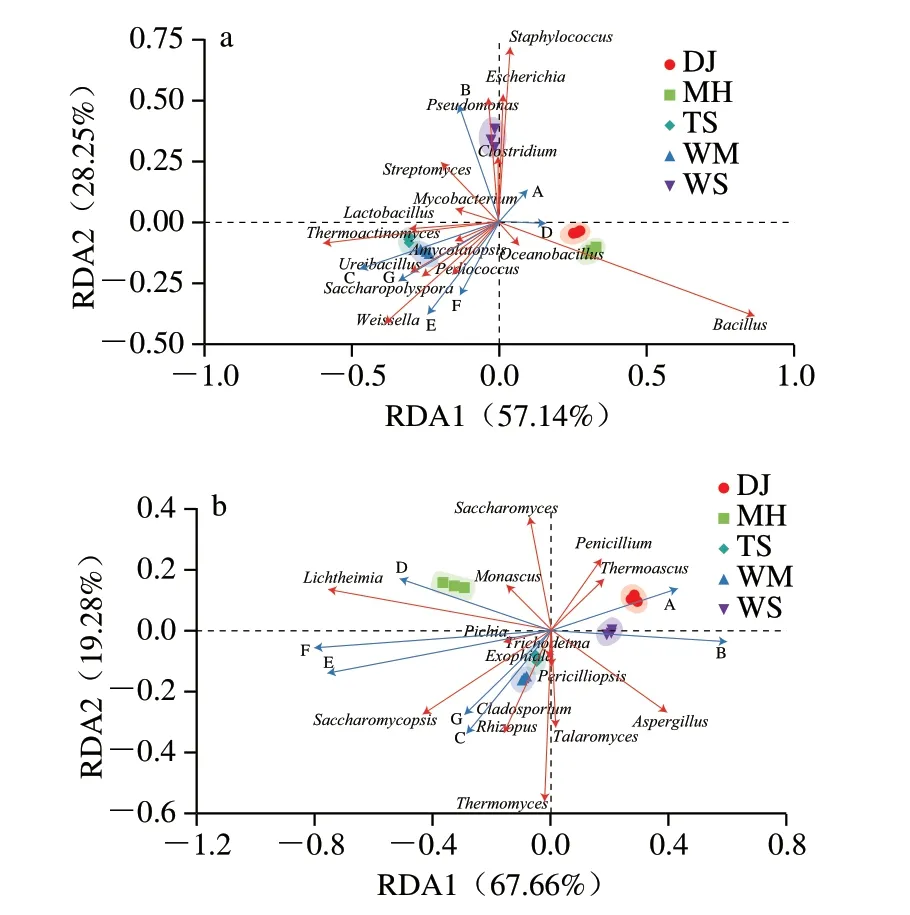
图6 不同酱香大曲微生物与理化指标的RDAFig.6 Redundancy analysis of correlation between microbial communities and physicochemical indexes of Daqu
2.5 不同酱香大曲微生物与特征风味的相关性分析
大曲的风味物质可直接或间接影响白酒发酵过程中风味物质的形成,对白酒终产品的复杂香气具有重要的影响。本研究采用张晓婕等[14]的方法对大曲特征风味物质进行定量,如表4所示,共检测到45 种挥发性化合物。为了进一步探究引起茅台镇不同区域酱香大曲特征风味差异的微生物,选取14 种特征差异物质和15 种优势菌属进行RDA。
如图7a所示,芽孢杆菌属与四甲基吡嗪、丙酸、异戊酸、邻苯二甲酸二丁酯、2,3-丁二醇、苯乙醛呈正相关,已有研究报道芽孢杆菌属是生产四甲基吡嗪、2,3-丁二醇的重要微生物[43-44]。魏斯氏菌属与乙酸、乳酸乙酯、乙酸乙酯、正戊醇呈正相关;葡萄球菌属、埃希氏杆菌属、假单胞菌属与2-甲基丁酸乙酯、正丁醇、乙醛、4-乙基愈创木酚呈正相关。
如图7b所示,曲霉属与正丁醇、2-甲基丁酸乙酯呈正相关;青霉属、嗜热子囊菌属与丙酸、4-乙基愈创木酚呈正相关;酵母属与四甲基吡嗪呈正相关;横梗霉属是引起多种风味物质差异的关键菌群,与乙酸、异戊酸、2,3-丁二醇、苯乙醛、邻苯二甲酸二丁酯呈正相关;覆膜孢酵母属与乙酸乙酯呈正相关。综上,细菌中的芽孢杆菌属和真菌中的横梗霉属是引起大曲风味物质差异的优势菌群,覆膜孢酵母属是乙酸乙酯的关键菌群,这与上述WM酯化力高相符合。
高温大曲中的细菌种类和数量直接影响碳水化合物和氨基酸的运输和代谢[45],芽孢杆菌属作为高温大曲的优势菌群,其数量与种类直接影响大曲的特征风味。有研究表明,可通过高温坏境影响芽孢杆菌属的生长,促进吡嗪类、酸类、酮类、醛类化合物的生成[24,33,46]。横梗霉属是中高温大曲产生酶和风味前体化合物的潜在优势菌群,据报道在大曲酸化后成为最丰富的真菌,与苯乙酮、苯甲醇、丁酸等风味物质呈正相关[30]。覆膜孢酵母属可提高淀粉酶活,增加物种丰富度,促进醇类、酯类化合物的生成,对糖化酶活性、微生物群落结构和风味代谢物有积极的影响,与本研究结果一致[40,47]。
3 结论
采用高通量测序技术分析比较茅台镇不同区域酱香大曲的微生物群落结构,并结合RDA法研究微生物与微生物、理化因子、特征风味物质之间的相关性。结果表明,在细菌属水平上,位于茅台镇中心区域的MH与同为赤水河右岸的DJ具有相似细菌群落结构,芽孢杆菌属是MH、DJ的绝对优势细菌属,而位于赤水河左岸的TS与WM的细菌群落结构更相似,魏斯氏菌属与高温放线菌属在TS、WM的占比远高于MH、DJ、WS;在真菌属水平上,DJ与WS具有相似的真菌群落结构,而TS与WM的真菌结构更相似,此外,横梗霉属、覆膜孢酵母属在与茅台镇中心区域距离较近的TS、WM、MH中比例明显高于茅台镇中心区域外的DJ、WS。网络相关性表明距茅台镇中心较远的DJ、WS优势微生物间的正相关远大于距茅台镇中心较近的TS、WM、MH;位于赤水河右岸的MH、DJ、WS优势微生物间相互作用更强。RDA发现魏斯氏菌属、横梗霉属与大曲的生产性能有较大相关性,而覆膜孢酵母属可明显影响大曲的酯化力;芽孢杆菌属、横梗霉属是引起特征风味物质差异的主要菌群,覆膜孢酵母属是产生乙酸乙酯的关键菌群。
茅台镇不同区域酱香大曲的微生物结构、理化指标以及风味物质各有差异,同时存在一定的相关性,本研究可为酱香白酒行业提供理论依据,同时为后续研究大曲的功能微生物及代谢提供一定参考。
