鸭蛋及黑黄咸蛋壳外细菌多样性及PICRUSt基因功能预测分析
2023-08-05卢立志单雨萌梁振华杜金平
孙 静,杨 雪,彭 旭,卢立志,曾 涛,单雨萌,周 彬,梁振华,贾 鸣,申 杰,,杜金平,
(1.湖北省农业科学院畜牧兽医研究所,湖北 武汉 430064;2.浙江省农业科学院畜牧兽医研究所,浙江 杭州 310021;3.湖北工业大学生物工程与食品学院,湖北 武汉 430064)
鸭蛋含有丰富的蛋白质、氨基酸、矿物质、维生素等[1-2]。中医学认为鸭蛋滋阴补肾,能够提高机体免疫力,促进健康。鸭蛋作为咸蛋加工原料,其新鲜、洁净、无暗纹无破损是保障加工品质量的重要前提。限于我国以地面平养、网养为主的蛋鸭养殖现状,鸭蛋常沾有羽毛、泥粪污等,脏蛋多,这种鸭蛋洁净程度很难满足加工高品质咸蛋的需求[3]。一般认为,被污染蛋壳表层的微生物会透过蛋壳渗入蛋内而造成鸭蛋内容物的污染[4-5]。有研究表明,由于蛋体表面的微生物数目增加,导致蛋体中微生物渗入污染鸭蛋的内容物,特别是肠杆菌科的污染。细菌进入蛋壳,不但会导致蛋壳内部的结构形式发生变化,还会破坏蛋壳中的主要营养物质,导致蛋壳蛋白变稀,系带液化断裂,蛋黄膜失去弹性断裂;蛋清和蛋黄混合在一起会产生大量的硫化氢等难闻的气味,从而导致蛋壳的保质期受到影响。因此脏鸭蛋载菌,给鸭蛋加工及食品安全带来极大隐患;同时,鸭蛋上附着的污物风干后难以清洗,加大了生产难度,使产品质量下降,影响成品风味。原料鸭蛋的清洁程度即载菌量与加工效果关系密切[6]。
石一等[7]研究发现,鲜鸡蛋壳外细菌以厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)为主,葡萄球菌属(Staphylococcus)、链霉菌属(Streptomyces)和乳酸杆菌属(Lactobacillus)为优势菌属。卢昌丽等[8]通过对不同季节鸭蛋表面菌群多样性分析得出,鸭蛋壳表面主要为厚壁菌门和放线菌门,其中芽孢杆菌属(Bacillus)、肠球菌属和埃希氏菌属-志贺菌属(Escherichia-Shigella)为优势菌属。因鸭鸡的生活习惯、养殖场的环境不同,2 种禽类的蛋壳受污染的菌群存在差异[9]。目前已有研究并未探明新鲜鸭蛋表面微生物种类和数量对鸭蛋后续加工中品质产生异变的影响,未能阐明鸭蛋加工前进行洁净处理的必要性。因此,理清鸭蛋载菌情况、鸭蛋载菌对加工的影响是解决脏鸭蛋加工的理论基础课题。本研究选取不同洁净程度的鸭蛋,测定鸭蛋的菌落总数,采用16S rDNA基因检测分析鸭蛋的载菌组成,以分析比较鸭蛋载菌的表型及功能差异,以期为鸭蛋清洁生产提供理论支撑。
1 材料与方法
1.1 材料与试剂
鸭蛋来自湖北省农业科学院畜牧兽医研究所金水家禽养殖基地,相同日龄农湖2号蛋鸭,分别采集蛋壳表面无明显脏污蛋(CE)与有明显脏污蛋(DE)及实验室腌制黑黄咸蛋(BSE)各200 枚。
RNasea、1×TE Biosharp生物科技有限公司;Q5®High-Fidelity DNA Polymerase 上海金畔生物科技有限公司;Quant-iT PicoGreen dsDNA Assay Kit9 上海懋康生物科技有限公司。
1.2 仪器与设备
2720聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 美国ABI公司;FLX800T酶标仪 美国BioTek公司;DYY-6C电泳仪 北京六一公司;BG-gdsAUTO(130)凝胶成像系统 北京百晶生物技术有限公司;MiSeq高通量测序平台 美国Illumina 公司;Scilogex CF1524R常温离心机 北京奥利赛克生物科技有限公司;K1302半微量凯氏定氮仪 上海君翼仪器设备有限公司;AD200L-H均质机 上海昂尼仪器仪表有限公司。
1.3 方法
1.3.1 鸭蛋分组与鸭蛋壳外菌液样品的采集
按照庄宇[10]提出的抽样工作要点,随机选取CE、DE及BSE各40 枚。各组鸭蛋整蛋用无菌生理盐水,常温条件下置于超声波清洗器中清洗,收集洗蛋水混合液作为CE、DE、BSE的壳外菌液样本;在无菌环境下剥开蛋壳,分离蛋壳与壳膜,用200 mL无菌生理盐水浸泡壳膜并蘸取擦拭蛋壳内表面,收集该混合液作为CE、DE、BSE的壳内菌液样本;无菌条件下收集蛋白和蛋黄,混合均质得到内容物菌液样本。无菌条件下收集蛋白和蛋黄,混合均质得到内容物菌液样本。上述壳外、壳内、内容物样本均分为2 份,分别用来测定菌落总数和MiSeq高通量测序。
1.3.2 菌落总数的测定
参照GB/T 4789.19—2003《食品卫生微生物学检验 蛋与蛋制品检验》[11]方法测定;微生物限量标准参照GB 2749—2015《蛋与蛋制品》[12]。
1.3.3 菌落多样性的测定分析
由MiSeq平台进行高通量测序。采用细菌基因组DNA提取试剂盒提取DNA(步骤参照试剂盒说明书)。对提取好的DNA样品进行0.8%琼脂糖凝胶电泳进行分子大小判断,利用紫外分光光度计对DNA进行定量。过滤总序列中不合格的DNA模板,对合格的文库根据Illumina MiSeq测序区域(V3+V4),采用合成带有barcode的特异引物进行细菌16S rDNA PCR扩增,扩增结果进行2%琼脂糖凝胶电泳,切取目的片段然后用Axygen凝胶回收试剂盒回收目的片段。
根据barcode序列区分各个样本reads,去除嵌合序列后得到有效数据用于后续分析。对细菌可操作分类单元(operational taxonomic units,OTU)在100%相似水平下进行聚类分析,绘制稀释曲线;通过α多样性指数分析,即菌群丰度指数Chao和ACE、菌群多样性指数Shannon和Simpson,评价测序深度指数覆盖率,验证数据分析的合理性,对这些α多样性指数的计算方法详见http://scikit-bio.org/docs/latest/generated/skbio.diversity.alpha.html#module-skbio.diversity.alpha。以Venn图形式表现多个样本中共有和独有的OTU数目,分析门和属水平上物种多样性及其对应丰度,将聚类后属水平上的数据以热图形式表示,物种分块聚集后群落组成的相似性和差异性,颜色梯度代表差异大小。
1.3.4 菌落表型功能分析
利用BugBase软件[13]预测细菌组表型,并按革兰氏阴阳性、氧气消耗、生物膜、潜在致病力等对鉴定到的微生物进行组间差异分类。
1.3.5 菌落PICRUSt基因功能预测分析
PICRUSt是根据微生物群落的丰富度与数据库比,在无法观察的条件下,就可以推断出生物群落的功能。通过高通量测序技术和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库比对,赋予基因信息生物学意义。基于已测细菌的测序数据,对样本中微生物的基因进行功能预测。
1.4 数据处理
实验设置3 次重复,结果以图表形式表示。数据采用GraphPad Prism 7.00软件作图,方差分析采用SPSS 25.0软件进行Duncan多重比较分析,P<0.05,差异显著。相关性分析采用Pearson法。
2 结果与分析
2.1 菌落总数测定结果
如图1所示,DE壳外菌落总数显著高于CE,菌落总数差异显著,壳内菌落总数差别不大。BSE的壳内及内容物菌落总数大幅增加,DE和CE内容物未检出。可以看出,DE携带的细菌水平显著高于CE,DE更容易受到细菌污染;而BSE壳内及内容物携带细菌水平较高,BSE明显腐败变质,不能继续食用。
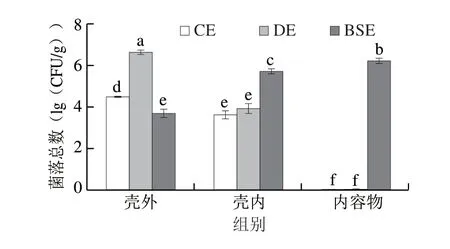
图1 脏污鸭蛋、干净鸭蛋和BSE壳外、壳内及内容物载菌数Fig.1 Number of bacteria on eggshell surface and shell membrane and in contents of stained duck eggs,clean duck eggs and BSE duck eggs
2.2 Illumina MiSeq测序数据与质量控制
采用合成带有barcode的特异引物进行细菌16S rRNA V3+V4区PCR扩增,所得PCR扩增产物经Illumina MiSeq测序,CE组获得101215 条有效序列信息,DE组获得51044 条优化序列信息,BSE组获得118059 条优化序列信息。CE和DE组序列平均长度为402.86 bp和415.87 bp,CE和DE组样品的检出有效序列条数相差2 倍,差异显著,说明两个样品间具有显著差异。
以CE、DE、BSE 3 组洗蛋水混合液作为样品,提取基因组DNA,样品浓度与纯度均符合PCR扩增的要求。稀释曲线可以反映检测样品中新物种的出现速度,曲线上某一点的斜率越大,表示出现新物种被检测的速率越快,斜率越小则表示新物种出现的速率越慢。如图2 所示,样品测序量低于20000时,OTU数量还有明显增加,说明此时样品中还有较多物种没有被检测。当测序量继续增加时,大部分样品的OTU虽仍有增加,但是趋势平缓,细菌的多样性增加已经不明显,则说明测序数量充分且合理,可用于进一步分析数据。
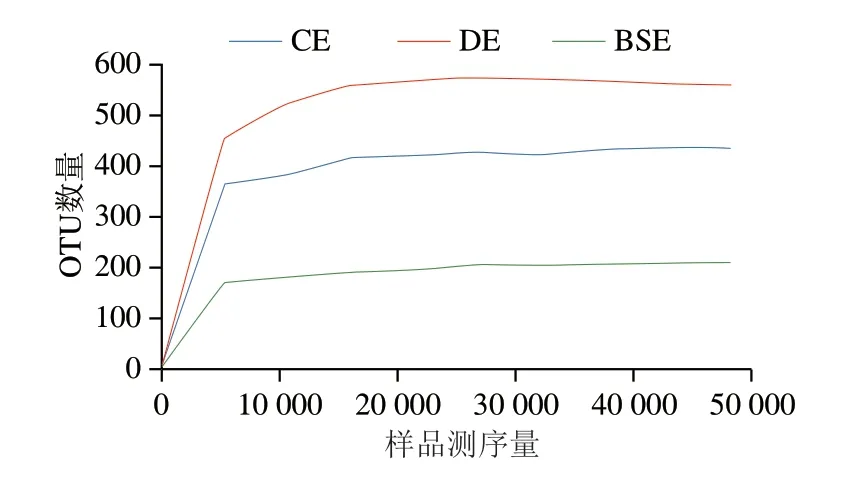
图2 各样品的稀释曲线Fig.2 Rarefaction curves of bacterial sample
2.3 鸭蛋表面菌落α多样性分析
CE、DE、BSE壳外微生物α多样性分析见表1。覆盖率即各组分样品中序列被测出的概率,均达到99%以上,因此测序深度足够、该组数据可有效表示样本中微生物多样性的真实情况,测序可信度高。
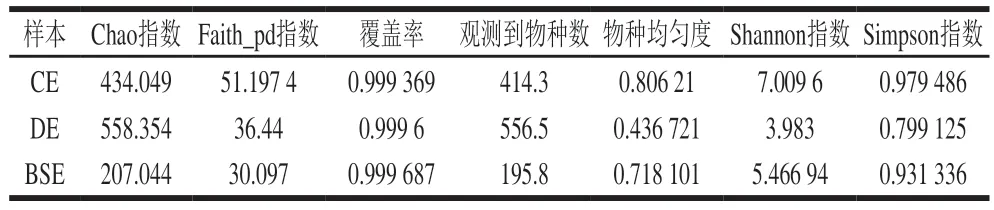
表1 α多样性指数统计Table 1 Statistical analysis of α diversity indexes
Chao指数、Shannon指数和Faith_pd指数均可用来评估不同洁净程度鸭蛋的物种丰富度,Chao指数越大,表明样本丰度指数越高,Shannon指数越大,表明样本多样性越高,Faith_pd指数差异越大,说明细菌物种差异越显著。从表1可以看出,DE组的Chao指数大于CE组,Shannon指数和Faith_pd指数CE组大于DE组,物种均匀度CE组大于DE组。DE组微生物丰度高于CE组,而CE组微生物多样性更丰富、均匀度更高,两个样品Shannon指数相差1 倍左右,组间差异有统计学意义。BSE壳外微生物丰度,多样性、均匀度均小于CE,推测咸蛋腌制时高盐高渗的环境抑制了BSE壳表面微生物的生长[14]。
2.4 鸭蛋表面菌落组分OTU Venn图分析
按100%的相似度聚类后归为935 个OTU,包括 18 个门,256 个属。由图3可看出,BSE组与正常咸蛋(NBSE)组样品壳内共有OTU数为152 个,占NBSE组OTU数的10.71%,占BSE组OTU数的19.26%。由此可以看出NBSE组较BSE组壳内细菌多样性更丰富,可能是BSE中主要优势菌落为某种或几种致黑类菌落,细菌种类多样性不如NBSE。CE、DE和BSE组样品壳外共有OTU有19 个,共有OTU分别占CE组4.50%,DE组3.42%,BSE组9.84%,各组重叠部分较小。由此可知,在不同分类水平上,不同洁净程度的鸭蛋及BSE细菌水平均存在数量上的差异。DE组独有的OTU数量多于CE组,说明DE组具有大量CE组没有的微生物。在DE组独有的OTU中占比最大为变形菌门(Proteobacteria)的嗜冷杆菌属(Psychrobacter),卢昌丽等[8]不同季节鸭蛋的表面细菌多样性分析得出,不同季节的温度、气候环境对鸭蛋表面菌群多样性有很大影响。杨伊磊等[9]研究表明,除了家禽的健康状况差,禽蛋产出过程会受到污染外,养殖场的土壤、垫草、饲料、空气、粪便等的卫生状况都会造成蛋壳表面细菌污染,因此导致DE比CE携带的细菌种群更为复杂多样。BSE与DE组比BSE与CE组共有的OTU数少,但BSE组与DE组共有OTU相对丰度大,BSE组与CE组共有OTU相对丰度小、绝对含量也少。
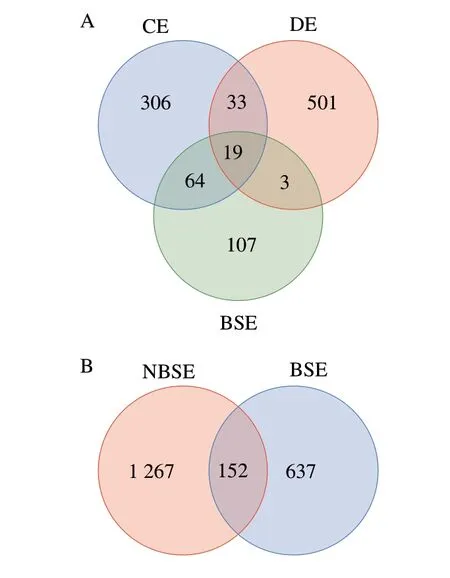
图3 不同样品组分共有或独有OTU数Venn图Fig.3 Venn diagram showing shared and unique OTUs between bacterial samples
2.5 微生物种类分布比较
在门水平上对样品进行注释分析,如图4所示,BSE组优势菌占比较高的为厚壁菌门、变形菌门和放线菌门,分别为72.20%、16.13%和4.30%;NBSE组优势菌门则只有变形菌门,占比为82.83%,厚壁菌门和放线菌门占比仅2.09%和1.75%。CE优势菌占比较高的为变形菌门、厚壁菌门和放线菌门,分别为34.35%、27.25%和17.28%,拟杆菌门(Bacteroidetes)占比较少为8.29%;而DE优势菌占比较高的是变形菌门为89.01%,厚壁菌门和放线菌门分别占6.16%和3.98%。BSE组优势菌占比较高的是变形菌门、拟杆菌门、放线菌门和厚壁菌门,分别为76.50%、8.00%、6.76%、5.43%。结果表明,DE组和BSE组壳外变形菌门的丰度大幅增加,为核心优势菌门,CE组壳外变形菌门、厚壁菌门和放线菌门均为优势菌门,NBSE组壳内变形菌门为核心优势菌门。由此可见,腌制过后NBSE和BSE壳内优势菌门存在显著差异,BSE壳内外细菌相对丰度较高的都有厚壁菌门、变形菌门和放线菌门,但各个菌门的相对丰度并不相同。研究表明,变形菌门是胃肠道中一类适应性强、具有潜在致病性的常见菌,包括大肠杆菌、沙门氏菌、霍乱弧菌、幽门螺旋杆菌等病原菌,其丰度变化可直接对宿主健康产生影响[15]。大部分变形菌门的细菌都会导致肺炎、泌尿道等多种传染病的症状[16-17]。刘肖利等[18]的研究表明,变形菌门为牛乳房炎的优势菌门。变形菌属会导致蛋白质、卵磷脂分解,产H2S,蛋白呈暗褐色、蛋黄呈褐色或黑色[19]。由此可见:DE及BSE携带致病菌及导致鸭蛋变质的腐败菌的丰度高于CE,DE和BSE受污染程度大大增加。根据谢雨衡[20]的研究可知,变形菌门、厚壁菌门、放线菌门和拟杆菌门微生物能够促进致黑臭物质H2S的产生,张伯涵[21]研究也证明了以上种类微生物对水体的致黑致臭有巨大作用,根据BSE和NBSE内部优势菌门差异推测,咸蛋黑黄形成原因与内部厚壁菌门和变形菌门丰度差异存在一定关系,当厚壁菌门相对丰度过高时会产生致黑致臭物质。
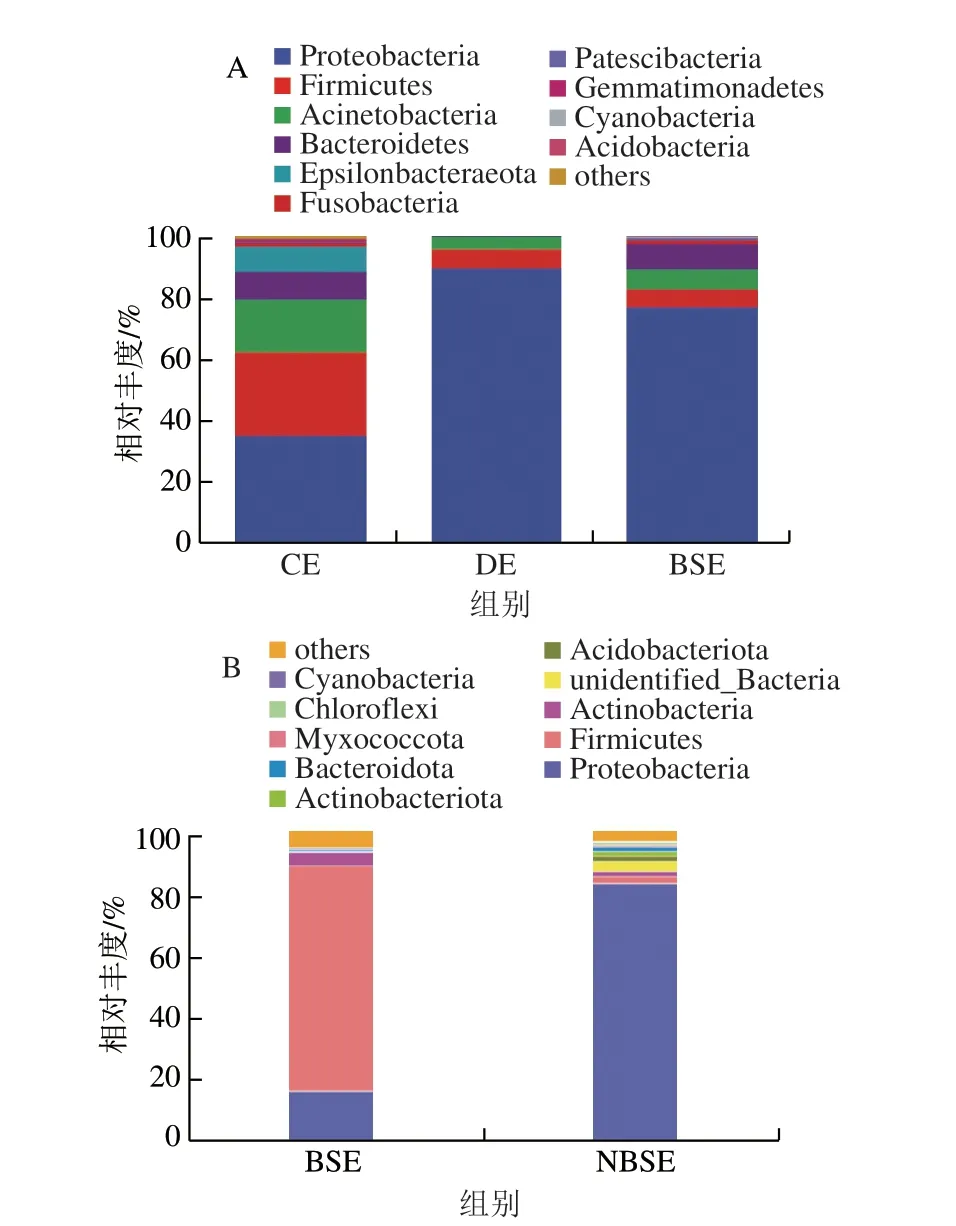
图4 壳内外微生物门水平相对丰度比较Fig.4 Comparison of relative abundance of bacteria at the phylum between the inside and the outside of duck eggshells
在属水平上,图5显示相对丰度前10的菌属,其他菌属归类为others。BSE壳内优势菌属为芽孢杆菌属(Bacillus)占46.04%,蒂西耶氏菌属(Tissierella)占22.60%,罗尔斯通氏菌属(Ralstonia)占4.50%,假单胞菌属(Pseudomonas)占3.43%;NBSE壳内优势菌属为假单胞菌属占50.80%,罗尔斯通氏菌属占20.27%,贪铜菌属(Cupriavidus)占2.45%。可以看出,与NBSE组相比,BSE假单胞菌属和罗尔斯通氏菌属相对丰度骤减,而芽孢杆菌属、蒂西耶氏菌属等菌属相对丰度则有不同程度的上升。CE壳外优势菌属为涅斯特捷科氏菌属(Nesterenkonia)占9.08%、弯曲杆菌属(Campylobacter)占7.91%、链球菌属(Streptococcus)占3.41%、寡养单胞菌属(Stenotrophomonas)占2.92%、赖氨酸芽孢杆菌属(Lysinibacillus)占2.65%和乳杆菌属(Lactobacillus)占2.27%;DE壳外优势菌属为嗜冷杆菌(Psychrobacter)占86.01%、不动杆菌属(Acinetobacter)占2.20%;BSE组壳优势菌属为罗尔斯通氏菌属占22.91%,沙雷氏菌属(Serratia)占5.05%,放线菌属(Actinomyces)占3.32%。在DE组中占绝对优势的嗜冷杆菌属丰度占比高达85.99%,而CE组(笼养蛋)蛋壳表面嗜冷杆菌属丰度占比小于1%。DE组中占2.20%的不动杆菌属也是一种常见腐败菌。研究表明,嗜冷杆菌属Psychrobactersp.ZY214菌具有产脂肪酶的功能[22],嗜冷杆菌属是引起冷鲜鸡冷藏保存过程中腐败变质的主要菌属之一[23],低温冷藏鲳鱼腐败过程中,嗜冷杆菌属与不动杆菌属起到重要作用[24]。寡养单胞菌属Stenotrophomonassp.sp3菌在25 ℃、微碱性条件下可以起到氧化水中S2-的功能,从而达到抑制水体黑臭的作用[25]。CE组中优势菌属弯曲杆菌属(丰度占比为7.94%)和涅斯特连科氏菌属(丰度占比为8.87%)在DE组中丰度占比均小于1%。CE组中相对丰度为2.92%的寡养单胞菌属,在DE中未检出。BSE组中的第1优势菌属是导致菌血症感染的条件致病菌,还会对蛋清凝胶性、疏水性、色度改变等劣变品质有较大影响[26];第2优势菌属沙雷氏菌属属于兼性厌氧菌,有研究指出该菌是腐败变质冰鲜鸭的第2优势菌种[27]。干净鸭蛋菌群多种多样,并且只有一小部分是致病菌,脏污鸭蛋的腐败菌占很大优势,而能抑制鸭蛋腐败变质的菌群丰度很小,且未检出。由此推测,DE比DE更容易腐败变质。因此鸭蛋产出后经过清洗、消毒对减少腐败菌、致病菌很有必要。
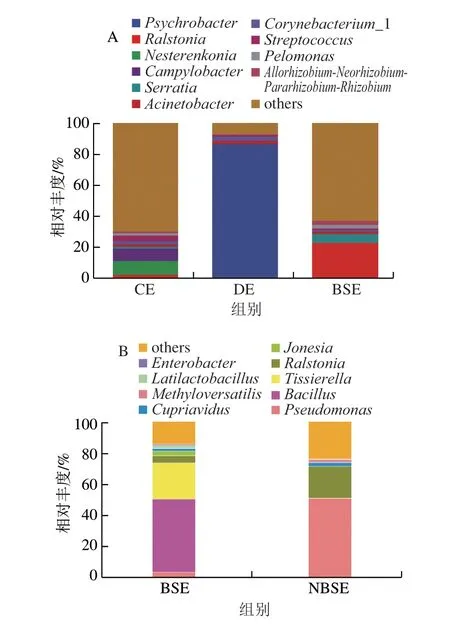
图5 壳内外微生物属水平相对丰度比较Fig.5 Comparison of relative abundance of bacteria at the genus level between the inside and the outside of duck eggshells
为进一步探究咸蛋异变的原因,对NBSE和BSE样品的微生物进行种水平的检测,2 组样品在种水平上丰度前10的微生物如图6所示,其他菌种微生物被归类为others。BSE组的优势菌种为皮氏罗尔斯通氏菌(Ralstonia pickettii)占4.50%,产氮假单胞菌(Pseudomonas azotoformans)占2.27%,偶发贪铜菌(Cupriavidus pauculus)占1.78%,清酒广布乳杆菌(Lactobacillus sakei)占1.57%;NBSE组的优势菌种为产氮假单胞菌占50.46%,皮氏罗尔斯通氏菌(Ralstonia pickettii)占20.27%,偶发贪铜菌(Cupriavidus pauculus)占2.45%。吴彩叶等[28]研究发现,产氮假单胞菌具有较强的组胺降解能力,能够有效抑制组胺的生成并减少食品中原有的组胺含量,并且不会产生组胺,该菌具有一定程度的耐盐性,但盐浓度过高时会抑制其生长和酶活性。皮氏罗尔斯通氏菌则具有良好的苯酚降解能力,同时还具有一定的重金属耐受能力[29]。这两种菌在NBSE组中都有很高的丰度占比,但在BSE中相对丰度明显减少,符合与前面属水平相对丰度的检测结果中NBSE组假单胞菌属和罗尔斯通氏菌属相对丰度骤减的现象。值得注意的是,在BSE组属水平上占有优势地位的芽孢杆菌属在种水平上并未有丰度前10的菌种存在,仅有清酒广布乳杆菌与其同属芽孢杆菌纲(Bacilli),因此可以推测,BSE存在许多归属于芽孢杆菌属的不同微生物种类,朱天傲[30]在研究中发现,枯草芽孢杆菌(Bacillus subtilis)和淀粉液化芽孢杆菌(B.amyloliquefaciens)为酱制品中主要的潜在产生物胺菌,其分离菌株中大部分含鸟氨酸脱羧酶和精氨酸脱羧酶基因,这两种酶都参与腐胺的生成;通过对豆瓣酱发酵环境的研究发现当盐含量为5%或pH 5时,发酵液中生物胺含量会达到最高值;淀粉液化芽孢杆菌是一种兼性厌氧菌,当氧含量不足时会通过产胺进行质子跨膜运输获得能量。结合咸蛋腌制环境看,咸蛋腌制时腌制液盐含量在5%左右,且咸蛋腌制时鸭蛋处于与空气隔绝的状态下,这种环境可能会对鸭蛋中生物胺的产生起到促进作用。
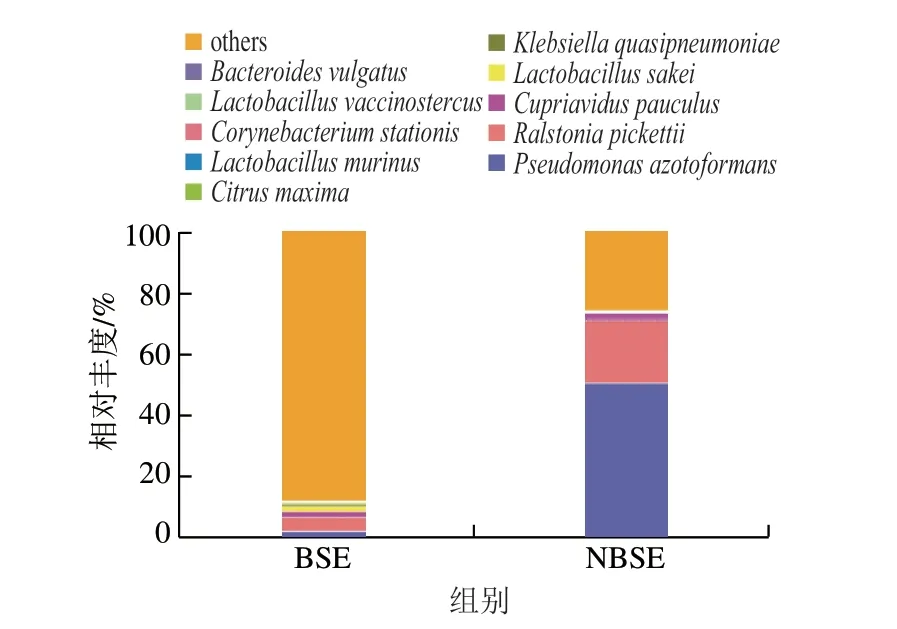
图6 BSE和NBSE壳内微生物种水平比较Fig.6 Comparison of relative abundance of bacteria at the species level between the inside of BSE and that of NBSE
2.6 鸭蛋壳外微生物表型分析
通过BugBase预测得到细菌群落表型分析示例[31],图7展示了样本细菌群落在需氧性、革兰氏染色阴阳性、氧化胁迫耐受性和致病性等表型上的相对丰度差异。
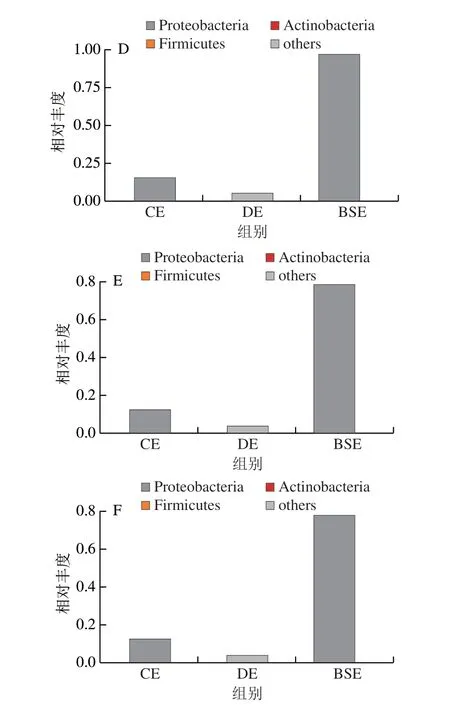
图7 CE、DE和BSE组微生物表型预测Fig.7 Prediction of microbial phenotypes in CE,DE and BSE
综合比较图7A、B,CE微生物以厌氧为主,厌氧菌(主要为厚壁菌门)略多于需氧菌(为变形杆菌门、放线菌门),BSE微生物以需氧为主,厌氧的厚壁菌门在BSE样品中丰度大幅降低、而需氧的变形杆菌门丰度大幅升高,推测鲜鸭蛋中厚壁菌门有一定的氧化胁迫耐受力,可在盐渍时缺氧环境下发挥作用,当“黑黄”产生时变形杆菌门又可大量增殖使蛋黄“黑化”程度加剧。这一现象与南宁市黑臭水体中变形杆菌门、厚壁菌门在黑臭生成阶段与黑臭生成后的变化规律一致[21]。
综合比较图7C、D,NBSE微生物以革兰氏阳性菌为主。图7F表明新鲜鸭蛋具致病性的微生物主要为变形杆菌门,且相对丰度较低,而BSE致病性微生物变形菌门的丰度大幅增加,变形杆菌是广泛分布于自然界及人和动物肠道中的致病菌[32],由变形杆菌引起的食物中毒事件屡有报道[33-34]。由图7E可知,CE的变形杆菌氧化胁迫耐受力较低,且相对丰度显著低于BSE,说明鲜鸭蛋上承载的变形杆菌门可采用具有一定氧化性的清洗剂去除。
2.7 功能预测
图8~10分别展示了BSE、CE、DE微生物涉及的功能通路,主要包括细胞过程和信号传导、信息储存和处理和新陈代谢,包含25 个代谢通路。从图9、10可以看出,DE组在碳水化合物运输和代谢通路上的丰度远大于CE组,由此可看出,DE碳水化合物分解能力强于CE,发现微生物在脂质运输和代谢以及次级代谢物生物合成、转运和分解代谢通路上的微生物丰度DE>CE。对比发现DE微生物致脂质氧化分解成次级代谢物的能力强,推测DE微生物在脂质代谢通路的活跃度明显高于CE,脂质氧化形成次级代谢物的能力也强于CE,而脏污鸭蛋在经历氧化劣变等一系列物化反应后其脂质氧化趋于平缓。在氨基酸转运和代谢及无机离子转运和代谢通路上微生物丰度CE>DE,CE微生物在氨基酸及无机离子转运代谢通路上均活跃,推测微生物对CE氨基酸与无机离子的转运与代谢影响较大。辅酶运输和代谢通路上微生物丰度也呈现DE>CE的规律,也说明DE中辅酶参与的生化反应更为活跃。BSE微生物在氨基酸转运和代谢通路上相对丰度最高,说明BSE微生物氨基酸转运和代谢最为活跃;BSE在次级代谢物生物合成、转运和分解代谢通路上微生物丰度高于CE和DE,推测微生物对BSE脂质氧化分解成次级代谢物的影响较大。虽然不同洁净程度鸭蛋样本预测的主要功能基因类别基本无差异,但丰度具有差异。DE碳水化合物以及脂质代谢通路丰度高于CE,而CE氨基酸与无机离子的转运与代谢通路表现出较高的丰度。碳水化合物是微生物生长繁殖的基本营养物质,这与DE微生物丰度高于CE的结果相符。由此推测,不同洁净程度的鸭蛋壳外细菌发挥各自的功能基因影响鸭蛋壳外微生物合成代谢途径,从而形成了DE容易腐败变质的现象。
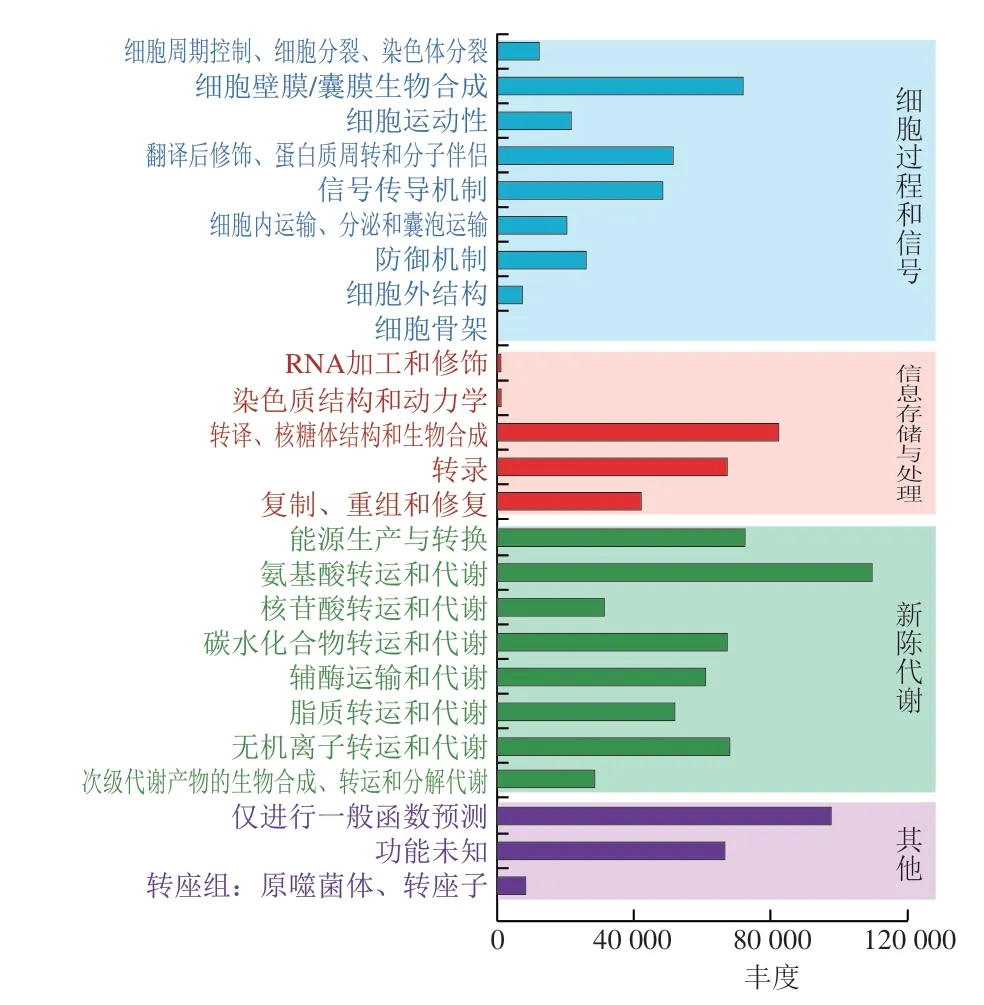
图8 BSE微生物代谢通路情况Fig.8 Microbial metabolic pathways in BSE
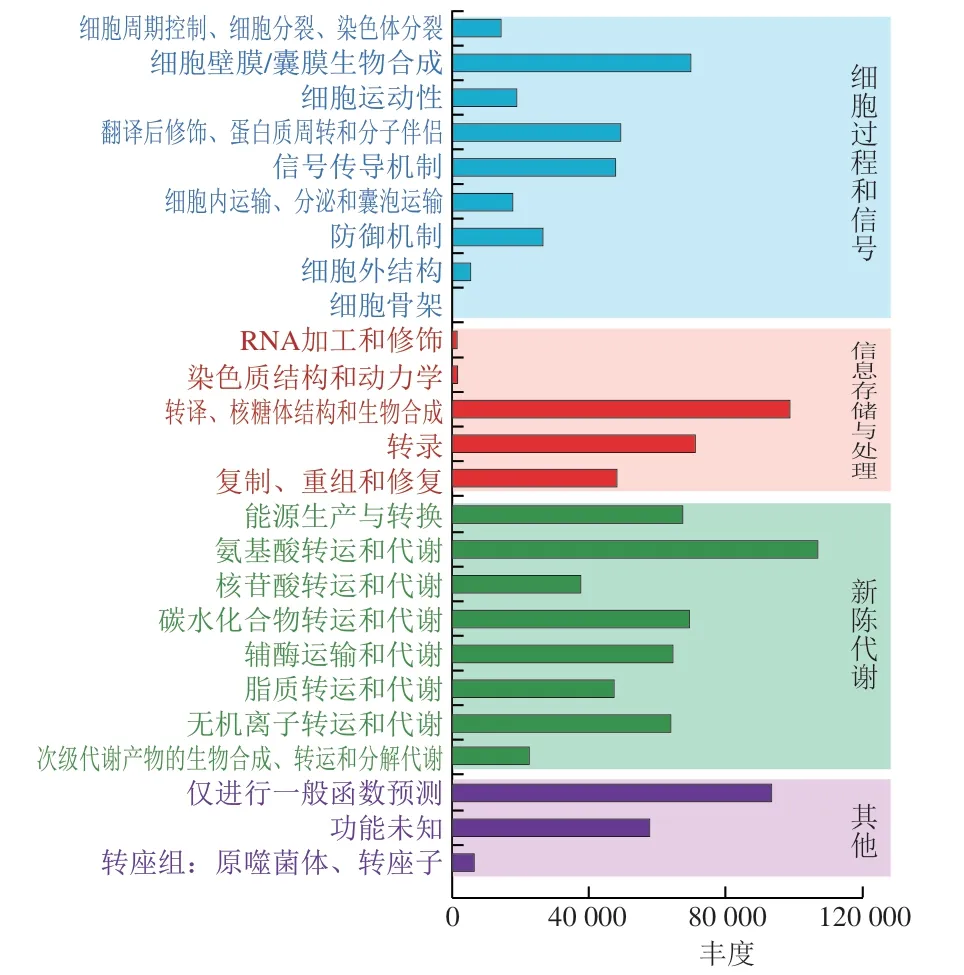
图9 CE微生物代谢通路Fig.9 Microbial metabolic pathways in CE
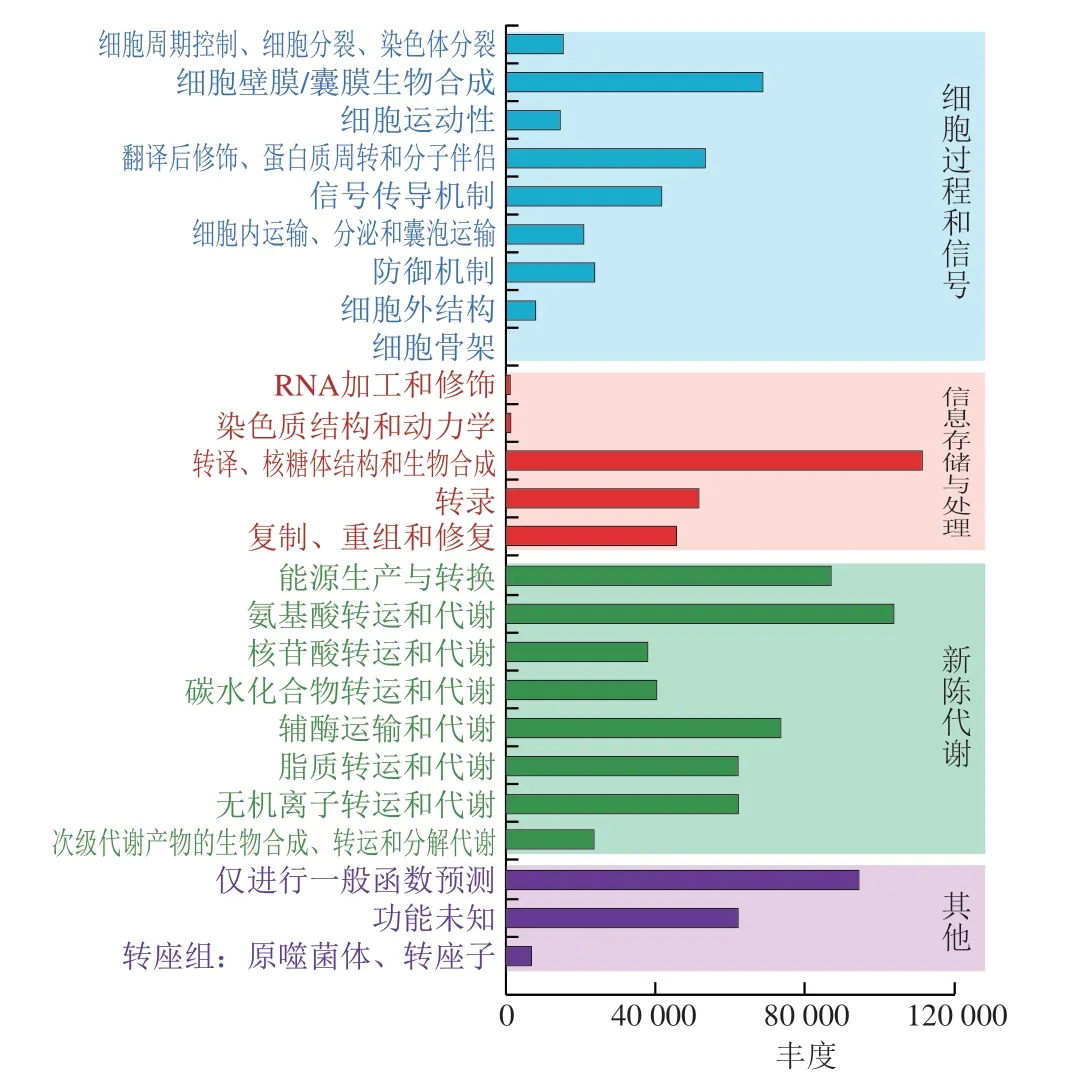
图10 DE微生物代谢通路统计Fig.10 Statistical analysis of microbial metabolic pathways in DE
图11反映了各组代谢通路物种组成情况,DE组主要微生物为嗜冷菌属、不动杆菌属等,CE组主要微生物为赖氨酸芽孢杆菌属、寡养单胞菌属、链球菌属、未分类的慢生根瘤菌属(unclassified_Rhizobiaceae)等,BSE组主要微生物为罗尔斯通菌属、未分类的慢生根瘤菌属、大豆根瘤菌属(Bradyrhizobium)、污泥单胞菌属(Pelomonas)等。
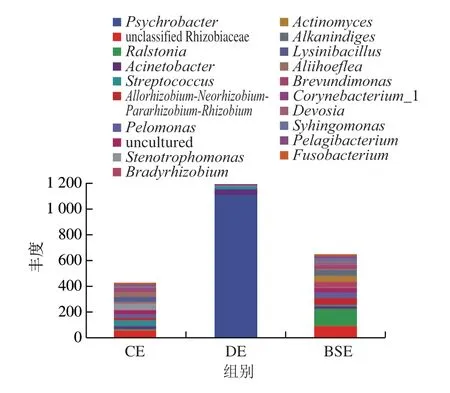
图11 各组代谢通路物种组成情况Fig.11 Species composition of metabolic pathways
DE组中嗜冷菌属占绝对优势,而CE组中嗜冷菌属的相对丰度很低,由此推测,DE和CE在基因功能上的差异主要是由嗜冷菌属引起。嗜冷杆菌是一种革兰氏阴性菌,嗜冷,感染人较为少见。人来源的嗜冷杆菌主要为肺炎嗜冷杆菌和粪嗜冷杆菌[35],吴国杰[36]研究表明,嗜冷杆菌产的酯酶Est10具有很强的耐盐性,酯酶Est12对一些有机溶剂和去污剂也具有较好的活性和稳定性。李建洲等[37]发现生鲜乳在低温贮藏时会受嗜冷菌污染导致其大量繁殖并产生蛋白酶和脂肪酶。可见,DE中嗜冷杆菌属丰度较高,极难清洗去除,且在高浓度盐水或盐泥盐渍加工咸蛋,其所属酯酶Est10依然有致劣能力。徐瑶瑶等[25]研究发现寡养单胞菌属具有抑制水体黑臭的作用,CE导致腐败变质的嗜冷菌属和不动杆菌属丰度很低,而寡养单胞菌属的丰度高,这也是洁净程度高鸭蛋不易形成黑黄的原因。
3 结论
测定CE、DE和BSE表面微生物总量、种类和丰度的差异,预测它们表面微生物的功能,并对比NBSE和BSE之间蛋内微生物的差异,得出DE表面微生物总量显著高于CE,且DE与CE表面不同优势菌属的不同功能使DE腌制后理论上品质变差的概率更高,细菌丰度分布、表型分析和功能预测也表明DE与BSE更为接近,对BSE和NBSE壳内检测也筛选出在鸭蛋腌制中影响品质的微生物。本实验从微生物方面研究不同表面洁净程度的鸭蛋,以不同微生物所产生的不同效果为依据,明确了DE在后续咸蛋加工中品质下降出现黑黄的概率显著高于CE,为鸭蛋清洁生产的必要性提供了理论依据。
