葛根素水凝胶对糖尿病大鼠创面血管形成及愈合的影响
2023-08-05周晶吴达莹杨清肖喜张珍珍张选奋兰州大学第二医院整形外科甘肃兰州730030兰州大学第二临床医学院甘肃兰州730030
周晶,吴达莹,杨清,肖喜,张珍珍,张选奋(. 兰州大学第二医院整形外科,甘肃 兰州 730030;.兰州大学第二临床医学院,甘肃 兰州 730030)
糖尿病创面是糖尿病慢性并发症之一,其以创面内高血糖为主要特征,伴有微循环障碍、炎症反应失调及氧化还原稳态破坏等[1]特点,在愈合过程中难以建立起适应性调节机制,最终造成难愈结局。中医将糖尿病创面归于“疮疡”“溃疡”范畴,病机主归为“邪气致瘀,瘀阻伤正,化腐致损”等,久之则现气血不足,腐肉不消,新肉难生[2]。目前,针对糖尿病创面的传统治疗方法有生长因子制剂[3]、高压氧[4]、光生物调节[5]及生物工程皮肤替代物[6]等,尽管取得部分疗效,但多存在治疗不便利和费用昂贵等缺点,难以在临床上推广。中药治疗糖尿病创面已被证实具有疗效确切、副反应少及价格低廉等优势,近年来广泛受到关注[7]。
葛根素是中草药类植物葛根的异黄酮类活性成分,体内实验[8-9]证实其具有降低血糖、改善循环、抗炎及抗氧化等作用,且安全性良好,可改善糖尿病视网膜病变及糖尿病心肌损伤缺血等多类糖尿病并发症,但其对糖尿病创面的作用效果尚未明确。葛根素水凝胶[10]是一种无需任何化学修饰的自组装天然水凝胶,制备流程简易,且成分单一,使用方便[11]。
本研究拟探索葛根素水凝胶在促进糖尿病创面血管形成及愈合中的作用,以期为葛根素水凝胶应用于糖尿病创面的治疗提供初步的研究基础。
1 材料与方法
1.1 动物雄性SD 大鼠,SPF 级,7 周龄,体质量(190±10)g,中国农业科学院兰州兽医研究所提供,动物生产许可证号:SCXK-(甘)2020-0002,动物质量合格证号:0002491,饲养于兰州大学动物实验基地,温度22~26 ℃,湿度45%~55%,可模拟昼夜光线。本研究已通过兰州大学第二医院实验动物福利伦理委员会审查,批件编号:D2022-001。
1.2 药物及试剂葛根素购自西安欣禄生物科技有限公司,纯度≥98%,分子量:416.38,CAS:3681-99-0;PBS、1%链脲佐菌素、苏木素-伊红染色试剂盒,购自北京索莱宝科技有限公司,批号依次为:P1032、IS0250、G1120;Weiger 铁苏木素染液、丽春红酸性品红染液,购自北京百奥莱博科技有限公司,批号依次为:GL0438、RFT056;BCA 试剂盒,购自北京康为世纪生物科技有限公司,批号:CW0014;兔源性CD31 多克隆抗体、兔源性血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)多克隆抗体及HRP 标记的山羊抗兔IgG 等,购自美国Affinity Biosciences 公司,批号依次为:AF6191、AF5131、S0002。
1.3 仪器GA-3 型血糖仪,三诺生物传感股份有限公司;PB303-S 型精密电子天平,上海Mettler toledo公司;Leica RM2235 型切片机,德国Leica 公司;DHG-9140A 型烤箱,上海慧泰仪器制造有限公司;MM800 型光学显微镜, 日本 Olympus 公司;PowerPac Basic 型电泳仪,美国Bio-rad 公司;WD-9405B 型脱色摇床,北京六一仪器厂;Gbox chemi XX9 化学发光成像系统,英国Syngene 公司。
1.4 药物制备葛根素水凝胶以葛根素为药理活性成分,以磷酸盐缓冲液(Phosphate buffered saline,PBS)为载体制成。预实验证实葛根素水凝胶最低成胶浓度为1%,6%[10]及更高浓度的葛根素水凝胶硬度明显增加。为避免过硬水凝胶对创面造成机械损伤,故制备1%、2%及4%葛根素水凝胶。以1%葛根素水凝胶制备流程为例:电子秤精确称取葛根素粉末10 mg 置于1 mL PBS 中,酒精灯加热至100 ℃,直至葛根素粉末完全溶解呈清亮透明状态,室温下冷却5~10 min 即可形成“果冻样”水凝胶。2%和4%葛根素水凝胶则分别称取葛根素粉末20、40 mg,同法制备。
1.5 模型复制、分组及给药方法将45 只雄性SD 大鼠适应性喂养1 周,再给予高糖、高脂饮食4 周,然后腹腔一次性注射40 mg·kg-1链脲佐菌素,3d 后若空腹血糖值≥16.7 mmol·L-1,并伴多饮、多食及毛发松散枯黄等症状视为糖尿病大鼠造模成功[12]。将造模成功的36 只大鼠随机分为4 组,依次标记为对照组、1%葛根素组、2%葛根素组和4%葛根素组。第0 天时进行皮肤创面制作,首先以直径2.0 cm 的圆形创面模具进行标记,再按标记痕迹以组织剪逐层剪除全层皮肤,无菌纱布压迫止血。对照组创面以PBS 湿敷处理,各葛根素组创面以无菌棉签涂抹对应浓度葛根素水凝胶,涂抹范围至少超出创缘2.0 mm,用无菌纱布覆盖后妥善固定。
1.6 创面愈合观察和标本切取分别于给药的第3、7 和14 天进行拍照记录。使用Image pro plus 6.0 软件做创面面积测量,取同一时刻点各组大鼠创面面积求平均值。按公式:创面愈合率=(初始创面面积-实际创面面积)/初始创面面积× 100%,计算创面愈合率。拍照后,用齿镊及手术刀剔除创面痂结,充分暴露创面,于创缘外2.0 mm 处完整切除创面组织,生理盐水冲洗血渍。将取下的创面组织的1/4 用液氮保存,其余部分以4%多聚甲醛溶液固定。
1.7 HE 及Masson 染色取4%多聚甲醛溶液中固定的创面组织标本,依次经梯度乙醇溶液脱水和二甲苯透明,石蜡包埋后制作4 μm 厚切片。染色前在60 ℃烤箱中烘烤30 min 后做组织切片的脱蜡及水化处理。HE 染色时,使用苏木素染液浸染5 min,流水冲洗后用1%盐酸酒精分化5 s,返蓝;1%伊红染液染90 s,梯度酒精脱水及二甲苯透明后,中性树胶封片。Masson 染色时,取脱蜡并水化后切片置于Bouin 氏液糟中常温过夜固定8 h,流水冲洗后以Weiger 铁苏木素试剂滴染组织10 min,流水冲洗,1%盐酸酒精分化后返蓝;丽春红酸性品红液滴染组织5 min,蒸馏水冲洗后浸入1%磷钼酸水溶液浸泡5 min,苯胺蓝液染色,1%冰醋酸浸泡1 min 后进行脱水与透明化处理,中性树胶封片。200 倍显微镜下观察创面组织毛细血管分布、纤维化等组织学变化,拍照后使用Image pro plus 6.0 软件测量胶原纤维面积。
1.8 VEGF 免疫组织化学染色取石蜡切片按“1.7”项下方法做脱蜡及水化处理后,将切片置于高压锅中行柠檬酸抗原修复5 min,5% BSA 避光封闭1 h,按1∶200 浓度滴加兔源性VEGF 多克隆抗体(一抗)后4 ℃过夜。再按1∶500 浓度加入HRP 标记山羊抗兔IgG 抗体(二抗)后孵育50 min,DAB 显色后以苏木素染液复染细胞核5 min,脱水及透明化处理,中性树胶封片。400 倍显微镜下随机取3 个不重叠视野进行拍照,VEGF 强阳性在视野下表现为棕褐色团块,Image pro plus 6.0 软件测量VEGF 的积分光密度(Integrated option density,IOD)。
1.9 微血管密度(Microvessel density,MVD)测量进行CD31 免疫组织化学染色,一抗采用1∶1 000 浓度的兔源性CD31 多克隆抗体,二抗使用1∶500 浓度的HRP 标记山羊抗兔IgG 抗体,余步骤同“1.8”项下。400 倍视野下随机取3 个不重叠视野拍照,视野下棕褐色内皮细胞围成的管腔且与周围有明确界限则视为一条微毛细血管,以Image pro plus 6.0 软件计数。
1.10 Western Blot 法检测VEGF 蛋白表达取液氮中保存的创面组织标本,滴加裂解液(RIPA∶PSMF=100∶1)后冰上研磨、裂解,4 ℃条件下以12 000 r· min-1(离心半径8 cm)离心10 min 后使用移液枪吸取上清蛋白液至干燥EP 管内,BCA 法测定蛋白浓度并计算上样量。电泳转膜后,5%脱脂奶粉摇床封闭1 h,按1∶1 000 浓度滴加兔源性VEGF 多克隆抗体后4 ℃过夜。洗膜后加入按1∶10 000 浓度稀释的HRP 标记山羊抗兔IgG 抗体,室温摇床孵育1 h,洗膜后滴加发光液显色,使用Image pro plus 6.0 软件计算灰度值。
1.11 统计学处理方法使用SPSS 26.0 软件进行数据统计分析,计量资料结果以均数± 标准差(±s)表示,多组间整体比较用F检验,内部各组间事后比较采用LSD 法。统计结果以双侧P<0.05 为差异有统计学意义。
2 结果
2.1 皮肤创面愈合情况如图1 和表1 所示,随着时间推移,各组创面均逐渐缩小。与对照组比较,各葛根素组创面愈合趋势增加,其中以4%葛根素组愈合率最优(P<0.01)。
表1 各组大鼠皮肤创面愈合率(±s,%;n=9)Table 1 Skin wound healing rate of rats in each group after the treatment of puerarin hydrogel(±s,%;n=9)
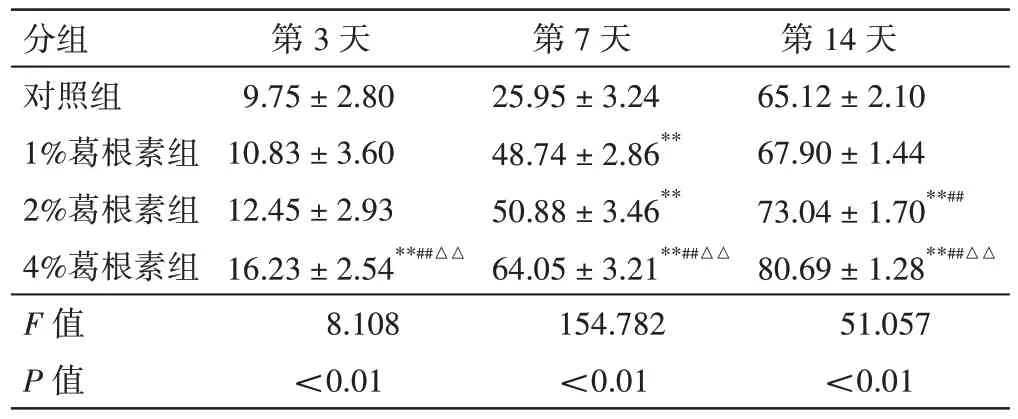
表1 各组大鼠皮肤创面愈合率(±s,%;n=9)Table 1 Skin wound healing rate of rats in each group after the treatment of puerarin hydrogel(±s,%;n=9)
注:与对照组比较,**P<0.01;与1%葛根素组比较,##P<0.01;与2%葛根素组比较,△△P<0.01
第14 天65.12±2.10 67.90±1.44 73.04±1.70**##80.69±1.28**##△△51.057<0.01分组对照组1%葛根素组2%葛根素组4%葛根素组F 值P 值第3 天9.75±2.80 10.83±3.60 12.45±2.93 16.23±2.54**##△△8.108<0.01第7 天25.95±3.24 48.74±2.86**50.88±3.46**64.05±3.21**##△△154.782<0.01
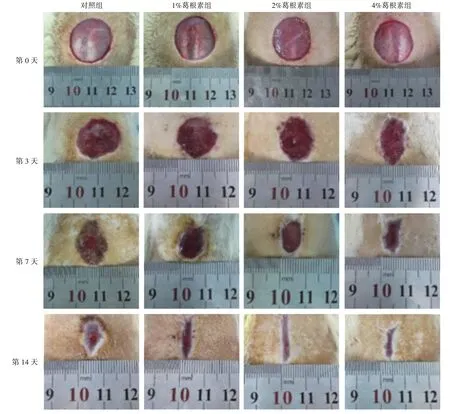
图1 葛根素水凝胶治疗后大鼠皮肤创面愈合情况Figure 1 Skin wound healing of rats in each group after the treatment of puerarin hydrogel
2.2 创面组织学变化如图2 所示,HE 及Masson 染色结果显示,第7 天时,对照组血管形成困难,胶原纤维较稀疏,排列紊乱;各葛根素组表现为不同程度的薄壁毛细血管增生及胶原分布,其中以4%葛根素组肉芽形成数量最多,胶原纤维最丰富。第14 天时,对照组形成少量薄壁毛细血管,管腔不规则,胶原较前稍致密,排列仍欠规则;各葛根素组毛细血管数量增多,并出现管腔狭窄及管壁增厚等愈合后期改变,胶原纤维更加丰富与致密,排列基本趋向规则,以4%葛根素组最为明显。
表2 为各组大鼠创面在不同时间点胶原纤维相对面积的比较。结果显示,随着时间推移,与相应时间点的对照组比较,各葛根素各组胶原纤维相对面积逐渐增大。其中以4%葛根素效果最佳(P<0.01)。
表2 葛根素水凝胶对大鼠皮肤创面组织内胶原纤维面积的影响(±s,%;n=3)Table 2 Effect of puerarin hydrogel on the area of collagen fibers of wounded skin in rats(±s,%;n=3)

表2 葛根素水凝胶对大鼠皮肤创面组织内胶原纤维面积的影响(±s,%;n=3)Table 2 Effect of puerarin hydrogel on the area of collagen fibers of wounded skin in rats(±s,%;n=3)
注:与对照组比较,**P<0.01;与1%葛根素组比较,##P<0.01;与2%葛根素组比较,△△P<0.01
第14 天30.56±0.86 41.51±2.68**54.83±2.60**##70.84±2.86**##△△159.049<0.01分组对照组1%葛根素组2%葛根素组4%葛根素组F 值P 值第7 天20.69±1.52 33.78±1.97**41.68±2.25**##59.09±1.64**##△△222.133<0.01
2.3 葛根素水凝胶对创面内VEGF IOD 的影响如图3 所示,第7 天时,与对照组创面内VEGF IOD(12 184.18±1 008.65)比较,1%、2%和4%葛根素组IOD 依次为(26 156.41±1 066.81)、(40 029.85 ±1 091.36)和(84 130.61±2 409.86);第14 天时,与对照组创面内VEGF IOD(21 434.16±2 011.40)比较,1%、2%和4%葛根素组IOD 依次为(54 734.60±3 454.35)、(80 965.60±3 814.17)和(131 271.98±4 244.21)。两时刻点葛根素组IOD 均高于相应的对照组(P<0.05),4%葛根素组均高于同一时刻点的其他浓度葛根素组(P<0.05),差异均有统计学意义,提示高浓度葛根素水凝胶可能对VEGF 的促分泌作用更强。
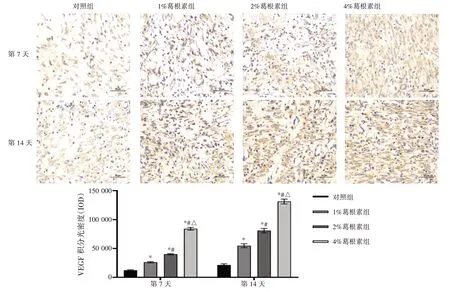
图3 葛根素水凝胶对大鼠创面内VEGF 积分光密度(IOD)的影响(×400;±s,n=3)Figure 3 Effect of puerarin hydrogel on integrated optical density(IOD)of VEGF in wounded skin from each group of rats(×400;±s,n=3)
2.4 葛根素水凝胶对创面MVD 的影响如图4 所示,第7 天时,与对照组创面内MVD[(15.23±0.60)根·mm-2]比较,1%、2%和4%葛根素组MVD 依次为(27.07±2.66)、(41.01±2.31)和(73.52±2.47)根·mm-2;第14 天时,与对照组创面内MVD[(34.06±1.36)根·mm-2]比较,1%、2%及4%葛根素组MVD 依次为(44.90±5.40)、(72.58±2.10)和(96.62±6.60)根·mm-2,两时刻点各葛根素组MVD 相较于相应对照组均明显增加(P<0.05),其中4%葛根素组MVD 高于同一时刻点的其他浓度葛根素组(P<0.05),差异均具有统计学意义。以上结果表明,葛根素水凝胶可能对CD31 具有较强的促分泌效应,在促进创面微血管形成方面有积极意义。
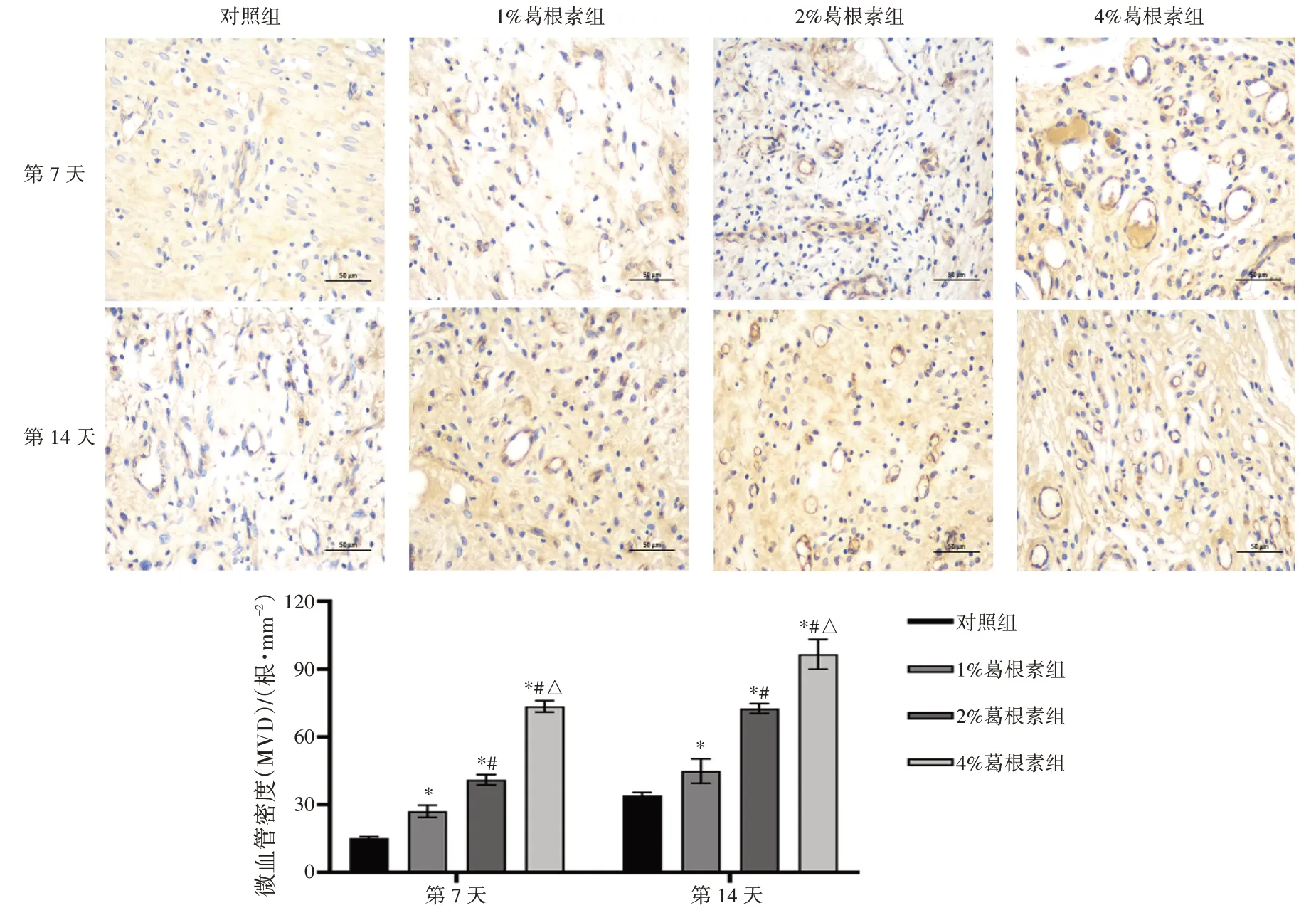
图4 葛根素水凝胶对大鼠创面内MVD 的影响(×400;±s,n=3)Figure 4 Effect of puerarin hydrogel on microvascular density(MVD) in wounded skin from each group of rats(×400;±s,n=3)
2.5 Western Blot 法检测VEGF 蛋白表达如图5所示,第14 天时,与对照组比较,1%、2%和4%葛根素组VEGF 蛋白表达量均增高(P<0.01);与其他浓度葛根素组比较,4%葛根素组VEGF 蛋白表达量最高(P<0.01),差异均具有统计学意义。
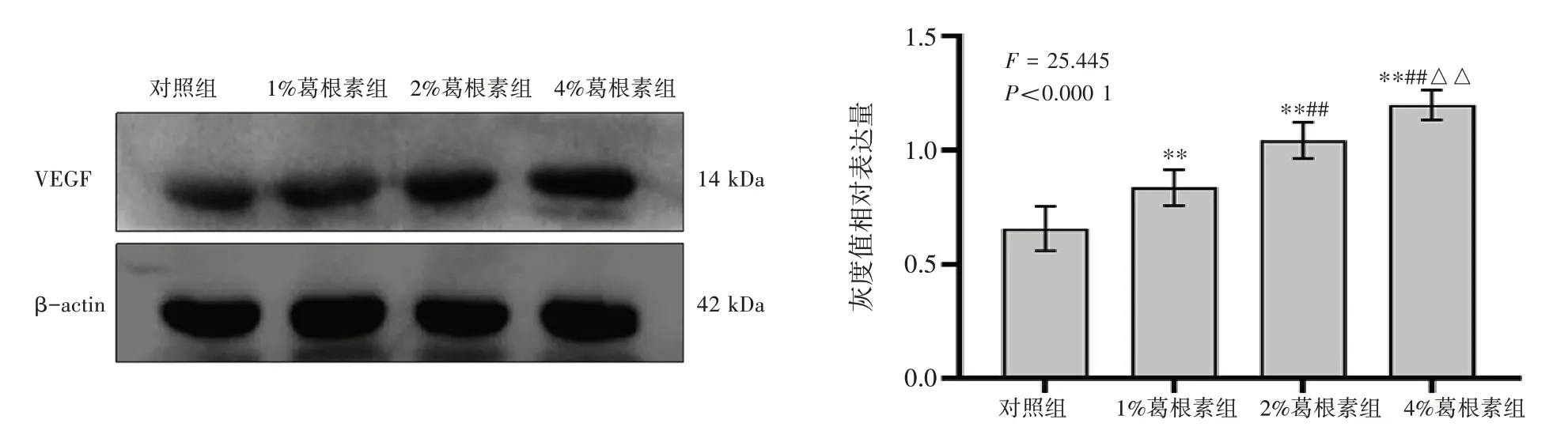
图5 第14 天时葛根素水凝胶对大鼠创面内VEGF 蛋白表达的影响(±s,n=3)Figure 5 Effect of puerarin hydrogel on VEGF protein expression in wounded skin from each group of rats at 14 days(±s,n=3)
3 讨论
糖尿病创面是糖尿病常见的慢性并发症,其发病率约为20%,通常表现为持续性的溃疡、深部感染或坏死,已成为非创伤性截肢的主要原因[13]。中医理论认为“气血相生”“养血生气,活血通络”,糖尿病创面内气血不足,自然表现出难愈之象。西医观念同样强调修复血管、维持循环是创面愈合的根本[1]。因此,创面组织内微循环状态是影响糖尿病创面愈合的关键因素。
VEGF 是迄今发现的最具特异性的促血管生成因子,在诱导血管内皮细胞增殖及改善血管内皮细胞间通透性等方面具有重要意义,能够在增加血管密度的基础上明显提升营养物质及代谢产物交换效率[14]。CD31 属于免疫球蛋白超家族的成员,可表达于各类免疫细胞及血管内皮细胞表面,参与血管生成,其经常用以反映血管内皮细胞的形成情况[15]。在高糖环境下,受异常炎症、氧化等[16-17]因素影响,糖尿病创面微循环系统遭到严重破坏,诱导创面内微血管形成的主要催化因子如VEGF、CD31 等表达减少,同时伴有血管管壁的动脉粥样硬化形成,导致管腔狭窄,营养成分和氧气得不到有效输送,造成组织修复的能力下降[1]。
现代药理学研究[18]证实,中药成分葛根素在改善微循环方面具有重要意义,可有效治疗糖尿病及其多种血管性并发症(如糖尿病视网膜及心肌病变等)。前期研究[19]发现,葛根素具有识别性结合并激活瞬时受体电位香草醛4 的作用,可通过调节血管内皮细胞钙离子内流来诱导内皮细胞依赖性血管舒张,增加局部血流量。另有证据[20]表明,葛根素能够剂量依赖性地促进血清中一氧化氮及前列腺素I2 等多种扩血管物质的表达,并具有抑制血管平滑肌迁移及改善血管重塑的作用,加速再内皮化过程。由此可见,葛根素对循环的改善作用十分明显,但其对糖尿病创面内微血管的影响尚不明确。陈敏生等[10]证实葛根素具有能够天然自组装形成水凝胶这一重要特性,故其具有创面应用的潜力。本研究使用葛根素水凝胶的对糖尿病大鼠创面进行湿敷以研究其创面应用时的功效。创面组织切片HE 和Masson 染色结果发现,相较于对照组,葛根素水凝胶能够明显促进创面肉芽组织的形成和胶原纤维沉积,表现出更显著的愈合趋势。免疫组织化学染色和Western Blot 实验证实,葛根素水凝胶可明显上调促血管因子VEGF 和CD31 的表达,增加微血管数量,表现出明显的益气补血、活血通络之功效。而葛根素水凝胶的优势在于其取材简单、制作方便,但其是否存在潜在细胞毒性及远期不良反应本研究尚未验证。
综上,葛根素水凝胶可能具有促进创面组织内VEGF 和CD31 的表达的作用而诱导微血管形成,同时有助于创面组织胶原纤维的沉积,在整体上呈浓度依赖型,对促糖尿病创面愈合具有积极意义。
