绿原酸灌胃对博莱霉素诱导小鼠肺纤维化的改善作用及其机制
2023-08-05王倩刘宇王荣丽
王倩,刘宇,王荣丽
西南医科大学附属医院呼吸与危重症医学科,四川泸州 646000
特发性肺纤维化(IPF)是一种病因不明、局限于肺部的慢性进行性纤维化性的间质性肺炎,其组织学和(或)胸部高分辨率CT(HRCT)常特征性表现为普通型间质性肺炎(UIP)[1]。IPF 好发于老年人,确诊后患者中位生存时间2~5 年,5 年生存率20%~25%[2]。目前IPF 的病因及发病机制仍不明确,目前FDA 仅批准尼达尼布(nintedanib)和吡非尼酮(pirfenidone)可用于治疗IPF,但治疗效果较差[3]。转化生长因子-β(TGF-β)是最有效的促纤维化细胞因子,在诱导肺纤维化中起关键作用,其中TGF-β1是其主要的形式。TGF-β 可促进肺成纤维细胞的增殖,促使肺成纤维细胞向肌成纤维细胞转化,导致Ⅰ型胶原蛋白(Collagen Ⅰ)、Ⅲ型胶原蛋白(CollagenⅢ)等细胞外基质(ECM)过度沉积,最终形成纤维化病灶[4]。上皮-间充质转化(EMT)发生过程中,上皮细胞失去极性,E-钙粘蛋白(E-Cadherin)、角蛋白等上皮细胞表型丢失或表达下调,波形蛋白(Vimentin)、α-平滑肌肌动蛋白(α-SMA)等间质细胞标记物表达上调,其中TGF-β可通过调控Smad信号通路诱导EMT,促进肺泡上皮细胞向肌成纤维细胞分化,导致细胞外基质积聚[5]。绿原酸(CGA)也被称为3-咖啡酰奎尼酸(3-CQA)[6],是一种具有多种生物活性的酚类化合物;广泛分布在杜仲、金银花、茵陈、枸杞、咖啡豆、猕猴桃等药品及食品中;具有抑菌、抗病毒、抗氧化、抗炎、抗肿瘤、保肝及降糖等作用[7]。CGA可通过抑制NF-κB p65 的磷酸化、降低炎症反应程度,减轻补体旁路激活诱导的小鼠急性肺损伤[8];体内外实验[9]发现,CGA可通过抑制内质网应激来抑制肺纤维化。CGA 是否可通过抑制TGF-β1/Smads 信号通路,抑制肺组织EMT 过程,发挥抗肺纤维化的作用,目前尚无相关研究。为此,2022年3—6月,我们观察了CGA 对博莱霉素诱导的小鼠肺纤维化的改善作用,进一步探讨其可能作用机制,现报告如下。
1 材料与方法
1.1 动物、试剂 清洁健康雄性C57BL/6 小鼠60只,6~8 周龄,体质量(20 ± 2)g,购自斯贝福(北京)生物技术有限公司[实验动物生产许可证号:SCXK(京)2019-0010]。小鼠饲养于温度 22~25 ℃、湿度50%~70%、12 h 昼夜循环的环境内,自主摄入水和食物。实验所有操作均符合实验动物福利伦理标准。盐酸博莱霉素(纯度≥98%,溶于生理盐水)购自北京泰泽嘉业科技发展有限公司;CGA(纯度≥98%,溶于超纯水)购自上海阿拉丁生化科技股份有限公司;HE 染色试剂盒、Masson 三色染色液试剂盒购自北京索莱宝科技有限公司;Collagen Ⅰ、Vimentin、α-SMA、TGF-β1抗体购自北京迈瑞达科技有限公司;Smad2/3 抗体购自成都杰德诺生物科技有限公司;免疫荧光染色试剂盒购自海门碧云天生物技术有限公司。
1.2 动物分组、博莱霉素(BLM)及CGA 给予方法 将60 只小鼠适应性饲养3 天后随机分为6 组(对照组、模型组、CGA 低剂量组、CGA 中剂量组、CGA 高剂量一组、CGA 高剂量二组),每组各10 只。其中5 组小鼠用博莱霉素诱导肺纤维化[10](诱导当天记作第1 天):腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉小鼠,固定四肢及头部,75%酒精消毒颈部,手术剪行正中纵向切口,钝性分离肌肉、组织直至暴露气管,经气管软骨环间隙行气管切开,用微量移液器将2 mg/kg 博莱霉素溶液沿气管切口朝向心端缓慢注入气管内;对照组小鼠相同操作后注入等体积生理盐水。各组小鼠注入液体后立即将鼠板直立旋转抖动,使博莱霉素/生理盐水在肺内均匀分布,缝合肌肉、皮肤后将各组小鼠置于鼠笼中自然苏醒。第1 天小鼠自然苏醒后,CGA 高剂量二组小鼠予CGA80 mg/kg 灌胃,1 次/天,连续灌胃14 d。第8 天起,CGA 低剂量组、CGA 中剂量组、CGA 高剂量一组分别予CGA20、40、80 mg/kg 灌胃,1 次/天,连续灌胃14 d。第8 天起,对照组及模型组予等体积超纯水连续灌胃,1次/天,连续灌胃14天。
1.3 各组小鼠左肺纤维化程度观察 观察并记录各组小鼠存活数量。饲养第21 天后,腹腔注射1%戊巴比妥钠麻醉小鼠、颈椎脱臼法处死后称重,开胸分离双肺,用滤纸吸干双肺表面的液体后称取湿重,按公式:肺系数(%)=肺湿重(mg)/小鼠体质量(g)×100%计算肺系数。将各组小鼠左肺置于10%多聚甲醛中固定24 h。石蜡包埋后对左肺组织行5 μm连续切片。按照HE 染色试剂盒操作说明书步骤进行HE 染色,光学显微镜下观察并记录各组小鼠肺组织形态学改变。取各组左肺组织切片,按照Masson 三色染色试剂盒操作说明书步骤进行Masson 染色,于光学显微镜下观察并记录小鼠左肺组织中胶原纤维沉积情况。依照Ashcroft 评分[11]标准对各组小鼠左肺组织纤维化程度进行定量分析:正常肺组织计0 分,肺泡或细支气管壁纤维轻度增厚计1 分,肺泡壁中度增厚、肺组织结构无明显破坏计3分,肺组织改变介于1、3分之间计2分,肺纤维化进一步加重、肺组织结构明显破坏、并且有纤维带或小纤维团块形成计5 分,肺组织改变介于3、5 分之间计4 分,肺组织结构严重破坏、大面积纤维灶形成、可有“蜂窝肺”形成计7 分,肺组织改变介于5、7 分之间计6分,整个视野肺组织完全纤维化闭塞坏死计8分。
1.4 各组小鼠肺组织TGF-β1/Smads、EMT、脂质过氧化相关指标检测
1.4.1 各组小鼠肺组织EMT 过程中间质细胞标记物α-SMA 蛋白检测 采用免疫荧光法。按照免疫荧光染色试剂盒说明书操作步骤进行,然后在荧光显微镜下观察、拍照,肺组织中α-SMA 蛋白呈橙红色荧光;每张切片随机选择3 个视野,用Fiji(Fiji is just ImageJ)软件对蛋白阳染面积的荧光强度进行定量分析,以蛋白阳染面积荧光强度代表α-SMA 蛋白的相对表达量。重复测算3次,取平均值。
1.4.2 各组小鼠左肺组织细胞外基质蛋白CollagenⅠ、EMT过程中间质细胞标记物Vimentin及TGF-β1/Smads 信号通路相关蛋白检测 采用免疫组化法。按照免疫组化试剂盒说明书操作步骤严格进行。显微镜下观察,每张切片随机选择3个视野,用Fiji(Fiji is just ImageJ)软件测算蛋白阳染面积的平均光密度值(MOD),肺组织中细胞核呈蓝色,Collagen I、Vimentin、TGF-β1、Smad2/3 蛋白阳性表达为棕色或棕黄色颗粒。以MOD 值代表Collagen Ⅰ、Vimentin、TGF-β1、Smad2/3 蛋白的相对表达量。重复测算3次,取平均值。
1.4.3 各组小鼠右肺组织丙二醛(MDA)检测 采用硫代巴比妥酸法(TBA法)。取小鼠右肺组织按照MDA 试剂盒说明书操作步骤,制备成10%肺组织匀浆,3 000 r/min离心10 min,取上清液。用酶标仪在波长532 nm 处测定每个样本的吸光度(OD 值),使用已知丙二醛含量的样本生成标准曲线,计算各组小鼠右肺组织MDA 含量(nmoL/mgprot)。MDA 含量越高,说明肺组织脂质过氧化程度越明显。
1.4.4 各组小鼠右肺组织EMT过程中上皮细胞标记物E-cadherin mRNA、间质细胞标志物α-SMA mRNA 检测 采用Real-time qPCR法。取各组小鼠右肺组织解融,剪碎后研磨,制备成匀浆。使用TRIzol法提取小鼠右肺组织的总RNA,使用Nanodrop检测RNA浓度及纯度;逆转录合成cDNA;定量PCR扩增,反应条件:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 30 s(40个循环);95 ℃ 15 s,60 ℃ 60 s,95 ℃15 s。E-cadherin mRNA上游引物5'-CGACCGGAAGTGACTCGAAAT-3',下游引物5' -TCAGAACCACTGCCCTCGTAAT-3';α-SMA mRNA上游引物5'-GTACCACCATGTACCCAGGC-3',5' -GAAGGTAGACAGCGAAGCCA-3';GAPDH 上游引物5'-CCTCGTCCCGTAGACAAAATG-3';下游引物5'-TGAGGTCAATGAAGGGGTCGT-3'。以GAPDH 作为内参,以2-△△CT代表E-cadherin mRNA、α-SMA mRNA的相对表达量。
1.5 统计学方法 采用SPSS 17.0 统计软件进行数据处理。计量资料通过Shapiro-Wilk 进行正态性检验,符合正态分布的数据以±s表示,多组比较采用单因素方差分析,通过Levene 检验进行方差齐性检验,方差齐时采用LSD-t法进行事后组间两两比较;方差不齐时进行Welch 检验,采用Tamhane's T2法进行事后组间两两比较,生存率采用Log-rank检验进行组间比较。P<0.05为差异具有统计学意义。
2 结果
2.1 各组小鼠左肺纤维化程度比较
2.1.1 各组小鼠左肺系数比较 第21 天时对照组小鼠死亡0 只,CGA 高剂量一组、二组分别死亡1只,CGA 中剂量、低剂量组分别死亡2 只,模型组死亡4只。CGA高剂量一组、CGA高剂量二组、CGA中剂量组、CGA 低剂量组、模型组及对照组小鼠的左肺系数分别为0.606 1% ± 0.007 4%、0.567 5% ±0.004 9%、0.852 6% ± 0.027 6%、1.304 5% ±0.035 6%、1.941 4% ± 0.027 3%、0.532 5% ±0.009 1%,与对照组相比,模型组小鼠左肺系数升高(P<0.001);与模型组相比,CGA 各剂量组小鼠的左肺系数降低(P均<0.001),且呈剂量依赖性(P<0.001);与CGA 高剂量一组比较,CGA 高剂量二组小鼠左肺系数低(P<0.001)。
2.1.2 各组小鼠左肺组织病理改变及Ashcroft 评分比较 对照组小鼠左肺组织结构正常,无肺泡间隔水肿,肺泡或支气管壁可见少许胶原纤维;与对照组相比,模型组小鼠肺组织肺泡腔狭窄、塌陷,肺泡间隔明显增厚,成纤维细胞显著增多,发生明显纤维化,大面积纤维灶形成,肺组织结构严重破坏;与模型组相比,CGA 各剂量组小鼠肺组织结构破坏程度及胶原纤维沉积情况均得到不同程度的改善。CGA高剂量一组、CGA 高剂量二组、CGA 低剂量组、CGA中剂量组、模型组及对照组小鼠左肺组织Ashcroft评分分别为(2.33 ± 1.21)、(2.33 ± 1.21)、(4.33 ±0.82)、(3.33 ± 0.82)、(7.33 ± 0.82)、(0.67 ±0.82)分。与对照组比较,模型组小鼠左肺组织Ashcroft 评分高(P<0.001);与模型组比较,CGA 各剂量组小鼠肺纤维化Ashcroft 评分均低(P均<0.001);与CGA 低剂量组比较,CGA 高剂量一组小鼠肺纤维化Ashcroft评分低(P<0.01)。
2.2 各组小鼠左肺组织α-SMA 蛋白相对表达水平比较 CGA高剂量一组、CGA高剂量二组、CGA中剂量组、CGA 低剂量组、模型组及对照组小鼠左肺组织α-SMA蛋白相对表达量分别为1.167 8 ± 0.014 3、1.141 8 ± 0.029 1、1.485 5 ± 0.018 5、1.724 1 ±0.054 7、2.215 3 ± 0.073 7、1.000 0 ± 0.029 4,与对照组比较,模型组小鼠左肺组织α-SMA 蛋白相对表达水平高(P<0.001);与模型组相比,CGA 各剂量组小鼠左肺组织α-SMA蛋白相对表达水平均低(P均<0.001),且降低程度呈剂量依赖性(P<0.01)。
2.3 各组小鼠左肺组织Collagen Ⅰ、Vimentin 及TGF-β1、Smads2/3 蛋白相对表达量比较 各组小鼠左肺组织Collagen Ⅰ、Vimentin 及TGF-β1、Smads2/3蛋白相对表达量比较见表1。
表1 各组小鼠左肺组织Collagen Ⅰ、Vimentin、TGF-β1及Smads2/3蛋白相对表达量比较(± s)

表1 各组小鼠左肺组织Collagen Ⅰ、Vimentin、TGF-β1及Smads2/3蛋白相对表达量比较(± s)
注:与对照组比较,*P<0.01;与模型组比较,#P<0.01;与CGA 低剂量组比较,&P<0.001;与CGA 中剂量组比较,▲P<0.01;与CGA 高剂量一组比较,▼P<0.001。
组别CGA低剂量组CGA中剂量组CGA高剂量一组CGA高剂量二组对照组模型组Collagen Ⅰ0.127 8 ± 0.006 4*#0.104 3 ± 0.003 5*#&0.084 0 ± 0.001 9*#&▲0.062 0 ± 0.005 2*#▼0.039 5 ± 0.003 6 0.216 2 ± 0.007 3*Vimentin 0.201 7 ± 0.006 5*#0.152 8 ± 0.006 6*#&0.129 0 ± 0.003 0*#&▲0.104 2 ± 0.004 8*#▼0.090 2 ± 0.004 7 0.266 8 ± 0.012 5*TGF-β1 0.141 0 ± 0.002 8*#0.117 8 ± 0.001 0*#&0.103 5 ± 0.002 2*#&▲0.085 2 ± 0.002 8*#▼0.064 5 ± 0.004 6 0.186 3 ± 0.014 2*Smad2/3 0.213 8 ± 0.004 1*#0.184 8 ± 0.001 8*#&0.162 0 ± 0.003 6*#&▲0.126 2 ± 0.002 8*#▼0.092 8 ± 0.002 7 0.255 2 ± 0.013 7*
2.4 各组小鼠右肺组织中MDA含量比较 CGA高剂量一组、CGA 高剂量二组、CGA 中剂量组、CGA 低剂量组、模型组及对照组小鼠右肺组织中MDA含量分别为(1.76 ± 0.08)、(1.58 ± 0.11)、(1.77 ±0.10)、(1.81 ± 0.08)、(1.82 ± 0.12)、(1.20 ± 0.18)nmoL/mgprot。与对照组比较,模型组小鼠右肺组织MDA含量高(P<0.001);与模型组比较,CGA高剂量二组小鼠右肺组织MDA含量低(P<0.01),CGA高剂量一组小鼠右肺组织MDA含量与模型组的差异无统计学意义(P>0.05);与CGA 高剂量一组比较,CGA高剂量二组小鼠右肺组织MDA含量低(P<0.05)。
2.5 各组小鼠右肺组织E-cadherin及α-SMA mRNA相对表达水平比较 各组小鼠右肺组织E-cadherin及α-SMA mRNA相对表达水平比较见表2。
表2 各组小鼠右肺组织E-cadherin及α-SMA mRNA相对表达量比较(± s)
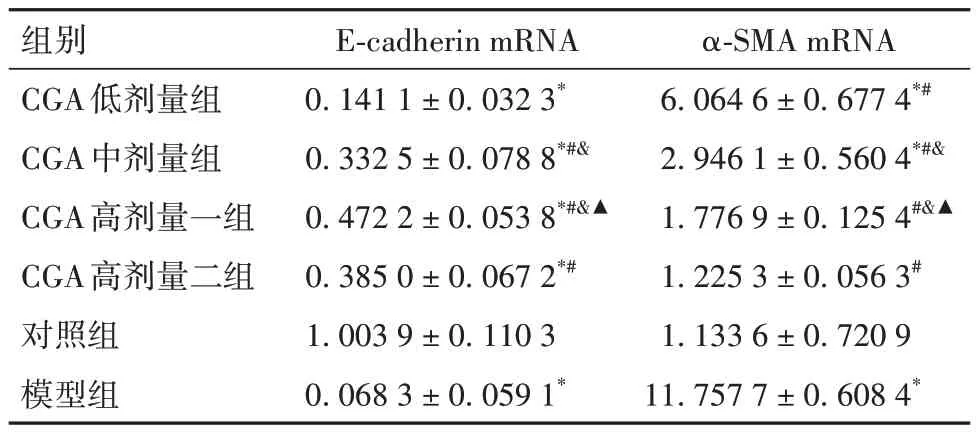
表2 各组小鼠右肺组织E-cadherin及α-SMA mRNA相对表达量比较(± s)
注:与对照组比较,*P<0.01;与模型组比较,#P<0.01;与CGA 低剂量组比较,&P<0.01;与CGA中剂量组比较,▲P<0.05。
组别CGA低剂量组CGA中剂量组CGA高剂量一组CGA高剂量二组对照组模型组E-cadherin mRNA 0.141 1 ± 0.032 3*0.332 5 ± 0.078 8*#&0.472 2 ± 0.053 8*#&▲0.385 0 ± 0.067 2*#1.003 9 ± 0.110 3 0.068 3 ± 0.059 1*α-SMA mRNA 6.064 6 ± 0.677 4*#2.946 1 ± 0.560 4*#&1.776 9 ± 0.125 4#&▲1.225 3 ± 0.056 3#1.133 6 ± 0.720 9 11.757 7 ± 0.608 4*
3 讨论
IPF 的发病机制至今尚未完全明确,涉及复杂的细胞及分子机制。目前普遍认为:遗传和环境等多种因素共同作用,导致肺泡上皮细胞(AECs)反复损伤和异常修复,诱导产生TGF-β、血小板源性生长因子(PDGF)、结缔组织生长因子(CTGF)、血管内皮生长因子(VEGF)及白介素-13(IL-13)等多种促纤维化细胞因子和生长因子,致使肺微环境内抗纤维化和致纤维化因子失衡,促进EMT 过程,使成纤维细胞、肌成纤维细胞等间叶细胞活化、增殖和募集,并分泌大量纤维性ECM,促进肺基质僵硬和纤维化的恶性循环,最终致使肺结构破坏和功能丧失[6]。因此,AECs 可以被认为是肺纤维化的启动因子,在疾病的发生和发展中发挥的关键作用,IPF 被认为是一种“上皮细胞驱动疾病”,E-Cadherin 是上皮细胞之间的粘附连接的关键分子,是一种钙依赖性细胞粘附跨膜糖蛋白,被认为是典型的上皮标志,并且E-Cadherin 下调在EMT 中起着核心作用;而肌成纤维细胞被认为是肺纤维化的关键效应因子,肌成纤维细胞特征性表达α-SMA,具有收缩、迁移的能力,同时仍保持成纤维细胞的功能和特性;TGF-β1是目前最有效的生长因子,被认为是参与IPF 发生发展最关键的成纤维因子,它可以诱导大量成纤维细胞增殖、迁移并分化为肌成纤维细胞,这些成纤维细胞对凋亡表现出抗性,并积聚在成纤维细胞灶的活性纤维化部位,导致细胞外基质的过量生产和沉积;在肺纤维化的进展过程中,EMT 也有助于肌成纤维细胞的扩张,导致纤维化过程的发展和维持[12]。因此,抑制肺成纤维细胞的增殖和活化,促进肌成纤维细胞凋亡,阻断EMT 过程对于肺纤维化的治疗至关重要。文献[13]中报导TGF-β1可通过Smad 蛋白依赖型信号传导通路诱导EMT,在肺纤维化中发挥重要作用。本研究结果发现,模型组小鼠肺组织中E-Cadherin等上皮细胞表型的表达水平明显降低,而Vimentin、α-SMA等间质细胞标记物表达水平明显升高,表明博莱霉素诱导的小鼠肺纤维过程中发生了EMT,若能有效抑制EMT过程的发生,可能延缓甚至终止肺纤维化进展。与此同时,模型组小鼠肺组织中TGF-β1/Smads 信号通路中的TGF-β1、Smad2/3 蛋白表达水平明显升高,表明TGF-β1/Smads 信号通路在博莱霉素诱导的小鼠肺纤维化过程中被激活。
小鼠单次气管内注射博莱霉素后1~7天为急性损伤和炎症期,大量活性氧产生,介导脂质过氧化等氧化应激反应,MDA是脂质过氧化的最终产物,其水平变化可直接反映组织中脂质过氧化程度及间接反映氧自由基含量,还可衡量机体氧化应激反应程度;博莱霉素作用后7~14 天是炎症向纤维化活跃期的过渡阶段;博莱霉素作用后第3 周为慢性纤维化阶段,肺泡内和间隔纤维化形态明显。本研究使用博莱霉素单次气管内注射诱导实验小鼠肺纤维化,模型组小鼠肺系数明显升高;HE染色可见肺泡结构破坏,肺泡间隔增厚明显,肺泡塌陷,肺泡腔缩小、甚至闭塞,大量纤维细胞增生;Masson染色可见明显的蓝色胶原纤维沉积,Ashcroft 评分明显升高;免疫组化可见肺组织中Collagen Ⅰ等胶原蛋白表达水平明显升高;表明成功诱导小鼠肺纤维模型。此外,模型组小鼠肺组织MDA 含量明显升高,表明博莱霉素诱导的小鼠肺纤维过程中发生了脂质过氧化反应。
CGA 来源广泛,其安全性已经得到了证实,具有多种药理特性。CGA 可防止肝纤维化过程中造血干细胞和成纤维细胞的氧化应激、炎症和纤维化;可抑制与肾纤维化相关的氧化应激、炎症和纤维化;可减轻与心脏纤维化相关的氧化应激和炎症[10]。本实验研究发现:各剂量CGA 干预组的小鼠肺系数降低,肺组织结构破坏程度得到不同程度的减轻,Collagen Ⅰ等胶原纤维沉积减少,Ashcroft 评分降低,肺组织纤维化程度得到不同程度的改善。与此同时,CGA 干预后可明显上调小鼠肺组织EMT 过程中的E-Cadherin 表达,下调Vimentin、α-SMA 表达,表明CGA 可抑制EMT 过程;在CGA 干预后TGF-β1、Smad2/3等与TGF-β1/ Smads信号通路相关的蛋白表达下调,表明CGA 可抑制肺纤维化过程中TGF-β1/Smads 信号通路。此外,CGA 高剂量二组小鼠肺系数及肺组织中的MDA 含量、Collagen Ⅰ蛋白表达较模型组低,且低于CGA 高剂量一组;表明早期予以CGA 干预能在一定程度上减轻小鼠在肺纤维化进程中的脂质过氧化程度,发挥抗氧化作用。
综上所述,在一定浓度范围内,绿原酸干预可减轻博莱霉素诱导的小鼠肺纤维化程度,且呈剂量依赖性,其改善肺纤维化的作用机制可能与抑制TGF-β 1/ Smads 信号通路从而抑制EMT 有关。此外,绿原酸早期干预可减轻小鼠肺纤维化过程中脂质过氧化程度,从而在一定程度上协同减轻肺纤维化。
